「パルミトイル化」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の11版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:palmitoylation | |||
タンパク質の''S''-パルミトイル化は、16炭素鎖飽和[[wikipedia:ja:脂肪酸|脂肪酸]]である[[wikipedia:ja:パルミチン酸|パルミチン酸]]がタンパク質の[[wikipedia:ja:システイン|システイン]]残基の[[wikipedia:ja:チオール|チオール]]基を介して[[wikipedia:ja:チオエステル|チオエステル]]結合で付加した翻訳後脂質修飾である。パルミトイル化修飾により、タンパク質の[[wikipedia:ja:疎水性|疎水性]]が上昇し、[[wikipedia:ja:細胞膜|細胞膜]]や[[wikipedia:ja:細胞内小器官|細胞内小器官]]膜(細胞質内膜)への親和性が上昇する。''S''-パルミトイル化は細胞内タンパク質や[[wikipedia:ja:膜タンパク質|膜タンパク質]]など多くのタンパク質に見られる普遍的な修飾であり、タンパク質の局在や機能の制御に重要な役割を果たしている。''S''-パルミトイル化は可逆的であり、細胞内でダイナミックなパルミトイル化-脱パルミトイル化の修飾サイクルを示す。この''S''-パルミトイル化サイクルによりタンパク質は細胞質、細胞質内膜や細胞膜の間を相互輸送(シャトリング)する。それぞれの反応は[[wikipedia:palmitoyl acyltransferase|''S''-パルミトイルアシル転移酵素]](PAT)と[[wikipedia:PPT1|タンパク質パルミトイルチオエステラーゼ]](PPT)が担うと考えられていたが、近年PATとして、活性部位にDHHC(Asp-His-His-Cys)配列をもつ[[wikipedia:DHHC domain|DHHCタンパク質]]ファミリーが同定され、''S''-パルミトイル化の制御機構が明らかになりつつある。 | |||
タンパク質の''S''-パルミトイル化は、16炭素鎖飽和[[wikipedia:ja:脂肪酸|脂肪酸]]である[[wikipedia:ja:パルミチン酸|パルミチン酸]]がタンパク質の[[wikipedia:ja:システイン|システイン]]残基の[[wikipedia:ja:チオール|チオール]]基を介して[[wikipedia:ja:チオエステル|チオエステル]]結合で付加した翻訳後脂質修飾である。パルミトイル化修飾により、タンパク質の[[wikipedia:ja:疎水性|疎水性]]が上昇し、[[細胞膜]]や[[wikipedia:ja:細胞内小器官|細胞内小器官]]膜(細胞質内膜)への親和性が上昇する。''S''-パルミトイル化は細胞内タンパク質や[[wikipedia:ja:膜タンパク質|膜タンパク質]]など多くのタンパク質に見られる普遍的な修飾であり、タンパク質の局在や機能の制御に重要な役割を果たしている。''S''-パルミトイル化は可逆的であり、細胞内でダイナミックなパルミトイル化-脱パルミトイル化の修飾サイクルを示す。この''S''-パルミトイル化サイクルによりタンパク質は細胞質、細胞質内膜や細胞膜の間を相互輸送(シャトリング)する。それぞれの反応は[[wikipedia:palmitoyl acyltransferase|''S''-パルミトイルアシル転移酵素]](PAT)と[[wikipedia:PPT1|タンパク質パルミトイルチオエステラーゼ]](PPT)が担うと考えられていたが、近年PATとして、活性部位にDHHC(Asp-His-His-Cys)配列をもつ[[wikipedia:DHHC domain|DHHCタンパク質]]ファミリーが同定され、''S''-パルミトイル化の制御機構が明らかになりつつある。 | |||
== ''S''-パルミトイル化:可逆的脂質修飾 == | == ''S''-パルミトイル化:可逆的脂質修飾 == | ||
[[Image:Palmitoylation Figure1.png|thumb | [[Image:Palmitoylation Figure1.png|thumb|300px|'''図1 構造''']] 翻訳後修飾の可逆的制御機構は細胞の秩序維持における不可欠なプロセスであり、[[リン酸化]]、[[ユビキチン]]化、[[アセチル化]]などが知られるが、[[脂質修飾]]の一つである''S''-パルミトイル化(''S''-palmitoylation)もその担い手である。 | ||
タンパク質の脂質修飾は、脂質付加による疎水性上昇効果から細胞質タンパク質の細胞膜への輸送、膜タンパク質の機能性膜ドメインへの側方輸送、タンパク質-脂質相互作用などにおいて重要な役割を果たす。脂質修飾は主に4つに分類され、1)脂肪酸[[wikipedia:ja:アシル化|アシル化]]、2)[[wikipedia:ja:プレニル化|プレニル化]]、3)[[wikipedia:ja: グリコシルホスファチジルイノシトール|グリコシルホスファチジルイノシトール]](GPI)化、および4) [[wikipedia:ja:コレステロール|コレステロール]]化である。''S''-パルミトイル化は脂肪酸アシル化修飾の一つであり、''N''-[[ミリストイル化]]とともに最も主要な脂質修飾である<ref><pubmed>17892486</pubmed></ref>。''S''-パルミトイル化は可逆的な[[翻訳後修飾]]であるのに対し、''N''-ミリストイル化は不可逆的な共翻訳時修飾であり、両者は協調的に機能することが多い(詳しくはミリストイル化の項を参照されたい)。 | タンパク質の脂質修飾は、脂質付加による疎水性上昇効果から細胞質タンパク質の細胞膜への輸送、膜タンパク質の機能性膜ドメインへの側方輸送、タンパク質-脂質相互作用などにおいて重要な役割を果たす。脂質修飾は主に4つに分類され、1)脂肪酸[[wikipedia:ja:アシル化|アシル化]]、2)[[wikipedia:ja:プレニル化|プレニル化]]、3)[[wikipedia:ja: グリコシルホスファチジルイノシトール|グリコシルホスファチジルイノシトール]](GPI)化、および4) [[wikipedia:ja:コレステロール|コレステロール]]化である。''S''-パルミトイル化は脂肪酸アシル化修飾の一つであり、''N''-[[ミリストイル化]]とともに最も主要な脂質修飾である<ref><pubmed>17892486</pubmed></ref>。''S''-パルミトイル化は可逆的な[[翻訳後修飾]]であるのに対し、''N''-ミリストイル化は不可逆的な共翻訳時修飾であり、両者は協調的に機能することが多い(詳しくはミリストイル化の項を参照されたい)。 | ||
| 24行目: | 13行目: | ||
''S''-パルミトイル化脂質修飾は1970年代に[[wikipedia:Sindbis virus|シンドビスウイルス]]の[[wikipedia:ja:糖タンパク質|糖タンパク質]]と脂質の相互作用解析を目指した研究からその存在が明らかになった。[<sup>3</sup>H]-パルミチン酸で処理したシンドビスウイルスタンパク質は加熱変性処理を行っても両者の解離が見られず、パルミチン酸の[[wikipedia:ja:共有結合|共有結合]]性修飾が示唆された。パルミチン酸付加物はチオエステル切断試薬である[[wikipedia:ja:ヒドロキシルアミン|ヒドロキシルアミン]](NH<sub>2</sub>OH)で解離することが分かり、システインのチオールを介したチオエステル結合であることが明らかになった<ref><pubmed>287008</pubmed></ref>。その後、ウイルスタンパク質に限らず[[Ras]]や[[三量体GTP結合タンパク質]]αサブユニット(Gα)、種々の膜タンパク質が''S''-パルミトイル化されることが報告された。パルミトイル化反応は可逆的であり、パルミトイル化と脱パルミトイル化のバランスにより、基質タンパク質のパルミトイル化レベルが規定される。このパルミトイルサイクルは、細胞においてはリン酸化などと同様に、外界刺激に反応して、動的に制御されることが知られている。たとえば、Gα<sub>s</sub>のパルミトイル化レベルは、共役する受容体の活性化により大きく変動する<ref><pubmed>7912657</pubmed></ref>。パルミトイルサイクルは外界刺激依存的にタンパク質の局在や機能を動的に制御する重要な修飾であることが予想される。 | ''S''-パルミトイル化脂質修飾は1970年代に[[wikipedia:Sindbis virus|シンドビスウイルス]]の[[wikipedia:ja:糖タンパク質|糖タンパク質]]と脂質の相互作用解析を目指した研究からその存在が明らかになった。[<sup>3</sup>H]-パルミチン酸で処理したシンドビスウイルスタンパク質は加熱変性処理を行っても両者の解離が見られず、パルミチン酸の[[wikipedia:ja:共有結合|共有結合]]性修飾が示唆された。パルミチン酸付加物はチオエステル切断試薬である[[wikipedia:ja:ヒドロキシルアミン|ヒドロキシルアミン]](NH<sub>2</sub>OH)で解離することが分かり、システインのチオールを介したチオエステル結合であることが明らかになった<ref><pubmed>287008</pubmed></ref>。その後、ウイルスタンパク質に限らず[[Ras]]や[[三量体GTP結合タンパク質]]αサブユニット(Gα)、種々の膜タンパク質が''S''-パルミトイル化されることが報告された。パルミトイル化反応は可逆的であり、パルミトイル化と脱パルミトイル化のバランスにより、基質タンパク質のパルミトイル化レベルが規定される。このパルミトイルサイクルは、細胞においてはリン酸化などと同様に、外界刺激に反応して、動的に制御されることが知られている。たとえば、Gα<sub>s</sub>のパルミトイル化レベルは、共役する受容体の活性化により大きく変動する<ref><pubmed>7912657</pubmed></ref>。パルミトイルサイクルは外界刺激依存的にタンパク質の局在や機能を動的に制御する重要な修飾であることが予想される。 | ||
しかしながら、2000年代前半まで責任酵素が同定されず、''S''-パルミトイル化は酵素非依存的な現象と捉える流れも存在した。パルミトイル化発見から30年近い年月が経ってようやく''S''- | しかしながら、2000年代前半まで責任酵素が同定されず、''S''-パルミトイル化は酵素非依存的な現象と捉える流れも存在した。パルミトイル化発見から30年近い年月が経ってようやく''S''-パルミトイルアシル転移酵素(palmitoyl acyl transferase, PAT)活性を担うDHHCファミリータンパク質が同定された<ref name=Lobo><pubmed>12193598</pubmed></ref><ref name=Amy><pubmed>12370247</pubmed></ref>。近年大規模な''S''-パルミトイル化タンパク質のスクリーニング法が確立され、著しい数のタンパク質がパルミトイル化されることが示された<ref name=Amy_Cell><pubmed>16751107</pubmed></ref><ref name=Rujun><pubmed>19092927</pubmed></ref>。DHHCファミリー''S''-パルミトイルアシル転移酵素の発見を皮切りに、''S''-パルミトイルアシル転移酵素と基質のペアの同定が続々とおこなわれており<ref name=MasakiFukata_Neuron><pubmed>15603741</pubmed></ref><ref name=YukoFukata_methods><pubmed>17012030</pubmed></ref><ref name=YukoFukata_NatRevNeurosci><pubmed>20168314</pubmed></ref>、''S''-パルミトイル化が担う細胞レベルの挙動が徐々に輪郭を見せ始めている。 | ||
== ''S''-パルミトイル化タンパク質 == | == ''S''-パルミトイル化タンパク質 == | ||
これまでに多くのタンパク質がS-パルミトイル化修飾されることが明らかになってきた(表1)。 | |||
{|border="1" cellspacing="1" cellpadding="1" | |||
|+ '''表1 主なパルミトイル化タンパク質''' 特記以外はS-パルミトイル化 | |||
|- | |- | ||
| '''ファミリー''' | | '''ファミリー''' | ||
| '''主な例''' | | '''主な例''' | ||
|- | |- | ||
| '''情報伝達分子'''<br> | | '''情報伝達分子'''<br> 小分子GTP結合蛋白質<br> 三量体GTP結合蛋白質<br> Srcファミリー非受容体型チロシンキナーゼ<br> その他<br> | ||
| <br>H-Ras, N-Ras,R-Ras, RhoB, Cdc42 isoform 2, Rab10<br>Gαs, Gαq, Gαi2<br>Yes, Fyn, Lyn, Lck, Hcr, Fgr, Yrk<br>GAP43, eNOS, [[パラレミニン]], ハンチンチン, [[GAD65]], [[スタスミン]]2 | | <br>H-Ras, N-Ras,R-Ras, RhoB, Cdc42 isoform 2, Rab10<br>Gαs, Gαq, Gαi2<br>Yes, Fyn, Lyn, Lck, Hcr, Fgr, Yrk<br>GAP43, eNOS, [[パラレミニン]], ハンチンチン, [[GAD65]], [[スタスミン]]2 | ||
|- | |- | ||
| | | | ||
''' | '''膜蛋白質'''<br> イオンチャネル<br> G蛋白質共役型受容体<br> 細胞接着分子<br> トランスポーター<br> [[マトリックスメタロプロテアーゼ]]<br> [[ミエリン]]結合分子<br> セクレターゼ<br> 細胞死関連<br> | ||
| <br>GluR1/2, GABAA γ2, [[アクアポリン]] 4, Kv1.1<br>[[ロドプシン]], β2-[[アドレナリン受容体]], <br>インテグリンα6, CD4, CD8, CD9, NCAM140, [[ニューロファシン]], [[DCC]] (deleted in colorectal cancer)<br>[[グルタミン酸トランスポーター]]EAAT1サブタイプ, EAAT3サブタイプ<br>MT1-マトリックスメタロプロテアーゼ<br>PLP, [[Neuronal membrane glycoprotein]] M6-a (GPM6A)<br>β-[[セクレターゼ]], [[ニカストリン]]<br>Fas, 低親和性[[神経成長因子]]受容体 | | <br>GluR1/2, GABAA γ2, [[アクアポリン]] 4, Kv1.1<br>[[ロドプシン]], β2-[[アドレナリン受容体]], <br>インテグリンα6, CD4, CD8, CD9, NCAM140, [[ニューロファシン]], [[DCC]] (deleted in colorectal cancer)<br>[[グルタミン酸トランスポーター]]EAAT1サブタイプ, EAAT3サブタイプ<br>MT1-マトリックスメタロプロテアーゼ<br>PLP, [[Neuronal membrane glycoprotein]] M6-a (GPM6A)<br>β-[[セクレターゼ]], [[ニカストリン]]<br>Fas, 低親和性[[神経成長因子]]受容体 | ||
|- | |- | ||
| ''' | | '''足場蛋白質'''<br> | ||
| PSD-95, [[PSD-93]]α/β, [[Glutamate receptor interacting protein]] (GRIP)1/2, [[デルフィリン]]<br> | | PSD-95, [[PSD-93]]α/β, [[Glutamate receptor interacting protein]] (GRIP)1/2, [[デルフィリン]]<br> | ||
|- | |- | ||
| ''' | | '''ウイルス蛋白質'''<br> | ||
| インフルエンザ HA H1サブユニット, | | インフルエンザ HA H1サブユニット, シンドビスウイルスE2蛋白質, HIV-1 gp160<br> | ||
|- | |- | ||
| '''N- | | '''N-パルミトイル化蛋白質'''<br> | ||
| ソニックヘッジホッグ, [[Wnt]], [[グレリン]] | | ソニックヘッジホッグ, [[Wnt]], [[グレリン]] | ||
|} | |} | ||
| 58行目: | 47行目: | ||
''S''-パルミトイル化はタンパク質内の近接する複数のシステインに付加する例も多く、また''N''-ミリストイル化やプレニル化とともに二重の脂質修飾を受けるタンパク質も複数知られている。''S''-パルミトイル化と''N''-ミリストイル化の二重修飾を受けるタンパク質としてSrcキナーゼファミリーのFynやLck、Gタンパク質αサブユニット(Gα<sub>i1</sub>、Gα<sub>o</sub>など)、[[内皮型一酸化窒素合成酵素]](endothelial NO synthase; eNOS)が有名である。詳細はミリストイル化の項を参照されたい。一方プレニル化は[[wikipedia:ja:イソプレノイド|イソプレノイド]]がシステイン残基にチオエーテル結合で結合する脂質修飾の総称で、15炭素鎖の[[ファルネシル化]]と20炭素鎖の[[ゲラニルゲラニル化]]の2種類の修飾が存在する。H-RasやN-RasはS-パルミトイル化とプレニル化(ファルネシル化)の二重修飾を受けるタンパク質として有名であり、2つのCys残基はC末端領域の互いに近い位置にある。二重修飾の場合、パルミトイル化修飾は、ミリストイル化あるいはプレニル化された基質に対してのみ二次的に起こることが知られている。 | ''S''-パルミトイル化はタンパク質内の近接する複数のシステインに付加する例も多く、また''N''-ミリストイル化やプレニル化とともに二重の脂質修飾を受けるタンパク質も複数知られている。''S''-パルミトイル化と''N''-ミリストイル化の二重修飾を受けるタンパク質としてSrcキナーゼファミリーのFynやLck、Gタンパク質αサブユニット(Gα<sub>i1</sub>、Gα<sub>o</sub>など)、[[内皮型一酸化窒素合成酵素]](endothelial NO synthase; eNOS)が有名である。詳細はミリストイル化の項を参照されたい。一方プレニル化は[[wikipedia:ja:イソプレノイド|イソプレノイド]]がシステイン残基にチオエーテル結合で結合する脂質修飾の総称で、15炭素鎖の[[ファルネシル化]]と20炭素鎖の[[ゲラニルゲラニル化]]の2種類の修飾が存在する。H-RasやN-RasはS-パルミトイル化とプレニル化(ファルネシル化)の二重修飾を受けるタンパク質として有名であり、2つのCys残基はC末端領域の互いに近い位置にある。二重修飾の場合、パルミトイル化修飾は、ミリストイル化あるいはプレニル化された基質に対してのみ二次的に起こることが知られている。 | ||
パルミトイル化蛋白質すべてに共通するコンセンサス配列は現時点では決定されていないが(下記参照)、これまでの知見を基に、''S''-パルミトイル化の予測プログラムCSS-palmが開発されておりインターネット上でフリーソフトとして配布されている。詳しくは[http://csspalm.biocuckoo.org/ こちら]を参照されたい。 | |||
== パルミトイル化サイクルの責任酵素 == | == パルミトイル化サイクルの責任酵素 == | ||
=== ''S''-パルミトイル化酵素の発見とその反応機構 === | === ''S''-パルミトイル化酵素の発見とその反応機構 === | ||
[[Image:Palmitoylation Figure2.png|thumb|right|400px|'''図2 DHHCファミリー''S''-パルミトイルアシル転移酵素''']] | |||
2002年に[[wikipedia:ja:酵母|酵母]]を用いた[[wikipedia:Forward genetics|順行性遺伝学]]的手法によりErf2 (effector of Ras function 2)/Erf4複合体<ref name=Lobo><pubmed>12193598</pubmed></ref>、Akr-1<ref name=Amy><pubmed>12370247</pubmed></ref>が''S''-パルミトイルアシル転移酵素として同定された。Erf2は4回膜貫通タンパク質でErf4と複合体を形成してRas2のパルミトイル化を担う。Akr-1(ankyrin repeat containing-1)は酵母[[カゼインキナーゼ]]Yck2をパルミトイル化する。相同性解析の結果これらはともに複数回の膜貫通領域に加えて、細胞質内領域に約50アミノ酸からなるシステインリッチドメイン(cysteine rich domain; CRD)を有しており、このドメイン内にパルミトイル化に不可欠なDHHC(Asp-His-His-Cys)配列を有していた(図2A)。[[wikipedia:ja:ゲノム|ゲノム]]データベース上、酵母では7種類、[[wikipedia:ja:哺乳動物|哺乳動物]]では24種類のDHHCファミリータンパク質が存在する(図2B;表2)。これまで、パルミトイル化反応がパルミトイル-CoA存在下で非酵素的に進行することも知られていたが、少なくとも酵母ではDHHCファミリー''S''-パルミトイルアシル転移酵素が細胞内のパルミトイル化の大部分を担っていることが示された<ref name=Amy_Cell><pubmed>16751107</pubmed></ref>。また哺乳類のDHHCファミリー''S''-パルミトイルアシル転移酵素遺伝子を用いた活性スクリーニング法(下記参照)などにより、24種類のうちのほとんどが何かしらの基質に対して酵素活性を示すことが明らかになってきた(表2)。DHHCファミリー''S''-パルミトイルアシル転移酵素は、CRDの相同性からさらにサブファミリーに分類できる(図2B)。DHHC酵素の基質特異性は、サブファミリーごとに保存される傾向にあり、またひとつの基質は複数のDHHCファミリー''S''-パルミトイルアシル転移酵素により修飾されうる(表2)。 | |||
GFP融合DHHCファミリー''S''-パルミトイルアシル転移酵素を過剰発現させた系で局在が調べられており、ほとんどが[[wikipedia:ja:小胞体|小胞体]]または[[wikipedia:ja:ゴルジ体|ゴルジ体]]に存在しており、一部細胞膜に局在していた(表2)<ref><pubmed>16647879</pubmed></ref>。したがって発現部位の特異性は低いと思われるが、DHHCファミリー''S''-パルミトイルアシル転移酵素の発現量の少なさゆえに[[wikipedia:ja: 抗体|抗体]]による特異的検出が難しく、内在性DHHCファミリー''S''-パルミトイルアシル転移酵素の局在に関してはほとんど明らかにされていない。最近の特異的抗体を用いた局在解析の結果、DHHC2は過剰発現系では小胞体/[[ゴルジ体]]に確認されたのに対して、内在性DHHC2は小胞(vesicle)上にも局在していた。その一方で、同じく過剰発現系でゴルジ体に見られたDHHC3は内在性酵素もゴルジ体に局在していた<ref name=Jun_J_Cell_Biol><pubmed>19596852</pubmed></ref>。DHHC2および3は複数の基質において重複が確認されている。DHHCファミリー''S''-パルミトイルアシル転移酵素それぞれの細胞内局在が''S''-パルミトイル化反応の時間・空間的制御機構に関与する可能性を示唆している。 | |||
GFP融合DHHCファミリー''S''-パルミトイルアシル転移酵素を過剰発現させた系で局在が調べられており、ほとんどが[[wikipedia:ja:小胞体|小胞体]]または[[wikipedia:ja:ゴルジ体|ゴルジ体]]に存在しており、一部細胞膜に局在していた(表2)<ref><pubmed>16647879</pubmed></ref>。したがって発現部位の特異性は低いと思われるが、DHHCファミリー''S''-パルミトイルアシル転移酵素の発現量の少なさゆえに[[wikipedia:ja: 抗体|抗体]]による特異的検出が難しく、内在性DHHCファミリー''S''-パルミトイルアシル転移酵素の局在に関してはほとんど明らかにされていない。最近の特異的抗体を用いた局在解析の結果、DHHC2は過剰発現系では小胞体/[[ゴルジ体]]に確認されたのに対して、内在性DHHC2は小胞(vesicle)上にも局在していた。その一方で、同じく過剰発現系でゴルジ体に見られたDHHC3は内在性酵素もゴルジ体に局在していた<ref name= | |||
酵母Saccharomyces cerevisiaeのErf2の解析からDHHCファミリー''S''-パルミトイルアシル転移酵素による''S''-パルミトイル化は2段階のプロセスからなることが報告された<ref><pubmed>20851885</pubmed></ref>。1)パルミトイル-[[wikipedia:ja:補酵素A|CoA]]存在下で、DHHC配列のうちCys残基が自己パルミトイル化(autopalmitoylaton)された後、2)基質のCys残基にパルミトイル基が移行する。''S''-パルミトイル化のコンセンサス配列は現時点では明らかになっていないが、現在進められている酵素-基質ペアの同定により、各DHHCファミリー''S''-パルミトイルアシル転移酵素が認識するパルミトイルモチーフが異なることが明らかになってきており、DHHCファミリー''S''-パルミトイルアシル転移酵素個々(あるいはサブファミリーごと)のコンセンサス配列が存在する可能性がある。 | 酵母Saccharomyces cerevisiaeのErf2の解析からDHHCファミリー''S''-パルミトイルアシル転移酵素による''S''-パルミトイル化は2段階のプロセスからなることが報告された<ref><pubmed>20851885</pubmed></ref>。1)パルミトイル-[[wikipedia:ja:補酵素A|CoA]]存在下で、DHHC配列のうちCys残基が自己パルミトイル化(autopalmitoylaton)された後、2)基質のCys残基にパルミトイル基が移行する。''S''-パルミトイル化のコンセンサス配列は現時点では明らかになっていないが、現在進められている酵素-基質ペアの同定により、各DHHCファミリー''S''-パルミトイルアシル転移酵素が認識するパルミトイルモチーフが異なることが明らかになってきており、DHHCファミリー''S''-パルミトイルアシル転移酵素個々(あるいはサブファミリーごと)のコンセンサス配列が存在する可能性がある。 | ||
{| border="1" cellspacing="1" cellpadding="1" | {| border="1" cellspacing="1" cellpadding="1" | ||
|+ '''表2 DHHCファミリー''S''-パルミトイルアシル転移酵素''' | |+'''表2 DHHCファミリー''S''-パルミトイルアシル転移酵素''' | ||
|- | |- | ||
! scope="col" | 酵素 | ! scope="col" | 酵素 | ||
| 81行目: | 70行目: | ||
| DHHC1 | | DHHC1 | ||
| ZDHHC1 | | ZDHHC1 | ||
| <br> | | <br> | ||
| 小胞体 | | 小胞体 | ||
| <br> | | <br> | ||
| 87行目: | 76行目: | ||
| DHHC2 | | DHHC2 | ||
| ZDHHC2 | | ZDHHC2 | ||
| PSD-95, SNAP25, eNOS, Nde1, CD151, [[ABCトランスポーター]]A1<br> | | PSD-95, SNAP25, eNOS, Nde1, CD151, [[ABCトランスポーター]]A1<br> | ||
| 小胞体/ゴルジ体<br> | | 小胞体/ゴルジ体<br> | ||
| 癌<br> | | 癌<br> | ||
|- | |- | ||
| DHHC3<br> | | DHHC3<br> | ||
| ZDHHC3<br>GODZ<br> | | ZDHHC3<br>GODZ<br> | ||
| PSD-95, SNAP25, Gαs, GABAAγ2, eNOS,<br> | | PSD-95, SNAP25, Gαs, GABAAγ2, eNOS,<br> | ||
| ゴルジ体<br> | | ゴルジ体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC4<br> | | DHHC4<br> | ||
| ZDHHC4<br> | | ZDHHC4<br> | ||
| BACE1<br> | | BACE1<br> | ||
| ゴルジ体<br> | | ゴルジ体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC5<br> | | DHHC5<br> | ||
| ZDHHC5<br> | | ZDHHC5<br> | ||
| STREX<br> | | STREX<br> | ||
| <br> | | <br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC6<br> | | DHHC6<br> | ||
| ZDHHC6<br> | | ZDHHC6<br> | ||
| <br> | | <br> | ||
| <br> | | <br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC7<br> | | DHHC7<br> | ||
| ZDHHC7<br> | | ZDHHC7<br> | ||
| PSD-95, SNAP25, Gαs, GAP43, GABAAγ2, eNOS<br> | | PSD-95, SNAP25, Gαs, GAP43, GABAAγ2, eNOS<br> | ||
| ゴルジ体<br> | | ゴルジ体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC8<br> | | DHHC8<br> | ||
| ZDHHC8<br> | | ZDHHC8<br> | ||
| PSD-95, SNAP25, eNOS, パラレンミン1<br> | | PSD-95, SNAP25, eNOS, パラレンミン1<br> | ||
| ゴルジ体<br> | | ゴルジ体<br> | ||
| 統合失調症<br> | | 統合失調症<br> | ||
|- | |- | ||
| DHHC9'''<br>''' | | DHHC9'''<br>''' | ||
| ZDHHC9<br> | | ZDHHC9<br> | ||
| H-RAS, N-Ras<br> | | H-RAS, N-Ras<br> | ||
| 小胞体/ゴルジ体<br> | | 小胞体/ゴルジ体<br> | ||
| 癌、[[X連鎖神経遅滞]]<br> | | 癌、[[X連鎖神経遅滞]]<br> | ||
|- | |- | ||
| DHHC10<br> | | DHHC10<br> | ||
| ZDHHC11<br> | | ZDHHC11<br> | ||
| <br> | | <br> | ||
| 小胞体<br> | | 小胞体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC11<br> | | DHHC11<br> | ||
| ZDHHC23<br>NIDD<br> | | ZDHHC23<br>NIDD<br> | ||
| <br> | | <br> | ||
| 小胞体<br> | | 小胞体<br> | ||
| 癌<br> | | 癌<br> | ||
|- | |- | ||
| DHHC12<br> | | DHHC12<br> | ||
| ZDHHC12<br> | | ZDHHC12<br> | ||
| ABCトランスポーターA1<br> | | ABCトランスポーターA1<br> | ||
| 小胞体/ゴルジ体<br> | | 小胞体/ゴルジ体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC13<br> | | DHHC13<br> | ||
| ZDHHC24<br> | | ZDHHC24<br> | ||
| huntingtin<br> | | huntingtin<br> | ||
| 小胞体<br> | | 小胞体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC14<br> | | DHHC14<br> | ||
| ZDHHC14<br> | | ZDHHC14<br> | ||
| <br> | | <br> | ||
| 小胞体<br> | | 小胞体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC15<br> | | DHHC15<br> | ||
| ZDHHC15<br> | | ZDHHC15<br> | ||
| PSD-95, [[GAP43]], GABAAγ2, [[BACE1]], CD151<br> | | PSD-95, [[GAP43]], GABAAγ2, [[BACE1]], CD151<br> | ||
| ゴルジ体<br> | | ゴルジ体<br> | ||
| X連鎖神経遅滞<br> | | X連鎖神経遅滞<br> | ||
|- | |- | ||
| DHHC16<br> | | DHHC16<br> | ||
| ZDHHC16<br> | | ZDHHC16<br> | ||
| <br> | | <br> | ||
| 小胞体<br> | | 小胞体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC17<br> | | DHHC17<br> | ||
| ZDHHC17 <br>HIP14 | | ZDHHC17 <br>HIP14 | ||
| SNAP25, ハンチンチン, <br> | | SNAP25, ハンチンチン, <br> | ||
| ゴルジ体<br> | | ゴルジ体<br> | ||
| ハンチントン病、癌<br> | | ハンチントン病、癌<br> | ||
|- | |- | ||
| DHHC18<br> | | DHHC18<br> | ||
| ZDHHC18<br> | | ZDHHC18<br> | ||
| <br> | | <br> | ||
| ゴルジ体<br> | | ゴルジ体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC19<br> | | DHHC19<br> | ||
| ZDHHC19<br> | | ZDHHC19<br> | ||
| R-Ras<br> | | R-Ras<br> | ||
| 小胞体<br> | | 小胞体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC20<br> | | DHHC20<br> | ||
| ZDHHC20<br> | | ZDHHC20<br> | ||
| BACE1, ABCトランスポーターA1<br> | | BACE1, ABCトランスポーターA1<br> | ||
| 細胞膜<br> | | 細胞膜<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC21<br> | | DHHC21<br> | ||
| ZDHHC21<br> | | ZDHHC21<br> | ||
| eNOS, Lck, Fyn, ABCトランスポーターA1<br> | | eNOS, Lck, Fyn, ABCトランスポーターA1<br> | ||
| 細胞膜<br> | | 細胞膜<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC22<br> | | DHHC22<br> | ||
| ZDHHC13<br> | | ZDHHC13<br> | ||
| <br> | | <br> | ||
| 小胞体/ゴルジ体<br> | | 小胞体/ゴルジ体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| DHHC23<br> | | DHHC23<br> | ||
| ZDHHC25<br> | | ZDHHC25<br> | ||
| <br> | | <br> | ||
| <br> | | <br> | ||
| <br> | | <br> | ||
|- | |- | ||
| <br> | | <br> | ||
| ZDHHC22<br> | | ZDHHC22<br> | ||
| <br> | | <br> | ||
| <br> | | <br> | ||
| <br> | | <br> | ||
|} | |} | ||
| 232行目: | 221行目: | ||
上記の通り少数ではあるが''N''-パルミトイル化タンパク質が存在する。主に細胞外分泌タンパク質にみられる。[[ソニックヘッジホッグ]]が代表的であり、[[wikipedia:Hhat|ヘッジホッグアシルトランスフェラーゼ]](Hedgehog acyltransferase : Hhat)により''N''-パルミトイル化される。HhatはMBOAT(membrane-bound O-acyltransferase)に属している。MBOATは複数回膜貫通タンパク質であり、相同性があるタンパク質の配列の解析からMBOATのパルミトイル化酵素活性に重要なアミノ酸が明らかにされている<ref><pubmed>20585641</pubmed></ref>。 | 上記の通り少数ではあるが''N''-パルミトイル化タンパク質が存在する。主に細胞外分泌タンパク質にみられる。[[ソニックヘッジホッグ]]が代表的であり、[[wikipedia:Hhat|ヘッジホッグアシルトランスフェラーゼ]](Hedgehog acyltransferase : Hhat)により''N''-パルミトイル化される。HhatはMBOAT(membrane-bound O-acyltransferase)に属している。MBOATは複数回膜貫通タンパク質であり、相同性があるタンパク質の配列の解析からMBOATのパルミトイル化酵素活性に重要なアミノ酸が明らかにされている<ref><pubmed>20585641</pubmed></ref>。 | ||
== ''S''-パルミトイル化の生理機能 == | == ''S''-パルミトイル化の生理機能== | ||
=== 概説 === | === 概説 === | ||
[[Image:Plamitoylation Figure3.png|thumb|right|250px|'''図3 <i>S</i>-パルミトイル化の生理的機能''']] | |||
細胞質タンパク質に対するS-パルミトイル化はタンパク質合成直後にER膜やゴルジ膜に存在する''S''-パルミトイルアシル転移酵素により行われる。その結果、タンパク質の疎水性が著しく上昇し、パルミトイル化タンパク質は細胞膜近傍へ輸送され、細胞膜に繋ぎとめられる(図3A)。続いて細胞膜に繋ぎとめられたパルミトイル化タンパク質はPPTにより脱パルミトイル化されると細胞膜から解放され、細胞質あるいはゴルジ体表面へと輸送される。最近、生細胞イメージングにより、H-Ras やGα<sub>q</sub>などのS-パルミトイル化タンパク質が、パルミトイルサイクルに応じて、細胞膜とゴルジ体の間をシャトリングする現象が明らかになった<ref><pubmed>15705808</pubmed></ref><ref name=Tsutsumi><pubmed>19001095</pubmed></ref>。 Gα<sub>q</sub>の'''S''-パルミトイルアシル転移酵素であるDHHC3はゴルジ体膜上で機能しており、''S''-パルミトイルアシル転移酵素の局在部位と活性がシャトリングの場所と速度を規定すると考えられる<ref name=Tsutsumi><pubmed>19001095</pubmed></ref>。 | |||
膜タンパク質に対するS-パルミトイル化も細胞質タンパク質と同様にゴルジ膜の''S''-パルミトイルアシル転移酵素により行われる。膜タンパク質はS-パルミトイル化とは無関係にゴルジ体から細胞膜へ輸送されるが、S-パルミトイル化は[[脂質ラフト]]を代表とする細胞膜上の微小ドメインへの輸送(図3A、図3B-a)、タンパク質―タンパク質相互作用(図3B-b,c)、コンフォメーション変化によるタンパク質の活性制御において重要であると考えられている。 | |||
脂質ラフトはコレステロールや[[wikipedia:ja:スフィンゴ脂質|スフィンゴ脂質]]を多く含む脂質秩序相で、エンドサイトーシス、細胞-細胞間接着、細胞-細胞外マトリックス相互作用などにおける機能性膜微小ドメインとして知られる。パルミチン酸はコレステロールやスフィンゴ脂質に対して高い親和性を示すことが知られており、''S''-パルミトイル化は脂質ラフトにおけるタンパク質集積、複合体形成において重要な役割を担っていると考えられている。神経細胞における[[シナプス]]前膜および後膜や免疫細胞における免疫細胞間インターフェース(免疫シナプス)は脂質ラフトを含む膜局所構造で、この部位に集積するタンパク質についてS-パルミトイル化の生理学的意義が盛んに解析されているため紹介する。 | |||
脂質ラフトはコレステロールや[[wikipedia:ja:スフィンゴ脂質|スフィンゴ脂質]]を多く含む脂質秩序相で、エンドサイトーシス、細胞-細胞間接着、細胞-細胞外マトリックス相互作用などにおける機能性膜微小ドメインとして知られる。パルミチン酸はコレステロールやスフィンゴ脂質に対して高い親和性を示すことが知られており、''S''-パルミトイル化は脂質ラフトにおけるタンパク質集積、複合体形成において重要な役割を担っていると考えられている。神経細胞における[[シナプス]] | |||
=== 神経細胞における''S''-パルミトイル化の機能 === | === 神経細胞における''S''-パルミトイル化の機能 === | ||
神経細胞は[[軸索]]と[[樹状突起]]という機能の異なる突起を有する高度に極性化した細胞で、シナプスという微少な接着部位を介して、細胞間の情報伝達が行われている。このシナプス前膜(軸索側:シナプス前膜)と後膜(樹状突起側:シナプス後膜)には、シナプス伝達に関わる特殊なタンパク質が局在化しているが、これら多くのシナプスタンパク質が''S''-パルミトイル化されることが知られている<ref name= | 神経細胞は[[軸索]]と[[樹状突起]]という機能の異なる突起を有する高度に極性化した細胞で、シナプスという微少な接着部位を介して、細胞間の情報伝達が行われている。このシナプス前膜(軸索側:シナプス前膜)と後膜(樹状突起側:シナプス後膜)には、シナプス伝達に関わる特殊なタンパク質が局在化しているが、これら多くのシナプスタンパク質が''S''-パルミトイル化されることが知られている<ref name=Rujun><pubmed>19092927</pubmed></ref><ref name=YukoFukata_NatRevNeurosci><pubmed>20168314</pubmed></ref>。PSD-95はシナプス後膜の足場タンパク質として、[[AMPA型グルタミン酸受容体]](AMPA受容体)などの様々な膜タンパク質のシナプス局在を制御する。細胞膜貫通領域を有さないPSD-95がポストシナプス膜直下に局在化するためには、''S''-パルミトイル化が必須である。PSD-95の''S''-パルミトイル化レベルはAMPA受容体のシナプス後膜への集積数を規定するので、シナプス伝達効率を制御しうる重要な翻訳後修飾である。DHHCファミリー''S''-パルミトイルアシル転移酵素のうちDHHC2/15およびDHHC3/7サブファミリーがPSD-95に対する''S''-パルミトイルアシル転移酵素活性を有している<ref name=MasakiFukata_Neuron><pubmed>15603741</pubmed></ref>。[[海馬]]神経細胞においてはDHHC2とDHHC3がPSD-95のシナプス局在に必須の''S''-パルミトイルアシル転移酵素であること、それぞれは神経細胞の違った場所で機能しており、特にDHHC2が樹状突起のシナプス近傍で神経活動を感受してPSD-95のパルミトイル化レベルを制御することが示された <ref name=Jun_J_Cell_Biol><pubmed>19596852</pubmed></ref>。また、最近AMPA受容体や[[NMDA型グルタミン酸受容体]]もパルミトイル化されることが示されている<ref><pubmed>19874789</pubmed></ref>。 | ||
=== 免疫細胞における''S''-パルミトイル化の機能 === | === 免疫細胞における''S''-パルミトイル化の機能 === | ||
| 256行目: | 245行目: | ||
S-パルミトイル化タンパク質の検出には[<sup>3</sup>H]-パルミチン酸による[[wikipedia:ja:放射性同位元素|放射性同位元素]]を用いた[[wikipedia:Isotopic labeling|代謝標識法]]がよく用いられ、''S''-パルミトイル化タンパク質の多くはこの手法により解析されてきた。しかし、放射性同位元素の検出感度には限界があり、微量タンパク質の検出には向いていない。現在は図4で示す方法もよく利用されるようになっている。 | S-パルミトイル化タンパク質の検出には[<sup>3</sup>H]-パルミチン酸による[[wikipedia:ja:放射性同位元素|放射性同位元素]]を用いた[[wikipedia:Isotopic labeling|代謝標識法]]がよく用いられ、''S''-パルミトイル化タンパク質の多くはこの手法により解析されてきた。しかし、放射性同位元素の検出感度には限界があり、微量タンパク質の検出には向いていない。現在は図4で示す方法もよく利用されるようになっている。 | ||
=== 精製方法 === | === 精製方法=== | ||
''S''-パルミトイル化タンパク質の精製方法として近年2つの方法が開発された。ABE(acyl-biotinyl exchange)法およびパルミチン酸誘導体代謝標識法である(図4)。前者はチオール特異的修飾試薬である[[wikipedia:N-Ethylmaleimide|''N''-エチルマレイミド]](NEM)で遊離のチオールをマスクした後、チオエステル結合を特異的に切断する[[wikipedia:ja:ヒドロキシルアミン|ヒドロキシルアミン]]を用いてパルミチン酸を遊離させる。その後、チオール特異的[[wikipedia:ja:ビオチン|ビオチン]]化試薬で処理して新たに露出したチオールをビオチン化する方法である。ビオチン化タンパク質を[[wikipedia:ja:アビジン|アビジン]]結合担体に結合させることにより、''S''-パルミトイル化されていたタンパク質を特異的に精製できる(図4A)。 | ''S''-パルミトイル化タンパク質の精製方法として近年2つの方法が開発された。ABE(acyl-biotinyl exchange)法およびパルミチン酸誘導体代謝標識法である(図4)。前者はチオール特異的修飾試薬である[[wikipedia:N-Ethylmaleimide|''N''-エチルマレイミド]](NEM)で遊離のチオールをマスクした後、チオエステル結合を特異的に切断する[[wikipedia:ja:ヒドロキシルアミン|ヒドロキシルアミン]]を用いてパルミチン酸を遊離させる。その後、チオール特異的[[wikipedia:ja:ビオチン|ビオチン]]化試薬で処理して新たに露出したチオールをビオチン化する方法である。ビオチン化タンパク質を[[wikipedia:ja:アビジン|アビジン]]結合担体に結合させることにより、''S''-パルミトイル化されていたタンパク質を特異的に精製できる(図4A)。 | ||
| 262行目: | 251行目: | ||
後者は末端アルキルを有するパルミチン酸誘導体17-ODYAで、細胞内のパルミトイル化タンパク質を代謝標識し、[[wikipedia:ja:クリックケミストリー|クリックケミストリー]]を利用してタグを導入する方法で、タグを利用して[[wikipedia:Affinity chromatography|アフィニティー精製]]が可能である(図4B)。 | 後者は末端アルキルを有するパルミチン酸誘導体17-ODYAで、細胞内のパルミトイル化タンパク質を代謝標識し、[[wikipedia:ja:クリックケミストリー|クリックケミストリー]]を利用してタグを導入する方法で、タグを利用して[[wikipedia:Affinity chromatography|アフィニティー精製]]が可能である(図4B)。 | ||
両者は[[質量分析]]と合わせて大規模''S''-パルミトイル化タンパク質探索法として用いられており、既知のパルミトイル化タンパク質に加えて、多くの新規基質が同定されている<ref name= | 両者は[[質量分析]]と合わせて大規模''S''-パルミトイル化タンパク質探索法として用いられており、既知のパルミトイル化タンパク質に加えて、多くの新規基質が同定されている<ref name=Amy_Cell><pubmed>16751107</pubmed></ref><ref name=Rujun><pubmed>19092927</pubmed></ref><ref><pubmed>19137006</pubmed></ref><ref><pubmed>19801377</pubmed></ref>。 | ||
[[Image:Palmitoylation Figure4.png|thumb|right|300px|'''図4 S-パルミトイル化タンパク質の精製方法''']] | [[Image:Palmitoylation Figure4.png|thumb|right|300px|'''図4 S-パルミトイル化タンパク質の精製方法''']] | ||
| 268行目: | 257行目: | ||
=== DHHC酵素-基質ペアの同定法 === | === DHHC酵素-基質ペアの同定法 === | ||
哺乳類のDHHCファミリー''S''-パルミトイルアシル転移酵素遺伝子を用いた活性スクリーニング法が用いられている。培養細胞に基質タンパク質および各DHHC酵素を共発現させ、[<sup>3</sup>H]-パルミチン酸代謝標識により酵素依存的なS-パルミトイル化の上昇を調べる<ref name= | 哺乳類のDHHCファミリー''S''-パルミトイルアシル転移酵素遺伝子を用いた活性スクリーニング法が用いられている。培養細胞に基質タンパク質および各DHHC酵素を共発現させ、[<sup>3</sup>H]-パルミチン酸代謝標識により酵素依存的なS-パルミトイル化の上昇を調べる<ref name=MasakiFukata_Neuron><pubmed>15603741</pubmed></ref><ref name=YukoFukata_methods><pubmed>17012030</pubmed></ref>。一方、酵母では、7種類のDHHCファミリー''S''-パルミトイルアシル転移酵素遺伝子のそれぞれ(あるいは複数)を欠失した変異体と上記ABE法-質量分析法を組み合わせて、変異体でパルミトイル化レベルが低下するタンパク質を同定することにより、''S''-パルミトイルアシル転移酵素-基質ペアが同定されている<ref name=Amy_Cell><pubmed>16751107</pubmed></ref>。 | ||
=== DHHC酵素阻害剤 === | === DHHC酵素阻害剤 === | ||
これまで脂質系[[阻害剤]]と低分子性阻害剤がDHHCファミリー''S''-パルミトイルアシル転移酵素阻害剤としていくつか報告されている。脂質系阻害剤では2-ブロモパルミチン酸(2-bromopalmitate; 2-BP)、Cerulenin(2,3-epoxy-4-oxo-7,10-dodecadienoylamide)、[[wikipedia:ja:抗生物質|抗生物質]][[wikipedia:tunicamycin|ツニカマイシン]]が阻害能を示す。特に2-BPはS-パルミトイル化サイクルのターンオーバーの解析などに利用されている。しかし、これらはいずれもDHHCファミリー''S''-パルミトイルアシル転移酵素特異的ではなく、脂質代謝系酵素にも影響を及ぼす。近年、脂質ペプチドを用いた''S''-パルミトイルアシル転移酵素阻害剤のハイスループットスクリーニングの確立により、低分子性化合物が5つ報告された。そのうち4つがRasなどのプレニル化タンパク質のパルミトイル化をターゲットとしたもので、''in vivo''において抗腫瘍活性を示した。残りの1つはSrcファミリーなどの''N''-ミリストイル化タンパク質のパルミトイル化をターゲットとしている。詳細は<ref><pubmed>19152182</pubmed></ref>を参考されたい。''S''-パルミトイル化はさまざまな生理・病理現象に関与しているので、''S''-パルミトイル化修飾の阻害剤は次項で示すようなさまざまな疾患の治療薬としても期待できる。 | これまで脂質系[[阻害剤]]と低分子性阻害剤がDHHCファミリー''S''-パルミトイルアシル転移酵素阻害剤としていくつか報告されている。脂質系阻害剤では2-ブロモパルミチン酸(2-bromopalmitate; 2-BP)、Cerulenin(2,3-epoxy-4-oxo-7,10-dodecadienoylamide)、[[wikipedia:ja:抗生物質|抗生物質]][[wikipedia:tunicamycin|ツニカマイシン]]が阻害能を示す。特に2-BPはS-パルミトイル化サイクルのターンオーバーの解析などに利用されている。しかし、これらはいずれもDHHCファミリー''S''-パルミトイルアシル転移酵素特異的ではなく、脂質代謝系酵素にも影響を及ぼす。近年、脂質ペプチドを用いた''S''-パルミトイルアシル転移酵素阻害剤のハイスループットスクリーニングの確立により、低分子性化合物が5つ報告された。そのうち4つがRasなどのプレニル化タンパク質のパルミトイル化をターゲットとしたもので、''in vivo''において抗腫瘍活性を示した。残りの1つはSrcファミリーなどの''N''-ミリストイル化タンパク質のパルミトイル化をターゲットとしている。詳細は<ref><pubmed>19152182</pubmed></ref>を参考されたい。''S''-パルミトイル化はさまざまな生理・病理現象に関与しているので、''S''-パルミトイル化修飾の阻害剤は次項で示すようなさまざまな疾患の治療薬としても期待できる。 | ||
== DHHCファミリー''S''-パルミトイルアシル転移酵素と関連疾患 == | == DHHCファミリー''S''-パルミトイルアシル転移酵素と関連疾患 == | ||
| 286行目: | 275行目: | ||
==== ハンチントン病 ==== | ==== ハンチントン病 ==== | ||
[[ハンチントン病]]は遺伝性精神神経疾患の一つであり、[[舞踏運動]]を中心とする[[不随意運動]]や[[認知症]]などの精神障害を特徴とする難病である。DHHC17はもともとハンチントン病の原因遺伝子である[[ハンチンチン]]の結合タンパク質のひとつ(HIP14)として同定され、のちにDHHCファミリー''S''-パルミトイルアシル転移酵素として分類された。DHHC17/HIP14はHuntingtinをパルミトイル化し、ハンチンチンのパルミトイル化レベルの低下は[[神経毒性]]を誘発することが知られている<ref><pubmed>16699508</pubmed></ref>。 | |||
==== X連鎖精神発達遅滞 ==== | ==== X連鎖精神発達遅滞 ==== | ||
| 296行目: | 283行目: | ||
=== 癌 === | === 癌 === | ||
[[wikipedia:ja:癌遺伝子|癌遺伝子]]として知られるSrcキナーゼファミリーや低分子Gタンパク質Rasの機能は''S''-パルミトイル化により制御されている。そのためSrcファミリーやRasの過剰な''S''-パルミトイル化は[[細胞増殖]]や[[wikipedia:ja:細胞運動|細胞運動]]の秩序を破綻させうると考えられる。DHHC2、DHHC9、DHHC11、DHHC17がある種の癌と関連することが示されているが、その病態機構は明らかではない。 | [[wikipedia:ja:癌遺伝子|癌遺伝子]]として知られるSrcキナーゼファミリーや低分子Gタンパク質Rasの機能は''S''-パルミトイル化により制御されている。そのためSrcファミリーやRasの過剰な''S''-パルミトイル化は[[wikipedia:ja:細胞増殖|細胞増殖]]や[[wikipedia:ja:細胞運動|細胞運動]]の秩序を破綻させうると考えられる。DHHC2、DHHC9、DHHC11、DHHC17がある種の癌と関連することが示されているが、その病態機構は明らかではない。 | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
(執筆者:関谷敦志、深田優子、深田正紀 編集委員:林 康紀) | |||
2012年1月25日 (水) 00:29時点における版
英語名:palmitoylation
タンパク質のS-パルミトイル化は、16炭素鎖飽和脂肪酸であるパルミチン酸がタンパク質のシステイン残基のチオール基を介してチオエステル結合で付加した翻訳後脂質修飾である。パルミトイル化修飾により、タンパク質の疎水性が上昇し、細胞膜や細胞内小器官膜(細胞質内膜)への親和性が上昇する。S-パルミトイル化は細胞内タンパク質や膜タンパク質など多くのタンパク質に見られる普遍的な修飾であり、タンパク質の局在や機能の制御に重要な役割を果たしている。S-パルミトイル化は可逆的であり、細胞内でダイナミックなパルミトイル化-脱パルミトイル化の修飾サイクルを示す。このS-パルミトイル化サイクルによりタンパク質は細胞質、細胞質内膜や細胞膜の間を相互輸送(シャトリング)する。それぞれの反応はS-パルミトイルアシル転移酵素(PAT)とタンパク質パルミトイルチオエステラーゼ(PPT)が担うと考えられていたが、近年PATとして、活性部位にDHHC(Asp-His-His-Cys)配列をもつDHHCタンパク質ファミリーが同定され、S-パルミトイル化の制御機構が明らかになりつつある。
S-パルミトイル化:可逆的脂質修飾

翻訳後修飾の可逆的制御機構は細胞の秩序維持における不可欠なプロセスであり、リン酸化、ユビキチン化、アセチル化などが知られるが、脂質修飾の一つであるS-パルミトイル化(S-palmitoylation)もその担い手である。
タンパク質の脂質修飾は、脂質付加による疎水性上昇効果から細胞質タンパク質の細胞膜への輸送、膜タンパク質の機能性膜ドメインへの側方輸送、タンパク質-脂質相互作用などにおいて重要な役割を果たす。脂質修飾は主に4つに分類され、1)脂肪酸アシル化、2)プレニル化、3)グリコシルホスファチジルイノシトール(GPI)化、および4) コレステロール化である。S-パルミトイル化は脂肪酸アシル化修飾の一つであり、N-ミリストイル化とともに最も主要な脂質修飾である[1]。S-パルミトイル化は可逆的な翻訳後修飾であるのに対し、N-ミリストイル化は不可逆的な共翻訳時修飾であり、両者は協調的に機能することが多い(詳しくはミリストイル化の項を参照されたい)。
S-パルミトイル化は16炭素鎖飽和脂肪酸のパルミチン酸(C16)がタンパク質のシステイン残基チオール(SH基)にチオエステル結合を介して付加する(図1)。パルミチン酸が一般的であるが、他にもミリスチン酸(C14)、ステアリン酸(C18)、その他長鎖脂肪酸が付加される場合もあり、総称してS-アシル化(S-acylation)と呼ぶこともある。また、パルミチン酸が末端アミノ基やヒドロキシル基を介してそれぞれアミド結合(N-パルミトイル化)、エステル結合(O-パルミトイル化)で付加するタンパク質も存在するが、S-パルミトイル化とは責任酵素が異なる。本稿では、以後主にS-パルミトイル化について概説する。
S-パルミトイル化脂質修飾は1970年代にシンドビスウイルスの糖タンパク質と脂質の相互作用解析を目指した研究からその存在が明らかになった。[3H]-パルミチン酸で処理したシンドビスウイルスタンパク質は加熱変性処理を行っても両者の解離が見られず、パルミチン酸の共有結合性修飾が示唆された。パルミチン酸付加物はチオエステル切断試薬であるヒドロキシルアミン(NH2OH)で解離することが分かり、システインのチオールを介したチオエステル結合であることが明らかになった[2]。その後、ウイルスタンパク質に限らずRasや三量体GTP結合タンパク質αサブユニット(Gα)、種々の膜タンパク質がS-パルミトイル化されることが報告された。パルミトイル化反応は可逆的であり、パルミトイル化と脱パルミトイル化のバランスにより、基質タンパク質のパルミトイル化レベルが規定される。このパルミトイルサイクルは、細胞においてはリン酸化などと同様に、外界刺激に反応して、動的に制御されることが知られている。たとえば、Gαsのパルミトイル化レベルは、共役する受容体の活性化により大きく変動する[3]。パルミトイルサイクルは外界刺激依存的にタンパク質の局在や機能を動的に制御する重要な修飾であることが予想される。
しかしながら、2000年代前半まで責任酵素が同定されず、S-パルミトイル化は酵素非依存的な現象と捉える流れも存在した。パルミトイル化発見から30年近い年月が経ってようやくS-パルミトイルアシル転移酵素(palmitoyl acyl transferase, PAT)活性を担うDHHCファミリータンパク質が同定された[4][5]。近年大規模なS-パルミトイル化タンパク質のスクリーニング法が確立され、著しい数のタンパク質がパルミトイル化されることが示された[6][7]。DHHCファミリーS-パルミトイルアシル転移酵素の発見を皮切りに、S-パルミトイルアシル転移酵素と基質のペアの同定が続々とおこなわれており[8][9][10]、S-パルミトイル化が担う細胞レベルの挙動が徐々に輪郭を見せ始めている。
S-パルミトイル化タンパク質
これまでに多くのタンパク質がS-パルミトイル化修飾されることが明らかになってきた(表1)。
| ファミリー | 主な例 |
| 情報伝達分子 小分子GTP結合蛋白質 三量体GTP結合蛋白質 Srcファミリー非受容体型チロシンキナーゼ その他 |
H-Ras, N-Ras,R-Ras, RhoB, Cdc42 isoform 2, Rab10 Gαs, Gαq, Gαi2 Yes, Fyn, Lyn, Lck, Hcr, Fgr, Yrk GAP43, eNOS, パラレミニン, ハンチンチン, GAD65, スタスミン2 |
|
膜蛋白質 |
GluR1/2, GABAA γ2, アクアポリン 4, Kv1.1 ロドプシン, β2-アドレナリン受容体, インテグリンα6, CD4, CD8, CD9, NCAM140, ニューロファシン, DCC (deleted in colorectal cancer) グルタミン酸トランスポーターEAAT1サブタイプ, EAAT3サブタイプ MT1-マトリックスメタロプロテアーゼ PLP, Neuronal membrane glycoprotein M6-a (GPM6A) β-セクレターゼ, ニカストリン Fas, 低親和性神経成長因子受容体 |
| 足場蛋白質 |
PSD-95, PSD-93α/β, Glutamate receptor interacting protein (GRIP)1/2, デルフィリン |
| ウイルス蛋白質 |
インフルエンザ HA H1サブユニット, シンドビスウイルスE2蛋白質, HIV-1 gp160 |
| N-パルミトイル化蛋白質 |
ソニックヘッジホッグ, Wnt, グレリン |
Ras(H-Ras, N-Ras)やSrcキナーゼファミリー(Fyn、Lck。但しSrc自体はパルミトイル化されない)、Gタンパク質αサブユニット(Gαs, Gαi, Gαo)などのシグナルタンパク質、各種足場タンパク質(PSD-95, GRIP)、さらには、膜貫通タンパク質であるグルタミン酸受容体などのイオンチャネル、テトラスパニン(CD9, CD151)、インテグリンなどの細胞接着分子、Gタンパク質共役型受容体、ウイルス構成タンパク質など多岐にわたる。特に近年S-パルミトイル化の大規模探索(下記参照)がおこなわれ、非常に多くのタンパク質が候補として挙げられている。表1に主なパルミトイル化タンパク質を示す。
S-パルミトイル化はタンパク質内の近接する複数のシステインに付加する例も多く、またN-ミリストイル化やプレニル化とともに二重の脂質修飾を受けるタンパク質も複数知られている。S-パルミトイル化とN-ミリストイル化の二重修飾を受けるタンパク質としてSrcキナーゼファミリーのFynやLck、Gタンパク質αサブユニット(Gαi1、Gαoなど)、内皮型一酸化窒素合成酵素(endothelial NO synthase; eNOS)が有名である。詳細はミリストイル化の項を参照されたい。一方プレニル化はイソプレノイドがシステイン残基にチオエーテル結合で結合する脂質修飾の総称で、15炭素鎖のファルネシル化と20炭素鎖のゲラニルゲラニル化の2種類の修飾が存在する。H-RasやN-RasはS-パルミトイル化とプレニル化(ファルネシル化)の二重修飾を受けるタンパク質として有名であり、2つのCys残基はC末端領域の互いに近い位置にある。二重修飾の場合、パルミトイル化修飾は、ミリストイル化あるいはプレニル化された基質に対してのみ二次的に起こることが知られている。
パルミトイル化蛋白質すべてに共通するコンセンサス配列は現時点では決定されていないが(下記参照)、これまでの知見を基に、S-パルミトイル化の予測プログラムCSS-palmが開発されておりインターネット上でフリーソフトとして配布されている。詳しくはこちらを参照されたい。
パルミトイル化サイクルの責任酵素
S-パルミトイル化酵素の発見とその反応機構
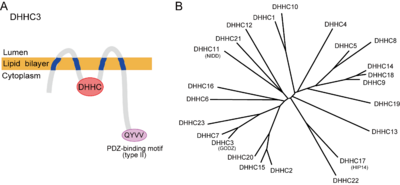
2002年に酵母を用いた順行性遺伝学的手法によりErf2 (effector of Ras function 2)/Erf4複合体[4]、Akr-1[5]がS-パルミトイルアシル転移酵素として同定された。Erf2は4回膜貫通タンパク質でErf4と複合体を形成してRas2のパルミトイル化を担う。Akr-1(ankyrin repeat containing-1)は酵母カゼインキナーゼYck2をパルミトイル化する。相同性解析の結果これらはともに複数回の膜貫通領域に加えて、細胞質内領域に約50アミノ酸からなるシステインリッチドメイン(cysteine rich domain; CRD)を有しており、このドメイン内にパルミトイル化に不可欠なDHHC(Asp-His-His-Cys)配列を有していた(図2A)。ゲノムデータベース上、酵母では7種類、哺乳動物では24種類のDHHCファミリータンパク質が存在する(図2B;表2)。これまで、パルミトイル化反応がパルミトイル-CoA存在下で非酵素的に進行することも知られていたが、少なくとも酵母ではDHHCファミリーS-パルミトイルアシル転移酵素が細胞内のパルミトイル化の大部分を担っていることが示された[6]。また哺乳類のDHHCファミリーS-パルミトイルアシル転移酵素遺伝子を用いた活性スクリーニング法(下記参照)などにより、24種類のうちのほとんどが何かしらの基質に対して酵素活性を示すことが明らかになってきた(表2)。DHHCファミリーS-パルミトイルアシル転移酵素は、CRDの相同性からさらにサブファミリーに分類できる(図2B)。DHHC酵素の基質特異性は、サブファミリーごとに保存される傾向にあり、またひとつの基質は複数のDHHCファミリーS-パルミトイルアシル転移酵素により修飾されうる(表2)。
GFP融合DHHCファミリーS-パルミトイルアシル転移酵素を過剰発現させた系で局在が調べられており、ほとんどが小胞体またはゴルジ体に存在しており、一部細胞膜に局在していた(表2)[11]。したがって発現部位の特異性は低いと思われるが、DHHCファミリーS-パルミトイルアシル転移酵素の発現量の少なさゆえに抗体による特異的検出が難しく、内在性DHHCファミリーS-パルミトイルアシル転移酵素の局在に関してはほとんど明らかにされていない。最近の特異的抗体を用いた局在解析の結果、DHHC2は過剰発現系では小胞体/ゴルジ体に確認されたのに対して、内在性DHHC2は小胞(vesicle)上にも局在していた。その一方で、同じく過剰発現系でゴルジ体に見られたDHHC3は内在性酵素もゴルジ体に局在していた[12]。DHHC2および3は複数の基質において重複が確認されている。DHHCファミリーS-パルミトイルアシル転移酵素それぞれの細胞内局在がS-パルミトイル化反応の時間・空間的制御機構に関与する可能性を示唆している。
酵母Saccharomyces cerevisiaeのErf2の解析からDHHCファミリーS-パルミトイルアシル転移酵素によるS-パルミトイル化は2段階のプロセスからなることが報告された[13]。1)パルミトイル-CoA存在下で、DHHC配列のうちCys残基が自己パルミトイル化(autopalmitoylaton)された後、2)基質のCys残基にパルミトイル基が移行する。S-パルミトイル化のコンセンサス配列は現時点では明らかになっていないが、現在進められている酵素-基質ペアの同定により、各DHHCファミリーS-パルミトイルアシル転移酵素が認識するパルミトイルモチーフが異なることが明らかになってきており、DHHCファミリーS-パルミトイルアシル転移酵素個々(あるいはサブファミリーごと)のコンセンサス配列が存在する可能性がある。
| 酵素 | 別名 | 主な基質 | 局在(過剰発現系) | 関連疾患 |
|---|---|---|---|---|
| DHHC1 | ZDHHC1 | 小胞体 | ||
| DHHC2 | ZDHHC2 | PSD-95, SNAP25, eNOS, Nde1, CD151, ABCトランスポーターA1 |
小胞体/ゴルジ体 |
癌 |
| DHHC3 |
ZDHHC3 GODZ |
PSD-95, SNAP25, Gαs, GABAAγ2, eNOS, |
ゴルジ体 |
|
| DHHC4 |
ZDHHC4 |
BACE1 |
ゴルジ体 |
|
| DHHC5 |
ZDHHC5 |
STREX |
||
| DHHC6 |
ZDHHC6 |
|||
| DHHC7 |
ZDHHC7 |
PSD-95, SNAP25, Gαs, GAP43, GABAAγ2, eNOS |
ゴルジ体 |
|
| DHHC8 |
ZDHHC8 |
PSD-95, SNAP25, eNOS, パラレンミン1 |
ゴルジ体 |
統合失調症 |
| DHHC9 |
ZDHHC9 |
H-RAS, N-Ras |
小胞体/ゴルジ体 |
癌、X連鎖神経遅滞 |
| DHHC10 |
ZDHHC11 |
小胞体 |
||
| DHHC11 |
ZDHHC23 NIDD |
小胞体 |
癌 | |
| DHHC12 |
ZDHHC12 |
ABCトランスポーターA1 |
小胞体/ゴルジ体 |
|
| DHHC13 |
ZDHHC24 |
huntingtin |
小胞体 |
|
| DHHC14 |
ZDHHC14 |
小胞体 |
||
| DHHC15 |
ZDHHC15 |
PSD-95, GAP43, GABAAγ2, BACE1, CD151 |
ゴルジ体 |
X連鎖神経遅滞 |
| DHHC16 |
ZDHHC16 |
小胞体 |
||
| DHHC17 |
ZDHHC17 HIP14 |
SNAP25, ハンチンチン, |
ゴルジ体 |
ハンチントン病、癌 |
| DHHC18 |
ZDHHC18 |
ゴルジ体 |
||
| DHHC19 |
ZDHHC19 |
R-Ras |
小胞体 |
|
| DHHC20 |
ZDHHC20 |
BACE1, ABCトランスポーターA1 |
細胞膜 |
|
| DHHC21 |
ZDHHC21 |
eNOS, Lck, Fyn, ABCトランスポーターA1 |
細胞膜 |
|
| DHHC22 |
ZDHHC13 |
小胞体/ゴルジ体 |
||
| DHHC23 |
ZDHHC25 |
|||
| ZDHHC22 |
脱パルミトイル化酵素
これまでタンパク質パルミトイルチオエステラーゼ(Palmitoyl-protein thioesterase (PPT), 脱パルミトイル化酵素)としてacyl protein thioesterase 1 (APT1)とPPT1が報告されている[14][15]。ATP1はラットの肝臓からリゾホスフォリパーゼとして同定され、その後RasやeNOSに対する脱パルミトイル化活性が見出された。PPT1(Palmitoyl-protein thioesterase 1)はウシの脳からH-Rasを脱パルミトイル化する酵素として同定された。APT1は細胞質タンパク質である一方、PPT1は膜タンパク質で管腔側に酵素活性部位があると示唆されており、細胞質に存在するパルミトイル化タンパク質の脱パルミトイル化酵素として機能するかに関しては議論の余地がある。APT1、PPT1のいずれ(あるいはそのファミリー分子APT2, PPT2)が、細胞膜あるいは細胞質内膜直下に存在する多くのパルミトイル化タンパク質に広く作用する酵素であるのかについては、まだ不明である。また、APT1、PPT1で脱パルミトイル化されないS-パルミトイル化タンパク質も多数存在する。PATの多様性からPPTも相同性の高いファミリーが担っている可能性が予測されるが、現時点では不明である。
MBOAT アシルトランスフェラーゼファミリー
上記の通り少数ではあるがN-パルミトイル化タンパク質が存在する。主に細胞外分泌タンパク質にみられる。ソニックヘッジホッグが代表的であり、ヘッジホッグアシルトランスフェラーゼ(Hedgehog acyltransferase : Hhat)によりN-パルミトイル化される。HhatはMBOAT(membrane-bound O-acyltransferase)に属している。MBOATは複数回膜貫通タンパク質であり、相同性があるタンパク質の配列の解析からMBOATのパルミトイル化酵素活性に重要なアミノ酸が明らかにされている[16]。
S-パルミトイル化の生理機能
概説
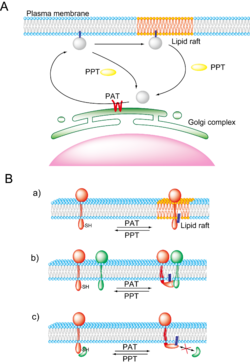
細胞質タンパク質に対するS-パルミトイル化はタンパク質合成直後にER膜やゴルジ膜に存在するS-パルミトイルアシル転移酵素により行われる。その結果、タンパク質の疎水性が著しく上昇し、パルミトイル化タンパク質は細胞膜近傍へ輸送され、細胞膜に繋ぎとめられる(図3A)。続いて細胞膜に繋ぎとめられたパルミトイル化タンパク質はPPTにより脱パルミトイル化されると細胞膜から解放され、細胞質あるいはゴルジ体表面へと輸送される。最近、生細胞イメージングにより、H-Ras やGαqなどのS-パルミトイル化タンパク質が、パルミトイルサイクルに応じて、細胞膜とゴルジ体の間をシャトリングする現象が明らかになった[17][18]。 Gαqの'S-パルミトイルアシル転移酵素であるDHHC3はゴルジ体膜上で機能しており、S-パルミトイルアシル転移酵素の局在部位と活性がシャトリングの場所と速度を規定すると考えられる[18]。
膜タンパク質に対するS-パルミトイル化も細胞質タンパク質と同様にゴルジ膜のS-パルミトイルアシル転移酵素により行われる。膜タンパク質はS-パルミトイル化とは無関係にゴルジ体から細胞膜へ輸送されるが、S-パルミトイル化は脂質ラフトを代表とする細胞膜上の微小ドメインへの輸送(図3A、図3B-a)、タンパク質―タンパク質相互作用(図3B-b,c)、コンフォメーション変化によるタンパク質の活性制御において重要であると考えられている。
脂質ラフトはコレステロールやスフィンゴ脂質を多く含む脂質秩序相で、エンドサイトーシス、細胞-細胞間接着、細胞-細胞外マトリックス相互作用などにおける機能性膜微小ドメインとして知られる。パルミチン酸はコレステロールやスフィンゴ脂質に対して高い親和性を示すことが知られており、S-パルミトイル化は脂質ラフトにおけるタンパク質集積、複合体形成において重要な役割を担っていると考えられている。神経細胞におけるシナプス前膜および後膜や免疫細胞における免疫細胞間インターフェース(免疫シナプス)は脂質ラフトを含む膜局所構造で、この部位に集積するタンパク質についてS-パルミトイル化の生理学的意義が盛んに解析されているため紹介する。
神経細胞におけるS-パルミトイル化の機能
神経細胞は軸索と樹状突起という機能の異なる突起を有する高度に極性化した細胞で、シナプスという微少な接着部位を介して、細胞間の情報伝達が行われている。このシナプス前膜(軸索側:シナプス前膜)と後膜(樹状突起側:シナプス後膜)には、シナプス伝達に関わる特殊なタンパク質が局在化しているが、これら多くのシナプスタンパク質がS-パルミトイル化されることが知られている[7][10]。PSD-95はシナプス後膜の足場タンパク質として、AMPA型グルタミン酸受容体(AMPA受容体)などの様々な膜タンパク質のシナプス局在を制御する。細胞膜貫通領域を有さないPSD-95がポストシナプス膜直下に局在化するためには、S-パルミトイル化が必須である。PSD-95のS-パルミトイル化レベルはAMPA受容体のシナプス後膜への集積数を規定するので、シナプス伝達効率を制御しうる重要な翻訳後修飾である。DHHCファミリーS-パルミトイルアシル転移酵素のうちDHHC2/15およびDHHC3/7サブファミリーがPSD-95に対するS-パルミトイルアシル転移酵素活性を有している[8]。海馬神経細胞においてはDHHC2とDHHC3がPSD-95のシナプス局在に必須のS-パルミトイルアシル転移酵素であること、それぞれは神経細胞の違った場所で機能しており、特にDHHC2が樹状突起のシナプス近傍で神経活動を感受してPSD-95のパルミトイル化レベルを制御することが示された [12]。また、最近AMPA受容体やNMDA型グルタミン酸受容体もパルミトイル化されることが示されている[19]。
免疫細胞におけるS-パルミトイル化の機能
T細胞シグナル伝達における主要な因子、T細胞受容体CD4およびCD8、アダプタータンパク質LAT、Cbp/PAG、SrcキナーゼファミリーLck、FynがS-パルミトイル化される。これらはパルミトイル化により脂質ラフトに凝集し、T細胞の活性化に重要であると考えられている。また、T細胞の活性化に伴い、Lckのパルミトイル化レベルが大きく変動することが示されている。DHHC21がLckやFynのPATとして同定されている[20](表2)が、T細胞機能におけるDHHC21の生理機能については、現時点では明らかになっていない。
パルミトイル化修飾の解析方法
検出方法
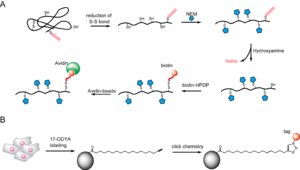
S-パルミトイル化タンパク質の検出には[3H]-パルミチン酸による放射性同位元素を用いた代謝標識法がよく用いられ、S-パルミトイル化タンパク質の多くはこの手法により解析されてきた。しかし、放射性同位元素の検出感度には限界があり、微量タンパク質の検出には向いていない。現在は図4で示す方法もよく利用されるようになっている。
精製方法
S-パルミトイル化タンパク質の精製方法として近年2つの方法が開発された。ABE(acyl-biotinyl exchange)法およびパルミチン酸誘導体代謝標識法である(図4)。前者はチオール特異的修飾試薬であるN-エチルマレイミド(NEM)で遊離のチオールをマスクした後、チオエステル結合を特異的に切断するヒドロキシルアミンを用いてパルミチン酸を遊離させる。その後、チオール特異的ビオチン化試薬で処理して新たに露出したチオールをビオチン化する方法である。ビオチン化タンパク質をアビジン結合担体に結合させることにより、S-パルミトイル化されていたタンパク質を特異的に精製できる(図4A)。
後者は末端アルキルを有するパルミチン酸誘導体17-ODYAで、細胞内のパルミトイル化タンパク質を代謝標識し、クリックケミストリーを利用してタグを導入する方法で、タグを利用してアフィニティー精製が可能である(図4B)。
両者は質量分析と合わせて大規模S-パルミトイル化タンパク質探索法として用いられており、既知のパルミトイル化タンパク質に加えて、多くの新規基質が同定されている[6][7][21][22]。
DHHC酵素-基質ペアの同定法
哺乳類のDHHCファミリーS-パルミトイルアシル転移酵素遺伝子を用いた活性スクリーニング法が用いられている。培養細胞に基質タンパク質および各DHHC酵素を共発現させ、[3H]-パルミチン酸代謝標識により酵素依存的なS-パルミトイル化の上昇を調べる[8][9]。一方、酵母では、7種類のDHHCファミリーS-パルミトイルアシル転移酵素遺伝子のそれぞれ(あるいは複数)を欠失した変異体と上記ABE法-質量分析法を組み合わせて、変異体でパルミトイル化レベルが低下するタンパク質を同定することにより、S-パルミトイルアシル転移酵素-基質ペアが同定されている[6]。
DHHC酵素阻害剤
これまで脂質系阻害剤と低分子性阻害剤がDHHCファミリーS-パルミトイルアシル転移酵素阻害剤としていくつか報告されている。脂質系阻害剤では2-ブロモパルミチン酸(2-bromopalmitate; 2-BP)、Cerulenin(2,3-epoxy-4-oxo-7,10-dodecadienoylamide)、抗生物質ツニカマイシンが阻害能を示す。特に2-BPはS-パルミトイル化サイクルのターンオーバーの解析などに利用されている。しかし、これらはいずれもDHHCファミリーS-パルミトイルアシル転移酵素特異的ではなく、脂質代謝系酵素にも影響を及ぼす。近年、脂質ペプチドを用いたS-パルミトイルアシル転移酵素阻害剤のハイスループットスクリーニングの確立により、低分子性化合物が5つ報告された。そのうち4つがRasなどのプレニル化タンパク質のパルミトイル化をターゲットとしたもので、in vivoにおいて抗腫瘍活性を示した。残りの1つはSrcファミリーなどのN-ミリストイル化タンパク質のパルミトイル化をターゲットとしている。詳細は[23]を参考されたい。S-パルミトイル化はさまざまな生理・病理現象に関与しているので、S-パルミトイル化修飾の阻害剤は次項で示すようなさまざまな疾患の治療薬としても期待できる。
DHHCファミリーS-パルミトイルアシル転移酵素と関連疾患
表1に示したようにDHHCファミリーS-パルミトイルアシル転移酵素によりS-パルミトイル化されるタンパク質の機能は多岐にわたり、S-パルミトイル化は細胞の恒常性維持に欠かせないプロセスである。その一方で、パルミトイル化制御システムの破綻は疾患の引き金になり、その表現型も多岐にわたっている。これまでに報告されているDHHCファミリーS-パルミトイルアシル転移酵素と関連疾患を表2に示す。
精神神経疾患
統合失調症
統合失調症の原因遺伝子のひとつとしてDHHC8が同定されている。DHHC8遺伝子は22番染色体に位置し、統合失調症と関連性が高い22q11.2微小欠失症候群の27個の遺伝子群に含まれている。DHHC8ノックアウトマウスは22q11.2微小欠失マウスと表現系が似ており、統合失調症の症状を示す。
ハンチントン病
ハンチントン病は遺伝性精神神経疾患の一つであり、舞踏運動を中心とする不随意運動や認知症などの精神障害を特徴とする難病である。DHHC17はもともとハンチントン病の原因遺伝子であるハンチンチンの結合タンパク質のひとつ(HIP14)として同定され、のちにDHHCファミリーS-パルミトイルアシル転移酵素として分類された。DHHC17/HIP14はHuntingtinをパルミトイル化し、ハンチンチンのパルミトイル化レベルの低下は神経毒性を誘発することが知られている[24]。
X連鎖精神発達遅滞
男性に発症する難病であるX連鎖精神発達遅滞の関連遺伝子としてDHHC9およびDHHC15が同定されているが、これらDHHCファミリーS-パルミトイルアシル転移酵素の基質と病態の関連については、まだ明らかになっていない。
癌
癌遺伝子として知られるSrcキナーゼファミリーや低分子Gタンパク質Rasの機能はS-パルミトイル化により制御されている。そのためSrcファミリーやRasの過剰なS-パルミトイル化は細胞増殖や細胞運動の秩序を破綻させうると考えられる。DHHC2、DHHC9、DHHC11、DHHC17がある種の癌と関連することが示されているが、その病態機構は明らかではない。
参考文献
- ↑
Nadolski, M.J., & Linder, M.E. (2007).
Protein lipidation. The FEBS journal, 274(20), 5202-10. [PubMed:17892486] [WorldCat] [DOI] - ↑
Schmidt, M.F., Bracha, M., & Schlesinger, M.J. (1979).
Evidence for covalent attachment of fatty acids to Sindbis virus glycoproteins. Proceedings of the National Academy of Sciences of the United States of America, 76(4), 1687-91. [PubMed:287008] [PMC] [WorldCat] [DOI] - ↑
Wedegaertner, P.B., & Bourne, H.R. (1994).
Activation and depalmitoylation of Gs alpha. Cell, 77(7), 1063-70. [PubMed:7912657] [WorldCat] [DOI] - ↑ 4.0 4.1
Lobo, S., Greentree, W.K., Linder, M.E., & Deschenes, R.J. (2002).
Identification of a Ras palmitoyltransferase in Saccharomyces cerevisiae. The Journal of biological chemistry, 277(43), 41268-73. [PubMed:12193598] [WorldCat] [DOI] - ↑ 5.0 5.1
Roth, A.F., Feng, Y., Chen, L., & Davis, N.G. (2002).
The yeast DHHC cysteine-rich domain protein Akr1p is a palmitoyl transferase. The Journal of cell biology, 159(1), 23-8. [PubMed:12370247] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3
Roth, A.F., Wan, J., Bailey, A.O., Sun, B., Kuchar, J.A., Green, W.N., ..., & Davis, N.G. (2006).
Global analysis of protein palmitoylation in yeast. Cell, 125(5), 1003-13. [PubMed:16751107] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Kang, R., Wan, J., Arstikaitis, P., Takahashi, H., Huang, K., Bailey, A.O., ..., & El-Husseini, A. (2008).
Neural palmitoyl-proteomics reveals dynamic synaptic palmitoylation. Nature, 456(7224), 904-9. [PubMed:19092927] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2
Fukata, M., Fukata, Y., Adesnik, H., Nicoll, R.A., & Bredt, D.S. (2004).
Identification of PSD-95 palmitoylating enzymes. Neuron, 44(6), 987-96. [PubMed:15603741] [WorldCat] [DOI] - ↑ 9.0 9.1
Fukata, Y., Iwanaga, T., & Fukata, M. (2006).
Systematic screening for palmitoyl transferase activity of the DHHC protein family in mammalian cells. Methods (San Diego, Calif.), 40(2), 177-82. [PubMed:17012030] [WorldCat] [DOI] - ↑ 10.0 10.1
Fukata, Y., & Fukata, M. (2010).
Protein palmitoylation in neuronal development and synaptic plasticity. Nature reviews. Neuroscience, 11(3), 161-75. [PubMed:20168314] [WorldCat] [DOI] - ↑
Ohno, Y., Kihara, A., Sano, T., & Igarashi, Y. (2006).
Intracellular localization and tissue-specific distribution of human and yeast DHHC cysteine-rich domain-containing proteins. Biochimica et biophysica acta, 1761(4), 474-83. [PubMed:16647879] [WorldCat] [DOI] - ↑ 12.0 12.1
Noritake, J., Fukata, Y., Iwanaga, T., Hosomi, N., Tsutsumi, R., Matsuda, N., ..., & Fukata, M. (2009).
Mobile DHHC palmitoylating enzyme mediates activity-sensitive synaptic targeting of PSD-95. The Journal of cell biology, 186(1), 147-60. [PubMed:19596852] [PMC] [WorldCat] [DOI] - ↑
Mitchell, D.A., Mitchell, G., Ling, Y., Budde, C., & Deschenes, R.J. (2010).
Mutational analysis of Saccharomyces cerevisiae Erf2 reveals a two-step reaction mechanism for protein palmitoylation by DHHC enzymes. The Journal of biological chemistry, 285(49), 38104-14. [PubMed:20851885] [PMC] [WorldCat] [DOI] - ↑
Duncan, J.A., & Gilman, A.G. (1998).
A cytoplasmic acyl-protein thioesterase that removes palmitate from G protein alpha subunits and p21(RAS). The Journal of biological chemistry, 273(25), 15830-7. [PubMed:9624183] [WorldCat] [DOI] - ↑
Camp, L.A., Verkruyse, L.A., Afendis, S.J., Slaughter, C.A., & Hofmann, S.L. (1994).
Molecular cloning and expression of palmitoyl-protein thioesterase. The Journal of biological chemistry, 269(37), 23212-9. [PubMed:7916016] [WorldCat] - ↑
Buglino, J.A., & Resh, M.D. (2010).
Identification of conserved regions and residues within Hedgehog acyltransferase critical for palmitoylation of Sonic Hedgehog. PloS one, 5(6), e11195. [PubMed:20585641] [PMC] [WorldCat] [DOI] - ↑
Rocks, O., Peyker, A., Kahms, M., Verveer, P.J., Koerner, C., Lumbierres, M., ..., & Bastiaens, P.I. (2005).
An acylation cycle regulates localization and activity of palmitoylated Ras isoforms. Science (New York, N.Y.), 307(5716), 1746-52. [PubMed:15705808] [WorldCat] [DOI] - ↑ 18.0 18.1
Tsutsumi, R., Fukata, Y., Noritake, J., Iwanaga, T., Perez, F., & Fukata, M. (2009).
Identification of G protein alpha subunit-palmitoylating enzyme. Molecular and cellular biology, 29(2), 435-47. [PubMed:19001095] [PMC] [WorldCat] [DOI] - ↑
Hayashi, T., Thomas, G.M., & Huganir, R.L. (2009).
Dual palmitoylation of NR2 subunits regulates NMDA receptor trafficking. Neuron, 64(2), 213-26. [PubMed:19874789] [PMC] [WorldCat] [DOI] - ↑
Mill, P., Lee, A.W., Fukata, Y., Tsutsumi, R., Fukata, M., Keighren, M., ..., & Jackson, I.J. (2009).
Palmitoylation regulates epidermal homeostasis and hair follicle differentiation. PLoS genetics, 5(11), e1000748. [PubMed:19956733] [PMC] [WorldCat] [DOI] - ↑
Martin, B.R., & Cravatt, B.F. (2009).
Large-scale profiling of protein palmitoylation in mammalian cells. Nature methods, 6(2), 135-8. [PubMed:19137006] [PMC] [WorldCat] [DOI] - ↑
Yang, W., Di Vizio, D., Kirchner, M., Steen, H., & Freeman, M.R. (2010).
Proteome scale characterization of human S-acylated proteins in lipid raft-enriched and non-raft membranes. Molecular & cellular proteomics : MCP, 9(1), 54-70. [PubMed:19801377] [PMC] [WorldCat] [DOI] - ↑
Draper, J.M., & Smith, C.D. (2009).
Palmitoyl acyltransferase assays and inhibitors (Review). Molecular membrane biology, 26(1), 5-13. [PubMed:19152182] [PMC] [WorldCat] [DOI] - ↑
Yanai, A., Huang, K., Kang, R., Singaraja, R.R., Arstikaitis, P., Gan, L., ..., & Hayden, M.R. (2006).
Palmitoylation of huntingtin by HIP14 is essential for its trafficking and function. Nature neuroscience, 9(6), 824-31. [PubMed:16699508] [PMC] [WorldCat] [DOI]
(執筆者:関谷敦志、深田優子、深田正紀 編集委員:林 康紀)