「DARPP-32」の版間の差分
細 Nijcadmin (トーク) による編集を Akinorinishi による直前の版へ差し戻しました タグ: 巻き戻し |
Akinorinishi (トーク | 投稿記録) 細編集の要約なし |
||
| (5人の利用者による、間の32版が非表示) | |||
| 1行目: | 1行目: | ||
• 英語名 | |||
英語名:dopamine- and [[cAMP]]-regulated phosphoprotein, M''<sub>r</sub>'' 32 kDa | 英語名:dopamine- and [[cAMP]]-regulated phosphoprotein, M''<sub>r</sub>'' 32 kDa | ||
英略語:DARPP-32 | 英略語:DARPP-32 | ||
• 同義語 | |||
同義語:protein phosphatase 1 regulatory (inhibitor) subunit 1B (PPP1R1B) | 同義語:protein phosphatase 1 regulatory (inhibitor) subunit 1B (PPP1R1B) | ||
• 要約 | |||
DARPP- | DARPP-32は、ドパミン情報伝達効率を制御するリン酸化タンパク質である。ドパミン神経の投射を受ける神経核、特に線条体や側坐核に多く発現している。DARPP-32のThr34が[[プロテインキナーゼA]]([[PKA]])によりリン酸化されると、プロテインホスファターゼ1(PP1)活性を抑制する。PP1活性の抑制はPP1基質タンパク質のリン酸化を促進し、PP1基質タンパク質の機能変化を誘導する。ドパミンによるD<sub>1</sub>受容体刺激によって活性化されたPKAは、PKA基質をリン酸化すると同時に、DARPP-32をリン酸化してPP1活性を抑制することにより、PKA/PP1基質のリン酸化を効率よく促進する。また、DARPP-32は、ドパミンと他の神経伝達物質([[グルタミン酸]]、アデノシン、[[アセチルコリン]]など)のシグナルを統合する分子としても重要である。遺伝子改変[[マウス]]を用いた行動解析により、DARPP-32は薬物依存、パーキンソン病、[[統合失調症]]などの病態とその治療薬の作用発現に重要であることが明らかにされている<ref name=ref1><pubmed> 10433257 </pubmed></ref> <ref name=ref2><pubmed> 14744247 </pubmed></ref>。 | ||
== イントロダクション == | == イントロダクション == | ||
DARPP- | DARPP-32は、ドパミン神経の投射を受ける線条体組織において、PKAによりリン酸化されるタンパク質をスクリーニングすることにより、1983年にPaul Greengard博士らにより発見された<ref><pubmed> 6296685 </pubmed></ref>。電気泳動(SDS-PAGE)において32 kDaの分子量であったため、“ドパミンおよび[[cyclic AMP]]によりリン酸化が制御される32 kDaのタンパク質”としてDARAPP-32と名付けられた。Greengard博士は、DARPP-32を中心とするドパミン情報伝達の解明により、2000年のノーベル生理・医学賞を受賞している。 | ||
== 構造 == | == 構造 == | ||
[[ファイル:Fig1 DARPP-32 構造.jpg| | [[ファイル:Fig1 DARPP-32 構造.jpg|サムネイル|図1 DARPP-32の構造とリン酸化サイト マウスのDARPP-32アミノ酸配列とリン酸化サイトを上段に示す。Thr34がリン酸化されるとPP1活性を抑制し、Thr75がリン酸化されるとPKA活性を抑制する。また、P-Ser97は核外移行シグナル(NES)として機能する。下段には、ヒトのDARPP-32アミノ酸配列とt-DARPPアミノ酸配列を示す。]] | ||
194-205アミノ酸(マウス 194; [[ラット]] 205; [[ヒト]] 204)より構成される酸性タンパク質である。リン酸化により機能が制御されるタンパク質であり、4つのリン酸化サイト[Thr34 (PKA)、Thr75 ([[Cdk5]])、Ser97 (CK2)、Ser130 (CK1)(マウスアミノ酸配列による)]の機能的意義が明らかにされている<ref name=ref2 />(図1)。N末端の7-11アミノ酸配列(KKIQF)はPP1触媒サブユニット(PP1c)結合モチーフとなっており、PP1cとの結合に重要である。さらに、リン酸化Thr34(P-Thr34)を含む領域は、Thr34がリン酸化されるとPP1c活性部位と結合してPP1c活性を抑制する<ref><pubmed> 9651542 </pubmed></ref>。Ser97近傍の103-111アミノ酸配列は核外移行シグナル(nuclear export signal, NES)となっており、Ser97がリン酸化されたDARPP-32はchromosome region maintenance 1 protein(CRM1)と結合して核外に移行する<ref name=ref3><pubmed> 18496528 </pubmed></ref>。 | |||
194- | |||
== サブファミリー == | == サブファミリー == | ||
Inhibitor-1のN末端 40アミノ酸配列はDARPP-32と40%の相同性があり、PP1c結合モチーフを持つ。さらに、inhibitor-1のThr35がPKAによりリン酸化されるとPP1c活性部位と結合して活性を抑制する。DARPP-32と異なり、inhibitor-1は中枢神経系および末梢組織に幅広く発現する<ref name=ref4><pubmed> 10662690 </pubmed></ref>。 | |||
== | == 発現(組織分布、細胞内分布) == | ||
中枢神経において、黒質と腹側被蓋野から多くのドパミン神経の投射を受ける線条体(背側線条体;被殻と尾状核 )、側坐核(腹側線条体)、嗅結節に高い発現がみられる。ドパミン神経の投射が比較的少ない脳部位では、[[大脳皮質]]や[[海馬]]などで低いレベルではあるが発現を認める<ref><pubmed> 6319625 </pubmed></ref> <ref><pubmed> 1353788 </pubmed></ref>。線条体では、直接路(ドパミン[[D1]]受容体を発現)と間接路(ドパミン[[D2受容体]]を発現)の2つのタイプの中型有棘神経細胞(medium spiny neuron, MSN)にDARPP-32は発現しており、[[コリン]]作動性介在神経、[[GABA作動性]]介在神経、ドパミン[[神経終末]]での発現は認められていない<ref name=ref2 /> <ref name=ref5><pubmed> 2191086 </pubmed></ref>。<br /> | |||
DARPP-32の細胞内分布であるが、線条体の中型有棘神経細胞の細胞質、樹状突起、[[軸索]]に発現している。DARPP-32は、細胞質分画に発現するタンパク質として分離されたが<ref><pubmed> 6319627 </pubmed></ref>、[[免疫染色]]により核内にも存在することが示唆されていた<ref name=ref5 />。その後、DARPP-32は細胞質—核内をシャトリングしていることが明らかにされた。ドパミンD1受容体刺激によりPKAが活性化されるとPP2Aの活性化によりP-Ser97が脱リン酸化され、NES機能の低下により核内にDARPP-32が蓄積する<ref name=ref3 />。また、DARPP-32の結合タンパク質はPP1c以外には知られていなかったが、[[細胞骨格]]の安定性とスパイン可塑性に関わるβ-adducinと結合することが報告された<ref><pubmed> 26639316 </pubmed></ref>。 | |||
== 機能 == | == 機能 == | ||
=== リン酸化によるDARPP-32の機能調節 === | === リン酸化によるDARPP-32の機能調節 === | ||
DARPP-32の最も重要な機能は、Thr34がPKAによりリン酸化されたP-Thr34 DARPP-32によるPP1活性の抑制である。DARPP-32はN末端7-11残基(KKIQF)にPP1c結合モチーフを持ち、この結合モチーフを介してPP1cと結合する。さらに、DARPP-32のThr34がPKAによりリン酸化されるとPP1c活性部位に対する親和性が増し、PP1活性を抑制する<ref name=ref4 /> | DARPP-32の最も重要な機能は、Thr34がPKAによりリン酸化されたP-Thr34 DARPP-32によるPP1活性の抑制である。DARPP-32はN末端7-11残基(KKIQF)にPP1c結合モチーフを持ち、この結合モチーフを介してPP1cと結合する。さらに、DARPP-32のThr34がPKAによりリン酸化されるとPP1c活性部位に対する親和性が増し、PP1活性を抑制する<ref name=ref4 />(図1)。PP1により機能が制御されるタンパク質として、NMDA受容体、AMPA受容体、Na<sup>+</sup>チャンネル、Ca<sup>2+</sup>チャンネル、Na<sup>+</sup>,K<sup>+</sup>-ATPase、ヒストンH3などが知られている<ref name=ref1 /> <ref name=ref2 /> <ref><pubmed> 21779236 </pubmed></ref>。NMDA受容体GluN1 (NR1) サブユニット(Ser897)、AMPA受容体GluA1 (GluR1) サブユニット(Ser845)はPKAによりリン酸化されるが、同時にP-Thr34 DARPP-32がPP-1による脱リン酸化を抑制するため、これらのPKA/PP-1基質のリン酸化が効率良く促進される。<br /> | ||
DARPP-32はPKAの他に、Cdk5(Thr75)、CK2(Ser97)、CK1(Ser130)によりリン酸化される。Cdk5によってリン酸化されたP-Thr75 DARPP-32はPKAを抑制する。つまり、DARPP-32はThr34あるいはThr75のリン酸化により、PP-1抑制タンパク質としてもPKA抑制タンパク質としても機能する<ref><pubmed> 10604473 </pubmed></ref>。<br /> | |||
Ser97、Ser130のリン酸化は、DARPP-32分子内メカニズムによりThr34リン酸化・脱リン酸化のカイネティクスを調節している。CK2によるSer97のリン酸化はThr34のPKAによるリン酸化を促進し<ref><pubmed> 2557337 </pubmed></ref>、CK1によるSer130のリン酸化はThr34のPP2B(カルシニューリン)による脱リン酸化を抑制する<ref><pubmed> 9461512 </pubmed></ref>(図1)。その結果、Ser97、Ser130のリン酸化により、ドパミンD<sub>1</sub>受容体/PKA/DARPP-32シグナルは促進される。<br /> | |||
Ser97のCK2によるリン酸化は、DARPP-32の細胞質—核内シャトリングの調節に重要である。P-Ser97 DARPP-32は核外に輸送されるが、Ser97が脱リン酸化されるとNESが機能しないためDARPP-32が核内に蓄積する<ref name=ref3 />。 | |||
DARPP-32はPKAの他に、Cdk5(Thr75)、CK2(Ser97)、CK1(Ser130)によりリン酸化される。Cdk5によってリン酸化されたP-Thr75 DARPP-32はPKAを抑制する。つまり、DARPP-32はThr34あるいはThr75のリン酸化により、PP-1抑制タンパク質としてもPKA抑制タンパク質としても機能する<ref><pubmed> 10604473 </pubmed></ref>。 | |||
Ser97、Ser130のリン酸化は、DARPP- | |||
=== DARPP-32の脱リン酸化調節 === | === DARPP-32の脱リン酸化調節 === | ||
DARPP- | DARPP-32のリン酸化レベルは、プロテインキナーゼによるリン酸化とプロテインホスファターゼによる脱リン酸化のバランスによって決定される。特に、P-Thr34 DARPP-32を脱リン酸化するPP2Bは、グルタミン酸によるNMDA受容体やAMPA受容体の刺激に伴うCa<sup>2+</sup>シグナルによって活性化される。ドパミンD<sub>1</sub>受容体やアデノシンA<sub>2A</sub>受容体によって活性化されるPKAシグナルはThr34をリン酸化し、グルタミン酸により活性化されるPP2BはP−Thr34を脱リン酸化する。拮抗的なドパミンD1受容体シグナルとNMDA受容体・AMPA受容体シグナルは、P-Thr34 DARPP-32のリン酸化を介して統合される<ref name=ref6><pubmed> 9334390 </pubmed></ref>。P-Thr34 DARPP-32は、PP2Bに加え、PKAにより活性化されるPP2A/B56δによっても脱リン酸化される。<br /> | ||
P-Thr75 DARPP-32は主にPP2Aにより脱リン酸化される。PKAにより活性化されるPP2A/B56δとCa<sup>2+</sup>により活性化されるPP2A/PR72の両者により脱リン酸化される。P-Ser97 DARPP-32は主にPP2A(PP2A/B56δとPP2A/PR72の両者)により脱リン酸化される。P-Ser130 DARPP-32はPP2AとPP2Cにより脱リン酸化される。このように、脱リン酸化に関わるプロテインホスファターゼはリン酸化サイト毎に異なり、Ca<sup>2+</sup>やPKAにより活性が調節されている<ref><pubmed> 26979514 </pubmed></ref>。 | P-Thr75 DARPP-32は主にPP2Aにより脱リン酸化される。PKAにより活性化されるPP2A/B56δとCa<sup>2+</sup>により活性化されるPP2A/PR72の両者により脱リン酸化される。P-Ser97 DARPP-32は主にPP2A(PP2A/B56δとPP2A/PR72の両者)により脱リン酸化される。P-Ser130 DARPP-32はPP2AとPP2Cにより脱リン酸化される。このように、脱リン酸化に関わるプロテインホスファターゼはリン酸化サイト毎に異なり、Ca<sup>2+</sup>やPKAにより活性が調節されている<ref><pubmed> 26979514 </pubmed></ref>。 | ||
=== | === ドパミンによるPKA/DARPP-32/PP1シグナル調節 === | ||
ドパミンD<sub>1</sub>受容体刺激はGs/olfタンパク質を介してアデニル酸シクラーゼを活性化し、cAMP/PKA/P-Thr34 DARPP-32シグナルを促進してPP1を抑制する。一方、ドパミンD<sub>2</sub>受容体はGiタンパク質を介してアデニル酸シクラーゼを抑制するため、cAMP/PKA/P-Thr34 DARPP-32シグナルは抑制されてPP1は活性化する<ref name=ref6 />。<br /> | |||
ドパミンD<sub>1</sub>受容体刺激はPKAを介してPP2A/B56δを活性化し、P-Thr75を脱リン酸化する<ref><pubmed> 17301223 </pubmed></ref>。P-Thr75 DARPP-32によるPKAの抑制がはずれるため、cAMP/PKA/P-Thr34 DARPP-32シグナルは効率よく伝達されるようになる<ref name=ref7><pubmed> 11050161 </pubmed></ref>。また、活性化されたPP2A/B56δはP-Ser97も脱リン酸化するため、P-Thr34/dephospho-Ser97 DARPP-32が核内に蓄積して核内PP1を抑制する<ref name=ref3 />。 | |||
=== 神経伝達物質シグナルを統合するDARPP-32 === | === 神経伝達物質シグナルを統合するDARPP-32 === | ||
DARPP- | DARPP-32はドパミン作用増幅因子であるとともに、複数の神経伝達物質シグナルの統合分子としても重要である。線条体は、大脳皮質と視床からの興奮性グルタミン酸作動性入力を受ける。グルタミン酸は、NMDA受容体およびAMPA受容体を介するCa<sup>2+</sup>シグナルの活性化に加え、代謝型グルタミン酸受容体(mGluR)シグナルを活性化してDARPP-32リン酸化を調節する。その結果、グルタミン酸シグナルはドパミン/PKA/DARPP-32/PP1シグナルと複雑な相互作用を示す<ref><pubmed> 15657149 </pubmed></ref>。さらに、線条体におけるDARPP-32リン酸化は、アセチルコリンを神経伝達物質とする介在神経や、アデノシン、セロトニン、GABA、エンケファリン、ニューロテンシンなどにより調節を受けている<ref name=ref2 />。 | ||
=== | === 直接路と間接路におけるDARPP-32機能の違い === | ||
[[ファイル:Fig2 D32 MSN.jpg| | [[ファイル:Fig2 D32 MSN.jpg|サムネイル|図2 線条体直接路および間接路神経におけるDARPP-32のリン酸化調節とその機能]] | ||
線条体の[[GABA]]作動性投射神経である中型有棘神経細胞(medium spiny neuron, MSN)は、ドパミンD<sub>1</sub>受容体を発現し黒質網様部(および淡蒼球内節)へ投射する直接路神経(D<sub>1</sub>タイプ; サブスタンスP陽性)と、ドパミンD<sub>2</sub>受容体を発現し淡蒼球外節に投射する間接路神経(D<sub>2</sub>タイプ;エンケファリン陽性)の2種類が存在する。大脳基底核運動制御サーキットにおいて、直接路神経は脱抑制系を、間接路神経は抑制強化系を構成しており、黒質網様部から視床へのGABA作動性出力の調節を介して大脳皮質運動機能を調節している。DARPP-32は直接路および間接路神経の両方に発現している(図2)。<br /> | |||
直接路神経では、D<sub>1</sub>受容体刺激はPKA/P-Thr34 DARPP-32シグナルの活性化によりPP1を抑制し、グルタミン酸シグナルを増強することにより直接路神経を活性化する。一方、間接路神経では、アデノシンA<sub>2A</sub>受容体刺激がPKA/P-Thr34 DARPP-32シグナルを活性化するのに対して、D<sub>2</sub>受容体刺激はPKA/P-Thr34 DARPP-32シグナルを減弱させる。その結果、D<sub>2</sub>受容体刺激はPP1を活性化し、グルタミン酸シグナルを抑制することにより間接路神経の活性を低下させる<ref name=ref2 /> <ref name=ref6 /> <ref name=ref8><pubmed> 18622401 </pubmed></ref>。<br /> | |||
直接路神経と間接路神経のDARPP-32を選択的に欠損したマウスの解析により、それぞれの神経のDARPP-32機能が解析されている<ref name=ref9><pubmed> 20682746 </pubmed></ref>。直接路神経のDARPP-32は、自発行動、コカインによる移所運動の増加、ハロペリドールによるカタレプシー、パーキンソン病モデルにおけるジスキネジアを促進することが示された。一方、間接路神経のDARPP-32は、自発行動、コカインによる移所運動の増加を抑制するが、ハロペリドールによるカタレプシーを促進する。また、これらの行動変化は、それぞれの神経におけるDARPP-32のリン酸化状態と相関性がある<ref name=ref8 />。 | |||
== [[精神神経疾患]]におけるDARPP-32の関与 == | |||
=== 薬物[[依存症]] === | |||
[[コカイン]]の急性投与により、マウスの線条体においてP-Thr34 DARPP-32の増加およびP-Thr75 DARPP-32の減少が起こる<ref name=ref7 />。DARPP-32欠損マウス<ref name=ref10><pubmed> 9694658 </pubmed></ref>、T34A DARPP-32点変異マウス<ref name=ref11><pubmed> 16123776 </pubmed></ref>、D<sub>1</sub>R-DARPP-32-Flag/D<sub>2</sub>R-DARPP-32-Mycマウス<ref name=ref8 />、および直接路神経選択的DARPP-32欠損マウス<ref name=ref9 />の解析の結果、直接路神経におけるDARPP-32のThr34リン酸化がコカイン急性投与による自発運動増加に必要であることが明らかにさらた。その他、DARPP-32欠損マウスでは、[[アンフェタミン]]、コカイン、[[モルヒネ]]、ニコチン、テトラヒドロカンナビノール([[大麻]]の主成分)の全身投与による線条体での細胞外シグナル調節キナーゼ ([[ERK]]) 活性化が抑制されることより<ref><pubmed> 15608059 </pubmed></ref>、DARPP-32は幅広い依存性薬物のドパミン作用を増強していると考えられる。<br /> | |||
DARPP-32欠損マウスでは、コカインによる条件付け場所嗜好性試験(CPP[[テスト]]; conditioned place preference [[test]])においてコカイン条件付けが減弱すること<ref><pubmed> 11955461 </pubmed></ref>や、CPPボックスでコカイン条件付けを行ったマウスを再びCPPボックスに戻すと側坐核でのP-Thr34 DARPP-32が増加することから<ref><pubmed> 18554320 </pubmed></ref>、薬物依存とDARPP-32の関連が示唆されている。コカイン慢性投与では、Cdk5誘導によるP-Thr75 DARPP-32増加と、P-Thr75 DARPP-32によるPKA抑制のためP-Thr34 DARPP-32減少をきたす<ref><pubmed> 11268215 </pubmed></ref> <ref><pubmed> 26142455 </pubmed></ref>。また、T34A DARPP-32点変異マウスでは、コカイン急性投与による自発運動量増加が減弱しているにも関わらず、コカイン慢性投与により惹起される自発運動量が野生型マウスよりも増大しており、行動逆耐性がより強く形成される<ref name=ref11 />。このことは、直接路神経とは別の神経(例えば、間接路神経<ref name=ref9 />)において、行動逆耐性の形成をDARPP-32が抑制していることを示唆している。 | |||
=== | |||
[[コカイン]]の急性投与により、マウスの線条体においてP-Thr34 DARPP-32の増加およびP-Thr75 DARPP-32の減少が起こる<ref name=ref7 />。DARPP-32欠損マウス<ref name=ref10><pubmed> 9694658 </pubmed></ref>、T34A DARPP-32点変異マウス<ref name=ref11><pubmed> 16123776 </pubmed></ref>、D<sub>1</sub>R-DARPP-32-Flag/D<sub>2</sub>R-DARPP-32-Mycマウス<ref name=ref8 />、および直接路神経選択的DARPP-32欠損マウス<ref name=ref9 />の解析の結果、直接路神経におけるDARPP-32のThr34リン酸化がコカイン急性投与による自発運動増加に必要であることが明らかにさらた。その他、DARPP-32欠損マウスでは、[[アンフェタミン]]、コカイン、[[モルヒネ]] | |||
DARPP- | |||
=== パーキンソン病 === | === パーキンソン病 === | ||
パーキンソン病の病態では、線条体におけるドパミン作用の低下により、直接路神経ではP-Thr34 DARPP-32の低下、間接路神経ではP-Thr34 DARPP-32の増加が想定される。しかし、6-hydroxydopamine(6-OHDA)により黒質ドパミン神経を片側的に破壊したパーキンソン病[[モデル動物]]では、線条体組織においても<ref name=ref12><pubmed> 12665799 </pubmed></ref> <ref><pubmed> 16029214 </pubmed></ref> <ref name=ref13><pubmed> 17596448 </pubmed></ref>、直接路神経と間接路神経を個別に解析しても<ref name=ref14><pubmed> 22753408 </pubmed></ref>、P-Thr34 DARPP-32の明らかな変動は捉えられておらず、代償的な調節機構が働いていると考えられる<ref><pubmed> 22877786 </pubmed></ref>。<br /> | |||
パーキンソン病治療薬の[[レボドパ]]([[L-DOPA]])長期服用に伴う副作用として、ジスキネジアとよばれる不随意運動が問題となる。ジスキネジアには、ERK活性化を伴う直接路神経の過剰興奮が関与している<ref><pubmed> 21886608 </pubmed></ref> <ref><pubmed> 18279379 </pubmed></ref>。ジスキネジア病態モデル[[動物]]の線条体では、P-Thr34 DARPP-32が増加し、ERK活性化を促進している<ref name=ref12 /> <ref name=ref14 />。また、DARPP-32欠損マウス<ref name=ref13 />、T34A DARPP-32点変異マウス<ref name=ref14 />、および直接路神経選択的DARPP-32欠損マウス<ref name=ref9 /> <ref name=ref14 />ではジスキネジア様行動異常が減弱することから、ジスキネジアにおける直接路神経過剰興奮の病態にDARPP-32の関与が示唆される。 | |||
パーキンソン病治療薬の[[レボドパ]]([[L-DOPA]] | |||
=== 統合失調症 === | === 統合失調症 === | ||
線条体や側坐核の間接路神経に発現するDARPP- | 線条体や側坐核の間接路神経に発現するDARPP-32はドパミンD<sub>2</sub>受容体作用に対して拮抗的に作用するため<ref name=ref6 /> <ref name=ref8 />、[[抗精神病薬]]の主な薬理作用であるドパミンD<sub>2</sub>受容体アンタゴニストと類似の作用([[陽性症状]]の改善)を持つと考えられる。線条体の間接路神経において、定型抗精神病薬である[[ハロペリドール]]の投与によりP-Thr34 DARPP-32が増加し<ref name=ref9 />、その結果、カタレプシーの発現を増強する<ref name=ref8 />。つまり、間接路神経でのDARPP-32作用は、抗精神病薬の副作用である[[錐体外路症状]]にも関係している。一方、DARPP-32は[[前頭葉]]([[前頭前皮質]])においてもドパミンD<sub>1</sub>受容体によるリン酸化調節を受けており<ref><pubmed> 16687181 </pubmed></ref> <ref><pubmed> 21833500 </pubmed></ref>、[[陰性症状]]や認知機能障害の原因とされる[[中脳]]—皮質ドパミン系の低活動や、抗精神病薬の陰性症状や認知機能障害に対する治療効果にも関与すると考えられる。<br /> | ||
アンフェタミン([[覚せい剤]]、ドパミン神経伝達の亢進)、D-リセルグ酸ジエチルアミド([[LSD]]、[[セロトニン神経]]伝達の亢進)、フェンシクリジン(PCP、グルタミン酸神経伝達の抑制)などの薬物は、それぞれ異なる機序で実験動物に統合失調症様の行動異常を引き起こす。これらの薬物をDARPP-32欠損マウス<ref name=ref10 />、DARPP-32点変異マウス(T34A、T75A、S130A)<ref><pubmed> 14631045 </pubmed></ref>に投与しても統合失調症様の行動異常が起きないことから、統合失調症の病態にDARPP-32の関与が示唆される。<br /> | |||
統合失調症患者において、抗精神病薬治療とは関係なく、前頭前皮質の神経細胞でDARPP-32タンパク質が減少していることが報告されている<ref><pubmed> 12150646 </pubmed></ref> <ref name=ref15><pubmed> 17521792 </pubmed></ref>。DARPP-32 mRNAについては、発現が前頭前皮質で低下しているという報告があるが<ref><pubmed> 18573638 </pubmed></ref>、不変<ref><pubmed> 16786528 </pubmed></ref>あるいは増加<ref><pubmed> 20874815 </pubmed></ref>という報告もあり、意見の一致を見ていない。また、双極性障害患者においても前頭前皮質におけるDARPP-32発現の低下が報告されている<ref name=ref15 />。さらに、統合失調症および[[双極性障害]]の前頭前皮質でDARPP-32のN末端を欠失した[[スプライスバリアント]]であるt-DARPP (truncated isoform of DARPP) [[mRNA]]が増加しているという報告がある<ref><pubmed> 23295814 </pubmed></ref>。動物実験では、出生前のリポ多糖類暴露による統合失調症モデル動物において前頭前皮質のDARPP-32の減少が見られるが<ref><pubmed> 17180123 </pubmed></ref>、すべての統合失調症モデル動物においてDARPP-32の発現が低下するわけではない<ref><pubmed> 22820052 </pubmed></ref> <ref><pubmed> 16132062 </pubmed></ref> <ref><pubmed> 23313709 </pubmed></ref>。<br /> | |||
健常人において、DARPP-32の一塩基多型(SNP)やハプロタイプは、前頭前皮質におけるDARPP-32の発現量、線条体・前頭前皮質の構造、認知機能、報酬予測行動などに影響することが知られている<ref><pubmed> 17290303 </pubmed></ref> <ref><pubmed> 17913879 </pubmed></ref> <ref><pubmed> 19620978 </pubmed></ref>。しかし、DARPP-32のSNPやハプロタイプと統合失調症との関連解析では、一部の報告で関連が認められているものの<ref><pubmed> 17290303 </pubmed></ref>、多くの報告で関連は認められておらず<ref><pubmed> 16750903 </pubmed></ref> <ref><pubmed> 17618027 </pubmed></ref> <ref><pubmed> 17360599 </pubmed></ref> <ref><pubmed> 18055181 </pubmed></ref> <ref><pubmed> 18045777 </pubmed></ref> <ref><pubmed> 20483474 </pubmed></ref>、統合失調症発症の主要なリスク遺伝子である可能性は低い。 | |||
健常人において、DARPP- | |||
== がんにおけるDARPP-32とt-DARPPの役割 == | == がんにおけるDARPP-32とt-DARPPの役割 == | ||
t-DARPP (truncated isoform of DARPP) は、DARPP-32のスプライスバリアントであり、Thr34を含むN末端の36アミノ酸が欠失している<ref name=ref16><pubmed> 26872373 </pubmed></ref> | t-DARPP (truncated isoform of DARPP) は、DARPP-32のスプライスバリアントであり、Thr34を含むN末端の36アミノ酸が欠失している<ref name=ref16><pubmed> 26872373 </pubmed></ref>。胃がんでDARPP-32およびt-DARPPの発現が増加していることが報告されて以来<ref><pubmed> 12124342 </pubmed></ref>、t-DARPPが注目されるようになった。胃がん(腺癌)の3分の2でDARPP-32およびt-DARPPの発現が増加している<ref><pubmed> 16061638 </pubmed></ref>。また、乳がんや前立腺がん、大腸がんにおいてもDARPP-32およびt-DARPPの発現増加が報告されている<ref><pubmed> 14508844 </pubmed></ref>。DARPP-32およびt-DARPPの発現増加は、PP1抑制とは異なる発がん経路の活性化(PI3K/Aktシグナルの活性化、Bcl2の発現など)により、腫瘍細胞の増殖・浸潤・転移や腫瘍血管新生を促進し、また、抗がん剤耐性の獲得にも関与することが明らかにされている<ref name=ref16 />。 | ||
== 参考文献 == | == 参考文献 == | ||
<references/> | <references/> | ||
同義語:ドーパミン<br /> | |||
重要な関連語:ドパミン、グルタミン酸、プロテインキナーゼ、プロテインホスファターゼ、線条体、大脳基底核、t-DARPP<br /> | |||
(執筆者:首藤隆秀、西昭徳、担当編集委員:柚崎通介) | |||
2016年3月30日 (水) 14:22時点における版
• 英語名 英語名:dopamine- and cAMP-regulated phosphoprotein, Mr 32 kDa 英略語:DARPP-32
• 同義語 同義語:protein phosphatase 1 regulatory (inhibitor) subunit 1B (PPP1R1B)
• 要約 DARPP-32は、ドパミン情報伝達効率を制御するリン酸化タンパク質である。ドパミン神経の投射を受ける神経核、特に線条体や側坐核に多く発現している。DARPP-32のThr34がプロテインキナーゼA(PKA)によりリン酸化されると、プロテインホスファターゼ1(PP1)活性を抑制する。PP1活性の抑制はPP1基質タンパク質のリン酸化を促進し、PP1基質タンパク質の機能変化を誘導する。ドパミンによるD1受容体刺激によって活性化されたPKAは、PKA基質をリン酸化すると同時に、DARPP-32をリン酸化してPP1活性を抑制することにより、PKA/PP1基質のリン酸化を効率よく促進する。また、DARPP-32は、ドパミンと他の神経伝達物質(グルタミン酸、アデノシン、アセチルコリンなど)のシグナルを統合する分子としても重要である。遺伝子改変マウスを用いた行動解析により、DARPP-32は薬物依存、パーキンソン病、統合失調症などの病態とその治療薬の作用発現に重要であることが明らかにされている[1] [2]。
イントロダクション
DARPP-32は、ドパミン神経の投射を受ける線条体組織において、PKAによりリン酸化されるタンパク質をスクリーニングすることにより、1983年にPaul Greengard博士らにより発見された[3]。電気泳動(SDS-PAGE)において32 kDaの分子量であったため、“ドパミンおよびcyclic AMPによりリン酸化が制御される32 kDaのタンパク質”としてDARAPP-32と名付けられた。Greengard博士は、DARPP-32を中心とするドパミン情報伝達の解明により、2000年のノーベル生理・医学賞を受賞している。
構造
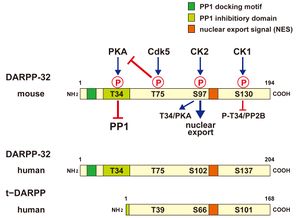
194-205アミノ酸(マウス 194; ラット 205; ヒト 204)より構成される酸性タンパク質である。リン酸化により機能が制御されるタンパク質であり、4つのリン酸化サイト[Thr34 (PKA)、Thr75 (Cdk5)、Ser97 (CK2)、Ser130 (CK1)(マウスアミノ酸配列による)]の機能的意義が明らかにされている[2](図1)。N末端の7-11アミノ酸配列(KKIQF)はPP1触媒サブユニット(PP1c)結合モチーフとなっており、PP1cとの結合に重要である。さらに、リン酸化Thr34(P-Thr34)を含む領域は、Thr34がリン酸化されるとPP1c活性部位と結合してPP1c活性を抑制する[4]。Ser97近傍の103-111アミノ酸配列は核外移行シグナル(nuclear export signal, NES)となっており、Ser97がリン酸化されたDARPP-32はchromosome region maintenance 1 protein(CRM1)と結合して核外に移行する[5]。
サブファミリー
Inhibitor-1のN末端 40アミノ酸配列はDARPP-32と40%の相同性があり、PP1c結合モチーフを持つ。さらに、inhibitor-1のThr35がPKAによりリン酸化されるとPP1c活性部位と結合して活性を抑制する。DARPP-32と異なり、inhibitor-1は中枢神経系および末梢組織に幅広く発現する[6]。
発現(組織分布、細胞内分布)
中枢神経において、黒質と腹側被蓋野から多くのドパミン神経の投射を受ける線条体(背側線条体;被殻と尾状核 )、側坐核(腹側線条体)、嗅結節に高い発現がみられる。ドパミン神経の投射が比較的少ない脳部位では、大脳皮質や海馬などで低いレベルではあるが発現を認める[7] [8]。線条体では、直接路(ドパミンD1受容体を発現)と間接路(ドパミンD2受容体を発現)の2つのタイプの中型有棘神経細胞(medium spiny neuron, MSN)にDARPP-32は発現しており、コリン作動性介在神経、GABA作動性介在神経、ドパミン神経終末での発現は認められていない[2] [9]。
DARPP-32の細胞内分布であるが、線条体の中型有棘神経細胞の細胞質、樹状突起、軸索に発現している。DARPP-32は、細胞質分画に発現するタンパク質として分離されたが[10]、免疫染色により核内にも存在することが示唆されていた[9]。その後、DARPP-32は細胞質—核内をシャトリングしていることが明らかにされた。ドパミンD1受容体刺激によりPKAが活性化されるとPP2Aの活性化によりP-Ser97が脱リン酸化され、NES機能の低下により核内にDARPP-32が蓄積する[5]。また、DARPP-32の結合タンパク質はPP1c以外には知られていなかったが、細胞骨格の安定性とスパイン可塑性に関わるβ-adducinと結合することが報告された[11]。
機能
リン酸化によるDARPP-32の機能調節
DARPP-32の最も重要な機能は、Thr34がPKAによりリン酸化されたP-Thr34 DARPP-32によるPP1活性の抑制である。DARPP-32はN末端7-11残基(KKIQF)にPP1c結合モチーフを持ち、この結合モチーフを介してPP1cと結合する。さらに、DARPP-32のThr34がPKAによりリン酸化されるとPP1c活性部位に対する親和性が増し、PP1活性を抑制する[6](図1)。PP1により機能が制御されるタンパク質として、NMDA受容体、AMPA受容体、Na+チャンネル、Ca2+チャンネル、Na+,K+-ATPase、ヒストンH3などが知られている[1] [2] [12]。NMDA受容体GluN1 (NR1) サブユニット(Ser897)、AMPA受容体GluA1 (GluR1) サブユニット(Ser845)はPKAによりリン酸化されるが、同時にP-Thr34 DARPP-32がPP-1による脱リン酸化を抑制するため、これらのPKA/PP-1基質のリン酸化が効率良く促進される。
DARPP-32はPKAの他に、Cdk5(Thr75)、CK2(Ser97)、CK1(Ser130)によりリン酸化される。Cdk5によってリン酸化されたP-Thr75 DARPP-32はPKAを抑制する。つまり、DARPP-32はThr34あるいはThr75のリン酸化により、PP-1抑制タンパク質としてもPKA抑制タンパク質としても機能する[13]。
Ser97、Ser130のリン酸化は、DARPP-32分子内メカニズムによりThr34リン酸化・脱リン酸化のカイネティクスを調節している。CK2によるSer97のリン酸化はThr34のPKAによるリン酸化を促進し[14]、CK1によるSer130のリン酸化はThr34のPP2B(カルシニューリン)による脱リン酸化を抑制する[15](図1)。その結果、Ser97、Ser130のリン酸化により、ドパミンD1受容体/PKA/DARPP-32シグナルは促進される。
Ser97のCK2によるリン酸化は、DARPP-32の細胞質—核内シャトリングの調節に重要である。P-Ser97 DARPP-32は核外に輸送されるが、Ser97が脱リン酸化されるとNESが機能しないためDARPP-32が核内に蓄積する[5]。
DARPP-32の脱リン酸化調節
DARPP-32のリン酸化レベルは、プロテインキナーゼによるリン酸化とプロテインホスファターゼによる脱リン酸化のバランスによって決定される。特に、P-Thr34 DARPP-32を脱リン酸化するPP2Bは、グルタミン酸によるNMDA受容体やAMPA受容体の刺激に伴うCa2+シグナルによって活性化される。ドパミンD1受容体やアデノシンA2A受容体によって活性化されるPKAシグナルはThr34をリン酸化し、グルタミン酸により活性化されるPP2BはP−Thr34を脱リン酸化する。拮抗的なドパミンD1受容体シグナルとNMDA受容体・AMPA受容体シグナルは、P-Thr34 DARPP-32のリン酸化を介して統合される[16]。P-Thr34 DARPP-32は、PP2Bに加え、PKAにより活性化されるPP2A/B56δによっても脱リン酸化される。
P-Thr75 DARPP-32は主にPP2Aにより脱リン酸化される。PKAにより活性化されるPP2A/B56δとCa2+により活性化されるPP2A/PR72の両者により脱リン酸化される。P-Ser97 DARPP-32は主にPP2A(PP2A/B56δとPP2A/PR72の両者)により脱リン酸化される。P-Ser130 DARPP-32はPP2AとPP2Cにより脱リン酸化される。このように、脱リン酸化に関わるプロテインホスファターゼはリン酸化サイト毎に異なり、Ca2+やPKAにより活性が調節されている[17]。
ドパミンによるPKA/DARPP-32/PP1シグナル調節
ドパミンD1受容体刺激はGs/olfタンパク質を介してアデニル酸シクラーゼを活性化し、cAMP/PKA/P-Thr34 DARPP-32シグナルを促進してPP1を抑制する。一方、ドパミンD2受容体はGiタンパク質を介してアデニル酸シクラーゼを抑制するため、cAMP/PKA/P-Thr34 DARPP-32シグナルは抑制されてPP1は活性化する[16]。
ドパミンD1受容体刺激はPKAを介してPP2A/B56δを活性化し、P-Thr75を脱リン酸化する[18]。P-Thr75 DARPP-32によるPKAの抑制がはずれるため、cAMP/PKA/P-Thr34 DARPP-32シグナルは効率よく伝達されるようになる[19]。また、活性化されたPP2A/B56δはP-Ser97も脱リン酸化するため、P-Thr34/dephospho-Ser97 DARPP-32が核内に蓄積して核内PP1を抑制する[5]。
神経伝達物質シグナルを統合するDARPP-32
DARPP-32はドパミン作用増幅因子であるとともに、複数の神経伝達物質シグナルの統合分子としても重要である。線条体は、大脳皮質と視床からの興奮性グルタミン酸作動性入力を受ける。グルタミン酸は、NMDA受容体およびAMPA受容体を介するCa2+シグナルの活性化に加え、代謝型グルタミン酸受容体(mGluR)シグナルを活性化してDARPP-32リン酸化を調節する。その結果、グルタミン酸シグナルはドパミン/PKA/DARPP-32/PP1シグナルと複雑な相互作用を示す[20]。さらに、線条体におけるDARPP-32リン酸化は、アセチルコリンを神経伝達物質とする介在神経や、アデノシン、セロトニン、GABA、エンケファリン、ニューロテンシンなどにより調節を受けている[2]。
直接路と間接路におけるDARPP-32機能の違い
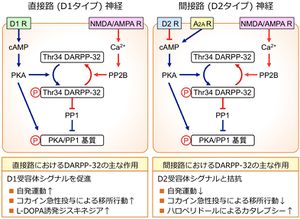
線条体のGABA作動性投射神経である中型有棘神経細胞(medium spiny neuron, MSN)は、ドパミンD1受容体を発現し黒質網様部(および淡蒼球内節)へ投射する直接路神経(D1タイプ; サブスタンスP陽性)と、ドパミンD2受容体を発現し淡蒼球外節に投射する間接路神経(D2タイプ;エンケファリン陽性)の2種類が存在する。大脳基底核運動制御サーキットにおいて、直接路神経は脱抑制系を、間接路神経は抑制強化系を構成しており、黒質網様部から視床へのGABA作動性出力の調節を介して大脳皮質運動機能を調節している。DARPP-32は直接路および間接路神経の両方に発現している(図2)。
直接路神経では、D1受容体刺激はPKA/P-Thr34 DARPP-32シグナルの活性化によりPP1を抑制し、グルタミン酸シグナルを増強することにより直接路神経を活性化する。一方、間接路神経では、アデノシンA2A受容体刺激がPKA/P-Thr34 DARPP-32シグナルを活性化するのに対して、D2受容体刺激はPKA/P-Thr34 DARPP-32シグナルを減弱させる。その結果、D2受容体刺激はPP1を活性化し、グルタミン酸シグナルを抑制することにより間接路神経の活性を低下させる[2] [16] [21]。
直接路神経と間接路神経のDARPP-32を選択的に欠損したマウスの解析により、それぞれの神経のDARPP-32機能が解析されている[22]。直接路神経のDARPP-32は、自発行動、コカインによる移所運動の増加、ハロペリドールによるカタレプシー、パーキンソン病モデルにおけるジスキネジアを促進することが示された。一方、間接路神経のDARPP-32は、自発行動、コカインによる移所運動の増加を抑制するが、ハロペリドールによるカタレプシーを促進する。また、これらの行動変化は、それぞれの神経におけるDARPP-32のリン酸化状態と相関性がある[21]。
精神神経疾患におけるDARPP-32の関与
薬物依存症
コカインの急性投与により、マウスの線条体においてP-Thr34 DARPP-32の増加およびP-Thr75 DARPP-32の減少が起こる[19]。DARPP-32欠損マウス[23]、T34A DARPP-32点変異マウス[24]、D1R-DARPP-32-Flag/D2R-DARPP-32-Mycマウス[21]、および直接路神経選択的DARPP-32欠損マウス[22]の解析の結果、直接路神経におけるDARPP-32のThr34リン酸化がコカイン急性投与による自発運動増加に必要であることが明らかにさらた。その他、DARPP-32欠損マウスでは、アンフェタミン、コカイン、モルヒネ、ニコチン、テトラヒドロカンナビノール(大麻の主成分)の全身投与による線条体での細胞外シグナル調節キナーゼ (ERK) 活性化が抑制されることより[25]、DARPP-32は幅広い依存性薬物のドパミン作用を増強していると考えられる。
DARPP-32欠損マウスでは、コカインによる条件付け場所嗜好性試験(CPPテスト; conditioned place preference test)においてコカイン条件付けが減弱すること[26]や、CPPボックスでコカイン条件付けを行ったマウスを再びCPPボックスに戻すと側坐核でのP-Thr34 DARPP-32が増加することから[27]、薬物依存とDARPP-32の関連が示唆されている。コカイン慢性投与では、Cdk5誘導によるP-Thr75 DARPP-32増加と、P-Thr75 DARPP-32によるPKA抑制のためP-Thr34 DARPP-32減少をきたす[28] [29]。また、T34A DARPP-32点変異マウスでは、コカイン急性投与による自発運動量増加が減弱しているにも関わらず、コカイン慢性投与により惹起される自発運動量が野生型マウスよりも増大しており、行動逆耐性がより強く形成される[24]。このことは、直接路神経とは別の神経(例えば、間接路神経[22])において、行動逆耐性の形成をDARPP-32が抑制していることを示唆している。
パーキンソン病
パーキンソン病の病態では、線条体におけるドパミン作用の低下により、直接路神経ではP-Thr34 DARPP-32の低下、間接路神経ではP-Thr34 DARPP-32の増加が想定される。しかし、6-hydroxydopamine(6-OHDA)により黒質ドパミン神経を片側的に破壊したパーキンソン病モデル動物では、線条体組織においても[30] [31] [32]、直接路神経と間接路神経を個別に解析しても[33]、P-Thr34 DARPP-32の明らかな変動は捉えられておらず、代償的な調節機構が働いていると考えられる[34]。
パーキンソン病治療薬のレボドパ(L-DOPA)長期服用に伴う副作用として、ジスキネジアとよばれる不随意運動が問題となる。ジスキネジアには、ERK活性化を伴う直接路神経の過剰興奮が関与している[35] [36]。ジスキネジア病態モデル動物の線条体では、P-Thr34 DARPP-32が増加し、ERK活性化を促進している[30] [33]。また、DARPP-32欠損マウス[32]、T34A DARPP-32点変異マウス[33]、および直接路神経選択的DARPP-32欠損マウス[22] [33]ではジスキネジア様行動異常が減弱することから、ジスキネジアにおける直接路神経過剰興奮の病態にDARPP-32の関与が示唆される。
統合失調症
線条体や側坐核の間接路神経に発現するDARPP-32はドパミンD2受容体作用に対して拮抗的に作用するため[16] [21]、抗精神病薬の主な薬理作用であるドパミンD2受容体アンタゴニストと類似の作用(陽性症状の改善)を持つと考えられる。線条体の間接路神経において、定型抗精神病薬であるハロペリドールの投与によりP-Thr34 DARPP-32が増加し[22]、その結果、カタレプシーの発現を増強する[21]。つまり、間接路神経でのDARPP-32作用は、抗精神病薬の副作用である錐体外路症状にも関係している。一方、DARPP-32は前頭葉(前頭前皮質)においてもドパミンD1受容体によるリン酸化調節を受けており[37] [38]、陰性症状や認知機能障害の原因とされる中脳—皮質ドパミン系の低活動や、抗精神病薬の陰性症状や認知機能障害に対する治療効果にも関与すると考えられる。
アンフェタミン(覚せい剤、ドパミン神経伝達の亢進)、D-リセルグ酸ジエチルアミド(LSD、セロトニン神経伝達の亢進)、フェンシクリジン(PCP、グルタミン酸神経伝達の抑制)などの薬物は、それぞれ異なる機序で実験動物に統合失調症様の行動異常を引き起こす。これらの薬物をDARPP-32欠損マウス[23]、DARPP-32点変異マウス(T34A、T75A、S130A)[39]に投与しても統合失調症様の行動異常が起きないことから、統合失調症の病態にDARPP-32の関与が示唆される。
統合失調症患者において、抗精神病薬治療とは関係なく、前頭前皮質の神経細胞でDARPP-32タンパク質が減少していることが報告されている[40] [41]。DARPP-32 mRNAについては、発現が前頭前皮質で低下しているという報告があるが[42]、不変[43]あるいは増加[44]という報告もあり、意見の一致を見ていない。また、双極性障害患者においても前頭前皮質におけるDARPP-32発現の低下が報告されている[41]。さらに、統合失調症および双極性障害の前頭前皮質でDARPP-32のN末端を欠失したスプライスバリアントであるt-DARPP (truncated isoform of DARPP) mRNAが増加しているという報告がある[45]。動物実験では、出生前のリポ多糖類暴露による統合失調症モデル動物において前頭前皮質のDARPP-32の減少が見られるが[46]、すべての統合失調症モデル動物においてDARPP-32の発現が低下するわけではない[47] [48] [49]。
健常人において、DARPP-32の一塩基多型(SNP)やハプロタイプは、前頭前皮質におけるDARPP-32の発現量、線条体・前頭前皮質の構造、認知機能、報酬予測行動などに影響することが知られている[50] [51] [52]。しかし、DARPP-32のSNPやハプロタイプと統合失調症との関連解析では、一部の報告で関連が認められているものの[53]、多くの報告で関連は認められておらず[54] [55] [56] [57] [58] [59]、統合失調症発症の主要なリスク遺伝子である可能性は低い。
がんにおけるDARPP-32とt-DARPPの役割
t-DARPP (truncated isoform of DARPP) は、DARPP-32のスプライスバリアントであり、Thr34を含むN末端の36アミノ酸が欠失している[60]。胃がんでDARPP-32およびt-DARPPの発現が増加していることが報告されて以来[61]、t-DARPPが注目されるようになった。胃がん(腺癌)の3分の2でDARPP-32およびt-DARPPの発現が増加している[62]。また、乳がんや前立腺がん、大腸がんにおいてもDARPP-32およびt-DARPPの発現増加が報告されている[63]。DARPP-32およびt-DARPPの発現増加は、PP1抑制とは異なる発がん経路の活性化(PI3K/Aktシグナルの活性化、Bcl2の発現など)により、腫瘍細胞の増殖・浸潤・転移や腫瘍血管新生を促進し、また、抗がん剤耐性の獲得にも関与することが明らかにされている[60]。
参考文献
- ↑ 1.0 1.1
Greengard, P., Allen, P.B., & Nairn, A.C. (1999).
Beyond the dopamine receptor: the DARPP-32/protein phosphatase-1 cascade. Neuron, 23(3), 435-47. [PubMed:10433257] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3 2.4 2.5
Svenningsson, P., Nishi, A., Fisone, G., Girault, J.A., Nairn, A.C., & Greengard, P. (2004).
DARPP-32: an integrator of neurotransmission. Annual review of pharmacology and toxicology, 44, 269-96. [PubMed:14744247] [WorldCat] [DOI] - ↑
Walaas, S.I., Aswad, D.W., & Greengard, P. (1983).
A dopamine- and cyclic AMP-regulated phosphoprotein enriched in dopamine-innervated brain regions. Nature, 301(5895), 69-71. [PubMed:6296685] [WorldCat] [DOI] - ↑
Greengard, P., Nairn, A.C., Girault, J.A., Ouimet, C.C., Snyder, G.L., Fisone, G., ..., & Nishi, A. (1998).
The DARPP-32/protein phosphatase-1 cascade: a model for signal integration. Brain research. Brain research reviews, 26(2-3), 274-84. [PubMed:9651542] - ↑ 5.0 5.1 5.2 5.3
Stipanovich, A., Valjent, E., Matamales, M., Nishi, A., Ahn, J.H., Maroteaux, M., ..., & Girault, J.A. (2008).
A phosphatase cascade by which rewarding stimuli control nucleosomal response. Nature, 453(7197), 879-84. [PubMed:18496528] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Aggen, J.B., Nairn, A.C., & Chamberlin, R. (2000).
Regulation of protein phosphatase-1. Chemistry & biology, 7(1), R13-23. [PubMed:10662690] [WorldCat] - ↑
Ouimet, C.C., Miller, P.E., Hemmings, H.C., Walaas, S.I., & Greengard, P. (1984).
DARPP-32, a dopamine- and adenosine 3':5'-monophosphate-regulated phosphoprotein enriched in dopamine-innervated brain regions. III. Immunocytochemical localization. The Journal of neuroscience : the official journal of the Society for Neuroscience, 4(1), 111-24. [PubMed:6319625] [WorldCat] - ↑
Hemmings, H.C., Girault, J.A., Nairn, A.C., Bertuzzi, G., & Greengard, P. (1992).
Distribution of protein phosphatase inhibitor-1 in brain and peripheral tissues of various species: comparison with DARPP-32. Journal of neurochemistry, 59(3), 1053-61. [PubMed:1353788] [WorldCat] [DOI] - ↑ 9.0 9.1
Ouimet, C.C., & Greengard, P. (1990).
Distribution of DARPP-32 in the basal ganglia: an electron microscopic study. Journal of neurocytology, 19(1), 39-52. [PubMed:2191086] [WorldCat] [DOI] - ↑
Walaas, S.I., & Greengard, P. (1984).
DARPP-32, a dopamine- and adenosine 3':5'-monophosphate-regulated phosphoprotein enriched in dopamine-innervated brain regions. I. Regional and cellular distribution in the rat brain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 4(1), 84-98. [PubMed:6319627] [WorldCat] - ↑
Engmann, O., Giralt, A., Gervasi, N., Marion-Poll, L., Gasmi, L., Filhol, O., ..., & Girault, J.A. (2015).
DARPP-32 interaction with adducin may mediate rapid environmental effects on striatal neurons. Nature communications, 6, 10099. [PubMed:26639316] [PMC] [WorldCat] [DOI] - ↑
Matamales, M., & Girault, J.A. (2011).
Signaling from the cytoplasm to the nucleus in striatal medium-sized spiny neurons. Frontiers in neuroanatomy, 5, 37. [PubMed:21779236] [PMC] [WorldCat] [DOI] - ↑
Bibb, J.A., Snyder, G.L., Nishi, A., Yan, Z., Meijer, L., Fienberg, A.A., ..., & Greengard, P. (1999).
Phosphorylation of DARPP-32 by Cdk5 modulates dopamine signalling in neurons. Nature, 402(6762), 669-71. [PubMed:10604473] [WorldCat] [DOI] - ↑
Girault, J.A., Hemmings, H.C., Williams, K.R., Nairn, A.C., & Greengard, P. (1989).
Phosphorylation of DARPP-32, a dopamine- and cAMP-regulated phosphoprotein, by casein kinase II. The Journal of biological chemistry, 264(36), 21748-59. [PubMed:2557337] [WorldCat] - ↑
Desdouits, F., Siciliano, J.C., Nairn, A.C., Greengard, P., & Girault, J.A. (1998).
Dephosphorylation of Ser-137 in DARPP-32 by protein phosphatases 2A and 2C: different roles in vitro and in striatonigral neurons. The Biochemical journal, 330 ( Pt 1), 211-6. [PubMed:9461512] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2 16.3
Nishi, A., Snyder, G.L., & Greengard, P. (1997).
Bidirectional regulation of DARPP-32 phosphorylation by dopamine. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(21), 8147-55. [PubMed:9334390] [WorldCat] - ↑
Yamada, K., Takahashi, S., Karube, F., Fujiyama, F., Kobayashi, K., Nishi, A., & Momiyama, T. (2016).
Neuronal circuits and physiological roles of the basal ganglia in terms of transmitters, receptors and related disorders. The journal of physiological sciences : JPS, 66(6), 435-446. [PubMed:26979514] [PMC] [WorldCat] [DOI] - ↑
Ahn, J.H., McAvoy, T., Rakhilin, S.V., Nishi, A., Greengard, P., & Nairn, A.C. (2007).
Protein kinase A activates protein phosphatase 2A by phosphorylation of the B56delta subunit. Proceedings of the National Academy of Sciences of the United States of America, 104(8), 2979-84. [PubMed:17301223] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Nishi, A., Bibb, J.A., Snyder, G.L., Higashi, H., Nairn, A.C., & Greengard, P. (2000).
Amplification of dopaminergic signaling by a positive feedback loop. Proceedings of the National Academy of Sciences of the United States of America, 97(23), 12840-5. [PubMed:11050161] [PMC] [WorldCat] [DOI] - ↑
Nishi, A., Watanabe, Y., Higashi, H., Tanaka, M., Nairn, A.C., & Greengard, P. (2005).
Glutamate regulation of DARPP-32 phosphorylation in neostriatal neurons involves activation of multiple signaling cascades. Proceedings of the National Academy of Sciences of the United States of America, 102(4), 1199-204. [PubMed:15657149] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1 21.2 21.3 21.4
Bateup, H.S., Svenningsson, P., Kuroiwa, M., Gong, S., Nishi, A., Heintz, N., & Greengard, P. (2008).
Cell type-specific regulation of DARPP-32 phosphorylation by psychostimulant and antipsychotic drugs. Nature neuroscience, 11(8), 932-9. [PubMed:18622401] [PMC] [WorldCat] [DOI] - ↑ 22.0 22.1 22.2 22.3 22.4
Bateup, H.S., Santini, E., Shen, W., Birnbaum, S., Valjent, E., Surmeier, D.J., ..., & Greengard, P. (2010).
Distinct subclasses of medium spiny neurons differentially regulate striatal motor behaviors. Proceedings of the National Academy of Sciences of the United States of America, 107(33), 14845-50. [PubMed:20682746] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Fienberg, A.A., Hiroi, N., Mermelstein, P.G., Song, W., Snyder, G.L., Nishi, A., ..., & Greengard, P. (1998).
DARPP-32: regulator of the efficacy of dopaminergic neurotransmission. Science (New York, N.Y.), 281(5378), 838-42. [PubMed:9694658] [WorldCat] [DOI] - ↑ 24.0 24.1
Zachariou, V., Sgambato-Faure, V., Sasaki, T., Svenningsson, P., Berton, O., Fienberg, A.A., ..., & Nestler, E.J. (2006).
Phosphorylation of DARPP-32 at Threonine-34 is required for cocaine action. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 31(3), 555-62. [PubMed:16123776] [WorldCat] [DOI] - ↑
Valjent, E., Pascoli, V., Svenningsson, P., Paul, S., Enslen, H., Corvol, J.C., ..., & Girault, J.A. (2005).
Regulation of a protein phosphatase cascade allows convergent dopamine and glutamate signals to activate ERK in the striatum. Proceedings of the National Academy of Sciences of the United States of America, 102(2), 491-6. [PubMed:15608059] [PMC] [WorldCat] [DOI] - ↑
Zachariou, V., Benoit-Marand, M., Allen, P.B., Ingrassia, P., Fienberg, A.A., Gonon, F., ..., & Picciotto, M.R. (2002).
Reduction of cocaine place preference in mice lacking the protein phosphatase 1 inhibitors DARPP 32 or Inhibitor 1. Biological psychiatry, 51(8), 612-20. [PubMed:11955461] [WorldCat] [DOI] - ↑
Tropea, T.F., Kosofsky, B.E., & Rajadhyaksha, A.M. (2008).
Enhanced CREB and DARPP-32 phosphorylation in the nucleus accumbens and CREB, ERK, and GluR1 phosphorylation in the dorsal hippocampus is associated with cocaine-conditioned place preference behavior. Journal of neurochemistry, 106(4), 1780-90. [PubMed:18554320] [PMC] [WorldCat] [DOI] - ↑
Bibb, J.A., Chen, J., Taylor, J.R., Svenningsson, P., Nishi, A., Snyder, G.L., ..., & Greengard, P. (2001).
Effects of chronic exposure to cocaine are regulated by the neuronal protein Cdk5. Nature, 410(6826), 376-80. [PubMed:11268215] [WorldCat] [DOI] - ↑
Kim, J., Ryu, I.S., Seo, S.Y., & Choe, E.S. (2015).
Activation of Protein Kinases and Phosphatases Coupled to Glutamate Receptors Regulates the Phosphorylation State of DARPP32 at Threonine 75 After Repeated Exposure to Cocaine in the Rat Dorsal Striatum in a Ca2+-Dependent Manner. The international journal of neuropsychopharmacology, 18(12). [PubMed:26142455] [PMC] [WorldCat] [DOI] - ↑ 30.0 30.1
Picconi, B., Centonze, D., Håkansson, K., Bernardi, G., Greengard, P., Fisone, G., ..., & Calabresi, P. (2003).
Loss of bidirectional striatal synaptic plasticity in L-DOPA-induced dyskinesia. Nature neuroscience, 6(5), 501-6. [PubMed:12665799] [WorldCat] [DOI] - ↑
Brown, A.M., Deutch, A.Y., & Colbran, R.J. (2005).
Dopamine depletion alters phosphorylation of striatal proteins in a model of Parkinsonism. The European journal of neuroscience, 22(1), 247-56. [PubMed:16029214] [PMC] [WorldCat] [DOI] - ↑ 32.0 32.1
Santini, E., Valjent, E., Usiello, A., Carta, M., Borgkvist, A., Girault, J.A., ..., & Fisone, G. (2007).
Critical involvement of cAMP/DARPP-32 and extracellular signal-regulated protein kinase signaling in L-DOPA-induced dyskinesia. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(26), 6995-7005. [PubMed:17596448] [PMC] [WorldCat] [DOI] - ↑ 33.0 33.1 33.2 33.3
Santini, E., Feyder, M., Gangarossa, G., Bateup, H.S., Greengard, P., & Fisone, G. (2012).
Dopamine- and cAMP-regulated phosphoprotein of 32-kDa (DARPP-32)-dependent activation of extracellular signal-regulated kinase (ERK) and mammalian target of rapamycin complex 1 (mTORC1) signaling in experimental parkinsonism. The Journal of biological chemistry, 287(33), 27806-12. [PubMed:22753408] [PMC] [WorldCat] [DOI] - ↑
Yuste, J.E., Echeverry, M.B., Ros-Bernal, F., Gomez, A., Ros, C.M., Campuzano, C.M., ..., & Herrero, M.T. (2012).
7-Nitroindazole down-regulates dopamine/DARPP-32 signaling in neostriatal neurons in a rat model of Parkinson's disease. Neuropharmacology, 63(7), 1258-67. [PubMed:22877786] [WorldCat] [DOI] - ↑
Murer, M.G., & Moratalla, R. (2011).
Striatal Signaling in L-DOPA-Induced Dyskinesia: Common Mechanisms with Drug Abuse and Long Term Memory Involving D1 Dopamine Receptor Stimulation. Frontiers in neuroanatomy, 5, 51. [PubMed:21886608] [PMC] [WorldCat] [DOI] - ↑
Santini, E., Valjent, E., & Fisone, G. (2008).
Parkinson's disease: levodopa-induced dyskinesia and signal transduction. The FEBS journal, 275(7), 1392-9. [PubMed:18279379] [WorldCat] [DOI] - ↑
Hotte, M., Thuault, S., Lachaise, F., Dineley, K.T., Hemmings, H.C., Nairn, A.C., & Jay, T.M. (2006).
D1 receptor modulation of memory retrieval performance is associated with changes in pCREB and pDARPP-32 in rat prefrontal cortex. Behavioural brain research, 171(1), 127-33. [PubMed:16687181] [WorldCat] [DOI] - ↑
Kuroiwa, M., Snyder, G.L., Shuto, T., Fukuda, A., Yanagawa, Y., Benavides, D.R., ..., & Nishi, A. (2012).
Phosphodiesterase 4 inhibition enhances the dopamine D1 receptor/PKA/DARPP-32 signaling cascade in frontal cortex. Psychopharmacology, 219(4), 1065-79. [PubMed:21833500] [PMC] [WorldCat] [DOI] - ↑
Svenningsson, P., Tzavara, E.T., Carruthers, R., Rachleff, I., Wattler, S., Nehls, M., ..., & Greengard, P. (2003).
Diverse psychotomimetics act through a common signaling pathway. Science (New York, N.Y.), 302(5649), 1412-5. [PubMed:14631045] [WorldCat] [DOI] - ↑
Albert, K.A., Hemmings, H.C., Adamo, A.I., Potkin, S.G., Akbarian, S., Sandman, C.A., ..., & Greengard, P. (2002).
Evidence for decreased DARPP-32 in the prefrontal cortex of patients with schizophrenia. Archives of general psychiatry, 59(8), 705-12. [PubMed:12150646] [WorldCat] [DOI] - ↑ 41.0 41.1
Ishikawa, M., Mizukami, K., Iwakiri, M., & Asada, T. (2007).
Immunohistochemical and immunoblot analysis of Dopamine and cyclic AMP-regulated phosphoprotein, relative molecular mass 32,000 (DARPP-32) in the prefrontal cortex of subjects with schizophrenia and bipolar disorder. Progress in neuro-psychopharmacology & biological psychiatry, 31(6), 1177-81. [PubMed:17521792] [WorldCat] [DOI] - ↑
Feldcamp, L.A., Souza, R.P., Romano-Silva, M., Kennedy, J.L., & Wong, A.H. (2008).
Reduced prefrontal cortex DARPP-32 mRNA in completed suicide victims with schizophrenia. Schizophrenia research, 103(1-3), 192-200. [PubMed:18573638] [WorldCat] [DOI] - ↑
Baracskay, K.L., Haroutunian, V., & Meador-Woodruff, J.H. (2006).
Dopamine receptor signaling molecules are altered in elderly schizophrenic cortex. Synapse (New York, N.Y.), 60(4), 271-9. [PubMed:16786528] [WorldCat] [DOI] - ↑
Zhan, L., Kerr, J.R., Lafuente, M.J., Maclean, A., Chibalina, M.V., Liu, B., ..., & Nasir, J. (2011).
Altered expression and coregulation of dopamine signalling genes in schizophrenia and bipolar disorder. Neuropathology and applied neurobiology, 37(2), 206-19. [PubMed:20874815] [WorldCat] [DOI] - ↑
Kunii, Y., Hyde, T.M., Ye, T., Li, C., Kolachana, B., Dickinson, D., ..., & Lipska, B.K. (2014).
Revisiting DARPP-32 in postmortem human brain: changes in schizophrenia and bipolar disorder and genetic associations with t-DARPP-32 expression. Molecular psychiatry, 19(2), 192-9. [PubMed:23295814] [WorldCat] [DOI] - ↑
Romero, E., Ali, C., Molina-Holgado, E., Castellano, B., Guaza, C., & Borrell, J. (2007).
Neurobehavioral and immunological consequences of prenatal immune activation in rats. Influence of antipsychotics. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 32(8), 1791-804. [PubMed:17180123] [WorldCat] [DOI] - ↑
Cantrup, R., Sathanantham, K., Rushlow, W.J., & Rajakumar, N. (2012).
Chronic hyperdopaminergic activity of schizophrenia is associated with increased ΔFosB levels and cdk-5 signaling in the nucleus accumbens. Neuroscience, 222, 124-35. [PubMed:22820052] [WorldCat] [DOI] - ↑
Powell, K.J., Binder, T.L., Hori, S., Nakabeppu, Y., Weinberger, D.R., Lipska, B.K., & Robertson, G.S. (2006).
Neonatal ventral hippocampal lesions produce an elevation of DeltaFosB-like protein(s) in the rodent neocortex. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 31(4), 700-11. [PubMed:16132062] [WorldCat] [DOI] - ↑
Yabuki, Y., Nakagawasai, O., Moriguchi, S., Shioda, N., Onogi, H., Tan-No, K., ..., & Fukunaga, K. (2013).
Decreased CaMKII and PKC activities in specific brain regions are associated with cognitive impairment in neonatal ventral hippocampus-lesioned rats. Neuroscience, 234, 103-15. [PubMed:23313709] [WorldCat] [DOI] - ↑
Meyer-Lindenberg, A., Straub, R.E., Lipska, B.K., Verchinski, B.A., Goldberg, T., Callicott, J.H., ..., & Weinberger, D.R. (2007).
Genetic evidence implicating DARPP-32 in human frontostriatal structure, function, and cognition. The Journal of clinical investigation, 117(3), 672-82. [PubMed:17290303] [PMC] [WorldCat] [DOI] - ↑
Frank, M.J., Moustafa, A.A., Haughey, H.M., Curran, T., & Hutchison, K.E. (2007).
Genetic triple dissociation reveals multiple roles for dopamine in reinforcement learning. Proceedings of the National Academy of Sciences of the United States of America, 104(41), 16311-6. [PubMed:17913879] [PMC] [WorldCat] [DOI] - ↑
Frank, M.J., Doll, B.B., Oas-Terpstra, J., & Moreno, F. (2009).
Prefrontal and striatal dopaminergic genes predict individual differences in exploration and exploitation. Nature neuroscience, 12(8), 1062-8. [PubMed:19620978] [PMC] [WorldCat] [DOI] - ↑
Meyer-Lindenberg, A., Straub, R.E., Lipska, B.K., Verchinski, B.A., Goldberg, T., Callicott, J.H., ..., & Weinberger, D.R. (2007).
Genetic evidence implicating DARPP-32 in human frontostriatal structure, function, and cognition. The Journal of clinical investigation, 117(3), 672-82. [PubMed:17290303] [PMC] [WorldCat] [DOI] - ↑
Li, C.H., Liao, H.M., Hung, T.W., & Chen, C.H. (2006).
Mutation analysis of DARPP-32 as a candidate gene for schizophrenia. Schizophrenia research, 87(1-3), 1-5. [PubMed:16750903] [WorldCat] [DOI] - ↑
Hu, J.X., Yu, L., Shi, Y.Y., Zhao, X.Z., Meng, J.W., He, G., ..., & He, L. (2007).
An association study between PPP1R1B gene and schizophrenia in the Chinese population. Progress in neuro-psychopharmacology & biological psychiatry, 31(6), 1303-6. [PubMed:17618027] [WorldCat] [DOI] - ↑
Yamada, K., Gerber, D.J., Iwayama, Y., Ohnishi, T., Ohba, H., Toyota, T., ..., & Yoshikawa, T. (2007).
Genetic analysis of the calcineurin pathway identifies members of the EGR gene family, specifically EGR3, as potential susceptibility candidates in schizophrenia. Proceedings of the National Academy of Sciences of the United States of America, 104(8), 2815-20. [PubMed:17360599] [PMC] [WorldCat] [DOI] - ↑
Yoshimi, A., Takahashi, N., Saito, S., Ito, Y., Aleksic, B., Usui, H., ..., & Ozaki, N. (2008).
Genetic analysis of the gene coding for DARPP-32 (PPP1R1B) in Japanese patients with schizophrenia or bipolar disorder. Schizophrenia research, 100(1-3), 334-41. [PubMed:18055181] [WorldCat] [DOI] - ↑
Talkowski, M.E., Kirov, G., Bamne, M., Georgieva, L., Torres, G., Mansour, H., ..., & Nimgaonkar, V.L. (2008).
A network of dopaminergic gene variations implicated as risk factors for schizophrenia. Human molecular genetics, 17(5), 747-58. [PubMed:18045777] [PMC] [WorldCat] [DOI] - ↑
Carrera, N., Arrojo, M., Paz, E., Ramos-Ríos, R., Agra, S., Páramo, M., ..., & Costas, J. (2010).
Testing the antagonistic pleiotropy model of schizophrenia susceptibility by analysis of DAOA, PPP1R1B, and APOL1 genes. Psychiatry research, 179(2), 126-9. [PubMed:20483474] [WorldCat] [DOI] - ↑ 60.0 60.1
Belkhiri, A., Zhu, S., & El-Rifai, W. (2016).
DARPP-32: from neurotransmission to cancer. Oncotarget, 7(14), 17631-40. [PubMed:26872373] [PMC] [WorldCat] [DOI] - ↑
El-Rifai, W., Smith, M.F., Li, G., Beckler, A., Carl, V.S., Montgomery, E., ..., & Powell, S.M. (2002).
Gastric cancers overexpress DARPP-32 and a novel isoform, t-DARPP. Cancer research, 62(14), 4061-4. [PubMed:12124342] [WorldCat] - ↑
Belkhiri, A., Zaika, A., Pidkovka, N., Knuutila, S., Moskaluk, C., & El-Rifai, W. (2005).
Darpp-32: a novel antiapoptotic gene in upper gastrointestinal carcinomas. Cancer research, 65(15), 6583-92. [PubMed:16061638] [WorldCat] [DOI] - ↑
Beckler, A., Moskaluk, C.A., Zaika, A., Hampton, G.M., Powell, S.M., Frierson, H.F., & El-Rifai, W. (2003).
Overexpression of the 32-kilodalton dopamine and cyclic adenosine 3',5'-monophosphate-regulated phosphoprotein in common adenocarcinomas. Cancer, 98(7), 1547-51. [PubMed:14508844] [WorldCat] [DOI]
同義語:ドーパミン
重要な関連語:ドパミン、グルタミン酸、プロテインキナーゼ、プロテインホスファターゼ、線条体、大脳基底核、t-DARPP
(執筆者:首藤隆秀、西昭徳、担当編集委員:柚崎通介)