「Parkin」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の2版が非表示) | |||
| 30行目: | 30行目: | ||
'''⑤''' リン酸化UblがRING0に結合し、安定的な活性化構造となる。RING1に結合したユビキチン結合酵素(E2)と協働して、基質(S)にユビキチンを転移する。<br>]] | '''⑤''' リン酸化UblがRING0に結合し、安定的な活性化構造となる。RING1に結合したユビキチン結合酵素(E2)と協働して、基質(S)にユビキチンを転移する。<br>]] | ||
==構造== | ==構造== | ||
ヒトParkinタンパク質は465 アミノ酸残基からなり、N末端のユビキチン様ドメイン(Ubl)、C末端に2つの[[RING fingerモチーフ]](RING1, RING2)とIn-Between-RINGs (IBR)という構造をもつ('''図2''')。その後、UblとRNIG1-IBR-RING2の間に、RING様構造が見つかり、[[RING0]](またはUPD; unique parkin domain)と呼ばれる<ref name=Hristova2009><pubmed>19339245</pubmed></ref> ('''図2''')。Parkinは、RING-IBR-RINGドメインを有するRBR型[[ユビキチンリガーゼ]]に分類され、同様の構造をもヒトユビキチンリガーゼに、[[HOIL-1]], [[ | ヒトParkinタンパク質は465 アミノ酸残基からなり、N末端のユビキチン様ドメイン(Ubl)、C末端に2つの[[RING fingerモチーフ]](RING1, RING2)とIn-Between-RINGs (IBR)という構造をもつ('''図2''')。その後、UblとRNIG1-IBR-RING2の間に、RING様構造が見つかり、[[RING0]](またはUPD; unique parkin domain)と呼ばれる<ref name=Hristova2009><pubmed>19339245</pubmed></ref> ('''図2''')。Parkinは、RING-IBR-RINGドメインを有するRBR型[[ユビキチンリガーゼ]]に分類され、同様の構造をもヒトユビキチンリガーゼに、[[HOIL-1]], [[HHAR]]I, [[DORFIN]]がある。タンパク質の全体構造は2013-2015年に解かれ、コンパクトに折り畳まれた状態であることが明らかとなった<ref name=Trempe2013><pubmed>23661642</pubmed></ref><ref name=Wauer2015><pubmed>26161729</pubmed></ref>('''図3''')。 | ||
==活性化機構== | ==活性化機構== | ||
| 82行目: | 82行目: | ||
ショウジョウバエでは、ParkinやPINK1変異でミトコンドリア呼吸鎖複合体サブユニット群の半減期が長くなっており、マイトファジー以外の選択的なミトコンドリアタンパク質分解機構も提唱されている<ref name=Vincow2013><pubmed>23509287</pubmed></ref><ref name=McLelland2016><pubmed>27458136</pubmed></ref> 。 | ショウジョウバエでは、ParkinやPINK1変異でミトコンドリア呼吸鎖複合体サブユニット群の半減期が長くなっており、マイトファジー以外の選択的なミトコンドリアタンパク質分解機構も提唱されている<ref name=Vincow2013><pubmed>23509287</pubmed></ref><ref name=McLelland2016><pubmed>27458136</pubmed></ref> 。 | ||
常染色体性潜性若年性パーキンソニズム脳[[アストロサイト]]の形態的異常や患者[[iPS細胞]]で作製した中脳[[オルガノイド]]でのアストロサイトの分化能低下<ref name=Kano2020>< | 常染色体性潜性若年性パーキンソニズム脳[[アストロサイト]]の形態的異常や患者[[iPS細胞]]で作製した中脳[[オルガノイド]]でのアストロサイトの分化能低下<ref name=Kano2020>'''Kano M, Takanashi M, Oyama G, Yoritaka A, Hatano T, et al. in press'''<br>Reduced astrocytic reactivity in human brains and midbrain organoids with PRKN mutations. NPJ Parkinsons Dis.</ref> 、Parkinノックアウトマウスにおいてアストロサイトのミトコンドリア損傷の報告<ref name=Schmidt2011><pubmed>21212098</pubmed></ref> がある。 | ||
免疫・炎症へのParkinの関与が示唆されている。PINK1とParkinは、ミトコンドリアの[[抗原提示経路]]に関わる分子[[Sorting nexin-9]]を分解し、[[T細胞]]への抗原提示を阻害する。Parkinのこの機能が過剰な免疫反応を抑制している可能性が報告された<ref name=Matheoud2016><pubmed>27345367</pubmed></ref> . PINK1, Parkinノックアウトマウスでは、ミトコンドリアへの強い負荷(激しい運動やミトコンドリアDNAへの構成的な変異の蓄積)により、[[STING経路]]を介した炎症性[[サイトカイン]]の上昇がみられる <ref name=Sliter2018><pubmed>30135585</pubmed></ref> 。STINGは血清中に遊離した損傷ミトコンドリアのDNAを認識し、自然免疫を活性化する。ミトコンドリアストレスで生した損傷ミトコンドリアのPINK1-Parkin経路を介したマイトファジーでの除去が、炎症の沈静化に寄与していることが示唆されている。 | 免疫・炎症へのParkinの関与が示唆されている。PINK1とParkinは、ミトコンドリアの[[抗原提示経路]]に関わる分子[[Sorting nexin-9]]を分解し、[[T細胞]]への抗原提示を阻害する。Parkinのこの機能が過剰な免疫反応を抑制している可能性が報告された<ref name=Matheoud2016><pubmed>27345367</pubmed></ref> . PINK1, Parkinノックアウトマウスでは、ミトコンドリアへの強い負荷(激しい運動やミトコンドリアDNAへの構成的な変異の蓄積)により、[[STING経路]]を介した炎症性[[サイトカイン]]の上昇がみられる <ref name=Sliter2018><pubmed>30135585</pubmed></ref> 。STINGは血清中に遊離した損傷ミトコンドリアのDNAを認識し、自然免疫を活性化する。ミトコンドリアストレスで生した損傷ミトコンドリアのPINK1-Parkin経路を介したマイトファジーでの除去が、炎症の沈静化に寄与していることが示唆されている。 | ||
| 100行目: | 100行目: | ||
PRKNミスセンス病因変異・レアバリアントとタンパク質の安定性・マイトファジーとの相関を培養細胞で調べた研究がある<ref name=Yi2019><pubmed>30994895</pubmed></ref> 。病態が比較的重篤なミスセンス病因変異は、すべてマイトファジー活性が50%以下(対野生型比)に低下していた。しかし、病態が軽度・病態への意義が不明なミスセンス病因変異・レアバリアントでは、マイトファジーへの影響がほとんどなく、まれに亢進しているものも観察された。ユビキチンリガーゼ活性やタンパク質の安定性に影響しない病因変異については、不活性状態を解く[[アミノ酸]]への置換(REPを不安定化させるF146AやW403A、'''図3'''参照)の導入により、マイトファジー活性が戻ることが示された。この観察は、Parkinの不活性状態を解く化合物がパーキンソン病の疾患修飾薬となる可能性を示唆している。 | PRKNミスセンス病因変異・レアバリアントとタンパク質の安定性・マイトファジーとの相関を培養細胞で調べた研究がある<ref name=Yi2019><pubmed>30994895</pubmed></ref> 。病態が比較的重篤なミスセンス病因変異は、すべてマイトファジー活性が50%以下(対野生型比)に低下していた。しかし、病態が軽度・病態への意義が不明なミスセンス病因変異・レアバリアントでは、マイトファジーへの影響がほとんどなく、まれに亢進しているものも観察された。ユビキチンリガーゼ活性やタンパク質の安定性に影響しない病因変異については、不活性状態を解く[[アミノ酸]]への置換(REPを不安定化させるF146AやW403A、'''図3'''参照)の導入により、マイトファジー活性が戻ることが示された。この観察は、Parkinの不活性状態を解く化合物がパーキンソン病の疾患修飾薬となる可能性を示唆している。 | ||
Parkin変異によるパーキンソン病の典型的な臨床像として、40歳未満での発症、緩慢な病態進行、正常な[[認知機能]]、下肢[[ジストニア]]、良好な[[L-ドーパ]]への反応性、が挙げられる <ref name=久保紳一郎、波田野琢、服部信孝2013>'''久保紳一郎、波田野琢、服部信孝. 2013.'''<br>常染色体劣性パーキンソン病 In ''パーキンソン病と運動症状'', ed. 高橋良輔, pp. 400-06: 中山書店</ref> 。神経病理学的特徴として、[[黒質]]および[[青斑核]]に限局した神経細胞減少を示し、[[グリオーシス]]は通常見られない。孤発性パーキンソン病の特徴的病理所見である[[ | Parkin変異によるパーキンソン病の典型的な臨床像として、40歳未満での発症、緩慢な病態進行、正常な[[認知機能]]、下肢[[ジストニア]]、良好な[[L-ドーパ]]への反応性、が挙げられる <ref name=久保紳一郎、波田野琢、服部信孝2013>'''久保紳一郎、波田野琢、服部信孝. 2013.'''<br>常染色体劣性パーキンソン病 In ''パーキンソン病と運動症状'', ed. 高橋良輔, pp. 400-06: 中山書店</ref> 。神経病理学的特徴として、[[黒質]]および[[青斑核]]に限局した神経細胞減少を示し、[[グリオーシス]]は通常見られない。孤発性パーキンソン病の特徴的病理所見である[[レビュー小体]]は通常みられない<ref name=久保紳一郎、波田野琢、服部信孝2013></ref> 。10歳未満での発症の報告もあり、Parkinはドーパミン神経発生の段階で機能していることが推察される<ref name=Matsumine1997><pubmed>9042918</pubmed></ref><ref name=Takei2000><pubmed>11086400</pubmed></ref> 。 | ||
Parkin変異患者由来のiPS細胞から作製したドーパミン神経では、リン酸化ユビキチンのシグナルが低下し、不良ミトコンドリアの神経軸索輸送停止が障害されている<ref name=Shiba-Fukushima2017><pubmed>28541509</pubmed></ref> 。 | Parkin変異患者由来のiPS細胞から作製したドーパミン神経では、リン酸化ユビキチンのシグナルが低下し、不良ミトコンドリアの神経軸索輸送停止が障害されている<ref name=Shiba-Fukushima2017><pubmed>28541509</pubmed></ref> 。 | ||
2020年11月5日 (木) 22:49時点における版
今居 譲
順天堂大学医学研究科 パーキンソン病病態解明研究講座
DOI:10.14931/bsd.9464 原稿受付日:2020年9月28日 原稿完成日:2020年11月5日
担当編集委員:山中 宏二(名古屋大学 環境医学研究所 病態神経科学)
外部査読者:松田憲之(東京都医学研)
英語名:parkin
Parkin(パーキン)遺伝子は、常染色体性潜性(劣性)若年性パーキンソニズム(autosomal recessive-juvenile Parkinsonism: AR-JP) の原因遺伝子である。Parkin遺伝子の正式名称はPRKNであり、PARK2とも表記される。遺伝子産物Parkinはユビキチン転移酵素(ユビキチンリガーゼ)であり、損傷したミトコンドリアを排除するミトコンドリアの品質管理に関与すると考えられている。一方、がん抑制遺伝子、らい菌の感受性遺伝子としても報告され、未解明の生理的機能も示唆される。
背景、歴史的推移
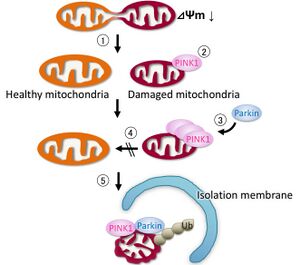
① 膜電位(∆Ψm)が低下したミトコンドリアは、断片化し切り離される。
② 膜電位低下したミトコンドリア外膜にPINK1が蓄積、キナーゼが活性化する。
③ PINK1が活性したミトコンドリアに、Parkinがリクルートされる。'
④ 断片化したミトコンドリアは、健常なミトコンドリアと再融合しない。
⑤ オートファジーで除去される。Ub, ユビキチン。図は文献[1]より改変。
パーキンソン病は振戦、無動・寡動、筋固縮、姿勢保持障害などの運動機能障害を特徴とする神経変性疾患である。運動症状は中脳黒質のドーパミン神経の選択的変性脱落に起因する。高齢になるほど発病率が増加し、60歳以上では約1%が罹患する。パーキンソン病の一部に、40歳以下で発症する若年性パーキンソン病と呼ばれる群があり、そのうち家族性(遺伝性)のものがいくつかみつかっている。
1998年、若年性パーキンソン病の一つである常染色体性潜性(劣性)若年性パーキンソニズム(autosomal recessive-juvenile Parkinsonism: AR-JP)の原因遺伝子としてParkin (PRKN, PARK2)が同定された[2] 。パーキンソン病原因遺伝子としては、αシヌクレイン(α-Synuclein; SNCA; PARK1/PARK4)に次いで、2番目に同定された遺伝子である。Parkinは、6番染色体(6q26)にある1.38 Mbの巨大な遺伝子で、欠失変異、フレームシフト変異、ミスセンス変異が、遺伝子全体にわたって見つかっている。Parkin変異は人種を越えてみられ、遺伝性若年性パーキンソン病の約50%を占めると報告されている[3][4] 。
Parkinタンパク質は基質タンパク質にユビキチンを転移するユビキチンリガーゼで、多くの病因変異でその活性が損なわれている[5][6][7] 。これまでにユビキチン化基質候補として数多くのタンパク質が報告されている[8] 。
2004年、PINK1(PTEN induced kinase 1; PARK6)が、常染色体性潜性若年性パーキンソン病原因遺伝子として同定された[9] 。遺伝性若年性パーキンソン病のうち、PINK1変異はParkinに次いで頻度が高く、Parkinと臨床像は類似している[10] 。ショウジョウバエを用いた遺伝学的研究から、常染色体性潜性(劣性)若年性パーキンソン病原因遺伝子PINK1がParkinの上流因子であり、PINK1とParkinがミトコンドリアの機能維持に関与することが明らかとなった[11][12][13] 。その後、ヒト培養細胞を用いた研究から、PINK1がParkinをリン酸化し[14][15][16]、協働して膜電位の低下したミトコンドリアを除去するマイトファジー(ミトコンドリアを対象とするオートファジー)に関与することが明らかになった(図1)[17][18][19][20] 。

ドメインの説明は本文を参照。REP(Repressor Element of Parkin)の役割は図3を参照。図は文献[1]より改変。

(左端)不活性型のParkin。ユビキチンリガーゼ活性中心(RING2の緑色の星印)はRING0でマスクされている。
① PINK1が活性化し、ミトコンドリア外膜タンパク質のポリユビキチン(Ub)鎖のSer65がリン酸化(P)される。次に、リン酸化ユビキチンにParkinが結合する。
② リン酸化ユビキチンの結合により、UblドメインのSer65が露出する。
③ Ubl Ser65がPINK1によってリン酸化される。
④ リン酸化されたUblがParkin本体から遊離するとともに、REPがRING1から外れ、RING2がRING0から遊離する。その結果、RING2の活性中心が露出する。
⑤ リン酸化UblがRING0に結合し、安定的な活性化構造となる。RING1に結合したユビキチン結合酵素(E2)と協働して、基質(S)にユビキチンを転移する。
構造
ヒトParkinタンパク質は465 アミノ酸残基からなり、N末端のユビキチン様ドメイン(Ubl)、C末端に2つのRING fingerモチーフ(RING1, RING2)とIn-Between-RINGs (IBR)という構造をもつ(図2)。その後、UblとRNIG1-IBR-RING2の間に、RING様構造が見つかり、RING0(またはUPD; unique parkin domain)と呼ばれる[21] (図2)。Parkinは、RING-IBR-RINGドメインを有するRBR型ユビキチンリガーゼに分類され、同様の構造をもヒトユビキチンリガーゼに、HOIL-1, HHARI, DORFINがある。タンパク質の全体構造は2013-2015年に解かれ、コンパクトに折り畳まれた状態であることが明らかとなった[22][23](図3)。
活性化機構
コンパクトに折り畳まれたParkinは、活性中心がマスクされ不活性型である。Parkinの活性化は2つのステップで起こる。1段階目として、PINK1によってSer65がリン酸化されたユビキチン[24][25][26] がParkinのリン酸基結合ポケットに結合し、ユビキチン様ドメインのリン酸化サイト(Ser65)が露出する。2段階目に、露出したユビキチン様ドメインのSer65がPINK1によりリン酸化され、リン酸化ユビキチン様ドメインがRING0/UPDに結合することで、RING2にある活性中心とRING1にあるユビキチン結合酵素(E2)結合部位が安定的に露出する[23](図3)。
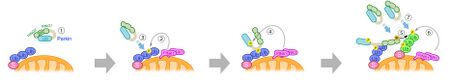
① 細胞質で不活性状態のParkin。ミトコンドリア外膜タンパク質(S)は、ミトコンドリア局在ユビキチンリガーゼにより、生理的にポリユビキチン化修飾を受けている。
② ミトコンドリア膜電位が低下し活性化したPINK1によるポリユビキチン鎖のリン酸化(P)。
③ Parkinのリン酸化ポリユビキチン(Ub)鎖への結合。
④ Parkin UblドメインのPINK1によるリン酸化。
⑤ Parkinの活性化、ミトコンドリア上での新規ポリユビキチン鎖(緑色)の形成。
⑥ PINK1による新規ポリユビキチン鎖のリン酸化。
⑦ 残りのParkinのリン酸化ポリユビキチン鎖への結合(以降④ 〜⑦の繰り返し)。
図は文献[16])より改変。
発現
ヒトParkin mRNAはユビキタスに発現しているが、筋組織、腎臓、脳で比較的高発現をしている[2][27] 。哺乳類ゲノムにおいて、PRKNはPACRG (Parkin co-regulated gene)と双方向プロモーターを共有する[28] 。Parkinの発現を制御する転写因子として、N-myc [29] , p53 [30] , ATF4 [31] が報告されている。小胞体ストレス・ミトコンドリアストレス [6][31][32] 、成長因子・栄養制限 [33] などの環境要因でも発現上昇が見られる。
哺乳類細胞内では主に細胞質に局在するが、PINK1の活性化に伴って、ミトコンドリアへの集積が見られる[18][19] 。PINK1によるParkinのミトコンドリアへの集積の分子メカニズムは、2014-2015年に明らかされた(図4)[34][35][36] 。
機能
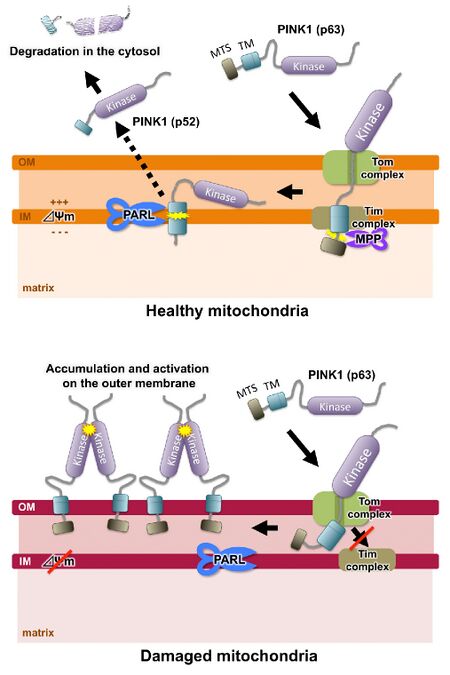
(上, 健康なミトコンドリア) 新規に作られたPINK1は、膜電位依存的輸送経路によりミトコンドリア内膜まで輸送される。内膜上でMPPとPARLにより切断をうけ、未解明の機構で細胞質へと放出される。その後、ユビキチン-プロテアソーム経路で分解される。
(下, 膜電位が低下したミトコンドリア) PINK1は外膜に集積し、自己会合・自己リン酸化により活性化する。
図は文献[1]より引用。
不良(不要)ミトコンドリアのマイトファジー
細胞での機能として、PINK1と協働してマイトファジーに関与することが、培養細胞で明らかにされている。
ミトコンドリア局在性キナーゼPINK1は、ミトコンドリア膜電位依存的に健常なミトコンドリアの内膜まで輸送され、ミトコンドリア内プロテアーゼMPP(mitochondrial processing peptidase)[37] とPARL [38][39] によって2段階の切断を受け、その後、細胞質にてユビキチン-プロテアソーム経路で分解されると考えられている[40] 。ミトコンドリア膜電位が低下すると、膜電位依存的な輸送効率が低下し、ミトコンドリア外膜に蓄積、自己会合および自己リン酸化により、キナーゼが活性化する[36][41][42] (図5)。以上から、PINK1は膜電位が低下した(機能低下した)ミトコンドリアを検出するセンサーとして働くと考えられる。
活性化したPINK1は、近傍のポリユビキチン化修飾を受けたタンパク質(主にミトコンドリア外膜のタンパク質)をリン酸化する(リン酸化ポリユビキチン鎖の種の形成)。Parkinはリン酸化ポリユビキチンへの親和性が高く、細胞質からミトコンドリア上のリン酸化ポリユビキチンへ繋留され活性化する。活性化されたParkinは、近傍のミトコンドリアタンパク質をユビキチン化する。さらに、PINK1がParkinによるポリユビキチン鎖をリン酸化し、新たなリン酸化ポリユビキチン鎖をミトコンドリア外膜上に形成する(リン酸化ポリユビキチン鎖の増幅)。増幅されたリン酸化ポリユビキチン鎖に、細胞質に残っている不活性型Parkinが繋留され活性化し、PINK1と協働して、さらにリン酸化ポリユビキチン鎖を形成する(リン酸化ポリユビキチン鎖の再増幅)。PINK1とParkinの役割は、上述のようなフィードフォワードループを形成して、不良ミトコンドリアをリン酸化ポリユビキチン鎖にて速やかにマーキングすることだと考えられる(図4)[34][35] 。
マイトファジー時のParkinのユビキチン化基質は数多く報告され、ミトコンドリア外膜・内膜・マトリクスタンパク質のほか、細胞質や核のタンパク質も含まれる[43] 。そのうち、Dynamin-like GTPase, Mitofusin(哺乳類ではMitofusin 1とMitofusin 2がある)は、Parkinによって早期にユビキチン化とその後のプロテアソーム経路での分解を受けるミトコンドリア外膜分子として知られる。Mitofusinの分解により、ミトコンドリアが断片化する[44][45][46][47][48] 。ミトコンドリアの断片化は、隔離膜形成とオートファジーによる除去を容易にすると考えられる[47] 。実際、ミトコンドリア断片化に働くDynamin-like GTPase, Drp1の過剰発現は、ParkinやPINK1ノックアウトハエのミトコンドリア変性を緩和する[49][50] 。このDrp1の効果は、Parkin非介在マイトファジーによる補完を促進するからと考えられる。
生理的なミトコンドリア排除へのParkinの関与も報告されている。寒冷暴露に応じて発達するベージュ脂肪細胞は、熱産生のためにミトコンドリアが豊富である。しかし寒冷ストレスがなくなると、脂肪滴貯蔵のためミトコンドリアが少ない白色脂肪細胞へと変化する。ベージュ脂肪細胞の白色脂肪細胞化の際に不要となったミトコンドリアがParkinによって除去される[51] 。
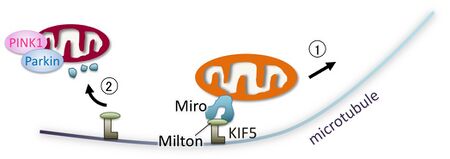
① 健康なミトコンドリアは、Miro-Milton-KIF5により、微小管に沿って順行輸送される。
② 膜電位が低下したミトコンドリア上では、PINK1-Parkinが活性化しMiroを分解する。その結果、順行輸送が停止する。 図は文献[1]より改変。
ミトコンドリア輸送制御
ミトコンドリア外膜Rho-GTPase, Miro (哺乳類ではMiro 1とMiro 2がある)は、キネシンタンパク質KIF5と協働して、微小管を介したミトコンドリアの順行輸送に関与する[52][53] 。神経細胞においては、神経軸索、前シナプスへのミトコンドリア供給機構として重要である。MiroがPINK1-Parkinによりユビキチン化、プロテアソーム経路での分解を受けることにより、ミトコンドリア輸送が停止する[52][53] 。その生理的意義として、不良ミトコンドリアを神経終末へ輸送しないミトコンドリア品質管理と考えられる(図6)。
ゼノファジー
ParkinはPACRG (Parkin co-regulated gene)とともにサルモネラ菌、らい菌感染の感受性遺伝子座に位置する[54][55] 。実験的にParkinが結核菌のゼノファジー(異物排除のためのオートファジー)に関与することが示されたが、Parkinが活性化するメカニズムは不明である[56] 。
個体レベルでの機能
ミトコンドリアゲノム変異[57] ・異常タンパク質のミトコンドリアへの蓄積引用エラー: <ref> タグ内の引数が無効です を示す動物モデルで、Parkinが不良ミトコンドリアの除去に関与することが示されている。しかし、マイトファジーを可視化できるmito-QCマウスの中脳黒質ドーパミン神経では、Parkinを介したマイトファジーは検出されていない[58] 。一方、マイトファジーを可視化するmt-Keimaを用いたマウスでは、PINK1の欠失によって、強負荷運動後の心筋におけるマイトファジーが減少することが報告されている[59] 。
ショウジョウバエでは、加齢依存的な中枢ドーパミン神経のマイトファジーにParkinが関与するという報告[60] 、しないという報告[61][62] がある。ただし文献[62] では、非神経組織において、低酸素処理によるマイトファジーや、ミトコンドリアから活性酸素種を発生させるロテノン処理で誘導されるマイトファジーにPINK1、Parkinが関与すると報告している。ショウジョウバエモデルにおいて、PINK1やParkinが中枢ドーパミン神経のマイトファジーに関与するという文献[60] ではmt-Keimaを、関与しないという文献[61] ではmt-Keimaとmito-QCを、非神経組織でのPINK1-Parkin依存的なマイトファジーをみた文献[62] ではmt-Keimaを、マイトファジーのレポーターとして用いている。今後、新たなマイトファジー解析手法が待たれる状況である。
ショウジョウバエでは、ParkinやPINK1変異でミトコンドリア呼吸鎖複合体サブユニット群の半減期が長くなっており、マイトファジー以外の選択的なミトコンドリアタンパク質分解機構も提唱されている[63][64] 。
常染色体性潜性若年性パーキンソニズム脳アストロサイトの形態的異常や患者iPS細胞で作製した中脳オルガノイドでのアストロサイトの分化能低下[65] 、Parkinノックアウトマウスにおいてアストロサイトのミトコンドリア損傷の報告[66] がある。
免疫・炎症へのParkinの関与が示唆されている。PINK1とParkinは、ミトコンドリアの抗原提示経路に関わる分子Sorting nexin-9を分解し、T細胞への抗原提示を阻害する。Parkinのこの機能が過剰な免疫反応を抑制している可能性が報告された[67] . PINK1, Parkinノックアウトマウスでは、ミトコンドリアへの強い負荷(激しい運動やミトコンドリアDNAへの構成的な変異の蓄積)により、STING経路を介した炎症性サイトカインの上昇がみられる [59] 。STINGは血清中に遊離した損傷ミトコンドリアのDNAを認識し、自然免疫を活性化する。ミトコンドリアストレスで生した損傷ミトコンドリアのPINK1-Parkin経路を介したマイトファジーでの除去が、炎症の沈静化に寄与していることが示唆されている。
疾患との関わり
PRKNのホモ接合性変異、複合ヘテロ接合性変異で、若年発症のパーキンソン病を発症する。ヘテロ接合性変異により、パーキンソン病を晩発で発症する例も見られる[68] 。PRKNの病因変異やレアバリアントの報告は、世界中で多数あり、以下のデータベースで検索できる。
バリアントデータベースとして以下も利用できる。
PRKNミスセンス病因変異・レアバリアントとタンパク質の安定性・マイトファジーとの相関を培養細胞で調べた研究がある[69] 。病態が比較的重篤なミスセンス病因変異は、すべてマイトファジー活性が50%以下(対野生型比)に低下していた。しかし、病態が軽度・病態への意義が不明なミスセンス病因変異・レアバリアントでは、マイトファジーへの影響がほとんどなく、まれに亢進しているものも観察された。ユビキチンリガーゼ活性やタンパク質の安定性に影響しない病因変異については、不活性状態を解くアミノ酸への置換(REPを不安定化させるF146AやW403A、図3参照)の導入により、マイトファジー活性が戻ることが示された。この観察は、Parkinの不活性状態を解く化合物がパーキンソン病の疾患修飾薬となる可能性を示唆している。
Parkin変異によるパーキンソン病の典型的な臨床像として、40歳未満での発症、緩慢な病態進行、正常な認知機能、下肢ジストニア、良好なL-ドーパへの反応性、が挙げられる [70] 。神経病理学的特徴として、黒質および青斑核に限局した神経細胞減少を示し、グリオーシスは通常見られない。孤発性パーキンソン病の特徴的病理所見であるレビュー小体は通常みられない[70] 。10歳未満での発症の報告もあり、Parkinはドーパミン神経発生の段階で機能していることが推察される[71][72] 。
Parkin変異患者由来のiPS細胞から作製したドーパミン神経では、リン酸化ユビキチンのシグナルが低下し、不良ミトコンドリアの神経軸索輸送停止が障害されている[73] 。 その他、がん抑制遺伝子として、いくつか報告がある[74][75][76][77][78] 。
関連項目
参考文献
- ↑ 1.0 1.1 1.2 1.3 Imai Y. (2012).
Mitochondrial Regulation by PINK1-Parkin Signaling. ISRN Cell Biol 2012: 926160 - ↑ 2.0 2.1
Kitada, T., Asakawa, S., Hattori, N., Matsumine, H., Yamamura, Y., Minoshima, S., ..., & Shimizu, N. (1998).
Mutations in the parkin gene cause autosomal recessive juvenile parkinsonism. Nature, 392(6676), 605-8. [PubMed:9560156] [WorldCat] [DOI] - ↑
Lücking, C.B., Dürr, A., Bonifati, V., Vaughan, J., De Michele, G., Gasser, T., ..., & European Consortium on Genetic Susceptibility in Parkinson's Disease (2000).
Association between early-onset Parkinson's disease and mutations in the parkin gene. The New England journal of medicine, 342(21), 1560-7. [PubMed:10824074] [WorldCat] [DOI] - ↑
Hattori, N., & Mizuno, Y. (2004).
Pathogenetic mechanisms of parkin in Parkinson's disease. Lancet (London, England), 364(9435), 722-4. [PubMed:15325839] [WorldCat] [DOI] - ↑
Shimura, H., Hattori, N., Kubo, S.i., Mizuno, Y., Asakawa, S., Minoshima, S., ..., & Suzuki, T. (2000).
Familial Parkinson disease gene product, parkin, is a ubiquitin-protein ligase. Nature genetics, 25(3), 302-5. [PubMed:10888878] [WorldCat] [DOI] - ↑ 6.0 6.1
Imai, Y., Soda, M., & Takahashi, R. (2000).
Parkin suppresses unfolded protein stress-induced cell death through its E3 ubiquitin-protein ligase activity. The Journal of biological chemistry, 275(46), 35661-4. [PubMed:10973942] [WorldCat] [DOI] - ↑
Zhang, Y., Gao, J., Chung, K.K., Huang, H., Dawson, V.L., & Dawson, T.M. (2000).
Parkin functions as an E2-dependent ubiquitin- protein ligase and promotes the degradation of the synaptic vesicle-associated protein, CDCrel-1. Proceedings of the National Academy of Sciences of the United States of America, 97(24), 13354-9. [PubMed:11078524] [PMC] [WorldCat] [DOI] - ↑
Zhang, C.W., Hang, L., Yao, T.P., & Lim, K.L. (2015).
Parkin Regulation and Neurodegenerative Disorders. Frontiers in aging neuroscience, 7, 248. [PubMed:26793099] [PMC] [WorldCat] [DOI] - ↑
Valente, E.M., Abou-Sleiman, P.M., Caputo, V., Muqit, M.M., Harvey, K., Gispert, S., ..., & Wood, N.W. (2004).
Hereditary early-onset Parkinson's disease caused by mutations in PINK1. Science (New York, N.Y.), 304(5674), 1158-60. [PubMed:15087508] [WorldCat] [DOI] - ↑
Kumazawa, R., Tomiyama, H., Li, Y., Imamichi, Y., Funayama, M., Yoshino, H., ..., & Hattori, N. (2008).
Mutation analysis of the PINK1 gene in 391 patients with Parkinson disease. Archives of neurology, 65(6), 802-8. [PubMed:18541801] [WorldCat] [DOI] - ↑
Clark, I.E., Dodson, M.W., Jiang, C., Cao, J.H., Huh, J.R., Seol, J.H., ..., & Guo, M. (2006).
Drosophila pink1 is required for mitochondrial function and interacts genetically with parkin. Nature, 441(7097), 1162-6. [PubMed:16672981] [WorldCat] [DOI] - ↑
Park, J., Lee, S.B., Lee, S., Kim, Y., Song, S., Kim, S., ..., & Chung, J. (2006).
Mitochondrial dysfunction in Drosophila PINK1 mutants is complemented by parkin. Nature, 441(7097), 1157-61. [PubMed:16672980] [WorldCat] [DOI] - ↑
Yang, Y., Gehrke, S., Imai, Y., Huang, Z., Ouyang, Y., Wang, J.W., ..., & Lu, B. (2006).
Mitochondrial pathology and muscle and dopaminergic neuron degeneration caused by inactivation of Drosophila Pink1 is rescued by Parkin. Proceedings of the National Academy of Sciences of the United States of America, 103(28), 10793-8. [PubMed:16818890] [PMC] [WorldCat] [DOI] - ↑
Kondapalli, C., Kazlauskaite, A., Zhang, N., Woodroof, H.I., Campbell, D.G., Gourlay, R., ..., & Muqit, M.M. (2012).
PINK1 is activated by mitochondrial membrane potential depolarization and stimulates Parkin E3 ligase activity by phosphorylating Serine 65. Open biology, 2(5), 120080. [PubMed:22724072] [PMC] [WorldCat] [DOI] - ↑
Shiba-Fukushima, K., Imai, Y., Yoshida, S., Ishihama, Y., Kanao, T., Sato, S., & Hattori, N. (2012).
PINK1-mediated phosphorylation of the Parkin ubiquitin-like domain primes mitochondrial translocation of Parkin and regulates mitophagy. Scientific reports, 2, 1002. [PubMed:23256036] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Shiba-Fukushima, K., Inoshita, T., Hattori, N., & Imai, Y. (2014).
PINK1-mediated phosphorylation of Parkin boosts Parkin activity in Drosophila. PLoS genetics, 10(6), e1004391. [PubMed:24901221] [PMC] [WorldCat] [DOI] - ↑
Narendra, D., Tanaka, A., Suen, D.F., & Youle, R.J. (2008).
Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. The Journal of cell biology, 183(5), 795-803. [PubMed:19029340] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1
Narendra, D.P., Jin, S.M., Tanaka, A., Suen, D.F., Gautier, C.A., Shen, J., ..., & Youle, R.J. (2010).
PINK1 is selectively stabilized on impaired mitochondria to activate Parkin. PLoS biology, 8(1), e1000298. [PubMed:20126261] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Matsuda, N., Sato, S., Shiba, K., Okatsu, K., Saisho, K., Gautier, C.A., ..., & Tanaka, K. (2010).
PINK1 stabilized by mitochondrial depolarization recruits Parkin to damaged mitochondria and activates latent Parkin for mitophagy. The Journal of cell biology, 189(2), 211-21. [PubMed:20404107] [PMC] [WorldCat] [DOI] - ↑
Geisler, S., Holmström, K.M., Skujat, D., Fiesel, F.C., Rothfuss, O.C., Kahle, P.J., & Springer, W. (2010).
PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1. Nature cell biology, 12(2), 119-31. [PubMed:20098416] [WorldCat] [DOI] - ↑
Hristova, V.A., Beasley, S.A., Rylett, R.J., & Shaw, G.S. (2009).
Identification of a novel Zn2+-binding domain in the autosomal recessive juvenile Parkinson-related E3 ligase parkin. The Journal of biological chemistry, 284(22), 14978-86. [PubMed:19339245] [PMC] [WorldCat] [DOI] - ↑
Trempe, J.F., Sauvé, V., Grenier, K., Seirafi, M., Tang, M.Y., Ménade, M., ..., & Gehring, K. (2013).
Structure of parkin reveals mechanisms for ubiquitin ligase activation. Science (New York, N.Y.), 340(6139), 1451-5. [PubMed:23661642] [WorldCat] [DOI] - ↑ 23.0 23.1
Wauer, T., Simicek, M., Schubert, A., & Komander, D. (2015).
Mechanism of phospho-ubiquitin-induced PARKIN activation. Nature, 524(7565), 370-4. [PubMed:26161729] [PMC] [WorldCat] [DOI] - ↑
Kane, L.A., Lazarou, M., Fogel, A.I., Li, Y., Yamano, K., Sarraf, S.A., ..., & Youle, R.J. (2014).
PINK1 phosphorylates ubiquitin to activate Parkin E3 ubiquitin ligase activity. The Journal of cell biology, 205(2), 143-53. [PubMed:24751536] [PMC] [WorldCat] [DOI] - ↑
Kazlauskaite, A., Kondapalli, C., Gourlay, R., Campbell, D.G., Ritorto, M.S., Hofmann, K., ..., & Muqit, M.M. (2014).
Parkin is activated by PINK1-dependent phosphorylation of ubiquitin at Ser65. The Biochemical journal, 460(1), 127-39. [PubMed:24660806] [PMC] [WorldCat] [DOI] - ↑
Koyano, F., Okatsu, K., Kosako, H., Tamura, Y., Go, E., Kimura, M., ..., & Matsuda, N. (2014).
Ubiquitin is phosphorylated by PINK1 to activate parkin. Nature, 510(7503), 162-6. [PubMed:24784582] [WorldCat] [DOI] - ↑
Uhlén, M., Fagerberg, L., Hallström, B.M., Lindskog, C., Oksvold, P., Mardinoglu, A., ..., & Pontén, F. (2015).
Proteomics. Tissue-based map of the human proteome. Science (New York, N.Y.), 347(6220), 1260419. [PubMed:25613900] [WorldCat] [DOI] - ↑
West, A.B., Lockhart, P.J., O'Farell, C., & Farrer, M.J. (2003).
Identification of a novel gene linked to parkin via a bi-directional promoter. Journal of molecular biology, 326(1), 11-9. [PubMed:12547187] [WorldCat] [DOI] - ↑
West, A.B., Kapatos, G., O'Farrell, C., Gonzalez-de-Chavez, F., Chiu, K., Farrer, M.J., & Maidment, N.T. (2004).
N-myc regulates parkin expression. The Journal of biological chemistry, 279(28), 28896-902. [PubMed:15078880] [WorldCat] [DOI] - ↑
Zhang, C., Lin, M., Wu, R., Wang, X., Yang, B., Levine, A.J., ..., & Feng, Z. (2011).
Parkin, a p53 target gene, mediates the role of p53 in glucose metabolism and the Warburg effect. Proceedings of the National Academy of Sciences of the United States of America, 108(39), 16259-64. [PubMed:21930938] [PMC] [WorldCat] [DOI] - ↑ 31.0 31.1
Bouman, L., Schlierf, A., Lutz, A.K., Shan, J., Deinlein, A., Kast, J., ..., & Winklhofer, K.F. (2011).
Parkin is transcriptionally regulated by ATF4: evidence for an interconnection between mitochondrial stress and ER stress. Cell death and differentiation, 18(5), 769-82. [PubMed:21113145] [PMC] [WorldCat] [DOI] - ↑
Wang, H.Q., Imai, Y., Kataoka, A., & Takahashi, R. (2007).
Cell type-specific upregulation of Parkin in response to ER stress. Antioxidants & redox signaling, 9(5), 533-42. [PubMed:17465879] [WorldCat] [DOI] - ↑
Klinkenberg, M., Gispert, S., Dominguez-Bautista, J.A., Braun, I., Auburger, G., & Jendrach, M. (2012).
Restriction of trophic factors and nutrients induces PARKIN expression. Neurogenetics, 13(1), 9-21. [PubMed:22028146] [PMC] [WorldCat] [DOI] - ↑ 34.0 34.1
Ordureau, A., Sarraf, S.A., Duda, D.M., Heo, J.M., Jedrychowski, M.P., Sviderskiy, V.O., ..., & Harper, J.W. (2014).
Quantitative proteomics reveal a feedforward mechanism for mitochondrial PARKIN translocation and ubiquitin chain synthesis. Molecular cell, 56(3), 360-75. [PubMed:25284222] [PMC] [WorldCat] [DOI] - ↑ 35.0 35.1
Shiba-Fukushima, K., Arano, T., Matsumoto, G., Inoshita, T., Yoshida, S., Ishihama, Y., ..., & Imai, Y. (2014).
Phosphorylation of mitochondrial polyubiquitin by PINK1 promotes Parkin mitochondrial tethering. PLoS genetics, 10(12), e1004861. [PubMed:25474007] [PMC] [WorldCat] [DOI] - ↑ 36.0 36.1
Okatsu, K., Kimura, M., Oka, T., Tanaka, K., & Matsuda, N. (2015).
Unconventional PINK1 localization to the outer membrane of depolarized mitochondria drives Parkin recruitment. Journal of cell science, 128(5), 964-78. [PubMed:25609704] [PMC] [WorldCat] [DOI] - ↑
Greene, A.W., Grenier, K., Aguileta, M.A., Muise, S., Farazifard, R., Haque, M.E., ..., & Fon, E.A. (2012).
Mitochondrial processing peptidase regulates PINK1 processing, import and Parkin recruitment. EMBO reports, 13(4), 378-85. [PubMed:22354088] [PMC] [WorldCat] [DOI] - ↑
Zhou, C., Huang, Y., Shao, Y., May, J., Prou, D., Perier, C., ..., & Przedborski, S. (2008).
The kinase domain of mitochondrial PINK1 faces the cytoplasm. Proceedings of the National Academy of Sciences of the United States of America, 105(33), 12022-7. [PubMed:18687899] [PMC] [WorldCat] [DOI] - ↑
Jin, S.M., Lazarou, M., Wang, C., Kane, L.A., Narendra, D.P., & Youle, R.J. (2010).
Mitochondrial membrane potential regulates PINK1 import and proteolytic destabilization by PARL. The Journal of cell biology, 191(5), 933-42. [PubMed:21115803] [PMC] [WorldCat] [DOI] - ↑
Yamano, K., & Youle, R.J. (2013).
PINK1 is degraded through the N-end rule pathway. Autophagy, 9(11), 1758-69. [PubMed:24121706] [PMC] [WorldCat] [DOI] - ↑
Okatsu, K., Oka, T., Iguchi, M., Imamura, K., Kosako, H., Tani, N., ..., & Matsuda, N. (2012).
PINK1 autophosphorylation upon membrane potential dissipation is essential for Parkin recruitment to damaged mitochondria. Nature communications, 3, 1016. [PubMed:22910362] [PMC] [WorldCat] [DOI] - ↑
Okatsu, K., Uno, M., Koyano, F., Go, E., Kimura, M., Oka, T., ..., & Matsuda, N. (2013).
A dimeric PINK1-containing complex on depolarized mitochondria stimulates Parkin recruitment. The Journal of biological chemistry, 288(51), 36372-84. [PubMed:24189060] [PMC] [WorldCat] [DOI] - ↑
Sarraf, S.A., Raman, M., Guarani-Pereira, V., Sowa, M.E., Huttlin, E.L., Gygi, S.P., & Harper, J.W. (2013).
Landscape of the PARKIN-dependent ubiquitylome in response to mitochondrial depolarization. Nature, 496(7445), 372-6. [PubMed:23503661] [PMC] [WorldCat] [DOI] - ↑
Gegg, M.E., Cooper, J.M., Chau, K.Y., Rojo, M., Schapira, A.H., & Taanman, J.W. (2010).
Mitofusin 1 and mitofusin 2 are ubiquitinated in a PINK1/parkin-dependent manner upon induction of mitophagy. Human molecular genetics, 19(24), 4861-70. [PubMed:20871098] [PMC] [WorldCat] [DOI] - ↑
Poole, A.C., Thomas, R.E., Yu, S., Vincow, E.S., & Pallanck, L. (2010).
The mitochondrial fusion-promoting factor mitofusin is a substrate of the PINK1/parkin pathway. PloS one, 5(4), e10054. [PubMed:20383334] [PMC] [WorldCat] [DOI] - ↑
Rakovic, A., Grünewald, A., Kottwitz, J., Brüggemann, N., Pramstaller, P.P., Lohmann, K., & Klein, C. (2011).
Mutations in PINK1 and Parkin impair ubiquitination of Mitofusins in human fibroblasts. PloS one, 6(3), e16746. [PubMed:21408142] [PMC] [WorldCat] [DOI] - ↑ 47.0 47.1
Tanaka, A., Cleland, M.M., Xu, S., Narendra, D.P., Suen, D.F., Karbowski, M., & Youle, R.J. (2010).
Proteasome and p97 mediate mitophagy and degradation of mitofusins induced by Parkin. The Journal of cell biology, 191(7), 1367-80. [PubMed:21173115] [PMC] [WorldCat] [DOI] - ↑
Ziviani, E., Tao, R.N., & Whitworth, A.J. (2010).
Drosophila parkin requires PINK1 for mitochondrial translocation and ubiquitinates mitofusin. Proceedings of the National Academy of Sciences of the United States of America, 107(11), 5018-23. [PubMed:20194754] [PMC] [WorldCat] [DOI] - ↑
Deng, H., Dodson, M.W., Huang, H., & Guo, M. (2008).
The Parkinson's disease genes pink1 and parkin promote mitochondrial fission and/or inhibit fusion in Drosophila. Proceedings of the National Academy of Sciences of the United States of America, 105(38), 14503-8. [PubMed:18799731] [PMC] [WorldCat] [DOI] - ↑
Yang, Y., Ouyang, Y., Yang, L., Beal, M.F., McQuibban, A., Vogel, H., & Lu, B. (2008).
Pink1 regulates mitochondrial dynamics through interaction with the fission/fusion machinery. Proceedings of the National Academy of Sciences of the United States of America, 105(19), 7070-5. [PubMed:18443288] [PMC] [WorldCat] [DOI] - ↑
Lu, X., Altshuler-Keylin, S., Wang, Q., Chen, Y., Henrique Sponton, C., Ikeda, K., ..., & Kajimura, S. (2018).
Mitophagy controls beige adipocyte maintenance through a Parkin-dependent and UCP1-independent mechanism. Science signaling, 11(527). [PubMed:29692364] [PMC] [WorldCat] [DOI] - ↑ 52.0 52.1
Wang, X., Winter, D., Ashrafi, G., Schlehe, J., Wong, Y.L., Selkoe, D., ..., & Schwarz, T.L. (2011).
PINK1 and Parkin target Miro for phosphorylation and degradation to arrest mitochondrial motility. Cell, 147(4), 893-906. [PubMed:22078885] [PMC] [WorldCat] [DOI] - ↑ 53.0 53.1
Liu, S., Sawada, T., Lee, S., Yu, W., Silverio, G., Alapatt, P., ..., & Lu, B. (2012).
Parkinson's disease-associated kinase PINK1 regulates Miro protein level and axonal transport of mitochondria. PLoS genetics, 8(3), e1002537. [PubMed:22396657] [PMC] [WorldCat] [DOI] - ↑
Mira, M.T., Alcaïs, A., Nguyen, V.T., Moraes, M.O., Di Flumeri, C., Vu, H.T., ..., & Schurr, E. (2004).
Susceptibility to leprosy is associated with PARK2 and PACRG. Nature, 427(6975), 636-40. [PubMed:14737177] [WorldCat] [DOI] - ↑
Ali, S., Vollaard, A.M., Widjaja, S., Surjadi, C., van de Vosse, E., & van Dissel, J.T. (2006).
PARK2/PACRG polymorphisms and susceptibility to typhoid and paratyphoid fever. Clinical and experimental immunology, 144(3), 425-31. [PubMed:16734611] [PMC] [WorldCat] [DOI] - ↑
Manzanillo, P.S., Ayres, J.S., Watson, R.O., Collins, A.C., Souza, G., Rae, C.S., ..., & Cox, J.S. (2013).
The ubiquitin ligase parkin mediates resistance to intracellular pathogens. Nature, 501(7468), 512-6. [PubMed:24005326] [PMC] [WorldCat] [DOI] - ↑
Pickrell, A.M., Huang, C.H., Kennedy, S.R., Ordureau, A., Sideris, D.P., Hoekstra, J.G., ..., & Youle, R.J. (2015).
Endogenous Parkin Preserves Dopaminergic Substantia Nigral Neurons following Mitochondrial DNA Mutagenic Stress. Neuron, 87(2), 371-81. [PubMed:26182419] [PMC] [WorldCat] [DOI] - ↑
McWilliams, T.G., Prescott, A.R., Montava-Garriga, L., Ball, G., Singh, F., Barini, E., ..., & Ganley, I.G. (2018).
Basal Mitophagy Occurs Independently of PINK1 in Mouse Tissues of High Metabolic Demand. Cell metabolism, 27(2), 439-449.e5. [PubMed:29337137] [PMC] [WorldCat] [DOI] - ↑ 59.0 59.1
Sliter, D.A., Martinez, J., Hao, L., Chen, X., Sun, N., Fischer, T.D., ..., & Youle, R.J. (2018).
Parkin and PINK1 mitigate STING-induced inflammation. Nature, 561(7722), 258-262. [PubMed:30135585] [PMC] [WorldCat] [DOI] - ↑ 60.0 60.1
Cornelissen, T., Vilain, S., Vints, K., Gounko, N., Verstreken, P., & Vandenberghe, W. (2018).
Deficiency of parkin and PINK1 impairs age-dependent mitophagy in Drosophila. eLife, 7. [PubMed:29809156] [PMC] [WorldCat] [DOI] - ↑ 61.0 61.1
Lee, J.J., Sanchez-Martinez, A., Zarate, A.M., Benincá, C., Mayor, U., Clague, M.J., & Whitworth, A.J. (2018).
Basal mitophagy is widespread in Drosophila but minimally affected by loss of Pink1 or parkin. The Journal of cell biology, 217(5), 1613-1622. [PubMed:29500189] [PMC] [WorldCat] [DOI] - ↑ 62.0 62.1 62.2
Kim, Y.Y., Um, J.H., Yoon, J.H., Kim, H., Lee, D.Y., Lee, Y.J., ..., & Yun, J. (2019).
Assessment of mitophagy in mt-Keima Drosophila revealed an essential role of the PINK1-Parkin pathway in mitophagy induction in vivo. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 33(9), 9742-9751. [PubMed:31120803] [WorldCat] [DOI] - ↑
Vincow, E.S., Merrihew, G., Thomas, R.E., Shulman, N.J., Beyer, R.P., MacCoss, M.J., & Pallanck, L.J. (2013).
The PINK1-Parkin pathway promotes both mitophagy and selective respiratory chain turnover in vivo. Proceedings of the National Academy of Sciences of the United States of America, 110(16), 6400-5. [PubMed:23509287] [PMC] [WorldCat] [DOI] - ↑
McLelland, G.L., Lee, S.A., McBride, H.M., & Fon, E.A. (2016).
Syntaxin-17 delivers PINK1/parkin-dependent mitochondrial vesicles to the endolysosomal system. The Journal of cell biology, 214(3), 275-91. [PubMed:27458136] [PMC] [WorldCat] [DOI] - ↑ Kano M, Takanashi M, Oyama G, Yoritaka A, Hatano T, et al. in press
Reduced astrocytic reactivity in human brains and midbrain organoids with PRKN mutations. NPJ Parkinsons Dis. - ↑
Schmidt, S., Linnartz, B., Mendritzki, S., Sczepan, T., Lübbert, M., Stichel, C.C., & Lübbert, H. (2011).
Genetic mouse models for Parkinson's disease display severe pathology in glial cell mitochondria. Human molecular genetics, 20(6), 1197-211. [PubMed:21212098] [WorldCat] [DOI] - ↑
Matheoud, D., Sugiura, A., Bellemare-Pelletier, A., Laplante, A., Rondeau, C., Chemali, M., ..., & Desjardins, M. (2016).
Parkinson's Disease-Related Proteins PINK1 and Parkin Repress Mitochondrial Antigen Presentation. Cell, 166(2), 314-327. [PubMed:27345367] [WorldCat] [DOI] - ↑
Klein, C., Lohmann-Hedrich, K., Rogaeva, E., Schlossmacher, M.G., & Lang, A.E. (2007).
Deciphering the role of heterozygous mutations in genes associated with parkinsonism. The Lancet. Neurology, 6(7), 652-62. [PubMed:17582365] [WorldCat] [DOI] - ↑
Yi, W., MacDougall, E.J., Tang, M.Y., Krahn, A.I., Gan-Or, Z., Trempe, J.F., & Fon, E.A. (2019).
The landscape of Parkin variants reveals pathogenic mechanisms and therapeutic targets in Parkinson's disease. Human molecular genetics, 28(17), 2811-2825. [PubMed:30994895] [PMC] [WorldCat] [DOI] - ↑ 70.0 70.1 久保紳一郎、波田野琢、服部信孝. 2013.
常染色体劣性パーキンソン病 In パーキンソン病と運動症状, ed. 高橋良輔, pp. 400-06: 中山書店 - ↑
Matsumine, H., Saito, M., Shimoda-Matsubayashi, S., Tanaka, H., Ishikawa, A., Nakagawa-Hattori, Y., ..., & Mizuno, Y. (1997).
Localization of a gene for an autosomal recessive form of juvenile Parkinsonism to chromosome 6q25.2-27. American journal of human genetics, 60(3), 588-96. [PubMed:9042918] [PMC] [WorldCat] - ↑
Takei, K., Yamamoto, T., Asano, Y., Iwasaki, S., & Shimazu, K. (2000).
[A case of autosomal recessive juvenile parkinsonism (AR-JP) with onset at the age of 6 years]. Rinsho shinkeigaku = Clinical neurology, 40(6), 596-9. [PubMed:11086400] [WorldCat] - ↑
Shiba-Fukushima, K., Ishikawa, K.I., Inoshita, T., Izawa, N., Takanashi, M., Sato, S., ..., & Hattori, N. (2017).
Evidence that phosphorylated ubiquitin signaling is involved in the etiology of Parkinson's disease. Human molecular genetics, 26(16), 3172-3185. [PubMed:28541509] [WorldCat] [DOI] - ↑
Denison, S.R., Callahan, G., Becker, N.A., Phillips, L.A., & Smith, D.I. (2003).
Characterization of FRA6E and its potential role in autosomal recessive juvenile parkinsonism and ovarian cancer. Genes, chromosomes & cancer, 38(1), 40-52. [PubMed:12874785] [WorldCat] [DOI] - ↑
Cesari, R., Martin, E.S., Calin, G.A., Pentimalli, F., Bichi, R., McAdams, H., ..., & Croce, C.M. (2003).
Parkin, a gene implicated in autosomal recessive juvenile parkinsonism, is a candidate tumor suppressor gene on chromosome 6q25-q27. Proceedings of the National Academy of Sciences of the United States of America, 100(10), 5956-61. [PubMed:12719539] [PMC] [WorldCat] [DOI] - ↑
Fujiwara, M., Marusawa, H., Wang, H.Q., Iwai, A., Ikeuchi, K., Imai, Y., ..., & Chiba, T. (2008).
Parkin as a tumor suppressor gene for hepatocellular carcinoma. Oncogene, 27(46), 6002-11. [PubMed:18574468] [WorldCat] [DOI] - ↑
Veeriah, S., Taylor, B.S., Meng, S., Fang, F., Yilmaz, E., Vivanco, I., ..., & Chan, T.A. (2010).
Somatic mutations of the Parkinson's disease-associated gene PARK2 in glioblastoma and other human malignancies. Nature genetics, 42(1), 77-82. [PubMed:19946270] [PMC] [WorldCat] [DOI] - ↑
Gong, Y., Zack, T.I., Morris, L.G., Lin, K., Hukkelhoven, E., Raheja, R., ..., & Chan, T.A. (2014).
Pan-cancer genetic analysis identifies PARK2 as a master regulator of G1/S cyclins. Nature genetics, 46(6), 588-94. [PubMed:24793136] [PMC] [WorldCat] [DOI]