「IPS細胞」の版間の差分
細 →誘導因子 |
細編集の要約なし |
||
| (4人の利用者による、間の14版が非表示) | |||
| 1行目: | 1行目: | ||
{{lowercase title}} | {{lowercase title}} | ||
英語名:induced pluripotent stem cells、英略語:iPS cells, iPSCs 独:induzierte pluripotente Stammzelle 仏:cellule souche pluripotente induite | 英語名:induced pluripotent stem cells、英略語:iPS cells, iPSCs 独:induzierte pluripotente Stammzelle 仏:cellule souche pluripotente induite | ||
| 13行目: | 4行目: | ||
同義語:人工多能性幹細胞 | 同義語:人工多能性幹細胞 | ||
[[Image:Mouse iPSC.png|thumb|250px|''' | iPS細胞(人工多能性幹細胞)とは、本来、[[wikipedia:Cell_potency#Pluripotency|分化多能性]](pluripotency)を喪失している[[wikipedia:JA:体細胞|体細胞]]に特定の遺伝子を導入することによって、人為的に誘導される多能性幹細胞株の総称である。[[wikipedia:JA:胚盤胞|胚盤胞]]と呼ばれる初期[[wikipedia:JA:胚|胚]]の[[wikipedia:JA:内部細胞塊|内部細胞塊]]から樹立されたES細胞([[胚性幹細胞]])と類似の特徴を示し、分化多能性の定義である三[[wikipedia:JA:胚|胚]]葉(外胚葉、中胚葉、内胚葉)や[[wikipedia:JA:生殖細胞|生殖細胞]]への分化能を保持したまま、培養下で半永久的に自己複製(self-renewal)する。2006年に[[wikipedia:JA:京都大学|京都大学]]の高橋和利博士と[[wikipedia:JA:山中伸弥|山中伸弥]]博士によって最初の報告<ref name="ref1"><pubmed> 16904174 </pubmed></ref>がなされて以降、様々な動物種、細胞種を起源とするiPS細胞が樹立されている。[[wikipedia:JA:ヒト|ヒト]]においても個々人の生検試料からiPS細胞を作成することが可能であることから、疾患特異的iPS細胞を利用した病態解明や薬剤スクリーニングのほか、[[wikipedia:JA:拒絶反応|免疫拒絶]]を回避した再生医療への応用が期待されている。 | ||
[[Image:Marmoset iPSC.png|thumb|250px|''' | |||
[[Image:Human iPSC.png|thumb|250px|''' | [[Image:Mouse iPSC.png|thumb|250px|'''図1 マウスiPS細胞''']] | ||
[[Image:Marmoset iPSC.png|thumb|250px|'''図2 マーモセットiPS細胞''']] | |||
[[Image:Human iPSC.png|thumb|250px|'''図3 ヒトiPS細胞''']] | |||
== iPS細胞樹立の経緯 == | == iPS細胞樹立の経緯 == | ||
| 26行目: | 16行目: | ||
=== 体細胞を初期化する因子 === | === 体細胞を初期化する因子 === | ||
iPS細胞樹立の以前から、[[wikipedia:JA:卵子|卵子]]やES細胞には体細胞を[[wikipedia:Reprogramming|初期化]](リプログラミング)する因子が含まれていることが知られていた。まず、[[wikipedia:Somatic-cell nuclear transfer|体細胞核移植]](somatic cell nuclear transfer, SCNT)の研究において、卵子の[[wikipedia:JA:細胞質|細胞質]]内部に体細胞を移植することにより[[wikipedia:JA:クローン#.E3.82.AF.E3.83.AD.E3.83.BC.E3.83.B3.E5.8B.95.E7.89.A9|クローン動物]]やクローンES細胞の作成が可能であることが示された。有名な例としては、[[wikipedia:Ian Wilmut|Ian Wilmut]]博士らによるクローン羊の[[wikipedia:JA:ドリー (羊)|ドリー]]や[[wikipedia:JA:若山照彦|若山照彦]]博士(当時、ハワイ大学)らによるクローンマウスのキュムリーナが挙げられる。一方、京都大学の多田高博士らは、ES細胞と体細胞を電気刺激により細胞融合させる一連の研究により、融合細胞はES細胞と同様の細胞特性を示すこと、体細胞側のゲノムDNAがES細胞様の[[wikipedia:JA:エピジェネティック|エピジェネティック]]状態に転換されることが明らかとなった。とりわけ、ES細胞は培養下で容易かつ半永久的に増幅可能であることから、これらの発見はその後の初期化因子の探索において非常に大きな僥倖となった。 | |||
=== 初期化因子 === | === 初期化因子 === | ||
上述の背景のもと、山中伸弥博士(当時、[[ | 上述の背景のもと、山中伸弥博士(当時、[[wikipedia:JA:奈良先端科学技術大学院大学|奈良先端科学技術大学院大学]])はES細胞の分化多能性維持機構の解明を第一の目的とし、ES細胞で特異的に発現する遺伝子群の同定を行った。公共のデータベースを利用したin silicoのスクリーニングによってES細胞特異的な遺伝子群が同定され、ECAT(ES cell associated transcript)と命名された<ref name="ref4"><pubmed> 12787504 </pubmed></ref>。ECATの中には[[wikipedia:Dppa5|Esg1]]/ECAT2/Dppa5や[[wikipedia:Oct4|Oct4]]等の既知のES細胞マーカー遺伝子のほか、[[wikipedia:ECAT1|ECAT1]]や[[wikipedia:Tdrd12|Tdrd12]]/ECAT8等の新規遺伝子も含まれていた。「ES細胞で特異的に発現している遺伝子≒ES細胞において機能的に重要な遺伝子」との仮説から各ECATのノックアウトや強制発現実験が試みられ、[[ホメオボックス]]転写因子である[[wikipedia:Nanog|Nanog]]/ECAT4は多能性ネットワークの構築と維持における中心であること、恒常活性化型[[Ras]]タンパク質であるERas/ECAT5はES細胞の増殖と造腫瘍性を担うこと等が示された。 また、iPS細胞を選択するために最初に利用された[[wikipedia:Fbx15|Fbx15]]/ECAT3も、このスクリーニングによって同定された遺伝子の一つである。 | ||
=== 樹立の成功 === | === 樹立の成功 === | ||
続いて、山中博士らは「ES細胞において機能的に重要な遺伝子≒体細胞の初期化を誘導する遺伝子」という仮説に基づき、ECATおよびES細胞の自己複製を支持する遺伝子([[STAT3]]や[[βカテニン]]等)を体細胞であるマウス胎仔[[ | 続いて、山中博士らは「ES細胞において機能的に重要な遺伝子≒体細胞の初期化を誘導する遺伝子」という仮説に基づき、ECATおよびES細胞の自己複製を支持する遺伝子([[STAT3]]や[[βカテニン]]等)を体細胞であるマウス胎仔[[wikipedia:JA:線維芽細胞|線維芽細胞]](MEF)に導入する実験を試みた。初期化因子候補としては計24の遺伝子が絞り込まれ、上述のFbx15遺伝子座に[[wikipedia:JA:ネオマイシン|ネオマイシン]]耐性遺伝子が挿入されたノックインマウスの細胞が利用された。このマウスの体細胞はECATであるFbx15を発現していないため、[[wikipedia:ja:G418|G418]](ネオマイシン耐性遺伝子によって不活性化される抗生物質)を添加すると細胞は死滅する。一方、ES細胞等の多能性幹細胞はFbx15の発現と一致してネオマイシン耐性遺伝子を発現することから、G418に対して耐性となる。このシステムを用いて各候補遺伝子が1種類ずつ導入されたが、この場合にはG418耐性のES細胞様コロニーは観察されなかった。ところが、24種類全ての候補遺伝子を同時に導入した場合、ES細胞に類似したG418耐性細胞コロニーが出現することが明らかとなった。その後、24遺伝子から1遺伝子を差し引いた23遺伝子を導入する実験により、最終的にES細胞様コロニーの誘導には4種類の遺伝子(Oct4、[[wikipedia:Sox2|Sox2]]、[[wikipedia:Klf4|Klf4]]、[[wikipedia:c-Myc|c-Myc]])の組合せで十分であることが判明した。得られた細胞はES細胞マーカー遺伝子を発現しているほか、胚葉体形成培養や皮下移植による[[wikipedia:JA:テラトーマ|テラトーマ]]形成実験により三胚葉に分化する能力を有することが確認され、iPS細胞と名付けられた<ref name="ref1" />。また、iPS細胞を誘導する遺伝子セットは通称「山中4因子」とも呼ばれる。 | ||
=== 初期化レベルにみられる多様性 === | === 初期化レベルにみられる多様性 === | ||
iPS細胞の誘導法の発見に付随して、体細胞の初期化レベルには多様性があることが明らかとなった。まず、山中4因子が同定される過程において、Sox2を除いた3遺伝子(Oct4、Klf4、c-Myc)の導入によってもG418耐性コロニーが得られていた。しかし、この細胞はES細胞マーカー遺伝子を一部しか発現しておらず、また造腫瘍性は有するものの分化能は獲得していなかった。一方、Fbx15の発現に基づいて誘導されたiPS細胞は確かに分化多能性を獲得してはいるが、[[キメラ]]マウスは胎性致死であり、遺伝子発現においてもECAT1の発現が認められない等、ES細胞とは明らかに異なっていた。しかし、iPS細胞選択の指標をFbx15からNanogやOct4の発現に変更することによって、キメラマウスの出生および生殖系列に寄与するiPS細胞が樹立できるようになった<ref name="ref5"><pubmed> 17554338 </pubmed></ref><ref><pubmed> 17554336 </pubmed></ref>。Fbx15の発現に基づく初期化レベルの低いiPS細胞は「第一世代」、Oct4やNanogの発現に基づく初期化レベルの高いiPS細胞は「第二世代」と呼ばれる。 | iPS細胞の誘導法の発見に付随して、体細胞の初期化レベルには多様性があることが明らかとなった。まず、山中4因子が同定される過程において、Sox2を除いた3遺伝子(Oct4、Klf4、c-Myc)の導入によってもG418耐性コロニーが得られていた。しかし、この細胞はES細胞マーカー遺伝子を一部しか発現しておらず、また造腫瘍性は有するものの分化能は獲得していなかった。一方、Fbx15の発現に基づいて誘導されたiPS細胞は確かに分化多能性を獲得してはいるが、[[wikipedia:ja:キメラ|キメラ]]マウスは胎性致死であり、遺伝子発現においてもECAT1の発現が認められない等、ES細胞とは明らかに異なっていた。しかし、iPS細胞選択の指標をFbx15からNanogやOct4の発現に変更することによって、キメラマウスの出生および生殖系列に寄与するiPS細胞が樹立できるようになった<ref name="ref5"><pubmed> 17554338 </pubmed></ref><ref><pubmed> 17554336 </pubmed></ref>。Fbx15の発現に基づく初期化レベルの低いiPS細胞は「第一世代」、Oct4やNanogの発現に基づく初期化レベルの高いiPS細胞は「第二世代」と呼ばれる。 | ||
== 特徴 == | == 特徴 == | ||
| 44行目: | 34行目: | ||
=== 細胞特性 === | === 細胞特性 === | ||
iPS細胞の一般的な細胞特性として、ES細胞を規定する特性である自己複製能、分化多能性、造腫瘍性、活発な増殖能、不死性を備えている。後述の通り、培養下においてiPS細胞を様々な細胞系譜へと分化誘導することも可能である。多能性幹細胞が有する分化多能性を表す一つの基準として、ナイーブ状態(naive state)とプライムド状態(primed state)の区分がある。ナイーブ状態は胚盤胞の内部細胞塊の起源をより強く反映していると考えられ、[[wikipedia:JA:マウス|マウス]]や[[wikipedia:JA:ラット|ラット]]のES細胞はこちらに分類される。形態的にはドーム状のコロニーを形成し、[[wikipedia:LIF|LIF]]と[[wikipedia:BMP4|BMP4]]依存的に自己複製する。ナイーブ状態の中でも、非常に高いキメラ形成能および生殖系列への寄与を示す細胞はグラウンドステート(ground state)にあるとも表現される。一方、プライムド状態は胚盤胞より発生が進んだ[[wikipedia:JA:エピブラスト|エピブラスト]]の起源に相当すると考えられ、[[wikipedia:JA:ウサギ|ウサギ]]や[[wikipedia:JA:霊長類|霊長類]]のES細胞が含まれる。 自己複製には[[wikipedia:FGF2|FGF2]]と[[wikipedia:アクチビン|アクチビンA]]を必要とし、扁平なコロニーを形成して増殖する。iPS細胞の多能性状態(ナイーブまたはプライムド)は基本的に同種のES細胞と相同であるが、これは種の相違によって規定されているものではなく、各々の細胞株として反映する発生段階の差に起因すると考えられる。 | |||
=== 利点 === | === 利点 === | ||
iPS細胞に先んじてSCNTやES細胞培養が確立されていたにも関わらずヒトiPS細胞の作成が求められた背景には、ヒト初期胚の研究利用をとりまく様々な課題や制限の存在があった。まず、ヒトES細胞の樹立には「生命の萌芽」と位置付けられるヒト[[ | iPS細胞に先んじてSCNTやES細胞培養が確立されていたにも関わらずヒトiPS細胞の作成が求められた背景には、ヒト初期胚の研究利用をとりまく様々な課題や制限の存在があった。まず、ヒトES細胞の樹立には「生命の萌芽」と位置付けられるヒト[[wikipedia:JA:受精卵|受精卵]]の破壊が伴うことから、倫理的な問題となっていた。また、細胞移植治療への応用を鑑みた際、ES細胞はレシピエントとは他人の細胞であることから、そのままでは免疫拒絶反応が惹起されてしまう。一方、SCNT研究の場面においては、ヒト卵の入手と使用に関わる数的・倫理的制限に加えて胚操作上の技術的困難が挙げられた。これに対し、体細胞起源であるiPS細胞はヒト胚の利用に関する倫理的問題には該当せず、細胞ソースの調達における数的制限もない。また、技術的にも非常に容易であることに加え、母体への侵襲や胚操作の実施が困難な動物種にも適用できる利点も大きい。さらに、基礎生物学的な観点からみると、特定の起源細胞と因子を出発点に体細胞初期化についてアプローチできることから、iPS細胞の誘導は初期化をもたらす分子機構を解明するための強力かつ簡便な実験系であるともいえる。 | ||
== 樹立方法 == | == 樹立方法 == | ||
| 54行目: | 44行目: | ||
===動物種 === | ===動物種 === | ||
マウスにおけるiPS細胞の樹立が報告された翌年、ヒトiPS細胞の樹立が報告された<ref name="ref2"><pubmed> 18035408 </pubmed></ref><ref name="ref3"><pubmed> 18029452 </pubmed></ref>。その後、ラット、ウサギ、[[ | マウスにおけるiPS細胞の樹立が報告された翌年、ヒトiPS細胞の樹立が報告された<ref name="ref2"><pubmed> 18035408 </pubmed></ref><ref name="ref3"><pubmed> 18029452 </pubmed></ref>。その後、ラット、ウサギ、[[wikipedia:JA:ブタ|ブタ]]、[[wikipedia:JA:ウマ|ウマ]]、[[wikipedia:JA:ウシ|ウシ]]、[[wikipedia:JA:ヒツジ|ヒツジ]]、[[wikipedia:JA:イヌ|イヌ]]のほか、非ヒト霊長類である[[wikipedia:JA:マーモセット|マーモセット]]、[[wikipedia:JA:アカゲザル|アカゲザル]]、[[wikipedia:JA:カニクイザル|カニクイザル]]においてもiPS細胞が樹立されている。また、[[wikipedia:JA:絶滅危惧種|絶滅危惧種]]である[[wikipedia:JA:シロサイ|シロサイ]]や[[wikipedia:JA:マンドリル|マンドリル]]のiPS細胞樹立の報告もあり、希少な[[wikipedia:JA:遺伝資源|遺伝子資源]]の保存といった観点からも注目されている。 | ||
=== 細胞種 === | === 細胞種 === | ||
最初のマウスiPS細胞の樹立には胎仔の線維芽細胞および成体の尾線維芽細胞が、最初のヒトiPS細胞の樹立には胎児、新生児、成人の線維芽細胞が用いられた。その後、[[ | 最初のマウスiPS細胞の樹立には胎仔の線維芽細胞および成体の尾線維芽細胞が、最初のヒトiPS細胞の樹立には胎児、新生児、成人の線維芽細胞が用いられた。その後、[[wikipedia:JA:胃|胃]]上皮細胞、[[wikipedia:JA:肝細胞|肝実質細胞]]、[[wikipedia:Keratinocyte|ケラチノサイト]]、[[wikipedia:Hair_follicle#Papilla|毛乳頭]]細胞、[[wikipedia:JA:色素細胞|色素細胞]]、[[wikipedia:JA:血管内皮|血管内皮]]細胞、血液細胞、[[wikipedia:JA:羊膜|羊膜]]細胞、[[神経幹細胞]]、[[wikipedia:JA:歯髄|歯髄]]幹細胞、[[wikipedia:JA:脂肪幹細胞移植|脂肪幹細胞]]、[[wikipedia:JA:間葉系幹細胞|間葉系幹細胞]]等、多様な細胞種からの樹立が相次いで報告されている。 | ||
=== 遺伝子導入方法 === | === 遺伝子導入方法 === | ||
当初、遺伝子導入の[[ベクター]]として[[ | 当初、遺伝子導入の[[wikipedia:JA:ベクター|ベクター]]として[[wikipedia:JA:レトロウイルス|レトロウイルス]]や[[wikipedia:JA:レンチウイルス|レンチウイルス]]が利用された。しかし、どちらのウイルスも導入細胞の[[wikipedia:JA:ゲノム|ゲノム]]DNAに組み込まれることから、挿入変異や近傍の遺伝子の発現に及ぼす影響等、予期しない異常が生じる危険性を包含している。また、レトロウイルスベクターは通常、多能性幹細胞において強力な発現抑制(サイレンシング)を受けるが、初期化レベルが低いiPS細胞では発現が持続していることや分化後も導入遺伝子の活性化が起こりうることから、細胞移植への応用には腫瘍形成といったリスクが伴う。そこで、iPS細胞樹立後に導入遺伝子を除去する手法として、[[wikipedia:Cre-loxP部位特異的組換え|Cre-loxP]]システムの利用や[[wikipedia:JA:トランスポゾン|トランスポゾン]]の特性を利用したピギーバック(piggyBac)が開発された。一方、そもそもゲノムに組み込まれないベクターとして、[[wikipedia:JA:アデノウイルス|アデノウイルス]]や[[wikipedia:JA:センダイウイルス|センダイウイルス]]、[[wikipedia:JA:プラスミド|プラスミド]]DNAを用いた誘導法も利用されている。さらに、ベクターを介さずに直接、組換えタンパク質や合成RNA、[[wikipedia:miRNA|miRNA]]を導入するiPS細胞の作成についても報告がなされている。 | ||
=== 誘導因子 === | === 誘導因子 === | ||
前述の通り、最初のiPS細胞はOct4、Sox2、Klf4、c-Mycの4種類の遺伝子(山中4因子)を導入することによって作成されたが、間もなく、誘導効率は低下するもののc-Mycを除いたOct4、Sox2、Klf4のみ(山中3因子)によってもiPS細胞が樹立できることが示された。ヒトの場合もマウスと同じ遺伝子セットでiPS細胞の誘導が可能であるが<ref name="ref2" />、山中博士らとほぼ同時にヒトiPS細胞について報告したJames Thomson博士らはOCT4、SOX2、NANOG、[[LIN28]]の組合せを用いている<ref name="ref3" />。最も広く用いられている遺伝子セットはプロトタイプである山中4因子であるが、神経幹細胞の場合はOct4単独の導入によってもiPS細胞が誘導しうるように、細胞種によっては少ない因子・異なる組合せでのiPS細胞誘導も可能である。また、iPS細胞の誘導効率や初期化レベルを向上させる要素として、[[Esrrb]]、[[Nr5a2]]、[[Tbx3]]、[[L-Myc]]、[[Glis1]] | 前述の通り、最初のiPS細胞はOct4、Sox2、Klf4、c-Mycの4種類の遺伝子(山中4因子)を導入することによって作成されたが、間もなく、誘導効率は低下するもののc-Mycを除いたOct4、Sox2、Klf4のみ(山中3因子)によってもiPS細胞が樹立できることが示された。ヒトの場合もマウスと同じ遺伝子セットでiPS細胞の誘導が可能であるが<ref name="ref2" />、山中博士らとほぼ同時にヒトiPS細胞について報告したJames Thomson博士らはOCT4、SOX2、NANOG、[[wikipedia:LIN28|LIN28]]の組合せを用いている<ref name="ref3" />。最も広く用いられている遺伝子セットはプロトタイプである山中4因子であるが、神経幹細胞の場合はOct4単独の導入によってもiPS細胞が誘導しうるように、細胞種によっては少ない因子・異なる組合せでのiPS細胞誘導も可能である。また、iPS細胞の誘導効率や初期化レベルを向上させる要素として、[[wikipedia:Estrogen-related receptor beta|Esrrb]]、[[wikipedia:Liver receptor homolog-1|Nr5a2]]、[[wikipedia:Tbx3|Tbx3]]、[[wikipedia:MYCL1|L-Myc]]、[[wikipedia:GLIS family zinc finger 1|Glis1]]や[[wikipedia:miRNA|miRNA]]-290クラスター等の導入、および[[wikipedia:Ink4|Ink4]]/Arf、[[wikipedia:p53|p53]]、[[wikipedia:p21|p21]]、[[wikipedia:Bax|Bax]]の抑制等が報告されている。 | ||
一方、低分子化合物を併用したiPS細胞誘導についても多数の報告がある。ES細胞の自己複製を亢進・維持する化合物として[[ | 一方、低分子化合物を併用したiPS細胞誘導についても多数の報告がある。ES細胞の自己複製を亢進・維持する化合物として[[wikipedia:Fibroblast growth factor receptor|FGF受容体]][[阻害剤]](SU5402)、[[wikipedia:MEK|MEK]]阻害剤(PD1843352またはPD0325901)、[[wikipedia:GSK3|GSK3]]阻害剤(CHIR99021)が知られており、3種の混合は「3i」、後者2種の混合は「2i」と俗称される。これらの阻害剤や[[wikipedia:TGF_beta_receptors|TGFβ受容体]]阻害剤(SB431542やA83-01)を添加することによって、iPS細胞の誘導効率の向上や選択が容易になるという報告例が示されている。また、エピジェネティック変化を促す化合物である[[wikipedia:JA:ヒストン脱アセチル化酵素|ヒストン脱アセチル化酵素]]阻害剤([[wikipedia:JA:バルプロ酸|バルプロ酸]]や[[wikipedia:JA:酪酸|酪酸]])、[[wikipedia:EHMT2|ヒストンリシン''N''-メチル転移酵素G9a]]阻害剤(BIX01294)、[[wikipedia:JA:DNAメチル化|DNAメチル化]]阻害剤([[wikipedia:Azacitidine|5-アザシチジン]]やRG108)等がiPS細胞誘導を促進することも報告されている。 | ||
== 特定の細胞系譜への分化誘導 == | == 特定の細胞系譜への分化誘導 == | ||
これまでにマウスおよびヒトiPS細胞から分化誘導が試みられた細胞系譜は多岐に亘る。例えば、神経系([[神経幹細胞]]、[[運動ニューロン]]等の各種ニューロン、[[アストロサイト]]、[[オリゴデンドロサイト]])、眼・耳([[網膜色素上皮細胞]]、[[視細胞]]、[[網膜神経節細胞]]、[[感覚有毛細胞]])、[[ | これまでにマウスおよびヒトiPS細胞から分化誘導が試みられた細胞系譜は多岐に亘る。例えば、神経系([[神経幹細胞]]、[[運動ニューロン]]等の各種ニューロン、[[アストロサイト]]、[[オリゴデンドロサイト]])、眼・耳([[網膜色素上皮細胞]]、[[視細胞]]、[[網膜神経節細胞]]、[[感覚有毛細胞]])、[[wikipedia:JA:表皮|表皮]](ケラチノサイト、[[wikipedia:JA:メラノサイト|メラノサイト]])、[[wikipedia:JA:血球|血球]]系([[wikipedia:JA:造血幹細胞|造血幹細胞]]、[[wikipedia:JA:マクロファージ|マクロファージ]]、[[wikipedia:JA:樹状細胞|樹状細胞]]、[[wikipedia:JA:T細胞|T細胞]]、[[wikipedia:JA:ナチュラルキラーT細胞|ナチュラルキラーT細胞]]、[[wikipedia:JA:好中球|好中球]]、[[wikipedia:JA:巨核球|巨核球]]、[[wikipedia:JA:血小板|血小板]]、[[wikipedia:JA:赤血球|赤血球]])、[[wikipedia:JA:心|心]][[wikipedia:JA:血管|血管]]系([[wikipedia:JA:心筋細胞|心筋細胞]]、心血管、[[wikipedia:JA:血管内皮|血管内皮]]、[[wikipedia:JA:壁細胞|壁細胞]](単に壁細胞というと胃の壁細胞をさすようです。御確認下さい。)、筋([[wikipedia:JA:骨格筋|骨格筋]]、[[wikipedia:JA:平滑筋|平滑筋]])、[[wikipedia:JA:骨|骨]]・[[wikipedia:JA:間葉系|間葉系]](間葉系幹細胞、[[wikipedia:JA:造骨細胞|造骨細胞]](生物学的にはあまり使われない用語のようです。御確認下さい。)、[[wikipedia:JA:破骨細胞|破骨細胞]]、[[wikipedia:JA:軟骨|軟骨]]、[[wikipedia:JA:脂肪細胞|白色]]・[[wikipedia:JA:褐色脂肪組織|褐色脂肪細胞]])、[[wikipedia:JA:歯|歯]]([[wikipedia:JA:エナメル芽細胞|エナメル芽細胞]])、消化器系([[wikipedia:JA:肝芽細胞|肝芽細胞]]、[[wikipedia:JA:肝細胞|肝細胞]]、[[wikipedia:JA:Metanephros#Metanephros|後腎]][[wikipedia:JA:間葉|間充織]]、[[wikipedia:JA:尿細管|尿細管]]細胞、[[wikipedia:JA:腸管|腸管]]組織、[[wikipedia:JA:膵島|膵島]]細胞)、[[wikipedia:JA:生殖細胞|生殖細胞]]等が挙げられる。 | ||
== 医療応用の可能性 == | == 医療応用の可能性 == | ||
| 78行目: | 68行目: | ||
=== 安全性 === | === 安全性 === | ||
ヒトiPS細胞を用いた細胞移植医療を目指す上で、品質評価と安全性の確保は最重要事項である。実際、iPS細胞の治療用途には克服すべき様々な懸念材料がある。例えば、c-MycをゲノムDNAに導入したマウスiPS細胞は、キメラマウスおよびその子孫において高頻度に腫瘍を誘発する<ref name="ref5" />。これらの腫瘍では外来性c-Mycが再活性化しており、初期化因子のゲノムへの組込みはiPS細胞利用における永続的なリスクファクターであることが示された。また、分化誘導時に残存する未分化細胞、とりわけ「分化抵抗性」細胞の混入は、移植レシピエントにおいてテラトーマ形成を引き起こす。[[ | ヒトiPS細胞を用いた細胞移植医療を目指す上で、品質評価と安全性の確保は最重要事項である。実際、iPS細胞の治療用途には克服すべき様々な懸念材料がある。例えば、c-MycをゲノムDNAに導入したマウスiPS細胞は、キメラマウスおよびその子孫において高頻度に腫瘍を誘発する<ref name="ref5" />。これらの腫瘍では外来性c-Mycが再活性化しており、初期化因子のゲノムへの組込みはiPS細胞利用における永続的なリスクファクターであることが示された。また、分化誘導時に残存する未分化細胞、とりわけ「分化抵抗性」細胞の混入は、移植レシピエントにおいてテラトーマ形成を引き起こす。[[wikipedia:JA:慶應義塾大学|慶應義塾大学]]の三浦恭子博士らは、複数のマウスiPS細胞株から分化誘導した神経幹細胞(ニューロスフェア)を免疫不全マウス成体脳へと移植し、腫瘍形成の有無について検証を行った<ref><pubmed> 19590502 </pubmed></ref>。その結果、移植を受けたマウス全体の4割において未分化細胞に起因するテラトーマ形成が観察された。こうした造腫瘍性はiPS細胞樹立過程におけるc-Mycの導入や薬剤選択の有無ではなく、iPS細胞の起源と相関(胎仔由来では低頻度、成体由来では高頻度)していた。一方、成体マウスの肝実質細胞由来のiPS細胞は[[wikipedia:JA:キメラマウス|キメラマウス]]へと寄与するものの、[[wikipedia:JA:周産期|周産期]]において原因不明の高い死亡率を示すことが報告されている。極めて人工的な手法で作成される細胞であるがためにiPS細胞の基本特性について不明な点も多く、医療適正のあるiPS細胞株を精査、選別、作成するための方法の開発が必要不可欠である。 | ||
=== 細胞移植治療 === | === 細胞移植治療 === | ||
最も早期の実用化が期待されるヒトiPS細胞の利用には[[ | 最も早期の実用化が期待されるヒトiPS細胞の利用には[[wikipedia:JA:創薬|創薬]]研究が挙げられる。例えば、心機能におよぼす副作用の評価系としてiPS細胞由来の心筋細胞を用いた薬剤誘発性[[wikipedia:JA:QT時間|QT延長]]試験が提示されており、こうした利用を見据えてヒトiPS細胞由来の心筋細胞、[[ドーパミン]]神経細胞、肝細胞が既に市販ベースにある。一方、細胞移植治療に向けた実践的な基礎研究も活発に進められている。iPS細胞を用いた最初の自家移植治療モデルとして、[[wikipedia:Rudolf Jaenisch|Rudolf Jaenisch]]博士らは[[wikipedia:JA:鎌状赤血球貧血症|鎌状赤血球貧血症]]マウスからiPS細胞を作成して疾患原因遺伝子の修復を施し、分化誘導した造血幹細胞による自家移植治療の実例を示した<ref><pubmed> 18063756 </pubmed></ref>。同グループは、マウスiPS細胞から分化誘導したドーパミン神経を[[パーキンソン病]]モデルラット成体脳に異種移植し、行動改善がみられることについても報告している<ref><pubmed> 18391196 </pubmed></ref>。一方、パーキンソン病患者のiPS細胞由来のドーパミン神経を異種移植したラットにおいても、同様に運動機能の改善がみられている。また、正常マウスのiPS細胞から内皮細胞を誘導し、[[wikipedia:JA:血友病A|血友病A]]モデルマウスの肝臓へと他家移植した治療実験例もある。国内では、[[wikipedia:JA:慶應義塾大学|慶應義塾大学]]の[[wikipedia:JA:岡野栄之|岡野栄之]]博士のグループがマウスおよびヒトiPS細胞から分化誘導した[[ニューロスフェア]]を[[脊髄]]損傷モデルマウスに移植し、下肢運動機能に改善が認められることを報告している<ref><pubmed> 20615974 </pubmed></ref><ref><pubmed> 21949375 </pubmed></ref>。脊髄損傷に関しては、奈良先端科学技術大学院大学の中島欽一博士らもヒトiPS細胞からの神経幹細胞(神経上皮様幹細胞)分化誘導と移植を行い、モデルマウスの運動機能が回復することを確認している。最近では、iPS細胞を介さずに任意の細胞種を直接誘導する「ダイレクトリプログラミング」の研究も盛んに進められており、iPS細胞以外の選択肢も並行して開発されることが期待される。 | ||
== 新たな課題 == | == 新たな課題 == | ||
| 96行目: | 82行目: | ||
* [[分化多能性]] | * [[分化多能性]] | ||
* [[初期化]] | * [[初期化]] | ||
* [[ | * [[ダイレクトリプログラミング]] | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
(執筆者:今村公紀、中島龍介 担当編集委員:岡野栄之) | |||
2012年4月3日 (火) 23:13時点における版
英語名:induced pluripotent stem cells、英略語:iPS cells, iPSCs 独:induzierte pluripotente Stammzelle 仏:cellule souche pluripotente induite
同義語:人工多能性幹細胞
iPS細胞(人工多能性幹細胞)とは、本来、分化多能性(pluripotency)を喪失している体細胞に特定の遺伝子を導入することによって、人為的に誘導される多能性幹細胞株の総称である。胚盤胞と呼ばれる初期胚の内部細胞塊から樹立されたES細胞(胚性幹細胞)と類似の特徴を示し、分化多能性の定義である三胚葉(外胚葉、中胚葉、内胚葉)や生殖細胞への分化能を保持したまま、培養下で半永久的に自己複製(self-renewal)する。2006年に京都大学の高橋和利博士と山中伸弥博士によって最初の報告[1]がなされて以降、様々な動物種、細胞種を起源とするiPS細胞が樹立されている。ヒトにおいても個々人の生検試料からiPS細胞を作成することが可能であることから、疾患特異的iPS細胞を利用した病態解明や薬剤スクリーニングのほか、免疫拒絶を回避した再生医療への応用が期待されている。
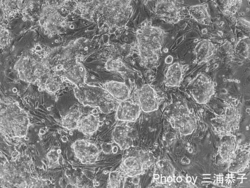
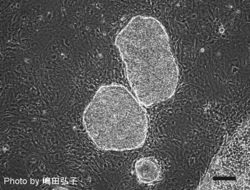
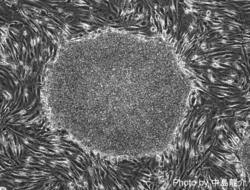
iPS細胞樹立の経緯
体細胞を初期化する因子
iPS細胞樹立の以前から、卵子やES細胞には体細胞を初期化(リプログラミング)する因子が含まれていることが知られていた。まず、体細胞核移植(somatic cell nuclear transfer, SCNT)の研究において、卵子の細胞質内部に体細胞を移植することによりクローン動物やクローンES細胞の作成が可能であることが示された。有名な例としては、Ian Wilmut博士らによるクローン羊のドリーや若山照彦博士(当時、ハワイ大学)らによるクローンマウスのキュムリーナが挙げられる。一方、京都大学の多田高博士らは、ES細胞と体細胞を電気刺激により細胞融合させる一連の研究により、融合細胞はES細胞と同様の細胞特性を示すこと、体細胞側のゲノムDNAがES細胞様のエピジェネティック状態に転換されることが明らかとなった。とりわけ、ES細胞は培養下で容易かつ半永久的に増幅可能であることから、これらの発見はその後の初期化因子の探索において非常に大きな僥倖となった。
初期化因子
上述の背景のもと、山中伸弥博士(当時、奈良先端科学技術大学院大学)はES細胞の分化多能性維持機構の解明を第一の目的とし、ES細胞で特異的に発現する遺伝子群の同定を行った。公共のデータベースを利用したin silicoのスクリーニングによってES細胞特異的な遺伝子群が同定され、ECAT(ES cell associated transcript)と命名された[2]。ECATの中にはEsg1/ECAT2/Dppa5やOct4等の既知のES細胞マーカー遺伝子のほか、ECAT1やTdrd12/ECAT8等の新規遺伝子も含まれていた。「ES細胞で特異的に発現している遺伝子≒ES細胞において機能的に重要な遺伝子」との仮説から各ECATのノックアウトや強制発現実験が試みられ、ホメオボックス転写因子であるNanog/ECAT4は多能性ネットワークの構築と維持における中心であること、恒常活性化型Rasタンパク質であるERas/ECAT5はES細胞の増殖と造腫瘍性を担うこと等が示された。 また、iPS細胞を選択するために最初に利用されたFbx15/ECAT3も、このスクリーニングによって同定された遺伝子の一つである。
樹立の成功
続いて、山中博士らは「ES細胞において機能的に重要な遺伝子≒体細胞の初期化を誘導する遺伝子」という仮説に基づき、ECATおよびES細胞の自己複製を支持する遺伝子(STAT3やβカテニン等)を体細胞であるマウス胎仔線維芽細胞(MEF)に導入する実験を試みた。初期化因子候補としては計24の遺伝子が絞り込まれ、上述のFbx15遺伝子座にネオマイシン耐性遺伝子が挿入されたノックインマウスの細胞が利用された。このマウスの体細胞はECATであるFbx15を発現していないため、G418(ネオマイシン耐性遺伝子によって不活性化される抗生物質)を添加すると細胞は死滅する。一方、ES細胞等の多能性幹細胞はFbx15の発現と一致してネオマイシン耐性遺伝子を発現することから、G418に対して耐性となる。このシステムを用いて各候補遺伝子が1種類ずつ導入されたが、この場合にはG418耐性のES細胞様コロニーは観察されなかった。ところが、24種類全ての候補遺伝子を同時に導入した場合、ES細胞に類似したG418耐性細胞コロニーが出現することが明らかとなった。その後、24遺伝子から1遺伝子を差し引いた23遺伝子を導入する実験により、最終的にES細胞様コロニーの誘導には4種類の遺伝子(Oct4、Sox2、Klf4、c-Myc)の組合せで十分であることが判明した。得られた細胞はES細胞マーカー遺伝子を発現しているほか、胚葉体形成培養や皮下移植によるテラトーマ形成実験により三胚葉に分化する能力を有することが確認され、iPS細胞と名付けられた[1]。また、iPS細胞を誘導する遺伝子セットは通称「山中4因子」とも呼ばれる。
初期化レベルにみられる多様性
iPS細胞の誘導法の発見に付随して、体細胞の初期化レベルには多様性があることが明らかとなった。まず、山中4因子が同定される過程において、Sox2を除いた3遺伝子(Oct4、Klf4、c-Myc)の導入によってもG418耐性コロニーが得られていた。しかし、この細胞はES細胞マーカー遺伝子を一部しか発現しておらず、また造腫瘍性は有するものの分化能は獲得していなかった。一方、Fbx15の発現に基づいて誘導されたiPS細胞は確かに分化多能性を獲得してはいるが、キメラマウスは胎性致死であり、遺伝子発現においてもECAT1の発現が認められない等、ES細胞とは明らかに異なっていた。しかし、iPS細胞選択の指標をFbx15からNanogやOct4の発現に変更することによって、キメラマウスの出生および生殖系列に寄与するiPS細胞が樹立できるようになった[3][4]。Fbx15の発現に基づく初期化レベルの低いiPS細胞は「第一世代」、Oct4やNanogの発現に基づく初期化レベルの高いiPS細胞は「第二世代」と呼ばれる。
特徴
細胞特性
iPS細胞の一般的な細胞特性として、ES細胞を規定する特性である自己複製能、分化多能性、造腫瘍性、活発な増殖能、不死性を備えている。後述の通り、培養下においてiPS細胞を様々な細胞系譜へと分化誘導することも可能である。多能性幹細胞が有する分化多能性を表す一つの基準として、ナイーブ状態(naive state)とプライムド状態(primed state)の区分がある。ナイーブ状態は胚盤胞の内部細胞塊の起源をより強く反映していると考えられ、マウスやラットのES細胞はこちらに分類される。形態的にはドーム状のコロニーを形成し、LIFとBMP4依存的に自己複製する。ナイーブ状態の中でも、非常に高いキメラ形成能および生殖系列への寄与を示す細胞はグラウンドステート(ground state)にあるとも表現される。一方、プライムド状態は胚盤胞より発生が進んだエピブラストの起源に相当すると考えられ、ウサギや霊長類のES細胞が含まれる。 自己複製にはFGF2とアクチビンAを必要とし、扁平なコロニーを形成して増殖する。iPS細胞の多能性状態(ナイーブまたはプライムド)は基本的に同種のES細胞と相同であるが、これは種の相違によって規定されているものではなく、各々の細胞株として反映する発生段階の差に起因すると考えられる。
利点
iPS細胞に先んじてSCNTやES細胞培養が確立されていたにも関わらずヒトiPS細胞の作成が求められた背景には、ヒト初期胚の研究利用をとりまく様々な課題や制限の存在があった。まず、ヒトES細胞の樹立には「生命の萌芽」と位置付けられるヒト受精卵の破壊が伴うことから、倫理的な問題となっていた。また、細胞移植治療への応用を鑑みた際、ES細胞はレシピエントとは他人の細胞であることから、そのままでは免疫拒絶反応が惹起されてしまう。一方、SCNT研究の場面においては、ヒト卵の入手と使用に関わる数的・倫理的制限に加えて胚操作上の技術的困難が挙げられた。これに対し、体細胞起源であるiPS細胞はヒト胚の利用に関する倫理的問題には該当せず、細胞ソースの調達における数的制限もない。また、技術的にも非常に容易であることに加え、母体への侵襲や胚操作の実施が困難な動物種にも適用できる利点も大きい。さらに、基礎生物学的な観点からみると、特定の起源細胞と因子を出発点に体細胞初期化についてアプローチできることから、iPS細胞の誘導は初期化をもたらす分子機構を解明するための強力かつ簡便な実験系であるともいえる。
樹立方法
動物種
マウスにおけるiPS細胞の樹立が報告された翌年、ヒトiPS細胞の樹立が報告された[5][6]。その後、ラット、ウサギ、ブタ、ウマ、ウシ、ヒツジ、イヌのほか、非ヒト霊長類であるマーモセット、アカゲザル、カニクイザルにおいてもiPS細胞が樹立されている。また、絶滅危惧種であるシロサイやマンドリルのiPS細胞樹立の報告もあり、希少な遺伝子資源の保存といった観点からも注目されている。
細胞種
最初のマウスiPS細胞の樹立には胎仔の線維芽細胞および成体の尾線維芽細胞が、最初のヒトiPS細胞の樹立には胎児、新生児、成人の線維芽細胞が用いられた。その後、胃上皮細胞、肝実質細胞、ケラチノサイト、毛乳頭細胞、色素細胞、血管内皮細胞、血液細胞、羊膜細胞、神経幹細胞、歯髄幹細胞、脂肪幹細胞、間葉系幹細胞等、多様な細胞種からの樹立が相次いで報告されている。
遺伝子導入方法
当初、遺伝子導入のベクターとしてレトロウイルスやレンチウイルスが利用された。しかし、どちらのウイルスも導入細胞のゲノムDNAに組み込まれることから、挿入変異や近傍の遺伝子の発現に及ぼす影響等、予期しない異常が生じる危険性を包含している。また、レトロウイルスベクターは通常、多能性幹細胞において強力な発現抑制(サイレンシング)を受けるが、初期化レベルが低いiPS細胞では発現が持続していることや分化後も導入遺伝子の活性化が起こりうることから、細胞移植への応用には腫瘍形成といったリスクが伴う。そこで、iPS細胞樹立後に導入遺伝子を除去する手法として、Cre-loxPシステムの利用やトランスポゾンの特性を利用したピギーバック(piggyBac)が開発された。一方、そもそもゲノムに組み込まれないベクターとして、アデノウイルスやセンダイウイルス、プラスミドDNAを用いた誘導法も利用されている。さらに、ベクターを介さずに直接、組換えタンパク質や合成RNA、miRNAを導入するiPS細胞の作成についても報告がなされている。
誘導因子
前述の通り、最初のiPS細胞はOct4、Sox2、Klf4、c-Mycの4種類の遺伝子(山中4因子)を導入することによって作成されたが、間もなく、誘導効率は低下するもののc-Mycを除いたOct4、Sox2、Klf4のみ(山中3因子)によってもiPS細胞が樹立できることが示された。ヒトの場合もマウスと同じ遺伝子セットでiPS細胞の誘導が可能であるが[5]、山中博士らとほぼ同時にヒトiPS細胞について報告したJames Thomson博士らはOCT4、SOX2、NANOG、LIN28の組合せを用いている[6]。最も広く用いられている遺伝子セットはプロトタイプである山中4因子であるが、神経幹細胞の場合はOct4単独の導入によってもiPS細胞が誘導しうるように、細胞種によっては少ない因子・異なる組合せでのiPS細胞誘導も可能である。また、iPS細胞の誘導効率や初期化レベルを向上させる要素として、Esrrb、Nr5a2、Tbx3、L-Myc、Glis1やmiRNA-290クラスター等の導入、およびInk4/Arf、p53、p21、Baxの抑制等が報告されている。
一方、低分子化合物を併用したiPS細胞誘導についても多数の報告がある。ES細胞の自己複製を亢進・維持する化合物としてFGF受容体阻害剤(SU5402)、MEK阻害剤(PD1843352またはPD0325901)、GSK3阻害剤(CHIR99021)が知られており、3種の混合は「3i」、後者2種の混合は「2i」と俗称される。これらの阻害剤やTGFβ受容体阻害剤(SB431542やA83-01)を添加することによって、iPS細胞の誘導効率の向上や選択が容易になるという報告例が示されている。また、エピジェネティック変化を促す化合物であるヒストン脱アセチル化酵素阻害剤(バルプロ酸や酪酸)、ヒストンリシンN-メチル転移酵素G9a阻害剤(BIX01294)、DNAメチル化阻害剤(5-アザシチジンやRG108)等がiPS細胞誘導を促進することも報告されている。
特定の細胞系譜への分化誘導
これまでにマウスおよびヒトiPS細胞から分化誘導が試みられた細胞系譜は多岐に亘る。例えば、神経系(神経幹細胞、運動ニューロン等の各種ニューロン、アストロサイト、オリゴデンドロサイト)、眼・耳(網膜色素上皮細胞、視細胞、網膜神経節細胞、感覚有毛細胞)、表皮(ケラチノサイト、メラノサイト)、血球系(造血幹細胞、マクロファージ、樹状細胞、T細胞、ナチュラルキラーT細胞、好中球、巨核球、血小板、赤血球)、心血管系(心筋細胞、心血管、血管内皮、壁細胞(単に壁細胞というと胃の壁細胞をさすようです。御確認下さい。)、筋(骨格筋、平滑筋)、骨・間葉系(間葉系幹細胞、造骨細胞(生物学的にはあまり使われない用語のようです。御確認下さい。)、破骨細胞、軟骨、白色・褐色脂肪細胞)、歯(エナメル芽細胞)、消化器系(肝芽細胞、肝細胞、後腎間充織、尿細管細胞、腸管組織、膵島細胞)、生殖細胞等が挙げられる。
医療応用の可能性
安全性
ヒトiPS細胞を用いた細胞移植医療を目指す上で、品質評価と安全性の確保は最重要事項である。実際、iPS細胞の治療用途には克服すべき様々な懸念材料がある。例えば、c-MycをゲノムDNAに導入したマウスiPS細胞は、キメラマウスおよびその子孫において高頻度に腫瘍を誘発する[3]。これらの腫瘍では外来性c-Mycが再活性化しており、初期化因子のゲノムへの組込みはiPS細胞利用における永続的なリスクファクターであることが示された。また、分化誘導時に残存する未分化細胞、とりわけ「分化抵抗性」細胞の混入は、移植レシピエントにおいてテラトーマ形成を引き起こす。慶應義塾大学の三浦恭子博士らは、複数のマウスiPS細胞株から分化誘導した神経幹細胞(ニューロスフェア)を免疫不全マウス成体脳へと移植し、腫瘍形成の有無について検証を行った[7]。その結果、移植を受けたマウス全体の4割において未分化細胞に起因するテラトーマ形成が観察された。こうした造腫瘍性はiPS細胞樹立過程におけるc-Mycの導入や薬剤選択の有無ではなく、iPS細胞の起源と相関(胎仔由来では低頻度、成体由来では高頻度)していた。一方、成体マウスの肝実質細胞由来のiPS細胞はキメラマウスへと寄与するものの、周産期において原因不明の高い死亡率を示すことが報告されている。極めて人工的な手法で作成される細胞であるがためにiPS細胞の基本特性について不明な点も多く、医療適正のあるiPS細胞株を精査、選別、作成するための方法の開発が必要不可欠である。
細胞移植治療
最も早期の実用化が期待されるヒトiPS細胞の利用には創薬研究が挙げられる。例えば、心機能におよぼす副作用の評価系としてiPS細胞由来の心筋細胞を用いた薬剤誘発性QT延長試験が提示されており、こうした利用を見据えてヒトiPS細胞由来の心筋細胞、ドーパミン神経細胞、肝細胞が既に市販ベースにある。一方、細胞移植治療に向けた実践的な基礎研究も活発に進められている。iPS細胞を用いた最初の自家移植治療モデルとして、Rudolf Jaenisch博士らは鎌状赤血球貧血症マウスからiPS細胞を作成して疾患原因遺伝子の修復を施し、分化誘導した造血幹細胞による自家移植治療の実例を示した[8]。同グループは、マウスiPS細胞から分化誘導したドーパミン神経をパーキンソン病モデルラット成体脳に異種移植し、行動改善がみられることについても報告している[9]。一方、パーキンソン病患者のiPS細胞由来のドーパミン神経を異種移植したラットにおいても、同様に運動機能の改善がみられている。また、正常マウスのiPS細胞から内皮細胞を誘導し、血友病Aモデルマウスの肝臓へと他家移植した治療実験例もある。国内では、慶應義塾大学の岡野栄之博士のグループがマウスおよびヒトiPS細胞から分化誘導したニューロスフェアを脊髄損傷モデルマウスに移植し、下肢運動機能に改善が認められることを報告している[10][11]。脊髄損傷に関しては、奈良先端科学技術大学院大学の中島欽一博士らもヒトiPS細胞からの神経幹細胞(神経上皮様幹細胞)分化誘導と移植を行い、モデルマウスの運動機能が回復することを確認している。最近では、iPS細胞を介さずに任意の細胞種を直接誘導する「ダイレクトリプログラミング」の研究も盛んに進められており、iPS細胞以外の選択肢も並行して開発されることが期待される。
新たな課題
上述の通り、iPS細胞の誕生はES細胞やSCNT技術が抱える様々な倫理的、技術的制限を回避する新たな方法論を提起した。しかし、iPS細胞によって全ての課題が克服されたわけではなく、また新たな課題をも生み出している。その一つに、ヒトiPS細胞を用いた生殖細胞への分化誘導が挙げられる。現時点では、多能性幹細胞から機能的な精子と卵を培養下で分化誘導する手法は確立されていない。しかし、将来的にこれが実現した場合、iPS細胞を介して同一人物や同性の精子と卵の受精といったことも可能となる。日本においては「ヒトiPS細胞またはヒト組織幹細胞からの生殖細胞の作成を行う研究に関する指針(2010年に公布・施行)」によって、培養下で作成した生殖細胞の受精とヒト胚の作製を禁止している。しかし、こうした規制状況は国によって大きく異なる。また、iPS細胞は血液や毛根といった僅かな細胞ソースさえ入手すれば誘導ができてしまうことから、「ヒト細胞の管理」に対するシステム整備や意識改革も求められる。iPS細胞は医学・農学・生物学において多大な恩恵をもたらす技術であるからこそ、その有用性を損なわないためにも生殖倫理や法的な観点から適正に議論が交わされることが必要である。
関連用語
参考文献
- ↑ 1.0 1.1
Takahashi, K., & Yamanaka, S. (2006).
Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126(4), 663-76. [PubMed:16904174] [WorldCat] [DOI] - ↑
Mitsui, K., Tokuzawa, Y., Itoh, H., Segawa, K., Murakami, M., Takahashi, K., ..., & Yamanaka, S. (2003).
The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells. Cell, 113(5), 631-42. [PubMed:12787504] [WorldCat] [DOI] - ↑ 3.0 3.1
Okita, K., Ichisaka, T., & Yamanaka, S. (2007).
Generation of germline-competent induced pluripotent stem cells. Nature, 448(7151), 313-7. [PubMed:17554338] [WorldCat] [DOI] - ↑
Wernig, M., Meissner, A., Foreman, R., Brambrink, T., Ku, M., Hochedlinger, K., ..., & Jaenisch, R. (2007).
In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature, 448(7151), 318-24. [PubMed:17554336] [WorldCat] [DOI] - ↑ 5.0 5.1
Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., & Yamanaka, S. (2007).
Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 131(5), 861-72. [PubMed:18035408] [WorldCat] [DOI] - ↑ 6.0 6.1
Yu, J., Vodyanik, M.A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J.L., Tian, S., ..., & Thomson, J.A. (2007).
Induced pluripotent stem cell lines derived from human somatic cells. Science (New York, N.Y.), 318(5858), 1917-20. [PubMed:18029452] [WorldCat] [DOI] - ↑
Miura, K., Okada, Y., Aoi, T., Okada, A., Takahashi, K., Okita, K., ..., & Yamanaka, S. (2009).
Variation in the safety of induced pluripotent stem cell lines. Nature biotechnology, 27(8), 743-5. [PubMed:19590502] [WorldCat] [DOI] - ↑
Hanna, J., Wernig, M., Markoulaki, S., Sun, C.W., Meissner, A., Cassady, J.P., ..., & Jaenisch, R. (2007).
Treatment of sickle cell anemia mouse model with iPS cells generated from autologous skin. Science (New York, N.Y.), 318(5858), 1920-3. [PubMed:18063756] [WorldCat] [DOI] - ↑
Wernig, M., Zhao, J.P., Pruszak, J., Hedlund, E., Fu, D., Soldner, F., ..., & Jaenisch, R. (2008).
Neurons derived from reprogrammed fibroblasts functionally integrate into the fetal brain and improve symptoms of rats with Parkinson's disease. Proceedings of the National Academy of Sciences of the United States of America, 105(15), 5856-61. [PubMed:18391196] [PMC] [WorldCat] [DOI] - ↑
Tsuji, O., Miura, K., Okada, Y., Fujiyoshi, K., Mukaino, M., Nagoshi, N., ..., & Okano, H. (2010).
Therapeutic potential of appropriately evaluated safe-induced pluripotent stem cells for spinal cord injury. Proceedings of the National Academy of Sciences of the United States of America, 107(28), 12704-9. [PubMed:20615974] [PMC] [WorldCat] [DOI] - ↑
Nori, S., Okada, Y., Yasuda, A., Tsuji, O., Takahashi, Y., Kobayashi, Y., ..., & Okano, H. (2011).
Grafted human-induced pluripotent stem-cell-derived neurospheres promote motor functional recovery after spinal cord injury in mice. Proceedings of the National Academy of Sciences of the United States of America, 108(40), 16825-30. [PubMed:21949375] [PMC] [WorldCat] [DOI]
(執筆者:今村公紀、中島龍介 担当編集委員:岡野栄之)