「Ras homolog enriched in brain」の版間の差分
細 →発現と局在 |
細編集の要約なし |
||
| (同じ利用者による、間の8版が非表示) | |||
| 1行目: | 1行目: | ||
{{box|text= Ras homolog enriched in brain (RHEB)は神経活動に依存して発現が上昇する遺伝子として1994年に単離された。[[Ras]]スーパーファミリーに属する低分子量Gタンパク質であり、mTOR(mammalian target of rapamycin)複合体の制御を通じて、タンパク質合成や細胞増殖を制御していることが知られている。細胞内では、膜上、特に小胞体やリソソームの膜上に多く存在する。神経細胞の分化に関わるほか、軸索ガイダンスや樹状突起スパイン形態形成、シナプス機能調節などの神経機能の成熟への関与、軸索のミエリン化の制御などが知られている。}} | |||
{{box|text= Ras homolog enriched in brain ( | |||
== Ras homolog enriched in brainとは == | == Ras homolog enriched in brainとは == | ||
| 14行目: | 5行目: | ||
[[結節性硬化症]]原因遺伝子産物である[[Tuberous sclerosis complex 1]] ([[Tsc1]])、[[Tsc2]]とのかかわりが詳細に解析されており、また、主要な下流因子として[[mammalian target of rapamycin複合体|mammalian target of rapamycin (mTOR)複合体]]が広く知られている。GTP結合型の活性型RhebはmTORCを活性化し、タンパク質合成や[[細胞分裂]]を促進する効果を持っている<ref name=Long2005><pubmed>15854902</pubmed></ref>。 | [[結節性硬化症]]原因遺伝子産物である[[Tuberous sclerosis complex 1]] ([[Tsc1]])、[[Tsc2]]とのかかわりが詳細に解析されており、また、主要な下流因子として[[mammalian target of rapamycin複合体|mammalian target of rapamycin (mTOR)複合体]]が広く知られている。GTP結合型の活性型RhebはmTORCを活性化し、タンパク質合成や[[細胞分裂]]を促進する効果を持っている<ref name=Long2005><pubmed>15854902</pubmed></ref>。 | ||
== 構造 == | == 構造 == | ||
哺乳類Rheb1タンパク質は184アミノ酸、Rheb2は183アミノ酸から構成される。結晶構造解析の結果から、他の多くの低分子量Gタンパク質と同様、[[GTP]]結合型と[[GDP]] | 哺乳類Rheb1タンパク質は184アミノ酸、Rheb2は183アミノ酸から構成される。結晶構造解析の結果から、他の多くの低分子量Gタンパク質と同様、[[GTP]]結合型と[[GDP]]結合型で微細に構造が変化することが明らかとなっている。GDP/GTPサイクルによる活性状態の切り替えや、活性調整タンパク質およびエフェクタータンパク質との相互作用に関わるスイッチ1領域およびスイッチ2領域についてはRasタンパク質とよく似た構造を有している。しかし、Rasと比較すると、Rhebの[[GTPase]]活性は低く、GTP結合型を維持しやすいことが示されている<ref name=Yu2005><pubmed>15728574</pubmed></ref>。また、C末端には[[CAAXモチーフ]]が存在し、[[脂質]]修飾を受けることが示唆される。実際に、Rhebは[[ファルネシル化]]され、主に[[リソソーム]]膜上に移行する<ref name=Hanker2010><pubmed>19838215</pubmed></ref>。 | ||
== サブファミリー == | == サブファミリー == | ||
Rheb1の相同遺伝子としてRheb2が存在しているが、Rheb2についてはあまり多くの解析はなされていない。Rheb1, Rheb2はRasスーパーファミリーに属する低分子量Gタンパク質であるが、相同性が低く独立したファミリーと考えられる[[Rho]]や[[Rab]]などとは異なり、Rheb1, Rheb2はRasとの相同性が高く、Rasファミリー内のタンパク質とされ、Rhebサブファミリーを形成する<ref name=Liu2018><pubmed> 30109180 </pubmed></ref>。 | Rheb1の相同遺伝子としてRheb2が存在しているが、Rheb2についてはあまり多くの解析はなされていない。Rheb1, Rheb2はRasスーパーファミリーに属する低分子量Gタンパク質であるが、相同性が低く独立したファミリーと考えられる[[Rho]]や[[Rab]]などとは異なり、Rheb1, Rheb2はRasとの相同性が高く、Rasファミリー内のタンパク質とされ、Rhebサブファミリーを形成する<ref name=Liu2018><pubmed> 30109180 </pubmed></ref>。 | ||
== 発現と局在 == | == 発現と局在 == | ||
Rheb1は全身にユビキタスに発現しているが、Rheb2は脳において高い発現量を示す<ref name=Saito2005><pubmed> 15809346 </pubmed></ref> | Rheb1は全身にユビキタスに発現しているが、Rheb2は脳において高い発現量を示す<ref name=Saito2005><pubmed> 15809346 </pubmed></ref>。細胞内においては、Rhebは主に[[小胞体]]やリソソームの膜上に存在している。中でもリソソームの膜上に多く存在し、細胞膜上にはほぼ存在しないと考えられている<ref name=Sancak2007><pubmed>17386266</pubmed></ref>。ファルネシル化修飾を受けることで膜にアンカーされる。 | ||
== 機能 == | == 機能 == | ||
=== 活性調節 === | === 活性調節 === | ||
Rhebは、他の低分子量Gタンパク質と同様にGTPと結合し活性型となり、自身が持つGTPase活性によりGTPをGDPに変換することで不活性型であるGDP結合型とへと変化する。RhebのGTPase activating protein(GAP)として知られているタンパク質として[[tuberous sclerosis complex1|tuberous sclerosis complex (Tsc) 1]], [[Tsc2]]がある<ref name=Pan2004><pubmed>15102439</pubmed></ref>。Tsc1/2はヘテロ2量体を形成しGAPとして機能する。一方、結合したGDPを乖離させ、GTPを結合させる機能を持つグアニンヌクレオチド交換因子(guanine nucleotide-exchanging factor; GEF)タンパク質は未だ同定されていない。また、Rhebの活性化にはファルネシル化による膜アンカーが必須と考えられており<ref name=Heard2014><pubmed>24863881</pubmed></ref><ref name=Sancak2007><pubmed>17386266</pubmed></ref>、ファルネシル化を受けない変異型Rhebは下流シグナルを活性化しない。 | Rhebは、他の低分子量Gタンパク質と同様にGTPと結合し活性型となり、自身が持つGTPase活性によりGTPをGDPに変換することで不活性型であるGDP結合型とへと変化する。RhebのGTPase activating protein(GAP)として知られているタンパク質として[[tuberous sclerosis complex1|tuberous sclerosis complex (Tsc) 1]], [[Tsc2]]がある<ref name=Pan2004><pubmed>15102439</pubmed></ref>。Tsc1/2はヘテロ2量体を形成しGAPとして機能する。一方、結合したGDPを乖離させ、GTPを結合させる機能を持つグアニンヌクレオチド交換因子(guanine nucleotide-exchanging factor; GEF)タンパク質は未だ同定されていない。また、Rhebの活性化にはファルネシル化による膜アンカーが必須と考えられており<ref name=Heard2014><pubmed>24863881</pubmed></ref><ref name=Sancak2007><pubmed>17386266</pubmed></ref>、ファルネシル化を受けない変異型Rhebは下流シグナルを活性化しない。 | ||
[[ファイル:Shimada Rheb Fig.png|サムネイル|''' | [[ファイル:Shimada Rheb Fig.png|サムネイル|'''図. Rhebの活性化調節と下流シグナルの模式図'''<br>Rhebはファルネシル化修飾を受け、膜上に移行したのち、GTP結合型に変換され活性化する。Tsc1/2複合体はRhebに対するGAPタンパク質として機能することでGDP結合型への変換を促し不活性化を促進する。<br>Rhebの活性化に伴い、様々な下流シグナルが活性化する。ここでは代表的なものとしてmTORC1を示すが、これまでに多様な下流シグナル因子が明らかとなっている。]] | ||
=== エフェクター === | === エフェクター === | ||
Rhebのエフェクタータンパク質としては[[mTORC1]]が代表的である。GTP結合型RhebはmTORと直接結合し活性化させる<ref name=Heard2014><pubmed>24863881</pubmed></ref>。また、活性型Rhebは[[FK506結合タンパク質38]] ([[FK506 binding protein 38]]; [[FKBP38]])との結合、あるいは[[ホスホリパーゼD1]](PLD1)との結合を通じてもmTORC1の活性化を促進していると考えられている<ref name=Bai2007><pubmed>17991864</pubmed></ref><ref name=Heard2014><pubmed>24863881</pubmed></ref>。mTORは[[リボソームタンパク質S6キナーゼ]]([[S6K]])をリン酸化し、活性化する。S6Kは活性化することでタンパク質の翻訳を促進する。また、mTORは[[eukaryotic translation initiation factor 4E-binding protein 1]] ([[4E-BP1]]または[[EIF4EBP1]])を[[リン酸化]]することで不活性化する。4E-BP1はタンパク質[[翻訳]]開始因子[[eIF4F]]のネガティブレギュレーターであるため、4E-BP1の不活性化はタンパク質の合成を促進することになる。これらの機能を通じてmTORは細胞の成長や増殖、タンパク質合成を促進することが知られているが(''' | Rhebのエフェクタータンパク質としては[[mTORC1]]が代表的である。GTP結合型RhebはmTORと直接結合し活性化させる<ref name=Heard2014><pubmed>24863881</pubmed></ref>。また、活性型Rhebは[[FK506結合タンパク質38]] ([[FK506 binding protein 38]]; [[FKBP38]])との結合、あるいは[[ホスホリパーゼD1]](PLD1)との結合を通じてもmTORC1の活性化を促進していると考えられている<ref name=Bai2007><pubmed>17991864</pubmed></ref><ref name=Heard2014><pubmed>24863881</pubmed></ref>。mTORは[[リボソームタンパク質S6キナーゼ]]([[S6K]])をリン酸化し、活性化する。S6Kは活性化することでタンパク質の翻訳を促進する。また、mTORは[[eukaryotic translation initiation factor 4E-binding protein 1]] ([[4E-BP1]]または[[EIF4EBP1]])を[[リン酸化]]することで不活性化する。4E-BP1はタンパク質[[翻訳]]開始因子[[eIF4F]]のネガティブレギュレーターであるため、4E-BP1の不活性化はタンパク質の合成を促進することになる。これらの機能を通じてmTORは細胞の成長や増殖、タンパク質合成を促進することが知られているが('''図''')、Rhebの活性化はmTORC1活性化を通じて細胞の増殖などを引き起こすことが明らかとなっている。 | ||
mTORC1以外にもRhebにより制御されるシグナルタンパク質は幾つか知られている。例として、[[p21活性化キナーゼ]] ([[p21 activated kinase 2]]; [[PAK2]])は、活性化型Rheb依存的かつmTORC1非依存的にリン酸化を受け活性化される<ref name=Alves2015><pubmed>26412398</pubmed></ref>。また、[[シンテニン]]([[ | mTORC1以外にもRhebにより制御されるシグナルタンパク質は幾つか知られている。例として、[[p21活性化キナーゼ]] ([[p21 activated kinase 2]]; [[PAK2]])は、活性化型Rheb依存的かつmTORC1非依存的にリン酸化を受け活性化される<ref name=Alves2015><pubmed>26412398</pubmed></ref>。また、[[シンテニン]]]([[Syntenin]])もRhebと結合することが明らかとなっている。シンテニンは[[PDZドメイン]]を有する[[アダプタータンパク質]]で、様々なシグナルカスケード因子と結合しシグナルの活性を調節することが知られている。シンテニンはGDP結合型Rhebとより結合しやすく、シンテニンとRhebが結合することで両者ともに[[プロテアソーム]]による分解を受ける。そのため、GTP型Rhebが増えるとシンテニンと結合して分解されるRhebが減少するため、結果的にシンテニンが増加し、シンテニンに依存したシグナルの増強が起きる<ref name=Sugiura2015><pubmed>25880340</pubmed></ref>。 | ||
=== 神経系における機能 === | === 神経系における機能 === | ||
2025年4月11日 (金) 22:54時点における版
Ras homolog enriched in brain (RHEB)は神経活動に依存して発現が上昇する遺伝子として1994年に単離された。Rasスーパーファミリーに属する低分子量Gタンパク質であり、mTOR(mammalian target of rapamycin)複合体の制御を通じて、タンパク質合成や細胞増殖を制御していることが知られている。細胞内では、膜上、特に小胞体やリソソームの膜上に多く存在する。神経細胞の分化に関わるほか、軸索ガイダンスや樹状突起スパイン形態形成、シナプス機能調節などの神経機能の成熟への関与、軸索のミエリン化の制御などが知られている。
Ras homolog enriched in brainとは
1994年、ラットへの電気けいれん刺激により、脳において発現が上昇するタンパク質として山形らにより単離された[1]。Rasスーパーファミリーに属する低分子量Gタンパク質であることから、Ras homologue enriched in brainとしてRhebと命名されたが、その後の研究により脳以外の組織にも広く発現することが明らかとなっている。進化的には酵母から哺乳類まで、真核生物に広く保存されている。哺乳類では相同遺伝子が存在し、それぞれRheb1,Rheb2と呼称されている[2]。
結節性硬化症原因遺伝子産物であるTuberous sclerosis complex 1 (Tsc1)、Tsc2とのかかわりが詳細に解析されており、また、主要な下流因子としてmammalian target of rapamycin (mTOR)複合体が広く知られている。GTP結合型の活性型RhebはmTORCを活性化し、タンパク質合成や細胞分裂を促進する効果を持っている[3]。
構造
哺乳類Rheb1タンパク質は184アミノ酸、Rheb2は183アミノ酸から構成される。結晶構造解析の結果から、他の多くの低分子量Gタンパク質と同様、GTP結合型とGDP結合型で微細に構造が変化することが明らかとなっている。GDP/GTPサイクルによる活性状態の切り替えや、活性調整タンパク質およびエフェクタータンパク質との相互作用に関わるスイッチ1領域およびスイッチ2領域についてはRasタンパク質とよく似た構造を有している。しかし、Rasと比較すると、RhebのGTPase活性は低く、GTP結合型を維持しやすいことが示されている[4]。また、C末端にはCAAXモチーフが存在し、脂質修飾を受けることが示唆される。実際に、Rhebはファルネシル化され、主にリソソーム膜上に移行する[5]。
サブファミリー
Rheb1の相同遺伝子としてRheb2が存在しているが、Rheb2についてはあまり多くの解析はなされていない。Rheb1, Rheb2はRasスーパーファミリーに属する低分子量Gタンパク質であるが、相同性が低く独立したファミリーと考えられるRhoやRabなどとは異なり、Rheb1, Rheb2はRasとの相同性が高く、Rasファミリー内のタンパク質とされ、Rhebサブファミリーを形成する[6]。
発現と局在
Rheb1は全身にユビキタスに発現しているが、Rheb2は脳において高い発現量を示す[7]。細胞内においては、Rhebは主に小胞体やリソソームの膜上に存在している。中でもリソソームの膜上に多く存在し、細胞膜上にはほぼ存在しないと考えられている[8]。ファルネシル化修飾を受けることで膜にアンカーされる。
機能
活性調節
Rhebは、他の低分子量Gタンパク質と同様にGTPと結合し活性型となり、自身が持つGTPase活性によりGTPをGDPに変換することで不活性型であるGDP結合型とへと変化する。RhebのGTPase activating protein(GAP)として知られているタンパク質としてtuberous sclerosis complex (Tsc) 1, Tsc2がある[9]。Tsc1/2はヘテロ2量体を形成しGAPとして機能する。一方、結合したGDPを乖離させ、GTPを結合させる機能を持つグアニンヌクレオチド交換因子(guanine nucleotide-exchanging factor; GEF)タンパク質は未だ同定されていない。また、Rhebの活性化にはファルネシル化による膜アンカーが必須と考えられており[10][8]、ファルネシル化を受けない変異型Rhebは下流シグナルを活性化しない。
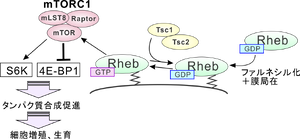
Rhebはファルネシル化修飾を受け、膜上に移行したのち、GTP結合型に変換され活性化する。Tsc1/2複合体はRhebに対するGAPタンパク質として機能することでGDP結合型への変換を促し不活性化を促進する。
Rhebの活性化に伴い、様々な下流シグナルが活性化する。ここでは代表的なものとしてmTORC1を示すが、これまでに多様な下流シグナル因子が明らかとなっている。
エフェクター
Rhebのエフェクタータンパク質としてはmTORC1が代表的である。GTP結合型RhebはmTORと直接結合し活性化させる[10]。また、活性型RhebはFK506結合タンパク質38 (FK506 binding protein 38; FKBP38)との結合、あるいはホスホリパーゼD1(PLD1)との結合を通じてもmTORC1の活性化を促進していると考えられている[11][10]。mTORはリボソームタンパク質S6キナーゼ(S6K)をリン酸化し、活性化する。S6Kは活性化することでタンパク質の翻訳を促進する。また、mTORはeukaryotic translation initiation factor 4E-binding protein 1 (4E-BP1またはEIF4EBP1)をリン酸化することで不活性化する。4E-BP1はタンパク質翻訳開始因子eIF4Fのネガティブレギュレーターであるため、4E-BP1の不活性化はタンパク質の合成を促進することになる。これらの機能を通じてmTORは細胞の成長や増殖、タンパク質合成を促進することが知られているが(図)、Rhebの活性化はmTORC1活性化を通じて細胞の増殖などを引き起こすことが明らかとなっている。
mTORC1以外にもRhebにより制御されるシグナルタンパク質は幾つか知られている。例として、p21活性化キナーゼ (p21 activated kinase 2; PAK2)は、活性化型Rheb依存的かつmTORC1非依存的にリン酸化を受け活性化される[12]。また、シンテニン](Syntenin)もRhebと結合することが明らかとなっている。シンテニンはPDZドメインを有するアダプタータンパク質で、様々なシグナルカスケード因子と結合しシグナルの活性を調節することが知られている。シンテニンはGDP結合型Rhebとより結合しやすく、シンテニンとRhebが結合することで両者ともにプロテアソームによる分解を受ける。そのため、GTP型Rhebが増えるとシンテニンと結合して分解されるRhebが減少するため、結果的にシンテニンが増加し、シンテニンに依存したシグナルの増強が起きる[13]。
神経系における機能
Rhebは細胞の増殖に関与するため、がん細胞と関連した機能が多く解析されているが、神経系における機能も多岐にわたり解析されている。mTORC1を介した細胞増殖の制御という観点から神経幹細胞におけるRhebの機能が示唆されており、神経幹細胞特異的なRhebのノックアウトマウスでは、出生後の脳構造の発達が著しく阻害され、個体の成長が抑えられて短命に終わる[14]。これは、Rhebノックアウトにより、オリゴデンドロサイト前駆細胞がオリゴデンドロサイトへと分化・成熟する過程が抑えられていることが原因とされており、このノックアウトマウスでは軸索のミエリン化が低下している。そのため大脳皮質の神経細胞数は変化していないにもかかわらず皮質が薄く、脳梁部では顕著なミエリンの減少が観察される[14]。
培養神経系においては、Rhebのノックダウンにより神経細胞分化直後の軸索形成が阻害される。また、Rhebの強制発現は過剰な軸索形成を引き起こす。すなわち、正常な神経細胞の発生・分化過程においては、適切なレベルのRheb活性が必要であることが示唆される[15]。
Rheb-mTORC1シグナルは、細胞増殖やタンパク質合成などに関わるため、このシグナルが抑えられたり、過剰に活性化したりすることで細胞機能に異常が生じる。部位特異的なRhebの機能阻害あるいは機能亢進に伴い、神経前駆細胞の遊走などを通じて脳構造の発達などに影響を与えていることが示されている[16][17]。
成熟後の神経においてもRhebは重要な役割を担っていると考えられている。RhebのmRNAは長期増強(long term potentiation; LTP))を誘導するような脳への電気刺激で発現が上昇する[1]。また、Tsc1/2の機能欠損マウスにおいてLTPの誘導が変化する報告があるほか、野生型マウスにmTORC1の阻害剤であるラパマイシンを投与することでLTPのレベルが変動する報告もある。また、このようにLTPのレベルが変化したマウスでは、学習・記憶能力の低下がみられることが多く、Tsc1/2-Rheb-mTORシグナルのシナプス伝達に対する影響とそれによる個体行動の変化のメカニズムは広く解析されている[18]。
さらに、mTORC1のエフェクター分子であるS6Kの欠損マウスでは、シナプス伝達の長期増強や学習行動に異常がみられる。また、phosphatase and Tensin Homolog Deleted from Chromosome 10 (PTEN)欠損マウスではホスファチジルイノシトール-3,4,5-トリスリン酸 (phosphatidylinositol 3,4,5-trisphosphate; PIP3)の増加によりAktが過剰に活性化され、これに伴ってTsc1/2複合体の機能が抑制され、その結果としてRheb活性が亢進する。こうしたPTEN欠損マウスでもシナプス伝達の長期増強の異常や行動の変化が観察される。これらの結果も、Rheb活性がシナプス機能の調節に関与することを示唆している。[19][20]。
Rhebの活性はシナプス形成部位である樹状突起スパインの形態を直接制御していることも明らかとなっている。不活性型のRhebはシンテニンタンパク質と結合し、プロテアソーム依存的な分解を受ける。Tsc2変異マウスでは活性型のRhebが増加して、シンテニンの分解が抑制されて、シンテニンが増加する。このシンテニンの増加は、樹状突起スパインの形態を細長く変形させ、スパイン先端にシナプスが形成されにくくすることが見いだされており、Rhebの活性増加はスパインの形態変化とシナプスの形成位置異常につながると考えられる[13]。原因となるメカニズムとして以下の分子的メカニズムが示唆されている。シンテニンはシンデカン2と結合するため、シンテニンの増加は、シンテニンと結合するシンデカン2の割合が増えることにつながる。その結果、シンデカン2と相互作用しているCASKタンパク質がシンデカン2から乖離する。CASKタンパク質はprotein 4.1と相互作用して線維状アクチンの伸長に関与することが知られており[21]、シンテニンの増加が、遊離CASKの増加を通じてスパイン内部の線維状アクチン制御メカニズムに対し影響を及ぼし、スパイン形態が変化すると予想されている[13]。
また、ショウジョウバエを用いた解析では、RhebによるmTORC1の活性制御が軸索ガイダンスに関与することが明らかとなっている。キノコ体における軸索先端の成長円錐の形態変化や、視覚システムにおける光受容神経の軸索の正常な伸長方向制御にRhebが関与することが示されている[22][23]。
疾患とのかかわり
がん
Rhebの変異に起因する疾患としては主にがんがあげられる。中でもよく知られているのはY35N変異であり、GAPタンパク質の影響を受けにくくなることでRhebの活性を保ち、mTORC1の恒常的な活性化を通じて細胞のがん化を引き起こすと考えられている[24][25]。
結節性硬化症
神経系の疾患としては、Rhebそのものの変異に起因したものではないが、関連疾患として結節性硬化症があげられる。結節性硬化症は、様々な臓器に良性の腫瘍形成を引き起こす遺伝性の疾患であり、知的障害などの精神神経学的な症状があることも知られている。TSCの原因遺伝子であるTsc1およびTsc2はヘテロ2量体を形成することで、RhebのGAPタンパク質として機能する[9]。Tsc1/2の機能が失われることでRhebの活性化状態が維持され、mTORC1をはじめとする様々な下流エフェクター因子の活性が亢進することで、様々な症状が引き起こされると考えられる[26]。例えば、脳だけでなく肺や心臓など様々な臓器に腫瘍が形成されるが、これはmTORC1の活性化に伴い細胞増殖が亢進することで腫瘍形成が促されると考えられる。脳内にも腫瘍が形成され、皮質結節や上衣下巨細胞性星細胞腫(subependymal giant cell astrocytoma; SEGA)と呼ばれる病変が生じるが、これらも同様にmTORC1が原因であると考えられている[27]。実際にSEGAに対してはmTORC1の阻害剤であるラパマイシンの誘導体が治療薬として使用されている[28]。また、Rhebの活性化に伴い神経細胞内で増加するシンテニンタンパク質の機能により樹状突起のスパイン形態、シナプス形成位置の異常が引き起こされるが、これらを原因とする神経伝達の変化もTSCの病態に関与すると考えられる。
TSCではてんかん発作や、知的障害や自閉症を含む結節性硬化症関連神経障害(TSC-associated neuropsychiatric disorders; TANDs)と呼称される様々な精神神経学的症状が観察されるが、これらの症状にもmTORC1の活性亢進により脳に形成された腫瘍やシンテニン増加により引き起こされた神経機能異常が関与する可能性が高い。
その他の神経疾患
Rheb-mTORC1シグナルの神経細胞形態に対する影響の一つとして、軸索再生があげられる。mTORC1の活性化はタンパク質合成の促進につながるため、TC10やPar3をはじめとする軸索伸長に必要な様々な因子や、細胞膜や細胞骨格タンパク質など軸索そのものの構成要素の合成がmTORC1の活性により促される[29][30]。そのためRhebの活性化は、軸索の再生を促進する。疾患と関わる具体的な例としては、恒常的活性型のRhebを発現させることで、パーキンソン病モデルとなる6-ヒドロキシドーパミン誘導性の、黒質ドーパミン神経の軸索退縮からの軸索の再生が促されることが示されている[31]。さらに、恒常的活性型のRhebは脳由来神経栄養因子 (BDNF)の発現を促進し、アルツハイマー病における神経細胞死のモデルとなるトロンビン誘導性の神経細胞死を抑制する[32]。これらの現象の詳細なメカニズムは不明であるが、mTORC1の活性化による軸索伸長の誘導が重要な役割を果たすと考えられている。
これら以外にも、mTORの活性異常については様々な神経・精神疾患との関与が示唆されており、Rhebの異常がmTORの活性調整を通じて神経疾患に関わる可能性がある。限局性皮質形成異常によるてんかんにおいてmTORやRhebの変異を持つ患者が報告されており[33][34]、てんかん発作に起因する精神疾患にmTORが関わると考えられる。また、慢性ストレスによるうつの誘導の際には、DNA damage-inducible transcript 4 (DDIT4)タンパク質の発現上昇を通じてTsc1/2のGAP活性が促進される。その結果、Rhebの不活性化とmTORシグナルの抑制がおこり、うつが誘導されることが示されている[35]。他にもmTORを通じた樹状突起スパインのダイナミクスと自閉症とのかかわりを示唆する報告が多々ある[36]。このようにRhebはmTORの制御を通じて多岐にわたる神経・精神疾患の発症メカニズムに関与することが示されている。
関連語
参考文献
- ↑ 1.0 1.1
Yamagata, K., Sanders, L.K., Kaufmann, W.E., Yee, W., Barnes, C.A., Nathans, D., & Worley, P.F. (1994).
rheb, a growth factor- and synaptic activity-regulated gene, encodes a novel Ras-related protein. The Journal of biological chemistry, 269(23), 16333-9. [PubMed:8206940] [WorldCat] - ↑
Aspuria, P.J., & Tamanoi, F. (2004).
The Rheb family of GTP-binding proteins. Cellular signalling, 16(10), 1105-12. [PubMed:15240005] [WorldCat] [DOI] - ↑
Long, X., Lin, Y., Ortiz-Vega, S., Yonezawa, K., & Avruch, J. (2005).
Rheb binds and regulates the mTOR kinase. Current biology : CB, 15(8), 702-13. [PubMed:15854902] [WorldCat] [DOI] - ↑
Yu, Y., Li, S., Xu, X., Li, Y., Guan, K., Arnold, E., & Ding, J. (2005).
Structural basis for the unique biological function of small GTPase RHEB. The Journal of biological chemistry, 280(17), 17093-100. [PubMed:15728574] [WorldCat] [DOI] - ↑
Hanker, A.B., Mitin, N., Wilder, R.S., Henske, E.P., Tamanoi, F., Cox, A.D., & Der, C.J. (2010).
Differential requirement of CAAX-mediated posttranslational processing for Rheb localization and signaling. Oncogene, 29(3), 380-91. [PubMed:19838215] [PMC] [WorldCat] [DOI] - ↑
Liu, F., Yang, X., Geng, M., & Huang, M. (2018).
Targeting ERK, an Achilles' Heel of the MAPK pathway, in cancer therapy. Acta pharmaceutica Sinica. B, 8(4), 552-562. [PubMed:30109180] [PMC] [WorldCat] [DOI] - ↑
Saito, K., Araki, Y., Kontani, K., Nishina, H., & Katada, T. (2005).
Novel role of the small GTPase Rheb: its implication in endocytic pathway independent of the activation of mammalian target of rapamycin. Journal of biochemistry, 137(3), 423-30. [PubMed:15809346] [WorldCat] [DOI] - ↑ 8.0 8.1
Sancak, Y., Thoreen, C.C., Peterson, T.R., Lindquist, R.A., Kang, S.A., Spooner, E., ..., & Sabatini, D.M. (2007).
PRAS40 is an insulin-regulated inhibitor of the mTORC1 protein kinase. Molecular cell, 25(6), 903-15. [PubMed:17386266] [WorldCat] [DOI] - ↑ 9.0 9.1
Pan, D., Dong, J., Zhang, Y., & Gao, X. (2004).
Tuberous sclerosis complex: from Drosophila to human disease. Trends in cell biology, 14(2), 78-85. [PubMed:15102439] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
Heard, J.J., Fong, V., Bathaie, S.Z., & Tamanoi, F. (2014).
Recent progress in the study of the Rheb family GTPases. Cellular signalling, 26(9), 1950-7. [PubMed:24863881] [PMC] [WorldCat] [DOI] - ↑
Bai, X., Ma, D., Liu, A., Shen, X., Wang, Q.J., Liu, Y., & Jiang, Y. (2007).
Rheb activates mTOR by antagonizing its endogenous inhibitor, FKBP38. Science (New York, N.Y.), 318(5852), 977-80. [PubMed:17991864] [WorldCat] [DOI] - ↑
Alves, M.M., Fuhler, G.M., Queiroz, K.C., Scholma, J., Goorden, S., Anink, J., ..., & Peppelenbosch, M.P. (2015).
PAK2 is an effector of TSC1/2 signaling independent of mTOR and a potential therapeutic target for Tuberous Sclerosis Complex. Scientific reports, 5, 14534. [PubMed:26412398] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Sugiura, H., Yasuda, S., Katsurabayashi, S., Kawano, H., Endo, K., Takasaki, K., ..., & Yamagata, K. (2015).
Rheb activation disrupts spine synapse formation through accumulation of syntenin in tuberous sclerosis complex. Nature communications, 6, 6842. [PubMed:25880340] [WorldCat] [DOI] - ↑ 14.0 14.1
Zou, J., Zhou, L., Du, X.X., Ji, Y., Xu, J., Tian, J., ..., & Xiao, B. (2011).
Rheb1 is required for mTORC1 and myelination in postnatal brain development. Developmental cell, 20(1), 97-108. [PubMed:21238928] [PMC] [WorldCat] [DOI] - ↑
Li, Y.H., Werner, H., & Püschel, A.W. (2008).
Rheb and mTOR regulate neuronal polarity through Rap1B. The Journal of biological chemistry, 283(48), 33784-92. [PubMed:18842593] [PMC] [WorldCat] [DOI] - ↑
Lafourcade, C.A., Lin, T.V., Feliciano, D.M., Zhang, L., Hsieh, L.S., & Bordey, A. (2013).
Rheb activation in subventricular zone progenitors leads to heterotopia, ectopic neuronal differentiation, and rapamycin-sensitive olfactory micronodules and dendrite hypertrophy of newborn neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(6), 2419-31. [PubMed:23392671] [PMC] [WorldCat] [DOI] - ↑
Moon, U.Y., Park, J.Y., Park, R., Cho, J.Y., Hughes, L.J., McKenna, J., ..., & Kim, S. (2015).
Impaired Reelin-Dab1 Signaling Contributes to Neuronal Migration Deficits of Tuberous Sclerosis Complex. Cell reports, 12(6), 965-78. [PubMed:26235615] [PMC] [WorldCat] [DOI] - ↑
Feliciano, D.M., Lin, T.V., Hartman, N.W., Bartley, C.M., Kubera, C., Hsieh, L., ..., & Bordey, A. (2013).
A circuitry and biochemical basis for tuberous sclerosis symptoms: from epilepsy to neurocognitive deficits. International journal of developmental neuroscience : the official journal of the International Society for Developmental Neuroscience, 31(7), 667-78. [PubMed:23485365] [PMC] [WorldCat] [DOI] - ↑
Antion, M.D., Hou, L., Wong, H., Hoeffer, C.A., & Klann, E. (2008).
mGluR-dependent long-term depression is associated with increased phosphorylation of S6 and synthesis of elongation factor 1A but remains expressed in S6K-deficient mice. Molecular and cellular biology, 28(9), 2996-3007. [PubMed:18316404] [PMC] [WorldCat] [DOI] - ↑
Kwon, C.H., Luikart, B.W., Powell, C.M., Zhou, J., Matheny, S.A., Zhang, W., ..., & Parada, L.F. (2006).
Pten regulates neuronal arborization and social interaction in mice. Neuron, 50(3), 377-88. [PubMed:16675393] [PMC] [WorldCat] [DOI] - ↑
Biederer, T., & Sudhof, T.C. (2001).
CASK and protein 4.1 support F-actin nucleation on neurexins. The Journal of biological chemistry, 276(51), 47869-76. [PubMed:11604393] [WorldCat] [DOI] - ↑
Brown, H.L., Kaun, K.R., & Edgar, B.A. (2012).
The small GTPase Rheb affects central brain neuronal morphology and memory formation in Drosophila. PloS one, 7(9), e44888. [PubMed:23028662] [PMC] [WorldCat] [DOI] - ↑
Knox, S., Ge, H., Dimitroff, B.D., Ren, Y., Howe, K.A., Arsham, A.M., ..., & Selleck, S.B. (2007).
Mechanisms of TSC-mediated control of synapse assembly and axon guidance. PloS one, 2(4), e375. [PubMed:17440611] [PMC] [WorldCat] [DOI] - ↑
Ghosh, A.P., Marshall, C.B., Coric, T., Shim, E.H., Kirkman, R., Ballestas, M.E., ..., & Sudarshan, S. (2015).
Point mutations of the mTOR-RHEB pathway in renal cell carcinoma. Oncotarget, 6(20), 17895-910. [PubMed:26255626] [PMC] [WorldCat] [DOI] - ↑
Lawrence, M.S., Stojanov, P., Mermel, C.H., Robinson, J.T., Garraway, L.A., Golub, T.R., ..., & Getz, G. (2014).
Discovery and saturation analysis of cancer genes across 21 tumour types. Nature, 505(7484), 495-501. [PubMed:24390350] [PMC] [WorldCat] [DOI] - ↑
Feliciano, D.M. (2020).
The Neurodevelopmental Pathogenesis of Tuberous Sclerosis Complex (TSC). Frontiers in neuroanatomy, 14, 39. [PubMed:32765227] [PMC] [WorldCat] [DOI] - ↑
Cotter, J.A. (2020).
An update on the central nervous system manifestations of tuberous sclerosis complex. Acta neuropathologica, 139(4), 613-624. [PubMed:30976976] [WorldCat] [DOI] - ↑
Luo, C., Ye, W.R., Shi, W., Yin, P., Chen, C., He, Y.B., ..., & Cai, Y. (2022).
Perfect match: mTOR inhibitors and tuberous sclerosis complex. Orphanet journal of rare diseases, 17(1), 106. [PubMed:35246210] [PMC] [WorldCat] [DOI] - ↑
Gracias, N.G., Shirkey-Son, N.J., & Hengst, U. (2014).
Local translation of TC10 is required for membrane expansion during axon outgrowth. Nature communications, 5, 3506. [PubMed:24667291] [PMC] [WorldCat] [DOI] - ↑
Wu, D., Klaw, M.C., Connors, T., Kholodilov, N., Burke, R.E., & Tom, V.J. (2015).
Expressing Constitutively Active Rheb in Adult Neurons after a Complete Spinal Cord Injury Enhances Axonal Regeneration beyond a Chondroitinase-Treated Glial Scar. The Journal of neuroscience : the official journal of the Society for Neuroscience, 35(31), 11068-80. [PubMed:26245968] [PMC] [WorldCat] [DOI] - ↑
Kim, S.R., Kareva, T., Yarygina, O., Kholodilov, N., & Burke, R.E. (2012).
AAV transduction of dopamine neurons with constitutively active Rheb protects from neurodegeneration and mediates axon regrowth. Molecular therapy : the journal of the American Society of Gene Therapy, 20(2), 275-86. [PubMed:22008911] [PMC] [WorldCat] [DOI] - ↑
Jeon, M.T., Nam, J.H., Shin, W.H., Leem, E., Jeong, K.H., Jung, U.J., ..., & Kim, S.R. (2015).
In vivo AAV1 transduction with hRheb(S16H) protects hippocampal neurons by BDNF production. Molecular therapy : the journal of the American Society of Gene Therapy, 23(3), 445-55. [PubMed:25502903] [PMC] [WorldCat] [DOI] - ↑
Hoeffer, C.A., & Klann, E. (2010).
mTOR signaling: at the crossroads of plasticity, memory and disease. Trends in neurosciences, 33(2), 67-75. [PubMed:19963289] [PMC] [WorldCat] [DOI] - ↑
Zhao, S., Li, Z., Zhang, M., Zhang, L., Zheng, H., Ning, J., ..., & Zhang, Y.W. (2019).
A brain somatic RHEB doublet mutation causes focal cortical dysplasia type II. Experimental & molecular medicine, 51(7), 1-11. [PubMed:31337748] [PMC] [WorldCat] [DOI] - ↑
Ota, K.T., Liu, R.J., Voleti, B., Maldonado-Aviles, J.G., Duric, V., Iwata, M., ..., & Duman, R.S. (2014).
REDD1 is essential for stress-induced synaptic loss and depressive behavior. Nature medicine, 20(5), 531-5. [PubMed:24728411] [PMC] [WorldCat] [DOI] - ↑
Chaudry, S., & Vasudevan, N. (2022).
mTOR-Dependent Spine Dynamics in Autism. Frontiers in molecular neuroscience, 15, 877609. [PubMed:35782388] [PMC] [WorldCat] [DOI]