脂質ラフト
高鳥 翔、藤本 豊士
名古屋大学 大学院医学系研究科 機能構築医学専攻 大学院医学系研究科 機能構築医学専攻
DOI:10.14931/bsd.1448 原稿受付日:2012年5月14日 原稿完成日:2013年2月21日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英語名:lipid raft
細胞膜の脂質分布は均質ではなく、一部の脂質は限局して存在しドメインを形成している。その形成要因の一つとして、ある種の脂質分子間には特異的な相互作用が働き、自発的なドメイン形成に至る可能性が想定されている。特に、コレステロールの存在下ではスフィンゴ脂質が集合を形成する現象が人工膜を用いた解析により見出されており、細胞膜にも同様の集合が存在する可能性について議論がなされている。これを流動膜に浮かぶ筏になぞらえて脂質ラフトと呼ぶ。脂質ラフトはシグナル分子間の相互作用の場として働くことが示唆されている[1][2]。
2006年に開催された脂質ラフトに関するキーストンシンポジウムでは、脂質ラフトは以下のように定義された[3]:
「脂質ラフトはステロールとスフィンゴ脂質に富んだ10-200 nmサイズの小さく不均一で非常に動的なドメインであり、細胞機能のコンパートメント化を担う。小さなラフトはタンパク質―タンパク質間またはタンパク質―脂質間の相互作用によって安定化し、大きなプラットフォームを形成することがある。」
この定義ではラフトが小さく、短寿命で不安定であり、タンパク質の関与で安定化する可能性が述べられているが、ラフトが脂質だけで形成されるどうかについては触れられていない。この点は過去10年以上論争の的であり、いまだ完全な決着を見ていない。またラフト以外のメカニズムで(例えばステロールの関与を必要とせずに)できる脂質集合もある。このため本稿では、形成のメカニズムを問わず脂質の集合を「脂質ドメイン」と呼び、上記の定義に沿う脂質ドメインを「脂質ラフト」と呼んで区別する。
以下では、まず人工膜において見出された脂質ドメインについて概説した後、細胞膜に同様のドメインが存在する可能性について論じる。特に、ラフト分子を直接可視化する試みと、それによりラフト仮説がどのように修正されつつあるかという点に重点を置いた。また最後に、ラフト局在分子と、関連する生命現象を取り上げ、脂質ラフトの機能的意義について論じる。
人工膜における脂質ドメイン
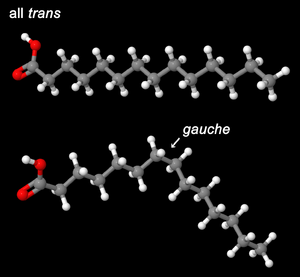
ミリスチン酸の全トランス型の立体配座(上)および1箇所のゴーシュ型立体配座を含む構造(下)。たった1箇所の回転で分子の形が大きく歪むことが分かる。Jmolにより描画。
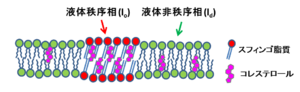
スフィンゴ脂質と不飽和脂肪酸などから成る人工膜ではコレステロール依存的に相分離を生じる。
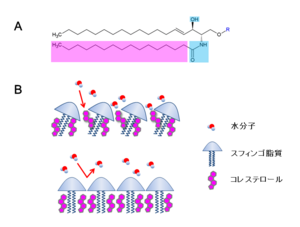
Aの図では水素結合可能な部位(水色)と飽和脂肪酸鎖(ピンク)が強調してある。
細胞膜は数千種の脂質を含む複雑な系である。しかし個々の脂質を特異的に同定したり、細胞内含量や分布を人為的に操作するための一般的手法は確立されておらず、細胞膜における脂質の動態や機能を解析することは困難である。このため脂質2重膜の多くの性質は単純な組成から成る人工膜を用いて明らかにされてきた。脂質ラフトに関してはコレステロールを含む人工膜で見られる液体秩序相(liquid-ordered; lo)との関連が注目されている。
リポソームのような人工膜において、脂質の脂肪酸鎖は低温下では全てトランス型の立体配座をとり伸びた状態にある(図1)。密なパッキングのため分子間にはファンデルワールス力が強く働き、膜の流動性は妨げられている。一方、相転移温度(Tm)以上では脂肪酸鎖が融解し、一部がトランス型からゴーシュ型の立体配座へと変化する(液晶相)。この状態では、分子間相互作用が減弱するため脂質の運動性が高まる。ここにコレステロールが共存した場合、硬い平板構造をもつステロール骨格が脂肪酸鎖の間隙を埋め、トランス型の立体配座を安定化することによって秩序性が増す。一方、脂質の運動性はよく保たれており、拡散係数は液晶相に比較して2~3分の1程度減少するに過ぎない[4]。さらにコレステロールは飽和脂肪酸鎖のみから成る脂質と安定に相互作用するため、飽和脂質と不飽和脂質、およびコレステロールの3者混合系では同一膜内で相分離を生じる。すなわち、飽和脂質とコレステロールから成る液体秩序相と、不飽和脂質が分布する液体非秩序相(liquid-disordered; ld)とが共存した状態になる(図2)。loには直鎖状の飽和脂肪酸をもつ脂質が集積するため、周囲のld相よりも膜が厚い特徴がある。
動物細胞の細胞膜(形質膜)は、他のオルガネラとは異なり、30 mol%程度という多量のコレステロールを含有している。また動物細胞における主要な膜脂質であるグリセロリン脂質は不飽和脂肪酸を持つものが大半を占めるが、細胞膜に多いスフィンゴ脂質の構成脂肪酸の殆どは飽和脂肪酸である。これらの理由から、細胞膜のスフィンゴ脂質とコレステロールもlo相を形成する可能性がある。なおスフィンゴ脂質とコレステロールの集合ができるメカニズムについては、前述のモデル以外にスフィンゴシン骨格のアミド結合が分子間で水素結合をつくり安定化するモデルや、スフィンゴ脂質の嵩高い極性頭部の下の空隙をコレステロールが埋めるというumbrella model[5]が提唱されている(図3)。
細胞膜における脂質ラフト
人工膜でlo相を作るスフィンゴ脂質やコレステロールは、生化学的に得られる界面活性剤不溶性画分(detergent-resistant membrane; DRM)に濃縮して回収される。同じ方法で細胞膜を分画すると同様の脂質組成を持つDRMが得られることから、細胞膜にも人工膜とおなじようにlo相のドメインがあるという議論が行われた。しかしこのセクションで述べるように、DRMをラフトそのものと考えることはできない。一方、ラフト局在分子を直接可視化するアプローチにより、細胞膜におけるラフトの性質について新たな知見が得られつつある。
界面活性剤不溶性に基づく分画
Triton X-100など非イオン性の界面活性剤を用いて低温で細胞を可溶化することにより、比重の小さい不溶性画分が得られる。DRMにはスフィンゴ脂質やコレステロールとともにグリコシルホスファチジルイノシトール(GPI)アンカー型タンパク質などが分画される。膜結合型のシグナル伝達分子がリガンド刺激依存的にDRMに移行することや、形質膜のコレステロールを減少させる薬剤処理によってこの移行が妨げられることが明らかにされており、DRMを脂質ラフトを生化学的に分離した画分として取り扱っている研究は多い。しかし一方、ラフトとDRMを同一視することには異論があり、界面活性剤処理によって膜分子分布に人工的な再編成が起こりうること、用いる界面活性剤によって回収されるタンパク質の種類が異なること、不溶性画分どうしの融合が起こりうることなどの問題点が指摘されている。DRMに含まれることが必ずしも細胞膜上での集合を意味しない点に注意する必要がある。
顕微鏡による可視化
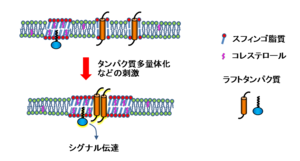
非刺激状態の細胞のラフトは小さくかつ短寿命であり、何らかの刺激を受けることによって安定化すると考えられる。
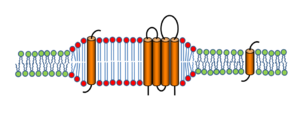
ある種の膜貫通タンパク質は膜貫通領域の長さゆえにlo選択的に局在し、また領域の境界付近に分布することで膜の厚さのミスマッチを軽減する可能性がある。
人工膜のlo相はミクロンスケールのドメインとして観察されるのに対し、細胞膜では通常このような大きなラフトは観察されない。これはラフトの大きさが通常の光学顕微鏡の分解能の限界よりも小さいためと考えられる。しかし高分解能の可視化技術を用いることにより、直径10~200 nmの脂質ドメインが観察される。たとえば、超解像度光学顕微鏡のひとつstimulated emission depletion (STED) microscopyを用いた解析では、スフィンゴ脂質やGPIアンカー型受容体が20 nmサイズの領域にごく短時間(<10-20 ms)局在することが明らかになった[6]。また、楠見らは1粒子追跡法(single particle tracking)によりGPIアンカー型受容体の動態を解析し、リガンドや抗体によって多量体化した場合に、受容体が50 nmサイズの領域に一過性(約0.5 s)にトラップされる現象を見出した。トラップが起きるためには細胞質側のLynなどエフェクター分子の活性化が必要であった[7]。こうした多くの報告を総合することで、非刺激状態の細胞のラフトは当初想定されていたよりも小さくかつ短寿命であり、何らかの刺激を受けることによって安定化されると考えられている(図4)。またラフトの形成には脂質の相分離のみならず、アクチンなどのタンパク質と脂質の相互作用の関与が強く示唆されている。
人工膜のlo相と違って細胞膜のラフトが小さい理由については幾つかの考察がある。単純な2相系のリポソームでは、lo相は平衡状態では融合して大きな領域を作る。これはloとldの境界部で脂質鎖の長さにミスマッチを生じると、疎水部が親水性環境に露出してエネルギー的に不利であるため、境界/面積比が最小になるように融合が進むことによる。一方、細胞膜では膜タンパク質が脂質との相互作用によりラフト形成や安定化に寄与しうる。例えば、ある種の膜貫通タンパク質はloとldの界面に分布することで膜の厚さのミスマッチを軽減すると考えられる(図5)。また細胞膜では膜成分に絶え間ない出入がある。これらの要因を考慮すると、細胞膜でのラフトは数十nm程度のサイズで分散した状態が安定であるという定量的考察がなされている[8]。
ラフト局在と機能的意義
ラフト局在分子
ラフトと非ラフトとでは膜の脂質組成や物性(膜の厚さや膜内分子の拡散速度など)に違いがあるため、膜タンパク質はそれぞれの膜領域に対して異なる親和性を示す。ラフトに局在するタンパク質には次の2つのタイプが知られている。①脂質修飾を受けたタンパク質と②膜貫通領域(transmembrane domain; TMD)がラフトに親和性をもつタンパク質である。①に関係する脂質修飾には、アシル化(ミリストイル化、パルミトイル化)やGPIアンカー付加などがあり、反対にプレニル化(ファルネシル化、ゲラニルゲラニル化)を受けたタンパク質はラフトから排除される傾向があることが報告されている。一方、②については、特にTMDの長い膜タンパク質が疎水性部分の露出を避けるため、膜の厚いラフト環境を好むことが推測されている(図5)。実際、細胞膜に存在する膜タンパク質では、ゴルジ体にあるタンパク質よりもTMDが長い傾向がある[9]。
脂質ラフトの機能
脂質ラフトの重要な機能は、これらのタンパク質を選別して特定の領域内に分布させることにより、分子間相互作用を効率化することであると考えられる。また、ある種のタンパク質では脂質環境の違いによって膜タンパク質のコンフォメーションが変化し、活性が変化すると考えられている。異なるスフィンゴ脂質が互いに排他的なドメインを形成している場合も明らかになっており[10]、異なる種類のラフトが特定のタンパク質の分子機能の制御に関わる可能性がある。
ラフトが関与する具体的な生命現象としては、IgE受容体やT細胞受容体 (TCR)によるシグナル伝達複合体の形成の例がよく知られている。TCRの場合には、抗原提示細胞から提示されたMHCリガンドとの結合により、TCRの近傍にLckやLATなどラフト親和性をもったタンパク質の一群がリクルートされる。この構造体は免疫シナプスと呼ばれ、周囲の膜環境は、膜環境感受性色素であるLaurdanを用いたイメージング法によりlo相に類似した性質をもつことが明らかになっている[11]。
また脂質ラフトの病態生理学的な役割についても近年注目されている。最も頻度の高い神経変性疾患であるアルツハイマー病の発症には、I型膜貫通タンパク質APPがβおよびγセクレターゼによる段階的切断を受けて生じるアミロイドβペプチド(Aβ)が重要な役割を果たしている。これらのタンパク質群はいずれもDRMに分画されることが知られており、脂質ラフト局在とアミロイド産生の関連に興味がもたれる[12]。
参考文献
- ↑
Simons, K., & Vaz, W.L. (2004).
Model systems, lipid rafts, and cell membranes. Annual review of biophysics and biomolecular structure, 33, 269-95. [PubMed:15139814] [WorldCat] [DOI] - ↑
Lingwood, D., & Simons, K. (2010).
Lipid rafts as a membrane-organizing principle. Science (New York, N.Y.), 327(5961), 46-50. [PubMed:20044567] [WorldCat] [DOI] - ↑
Pike, L.J. (2006).
Rafts defined: a report on the Keystone Symposium on Lipid Rafts and Cell Function. Journal of lipid research, 47(7), 1597-8. [PubMed:16645198] [WorldCat] [DOI] - ↑
Simons, K., & Vaz, W.L. (2004).
Model systems, lipid rafts, and cell membranes. Annual review of biophysics and biomolecular structure, 33, 269-95. [PubMed:15139814] [WorldCat] [DOI] - ↑
Huang, J., & Feigenson, G.W. (1999).
A microscopic interaction model of maximum solubility of cholesterol in lipid bilayers. Biophysical journal, 76(4), 2142-57. [PubMed:10096908] [PMC] [WorldCat] [DOI] - ↑
Eggeling, C., Ringemann, C., Medda, R., Schwarzmann, G., Sandhoff, K., Polyakova, S., ..., & Hell, S.W. (2009).
Direct observation of the nanoscale dynamics of membrane lipids in a living cell. Nature, 457(7233), 1159-62. [PubMed:19098897] [WorldCat] [DOI] - ↑
Suzuki, K.G., Fujiwara, T.K., Sanematsu, F., Iino, R., Edidin, M., & Kusumi, A. (2007).
GPI-anchored receptor clusters transiently recruit Lyn and G alpha for temporary cluster immobilization and Lyn activation: single-molecule tracking study 1. The Journal of cell biology, 177(4), 717-30. [PubMed:17517964] [PMC] [WorldCat] [DOI] - ↑
Turner, M.S., Sens, P., & Socci, N.D. (2005).
Nonequilibrium raftlike membrane domains under continuous recycling. Physical review letters, 95(16), 168301. [PubMed:16241845] [WorldCat] [DOI] - ↑
Sharpe, H.J., Stevens, T.J., & Munro, S. (2010).
A comprehensive comparison of transmembrane domains reveals organelle-specific properties. Cell, 142(1), 158-69. [PubMed:20603021] [PMC] [WorldCat] [DOI] - ↑
Fujita, A., Cheng, J., Hirakawa, M., Furukawa, K., Kusunoki, S., & Fujimoto, T. (2007).
Gangliosides GM1 and GM3 in the living cell membrane form clusters susceptible to cholesterol depletion and chilling. Molecular biology of the cell, 18(6), 2112-22. [PubMed:17392511] [PMC] [WorldCat] [DOI] - ↑
Zech, T., Ejsing, C.S., Gaus, K., de Wet, B., Shevchenko, A., Simons, K., & Harder, T. (2009).
Accumulation of raft lipids in T-cell plasma membrane domains engaged in TCR signalling. The EMBO journal, 28(5), 466-76. [PubMed:19177148] [PMC] [WorldCat] [DOI] - ↑
Vetrivel, K.S., & Thinakaran, G. (2010).
Membrane rafts in Alzheimer's disease beta-amyloid production. Biochimica et biophysica acta, 1801(8), 860-7. [PubMed:20303415] [PMC] [WorldCat] [DOI]