「Depolarization-induced suppression of inhibition」の版間の差分
細編集の要約なし |
Yukihashimotodani (トーク | 投稿記録) 細編集の要約なし |
||
| 18行目: | 18行目: | ||
== メカニズム == | == メカニズム == | ||
現在明らかにされているDSIのメカニズムは次の通りである(図2)。脱分極による細胞内へのカルシウムイオン流入が引き金となって細胞膜のリン脂質からDGが産生される。DGはDGLによって加水分解され2-AGが作られる。2-AGは細胞膜を通って細胞外へと放出され、シナプス前終末に局在するCB1受容体を活性化する。[[Gi/oタンパク質共役型受容体]]であるCB1受容体の活性化は[[Gi/oタンパク質]]を介して[[カルシウムチャネル]] | 現在明らかにされているDSIのメカニズムは次の通りである(図2)。脱分極による細胞内へのカルシウムイオン流入が引き金となって細胞膜のリン脂質からDGが産生される。DGはDGLによって加水分解され2-AGが作られる。2-AGは細胞膜を通って細胞外へと放出され、シナプス前終末に局在するCB1受容体を活性化する。[[Gi/oタンパク質共役型受容体]]であるCB1受容体の活性化は[[Gi/oタンパク質]]を介して[[カルシウムチャネル]]を抑制する。あるいはカリウムチャネルを活性化するという説もある。いずれにせよ、その結果、神経終末でのカルシウムイオン流入がブロックされ神経伝達物質の放出が抑制される。シナプス後細胞での脱分極によるカルシウムイオン流入からどのようにしてDGが作られるのかはまだ明らかでない。<br> | ||
== Gq/11共役型受容体活性化による、いわゆる「DSIの促進」 == | == Gq/11共役型受容体活性化による、いわゆる「DSIの促進」 == | ||
2012年9月29日 (土) 09:40時点における版
英略称: DSI
Depolarization-induced suppression of inhibition(日本語名はありますでしょうか?)とはニューロンが脱分極したときに、そのニューロンに入力している抑制性シナプス応答が一過性(1〜2分間程度)に抑制される現象をいう(図1)。同じ現象が興奮性シナプスで起こる場合、Depolarization-induced suppression of excitation (DSE)と呼ぶ。エンドカンナビノイド(内因性カンナビノイド)が担う逆行性シナプス伝達の一種である。DSI/DSEのメカニズムは以下のとおりである。脱分極による細胞内へのカルシウムイオン流入によってエンドカンナビノイドの一種である2-アラキドノイルグリセロール(2-AG)が産生される。シナプス後部でつくられた2-AGは細胞外へ放出され、シナプス間隙を逆行しシナプス前終末に局在するカンナビノイド受容体I型(CB1)に結合し活性化する。CB1受容体の活性化によって神経伝達物質の放出が一過性に抑制される。DSI及びDSEの発生条件として、そのニューロンに2-AGを産生する能力(2-AG合成酵素の有無)があり、かつ入力するシナプス前終末にCB1受容体が存在することが必要である。脳の広範囲のシナプスにおいてDSIやDSEが引き起こされることが知られている。
歴史
DSIは1991年に小脳で最初に報告された。小脳のプルキンエ細胞を脱分極させると一過性にプルキンエ細胞で記録される抑制性入力であるGABA応答が抑制されることが報告された[1]。翌1992年には海馬CA1野の錐体細胞を脱分極させると小脳と同様に一過性にGABA応答が抑制されることが報告された[2]。この二つの研究およびその後の研究からDSIはシナプス後部のニューロンの細胞内カルシウムイオン濃度上昇により誘導され、最終的にはシナプス前終末からのGABAの放出が抑制される現象であることが明らかになった。したがってシナプス後部ニューロンから何らかの逆行性伝達物質が放出されて、それがシナプス前部に作用することが予想された。

初代培養海馬ニューロンペアからホールセルパッチクランプ法により抑制性シナプス後電流(IPSC)を記録。ポスト側のニューロンを5秒間0 mVに脱分極させると一過性にIPSCの振幅が減少する。CB1受容体のアンタゴニストAM281で処理すると同じ脱分極刺激を与えてもIPSCの減少は起きなくなる。 (Hashimotodani et al, Neuroscientist 2007より一部改変)
逆行性伝達物質の発見
DSIの発見からおよそ10年の年月を経た2001年にようやく逆行性伝達物質の正体が突き止められた。同時に3つの独立した研究グループからエンドカンナビノイドが逆行性伝達物質であることが報告された[3][4][5]。そのうちの2つのグループは海馬のDSIにおいてエンドカンナビノイドが逆行性伝達物質であることを明らかにした[4][5]。残りのグループは小脳においてDSIと同様の現象が興奮性シナプスで起こることを初めて報告しDSEと命名した[3]。このDSEもエンドカンナビノイドによって担われることが明らかになった。DSIの最初の報告であった小脳のDSIもエンドカンナビノイドが逆行性伝達物質であることがわかった[6][7]。以降現在までに、海馬、小脳、線条体、大脳皮質、扁桃体、脳幹など脳の様々な部位でDSIやDSEが起こることが報告されている[8]。
2-アラキドノイルグリセロール
エンドカンナビノイドはカンナビノイド受容体に対するリガンドの総称で、複数存在する。その中でも2-AGがDSIおよびDSEを仲介する逆行性伝達物質として働く。2-AGは膜のリン脂質から2つの酵素反応によって生成される。ホスホリパーゼC(PLC)活性の産物であるジアシルグリセロール(DG)が前駆体となり、ジアシルグリセロールリパーゼ(DGL)による加水分解で2-AGが作られる。DGLを薬理的に阻害するとDSI/DSEがブロックされる。ただしDGLの薬理的阻害がDSI/DSEに影響しないという報告もある。しかし、αとβの2つのサブタイプを有するDGLのうちDGLαノックアウトマウスで海馬、小脳、線条体、扁桃体、前頭前野皮質という5つの異なった脳部位でDSIあるいはDSEが消失することが報告され[9][10][11][12][13]、DSIに DGLαが必須であることが確立した。さらに2-AGの分解酵素であるモノアシルグリセロールリパーゼを薬理的あるいは遺伝子欠損によって阻害するとDSI/DSEの持続時間が遷延する[14][15]。これらの結果から2-AGが逆行性伝達物質であることは疑いの余地がなくなっている。
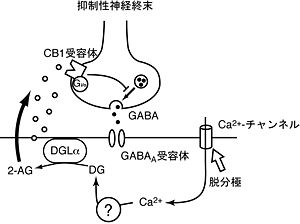
メカニズム
現在明らかにされているDSIのメカニズムは次の通りである(図2)。脱分極による細胞内へのカルシウムイオン流入が引き金となって細胞膜のリン脂質からDGが産生される。DGはDGLによって加水分解され2-AGが作られる。2-AGは細胞膜を通って細胞外へと放出され、シナプス前終末に局在するCB1受容体を活性化する。Gi/oタンパク質共役型受容体であるCB1受容体の活性化はGi/oタンパク質を介してカルシウムチャネルを抑制する。あるいはカリウムチャネルを活性化するという説もある。いずれにせよ、その結果、神経終末でのカルシウムイオン流入がブロックされ神経伝達物質の放出が抑制される。シナプス後細胞での脱分極によるカルシウムイオン流入からどのようにしてDGが作られるのかはまだ明らかでない。
Gq/11共役型受容体活性化による、いわゆる「DSIの促進」
グループI代謝活性型グルタミン酸受容体やM1/M3ムスカリン受容体のアゴニスト存在下でニューロンを脱分極させると、一見、DSI(あるいはDSE)が促進される[8]。すなわち弱い脱分極でも現象として、大きなDSIを引き起こすことができる。この現象のメカニズムとして、以下のことが明らかになっている。グループI代謝活性型グルタミン酸受容体やM1/M3ムスカリン受容体といったGq/11タンパク質共役型受容体はPLCβを活性化する。PLCβがカルシウム感受性を持つため、受容体活性化に加えて脱分極による細胞内カルシウム流入が生じると、PLCβ活性が増強し2-AGの前駆体であるDG産生が促進される。結果、2-AGが効率よく作られ、現象として、DSIが起きやすくなるように見える[16][17]。
上記の「DSIの促進」という表現は、分子機構を考慮に入れると、正しい表現ではない。神経細胞の強い脱分極だけで生ずるDSI/DSEは、PLCβを欠損するマウスでも全く影響されないことが分かっており[16][17]、PLCβ以外のPLCか、または別の分子を介するものと考えられている。厳密には、「DSIの促進」ではなく「Gq/11共役型受容体活性化による2-AGを介する逆行性シナプス伝達抑圧の、細胞内カルシウム上昇による促進」である。多くの論文において、このような重要な点を無視し、安易に「DSIの促進」という表現が使われているので、注意が必要である。分子メカニズムは異なるとはいえ、現象としての「DSIの促進」は機能的に重要な役割を担っていると考えられる。例えば、線条体ではアセチルコリン作動性抑制性ニューロンの発火によって恒常的に細胞外にアセチルコリンが存在する。そのため中型有棘神経細胞のシナプスではM1ムスカリン受容体が慢性的に活性化されており弱い脱分極でもDSIが引き起こされる[18]。
DSIの伝播
エンドカンナビノイドの細胞外での拡散範囲は非常に限られている。したがって、DSIは脱分極した細胞のごく近傍の細胞にしか及ばない。例えば海馬CA1錐体細胞のDSIでは脱分極した細胞からの距離が20 μm以内であれば脱分極していない細胞でもDSIが起こる[5]。
小脳では間接的なメカニズムによって遠くまでDSIの伝播が起こりうる。脱分極によってプルキンエ細胞から放出されたエンドカンナビノイドが、近傍の抑制性ニューロンのCB1受容体を活性化する。内向き整流性カリウムチャネルがCB1受容体の下流にあり、このカリウムチャネルの活性化によって抑制性ニューロンの発火が抑えられる。その結果、発火が抑えられた抑制性ニューロンが投射している多くのプルキンエ細胞において入力が抑制される[19]。
生理的役割
DSI/DSEはネガティブフィードバックとして働き局所回路においてシナプス伝達を制御すると考えられる。短期のシナプス可塑性であるDSIは神経回路の計算論的観点からも注目されている[20]。またDSIがメタ可塑性に関わることが示唆されている。海馬CA1において閾値以下のテタヌス刺激では長期増強(LTP)を引き起こさないような場合でもテタヌス刺激に先行してDSIを誘導させると次に来る閾値以下であった刺激でもLTPが誘導されることが報告されている[21]。DSIによる脱抑制が原因であると考えられる。
DSIおよびDSEを誘導するには細胞内のカルシウム濃度がµMレベルにまで達しなければならない。実際に生理的条件下でそのように大きなカルシウム濃度上昇を引き起こすほどニューロンが長時間脱分極するかどうかは疑わしい。したがってDSIが生理的な現象であることを疑問視する報告もある[22]。しかし一方で、小脳プルキンエ細胞や背側蝸牛神経核にあるCartwheel細胞の持続的な発火によるµM以下のカルシウム濃度上昇でもDSIまたはDSEが起こることからDSI/DSEが生理的現象である可能性も示唆されている[23][24]。
エンドカンナビノイドはDSIのような細胞内カルシウム濃度上昇だけでなく、グループI代謝活性型グルタミン酸受容体といったGq/11タンパク質共役型受容体の活性化によっても産生・放出される[25]。さらに前述のいわゆる「DSIの促進効果」により弱い脱分極でもGq/11タンパク質共役型受容体の活性化と組合わさると、効率よく逆行性シナプス伝達抑制が引き起こされる。したがって生理的条件下ではDSIが単独で起こるよりもGq/11タンパク質共役型受容体の活性化を伴った神経活動によってエンドカンナビノイドによる逆行性シナプス伝達抑制が引き起こされると考えられる[26]。
生理的役割とは別にDSI/DSEは着目するシナプスにおいて、エンドカンナビノイドによる逆行性シナプス伝達抑制を誘導する能力(シナプス後部にDGLが存在し、シナプス前終末にCB1受容体が存在する)があるかどうかを試すプロトコールとしても用いられる。
関連項目
参考文献
- ↑
Llano, I., Leresche, N., & Marty, A. (1991).
Calcium entry increases the sensitivity of cerebellar Purkinje cells to applied GABA and decreases inhibitory synaptic currents. Neuron, 6(4), 565-74. [PubMed:2015092] [WorldCat] [DOI] - ↑
Pitler, T.A., & Alger, B.E. (1992).
Postsynaptic spike firing reduces synaptic GABAA responses in hippocampal pyramidal cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 12(10), 4122-32. [PubMed:1403103] [WorldCat] - ↑ 3.0 3.1
Kreitzer, A.C., & Regehr, W.G. (2001).
Retrograde inhibition of presynaptic calcium influx by endogenous cannabinoids at excitatory synapses onto Purkinje cells. Neuron, 29(3), 717-27. [PubMed:11301030] [WorldCat] [DOI] - ↑ 4.0 4.1
Ohno-Shosaku, T., Maejima, T., & Kano, M. (2001).
Endogenous cannabinoids mediate retrograde signals from depolarized postsynaptic neurons to presynaptic terminals. Neuron, 29(3), 729-38. [PubMed:11301031] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Wilson, R.I., & Nicoll, R.A. (2001).
Endogenous cannabinoids mediate retrograde signalling at hippocampal synapses. Nature, 410(6828), 588-92. [PubMed:11279497] [WorldCat] [DOI] - ↑
Kreitzer, A.C., & Regehr, W.G. (2001).
Cerebellar depolarization-induced suppression of inhibition is mediated by endogenous cannabinoids. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(20), RC174. [PubMed:11588204] [PMC] [WorldCat] - ↑
Yoshida, T., Hashimoto, K., Zimmer, A., Maejima, T., Araishi, K., & Kano, M. (2002).
The cannabinoid CB1 receptor mediates retrograde signals for depolarization-induced suppression of inhibition in cerebellar Purkinje cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(5), 1690-7. [PubMed:11880498] [PMC] [WorldCat] - ↑ 8.0 8.1
Kano, M., Ohno-Shosaku, T., Hashimotodani, Y., Uchigashima, M., & Watanabe, M. (2009).
Endocannabinoid-mediated control of synaptic transmission. Physiological reviews, 89(1), 309-80. [PubMed:19126760] [WorldCat] [DOI] - ↑
Gao, Y., Vasilyev, D.V., Goncalves, M.B., Howell, F.V., Hobbs, C., Reisenberg, M., ..., & Doherty, P. (2010).
Loss of retrograde endocannabinoid signaling and reduced adult neurogenesis in diacylglycerol lipase knock-out mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(6), 2017-24. [PubMed:20147530] [PMC] [WorldCat] [DOI] - ↑
Tanimura, A., Yamazaki, M., Hashimotodani, Y., Uchigashima, M., Kawata, S., Abe, M., ..., & Kano, M. (2010).
The endocannabinoid 2-arachidonoylglycerol produced by diacylglycerol lipase alpha mediates retrograde suppression of synaptic transmission. Neuron, 65(3), 320-7. [PubMed:20159446] [WorldCat] [DOI] - ↑
Uchigashima, M., Yamazaki, M., Yamasaki, M., Tanimura, A., Sakimura, K., Kano, M., & Watanabe, M. (2011).
Molecular and morphological configuration for 2-arachidonoylglycerol-mediated retrograde signaling at mossy cell-granule cell synapses in the dentate gyrus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(21), 7700-14. [PubMed:21613483] [PMC] [WorldCat] [DOI] - ↑
Yoshida, T., Uchigashima, M., Yamasaki, M., Katona, I., Yamazaki, M., Sakimura, K., ..., & Watanabe, M. (2011).
Unique inhibitory synapse with particularly rich endocannabinoid signaling machinery on pyramidal neurons in basal amygdaloid nucleus. Proceedings of the National Academy of Sciences of the United States of America, 108(7), 3059-64. [PubMed:21282604] [PMC] [WorldCat] [DOI] - ↑
Yoshino, H., Miyamae, T., Hansen, G., Zambrowicz, B., Flynn, M., Pedicord, D., ..., & Gonzalez-Burgos, G. (2011).
Postsynaptic diacylglycerol lipase mediates retrograde endocannabinoid suppression of inhibition in mouse prefrontal cortex. The Journal of physiology, 589(Pt 20), 4857-84. [PubMed:21807615] [PMC] [WorldCat] [DOI] - ↑
Hashimotodani, Y., Ohno-Shosaku, T., & Kano, M. (2007).
Presynaptic monoacylglycerol lipase activity determines basal endocannabinoid tone and terminates retrograde endocannabinoid signaling in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(5), 1211-9. [PubMed:17267577] [PMC] [WorldCat] [DOI] - ↑
Pan, B., Wang, W., Zhong, P., Blankman, J.L., Cravatt, B.F., & Liu, Q.S. (2011).
Alterations of endocannabinoid signaling, synaptic plasticity, learning, and memory in monoacylglycerol lipase knock-out mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(38), 13420-30. [PubMed:21940435] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Hashimotodani, Y., Ohno-Shosaku, T., Tsubokawa, H., Ogata, H., Emoto, K., Maejima, T., ..., & Kano, M. (2005).
Phospholipase Cbeta serves as a coincidence detector through its Ca2+ dependency for triggering retrograde endocannabinoid signal. Neuron, 45(2), 257-68. [PubMed:15664177] [WorldCat] [DOI] - ↑ 17.0 17.1
Maejima, T., Oka, S., Hashimotodani, Y., Ohno-Shosaku, T., Aiba, A., Wu, D., ..., & Kano, M. (2005).
Synaptically driven endocannabinoid release requires Ca2+-assisted metabotropic glutamate receptor subtype 1 to phospholipase Cbeta4 signaling cascade in the cerebellum. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(29), 6826-35. [PubMed:16033892] [PMC] [WorldCat] [DOI] - ↑
Narushima, M., Uchigashima, M., Fukaya, M., Matsui, M., Manabe, T., Hashimoto, K., ..., & Kano, M. (2007).
Tonic enhancement of endocannabinoid-mediated retrograde suppression of inhibition by cholinergic interneuron activity in the striatum. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(3), 496-506. [PubMed:17234582] [PMC] [WorldCat] [DOI] - ↑
Kreitzer, A.C., Carter, A.G., & Regehr, W.G. (2002).
Inhibition of interneuron firing extends the spread of endocannabinoid signaling in the cerebellum. Neuron, 34(5), 787-96. [PubMed:12062024] [WorldCat] [DOI] - ↑
Abbott, L.F., & Regehr, W.G. (2004).
Synaptic computation. Nature, 431(7010), 796-803. [PubMed:15483601] [WorldCat] [DOI] - ↑
Carlson, G., Wang, Y., & Alger, B.E. (2002).
Endocannabinoids facilitate the induction of LTP in the hippocampus. Nature neuroscience, 5(8), 723-4. [PubMed:12080342] [WorldCat] [DOI] - ↑
Hampson, R.E., Zhuang, S.Y., Weiner, J.L., & Deadwyler, S.A. (2003).
Functional significance of cannabinoid-mediated, depolarization-induced suppression of inhibition (DSI) in the hippocampus. Journal of neurophysiology, 90(1), 55-64. [PubMed:12649318] [WorldCat] [DOI] - ↑
Brenowitz, S.D., Best, A.R., & Regehr, W.G. (2006).
Sustained elevation of dendritic calcium evokes widespread endocannabinoid release and suppression of synapses onto cerebellar Purkinje cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(25), 6841-50. [PubMed:16793891] [PMC] [WorldCat] [DOI] - ↑
Sedlacek, M., Tipton, P.W., & Brenowitz, S.D. (2011).
Sustained firing of cartwheel cells in the dorsal cochlear nucleus evokes endocannabinoid release and retrograde suppression of parallel fiber synapses. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(44), 15807-17. [PubMed:22049424] [PMC] [WorldCat] [DOI] - ↑
Maejima, T., Hashimoto, K., Yoshida, T., Aiba, A., & Kano, M. (2001).
Presynaptic inhibition caused by retrograde signal from metabotropic glutamate to cannabinoid receptors. Neuron, 31(3), 463-75. [PubMed:11516402] [WorldCat] [DOI] - ↑
Hashimotodani, Y., Ohno-Shosaku, T., & Kano, M. (2007).
Endocannabinoids and synaptic function in the CNS. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry, 13(2), 127-37. [PubMed:17404373] [WorldCat] [DOI]
(執筆者:橋本谷祐輝、狩野方伸 担当編集委員:柚崎通介)