「リーリン」の版間の差分
細編集の要約なし |
Takao kohno (トーク | 投稿記録) 細編集の要約なし |
||
| (3人の利用者による、間の13版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:Reelin | 英語名:Reelin | ||
リーリンは全長約3500アミノ酸残基からなる巨大[[分泌]]蛋[[白質]]であり、歩行時によろめく表現型を持つ自然発症マウス「リーラー」において欠損する分子として同定された。 | |||
リーリンは、リポ蛋白質受容体として知られるApoER2やVLDLRに結合し、細胞内蛋白質[[Dab1]]のリン酸化を誘導する。このシグナル経路の活性化により、[[胎生期]]では神経細胞の移動や形態形成が、成体期では記憶の形成やシナプス可塑性が制御される。 | |||
リーリンの欠損はヒトでも報告されており、てんかんや[[精神遅滞]]を呈する滑脳症を引き起こす。近年、統合失調症や[[アルツハイマー病]]患者におけるリーリンの発現量低下や一塩基多型が多く報告され、[[精神神経疾患]]の発症との関連が示唆されている。 | |||
== リーリンの同定 == | |||
1951年、Falconerにより、運動失調を呈する自然発症マウスが発見された。このマウスは、千鳥足のような歩き方(reeling gait)をするため、reeler(リーラー)と名付けられた。リーラーマウスの脳構造には、多くの異常が認められ、運動を司る小脳が非常に小さいこと、また[[大脳皮質]]の神経細胞の配置は概ね逆転する。そのため、リーラーマウスの原因遺伝子は正常な脳の形成に必須な分子であることが推察された。 | |||
1995年に、Tom curranのグループは、c-fos遺伝子の[[トランスジェニックマウス]]を作製中に、偶然リーラー遺伝子にトランスジーンが挿入されたマウスを得た。このマウスを利用することにより、全長cDNAを報告し、リーラーの原因遺伝子をリーリン(Reelin)と名付けた<ref><pubmed> 7715726 </pubmed></ref>。また同じ頃、林崎、Goffinetらのグループもポジショナルクローニング法により、部分配列を同定した。 | |||
御子柴らのグループは、野生型マウスの脳抽出物を、リーラーマウスに免疫することでリーラーマウスにおいて欠失した蛋白質に対するモノクローナル抗体の樹立を試み、CR-50抗体を樹立した。CR-50抗体は野生型マウス大脳皮質のカハール・レチウス細胞を標識することを見いだし、リーラーマウスで欠失する蛋白質が、カハール・レチウス細胞に発現する事が明らかになった<<ref><pubmed> 7748558 </pubmed></ref>。後に、CR-50の抗原がリーリン蛋白質のN末端側を認識することが確認された。 | |||
== | == リーリンの構造 == | ||
[[ファイル:Takao Kohno Fig 1.jpg|thumb|right|500px|リーリン蛋白質の構造]] | |||
リーリンは、マウスでは全長3461アミノ酸残基(エキソン65個)からなり、分泌シグナルに続いてN末端領域、8回の繰り返し構造(リーリンリピート)、そして塩基性アミノ酸に富むC末端領域(CTR)からなる<ref><pubmed> 7715726 </pubmed></ref>。 | |||
N末端領域は、F-スポンジンとの相同性を弱く持つが、他の領域に関しては、相同性の高い蛋白質は存在しない。それぞれのリーリンリピートは、3つのドメインを持ち、中央に[[EGF]]様モチーフ、さらにこれを挟むようにサブリピートAとサブリピートBが存在する。3番目のリーリンリピートの構造解析の結果、サブリピート同士は互いに接し、馬蹄の様な構造をとる事が分かった<ref><pubmed> 18787202 </pubmed></ref>。CTRは、わずか32アミノ酸残基からなり塩基性に富み、その一次構造は種を超えて高度に保存されている<ref name=ref5><pubmed> 17504759 </pubmed></ref>。フレームシフト変異により8番目のリーリンリピートの一部とCTRを欠くリーリンを発現するリーラーオルレアンマウスでは、リーリンは細胞外に分泌されない<ref><pubmed> 11745613 </pubmed></ref>。そのため、リーリンのCTRはリーリンの分泌に必須であると考えられてきた。しかし、CTRのみを欠くリーリンは分泌効率が低いものの細胞外に分泌されること、CTRをFLAG-tagなどに置換した場合では効率的に分泌されることが判った。そのため、CTRは分泌には必須ではないことが明らかになった<ref name=ref5 />。 | |||
リーリンは、リーリンリピートの2番目と3番目の間付近(N-t site)と、6番目と7番目のリーリンリピートの間付近(C-t site)の2カ所で分解を受け、この分解を担うプロテアーゼが、2価金属イオンを必要とする[[メタロプロテアーゼ]]であることが示唆された<ref><pubmed> 10192793 </pubmed></ref>。最近[[ADAMTS]]-4、ADAMTS-5や[[tPA]]にリーリン分解活性があることが判った<ref><pubmed> 22819337 </pubmed></ref><ref><pubmed> 23082219 </pubmed></ref>。 | |||
リーリンはApoER2/VLDLRに結合したのち、エンドサイトーシスにより細胞内に取り込まれ、取り込まれたリーリンはN-t siteで分解を受けること、これにより生じたN末断片は、Rab11依存的な経路により細胞外に再分泌されることが分かった<ref><pubmed> 19303411 </pubmed></ref>。そのため、リーリンは細胞外、及び細胞内の両方で分解を受けることが示唆される。また、N末断片はApoER2やVLDLRを介さない経路により神経細胞に作用し、樹状突起の成熟を制御することが報告されている<ref><pubmed> 19366679 </pubmed></ref>。 | |||
== リーリンの発現部位 == | |||
胎生期では、大脳皮質の辺縁層に位置するカハール・レチウス細胞、[[海馬]]の辺縁層の外側(将来の網状分子層)に強く発現する。 | |||
成体期になると、大脳皮質のカハール・レチウス細胞での発現が弱まり、[[GABA作動性]]神経細胞に発現が見られる。小脳では外顆粒細胞に発現する。 | |||
== リーリン受容体とその下流シグナル == | |||
リーリンは、リポ蛋白質受容体であるApoER2およびVLDLRに直接結合する<ref name=ref12><pubmed> 10571241 </pubmed></ref><ref><pubmed> 10571240 </pubmed></ref>。リーリンがこれら受容体に結合すると、FynなどのSrc family kinaseが活性化し<ref><pubmed> 12526739 </pubmed></ref><ref><pubmed> 12526740 </pubmed></ref>、細胞内蛋白質Dab1の[[チロシンリン酸化]]が誘導される<ref><pubmed> 10090720 </pubmed></ref>。ApoER2とVLDLRを共に欠くマウス<ref><pubmed> 10380922 </pubmed></ref>、Dab1欠損マウス<ref><pubmed> 9338784 </pubmed></ref><ref><pubmed> 9338785 </pubmed></ref>、Dab1のチロシン残基に変異を導入したマウス<ref><pubmed> 10959835 </pubmed></ref>、FynとSrcを共に欠くマウス<ref><pubmed> 16162939 </pubmed></ref>はいずれもリーラーマウスに酷似した脳形成異常を示す。従って、ApoER2/VLDLRを介したリーリンによるDab1のチロシンリン酸化が正常な脳形成に必要であると言える。 | |||
リーリンの刺激により、Dab1はY185、Y198、Y220、Y232の4カ所でリン酸化を受ける<ref><pubmed> 10959835 </pubmed></ref>。 | |||
Y185とY198でリン酸化を受けたDab1はPI3Kのp85aサブユニットに結合し<ref><pubmed> 12882964 </pubmed></ref>、Aktのリン酸化及び[[GSK3β]]のリン酸化を誘導する。これによりTauのリン酸化が制御されると考えられている。 | |||
Dab1のY220及びY232のリン酸化は、Crk/Crkl-C3G複合体をリクルートし、[[低分子量G蛋白質]]であるRap1のリン酸化を促す<ref><pubmed> 15062102 </pubmed></ref>。最近、大脳[[皮質形成]]の最終段階における、リーリン-Crk/CrkL-C3G-Rap1経路の重要性が明らかとなり、神経細胞が原皮質帯と呼ばれる領域へ進入する際に、この経路を介したインテグリンα5β1の活性化が必要であることが明らかになった<ref><pubmed> 23083738 </pubmed></ref>。また、Dab1を介したRap1の活性化は、[[カドヘリン]]の機能を調節し、早生まれの神経細胞の細胞体トランスロケーションや、遅生まれの神経細胞の多極性移動に重要な役割を担うことも明らかになった<ref><pubmed> 21315259 </pubmed></ref><ref><pubmed> 21516100 </pubmed></ref>。 | |||
Dab1の下流分子としては他にも数多くの候補分子が挙げられているが、どの分子が、どの現象でどの程度重要なのかについて、決定的な証拠がある例は少ない。おそらくは、細胞種や時期によって、複数の因子が関与しているものと推察される。 | |||
== 大脳皮質形成におけるリーリンの機能 == | |||
発生初期の大脳皮質は、プレプレートと呼ばれる層と、神経細胞が新たに生まれる[[脳室]]帯からなる。脳室帯で生まれた神経細胞はプレプレートに侵入し、プレプレートは、[[辺縁帯]]とサブプレートに分離する(この現象はプレプレートスプリッティングと呼ばれる)。これに続いて、脳室帯で生まれた神経細胞は、サブプレートを越え放射状に移動し(この時、遅生まれの神経細胞は、早生まれの神経細胞を追い越すように移動する)、辺縁帯の直前で移動を停止する。このようにして、大脳皮質は、早生まれの神経細胞が脳室側に、遅生まれの神経細胞が表層側に配置される。 | |||
リーリンを欠損するリーラーマウスでは、まずプレプレートスプリッティングが起きない。また、脳室帯で生まれた神経細胞は、早生まれの神経細胞を追い越すことができず、野生型の場合と比べて神経細胞の位置が概ね逆転する。このことから、まずリーリンはプレプレートスプリッティングを起こすために必要であると考えられる。またリーラーマウスにおける[[神経細胞移動]]の異常が、プレプレートスプリッティング異常による、二次的なものかであるか否かは明確な証拠は未だない。 | |||
大脳皮質神経細胞移動におけるリーリンの機能については、いくつかの説が提唱されている。 | |||
=== 停止シグナル説 === | |||
Antonらのグループは、α3β1インテグリンがリーリンの受容体であることを報告し、リーリンとインテグリンとの結合により、神経細胞はラジアルファイバーから離脱し、移動を停止するモデルを提唱した<ref><pubmed> 10939329 </pubmed></ref>。また、Dab1のリン酸化がα3インテグリンの発現量を制御し、これにより神経細胞とラジアルファイバーとの接着性が調節されることが報告された<ref><pubmed> 15091337 </pubmed></ref>。しかし、移動中の神経細胞においてβ1インテグリンを欠失した条件付きノックアウトマウスでは、リーラーの様な層構造形成異常は見られなかった<ref><pubmed> 18077697 </pubmed></ref>ため、インテグリンを介した神経細胞停止機構については更なる研究が必要である。 | |||
VLDLRノックアウトマウスの大脳皮質では、CuxII陽性細胞が辺縁層に侵入する<ref><pubmed> 17913789 </pubmed></ref>ため、辺縁層の直下で神経細胞が停止する機構に、VLDLRが必要であると考えられる。 | |||
=== 許容シグナル説 === | |||
停止シグナル説に対して、2002年頃からリーリンは神経細胞移動に対してpermissiveに働くという許容シグナル説が提唱された。Curranらは、表層側からのリーリン分泌が大脳皮質形成に必要であるかを検討するために、Nestinプロモーター下でリーリンを発現するトランスジェニックマウス(このマウスでは、脳室側でリーリンが異所的に発現する)を作製した<ref><pubmed> 11856531 </pubmed></ref>。このマウスでは神経細胞の移動が阻害されず、大脳皮質の層構造は正常であった。さらに、リーラーマウスと交配した場合、異所的に発現したリーリンは、リーラーマウスのプレプレートスプリッティング異常を回復した(大脳皮質の層構造異常を完全に回復することができなかった)。これらの結果から、リーリンは単純な停止シグナルとして働くのではなく許容シグナルとして働くことが提唱された。 | |||
また、cortical hemと呼ばれる部位由来のカハール・レチウス細胞を遺伝学的手法により除去したマウス<ref><pubmed> 16410414 </pubmed></ref>や、p73ノックアウト(辺縁層におけるカハール・レチウス細胞が激減する)マウス<ref><pubmed> 15525772 </pubmed></ref>では、プレプレートスプリッティングは起こり、層構造は概ね正常に形成された。さらに、リーラーの大脳皮質[[スライス培養]]系に、全長リーリンや、リーリン中央部分断片を添加すると、リーラーのプレプレートスプリッティング異常を回復することができるという報告もある<ref><pubmed> 14724251 </pubmed></ref>。 | |||
これらの知見は、大脳皮質形成におけるリーリンの機能(少なくともプレプレートスプリッティングなどの一部の機能)には、リーリンが必ずしも表層側から分泌される必要がないことを示唆する。 | |||
== | == 精神神経疾患におけるリーリン == | ||
=== 滑脳症 === | === 滑脳症 === | ||
ヒトでのリーリンの欠損は、てんかん、認知障害や精神遅滞を呈する滑脳症を引き起こす<ref><pubmed> 10973257 </pubmed></ref>。リーリン欠損による滑脳症は、小脳がほとんど形成されないことが特徴である。 | |||
=== アルツハイマー病 === | === アルツハイマー病 === | ||
リーリンとアルツハイマー病との関連は多数報告されており、アルツハイマー病患者の死後脳のアミロイドプラークにリーリンが検出されること<ref><pubmed> 11744223 </pubmed></ref>、アルツハイマー病患者の[[脳脊髄液]]におけるリーリンのN末端断片の増加<ref><pubmed> 12645087 </pubmed></ref>、リーリンの糖鎖修飾が健常者とは異なること<ref><pubmed> 16567613 </pubmed></ref>などがある。 | |||
近年、アルツハイマー病とリーリンとの関連を調べるために、in vitroの研究およびマウスを用いた研究が数多くなされてきた。例えば、リーリンによるDab1のリン酸化は、APP蛋白質の膜上での発現量とその分解を増大し、Aβの産生を減少させる<ref><pubmed> 16951405 </pubmed></ref><ref><pubmed> 18089558 </pubmed></ref>。また、リーリンのヘテロ欠損マウスでは、野生型マウスに比べ、早期にAβ沈着が検出される<ref><pubmed> 20610758 </pubmed></ref>。さらに、リーリンシグナルの低下がタウタンパク質の過剰なリン酸化を引き起こし、これがアルツハイマー病の増悪化を引き起こすという説もある<ref name=ref12 />。これらの論文は、リーリンの量または機能の低下が、アルツハイマー病の増悪化の一因であることを示唆している。 | |||
=== 統合失調症 === | === 統合失調症 === | ||
ヒトにおける統合失調症の発症とリーリンのSNPを調べた研究は多く、そしてそのほとんどで弱いながらも相関が検出されている<ref><pubmed> 21863557 </pubmed></ref><ref><pubmed> 18282107 </pubmed></ref>。また、リーリンヘテロ欠損マウスでは[[プレパルスインヒビション]]が異常であるという報告<ref><pubmed> 18547243 </pubmed></ref>もある。リーリンは発生から生後機能まで様々な場面で重要な働きをすると考えられるので、その機能低下が統合失調症につながることは想像しやすいことではある。しかし、今まで行われたヒト遺伝学的解析は小規模なものが多く、またマウスを用いた研究や分子レベルの研究も散発的であり再現性などが充分担保されていないので、リーリンが統合失調症発症に関与するか否かは明確とは言えない。 | |||
=== 自閉症 === | === 自閉症 === | ||
近年の総説では、[[自閉症]]と関連が疑われる遺伝子のスコア付けが試みられている(72)が、リーリンはその中で最高スコアを得ている。また、リーリンヘテロ欠損マウスを用いて自閉症とリーリンを結びつける試みも少なからず行われている<ref><pubmed> 18414403 </pubmed></ref>。ヒトでも、リーリン遺伝子の多型と自閉症発症の相関に関して多くの人種で様々な研究が行われているが、肯定的見解と否定的見解がほぼ相半ばしている。 | |||
=== 気分障害 === | === 気分障害 === | ||
[[双極性障害]]やうつ病においてもリーリンの関与は研究されており、患者死後脳の研究ではリーリンはこれらの患者ではわずかではあるが減少している<ref><pubmed> 11074872 </pubmed></ref><ref><pubmed> 11126396 </pubmed></ref>。また、リーリンにはCTRをコードするエキソンの直前で選択的スプライシングが生じ、CTRの無いアイソフォームが生じることが知られている。双極性障害の患者では、このタイプのmRNAの割合が減少していることが報告されている<ref><pubmed> 21603580 </pubmed></ref>。CTRを欠損するアイソフォームはシグナル活性が弱いので、双極性障害患者では相対的にリーリン機能は亢進していることになる。しかしこれは、リーリンの機能低下を補う代償機構の結果である可能性も残されている。 | |||
<references/> | <references/> | ||
2013年7月24日 (水) 15:40時点における版
英語名:Reelin
リーリンは全長約3500アミノ酸残基からなる巨大分泌蛋白質であり、歩行時によろめく表現型を持つ自然発症マウス「リーラー」において欠損する分子として同定された。 リーリンは、リポ蛋白質受容体として知られるApoER2やVLDLRに結合し、細胞内蛋白質Dab1のリン酸化を誘導する。このシグナル経路の活性化により、胎生期では神経細胞の移動や形態形成が、成体期では記憶の形成やシナプス可塑性が制御される。 リーリンの欠損はヒトでも報告されており、てんかんや精神遅滞を呈する滑脳症を引き起こす。近年、統合失調症やアルツハイマー病患者におけるリーリンの発現量低下や一塩基多型が多く報告され、精神神経疾患の発症との関連が示唆されている。
リーリンの同定
1951年、Falconerにより、運動失調を呈する自然発症マウスが発見された。このマウスは、千鳥足のような歩き方(reeling gait)をするため、reeler(リーラー)と名付けられた。リーラーマウスの脳構造には、多くの異常が認められ、運動を司る小脳が非常に小さいこと、また大脳皮質の神経細胞の配置は概ね逆転する。そのため、リーラーマウスの原因遺伝子は正常な脳の形成に必須な分子であることが推察された。 1995年に、Tom curranのグループは、c-fos遺伝子のトランスジェニックマウスを作製中に、偶然リーラー遺伝子にトランスジーンが挿入されたマウスを得た。このマウスを利用することにより、全長cDNAを報告し、リーラーの原因遺伝子をリーリン(Reelin)と名付けた[1]。また同じ頃、林崎、Goffinetらのグループもポジショナルクローニング法により、部分配列を同定した。 御子柴らのグループは、野生型マウスの脳抽出物を、リーラーマウスに免疫することでリーラーマウスにおいて欠失した蛋白質に対するモノクローナル抗体の樹立を試み、CR-50抗体を樹立した。CR-50抗体は野生型マウス大脳皮質のカハール・レチウス細胞を標識することを見いだし、リーラーマウスで欠失する蛋白質が、カハール・レチウス細胞に発現する事が明らかになった<[2]。後に、CR-50の抗原がリーリン蛋白質のN末端側を認識することが確認された。
リーリンの構造
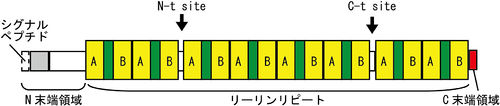
リーリンは、マウスでは全長3461アミノ酸残基(エキソン65個)からなり、分泌シグナルに続いてN末端領域、8回の繰り返し構造(リーリンリピート)、そして塩基性アミノ酸に富むC末端領域(CTR)からなる[3]。 N末端領域は、F-スポンジンとの相同性を弱く持つが、他の領域に関しては、相同性の高い蛋白質は存在しない。それぞれのリーリンリピートは、3つのドメインを持ち、中央にEGF様モチーフ、さらにこれを挟むようにサブリピートAとサブリピートBが存在する。3番目のリーリンリピートの構造解析の結果、サブリピート同士は互いに接し、馬蹄の様な構造をとる事が分かった[4]。CTRは、わずか32アミノ酸残基からなり塩基性に富み、その一次構造は種を超えて高度に保存されている[5]。フレームシフト変異により8番目のリーリンリピートの一部とCTRを欠くリーリンを発現するリーラーオルレアンマウスでは、リーリンは細胞外に分泌されない[6]。そのため、リーリンのCTRはリーリンの分泌に必須であると考えられてきた。しかし、CTRのみを欠くリーリンは分泌効率が低いものの細胞外に分泌されること、CTRをFLAG-tagなどに置換した場合では効率的に分泌されることが判った。そのため、CTRは分泌には必須ではないことが明らかになった[5]。 リーリンは、リーリンリピートの2番目と3番目の間付近(N-t site)と、6番目と7番目のリーリンリピートの間付近(C-t site)の2カ所で分解を受け、この分解を担うプロテアーゼが、2価金属イオンを必要とするメタロプロテアーゼであることが示唆された[7]。最近ADAMTS-4、ADAMTS-5やtPAにリーリン分解活性があることが判った[8][9]。 リーリンはApoER2/VLDLRに結合したのち、エンドサイトーシスにより細胞内に取り込まれ、取り込まれたリーリンはN-t siteで分解を受けること、これにより生じたN末断片は、Rab11依存的な経路により細胞外に再分泌されることが分かった[10]。そのため、リーリンは細胞外、及び細胞内の両方で分解を受けることが示唆される。また、N末断片はApoER2やVLDLRを介さない経路により神経細胞に作用し、樹状突起の成熟を制御することが報告されている[11]。
リーリンの発現部位
胎生期では、大脳皮質の辺縁層に位置するカハール・レチウス細胞、海馬の辺縁層の外側(将来の網状分子層)に強く発現する。 成体期になると、大脳皮質のカハール・レチウス細胞での発現が弱まり、GABA作動性神経細胞に発現が見られる。小脳では外顆粒細胞に発現する。
リーリン受容体とその下流シグナル
リーリンは、リポ蛋白質受容体であるApoER2およびVLDLRに直接結合する[12][13]。リーリンがこれら受容体に結合すると、FynなどのSrc family kinaseが活性化し[14][15]、細胞内蛋白質Dab1のチロシンリン酸化が誘導される[16]。ApoER2とVLDLRを共に欠くマウス[17]、Dab1欠損マウス[18][19]、Dab1のチロシン残基に変異を導入したマウス[20]、FynとSrcを共に欠くマウス[21]はいずれもリーラーマウスに酷似した脳形成異常を示す。従って、ApoER2/VLDLRを介したリーリンによるDab1のチロシンリン酸化が正常な脳形成に必要であると言える。 リーリンの刺激により、Dab1はY185、Y198、Y220、Y232の4カ所でリン酸化を受ける[22]。 Y185とY198でリン酸化を受けたDab1はPI3Kのp85aサブユニットに結合し[23]、Aktのリン酸化及びGSK3βのリン酸化を誘導する。これによりTauのリン酸化が制御されると考えられている。 Dab1のY220及びY232のリン酸化は、Crk/Crkl-C3G複合体をリクルートし、低分子量G蛋白質であるRap1のリン酸化を促す[24]。最近、大脳皮質形成の最終段階における、リーリン-Crk/CrkL-C3G-Rap1経路の重要性が明らかとなり、神経細胞が原皮質帯と呼ばれる領域へ進入する際に、この経路を介したインテグリンα5β1の活性化が必要であることが明らかになった[25]。また、Dab1を介したRap1の活性化は、カドヘリンの機能を調節し、早生まれの神経細胞の細胞体トランスロケーションや、遅生まれの神経細胞の多極性移動に重要な役割を担うことも明らかになった[26][27]。
Dab1の下流分子としては他にも数多くの候補分子が挙げられているが、どの分子が、どの現象でどの程度重要なのかについて、決定的な証拠がある例は少ない。おそらくは、細胞種や時期によって、複数の因子が関与しているものと推察される。
大脳皮質形成におけるリーリンの機能
発生初期の大脳皮質は、プレプレートと呼ばれる層と、神経細胞が新たに生まれる脳室帯からなる。脳室帯で生まれた神経細胞はプレプレートに侵入し、プレプレートは、辺縁帯とサブプレートに分離する(この現象はプレプレートスプリッティングと呼ばれる)。これに続いて、脳室帯で生まれた神経細胞は、サブプレートを越え放射状に移動し(この時、遅生まれの神経細胞は、早生まれの神経細胞を追い越すように移動する)、辺縁帯の直前で移動を停止する。このようにして、大脳皮質は、早生まれの神経細胞が脳室側に、遅生まれの神経細胞が表層側に配置される。 リーリンを欠損するリーラーマウスでは、まずプレプレートスプリッティングが起きない。また、脳室帯で生まれた神経細胞は、早生まれの神経細胞を追い越すことができず、野生型の場合と比べて神経細胞の位置が概ね逆転する。このことから、まずリーリンはプレプレートスプリッティングを起こすために必要であると考えられる。またリーラーマウスにおける神経細胞移動の異常が、プレプレートスプリッティング異常による、二次的なものかであるか否かは明確な証拠は未だない。 大脳皮質神経細胞移動におけるリーリンの機能については、いくつかの説が提唱されている。
停止シグナル説
Antonらのグループは、α3β1インテグリンがリーリンの受容体であることを報告し、リーリンとインテグリンとの結合により、神経細胞はラジアルファイバーから離脱し、移動を停止するモデルを提唱した[28]。また、Dab1のリン酸化がα3インテグリンの発現量を制御し、これにより神経細胞とラジアルファイバーとの接着性が調節されることが報告された[29]。しかし、移動中の神経細胞においてβ1インテグリンを欠失した条件付きノックアウトマウスでは、リーラーの様な層構造形成異常は見られなかった[30]ため、インテグリンを介した神経細胞停止機構については更なる研究が必要である。 VLDLRノックアウトマウスの大脳皮質では、CuxII陽性細胞が辺縁層に侵入する[31]ため、辺縁層の直下で神経細胞が停止する機構に、VLDLRが必要であると考えられる。
許容シグナル説
停止シグナル説に対して、2002年頃からリーリンは神経細胞移動に対してpermissiveに働くという許容シグナル説が提唱された。Curranらは、表層側からのリーリン分泌が大脳皮質形成に必要であるかを検討するために、Nestinプロモーター下でリーリンを発現するトランスジェニックマウス(このマウスでは、脳室側でリーリンが異所的に発現する)を作製した[32]。このマウスでは神経細胞の移動が阻害されず、大脳皮質の層構造は正常であった。さらに、リーラーマウスと交配した場合、異所的に発現したリーリンは、リーラーマウスのプレプレートスプリッティング異常を回復した(大脳皮質の層構造異常を完全に回復することができなかった)。これらの結果から、リーリンは単純な停止シグナルとして働くのではなく許容シグナルとして働くことが提唱された。 また、cortical hemと呼ばれる部位由来のカハール・レチウス細胞を遺伝学的手法により除去したマウス[33]や、p73ノックアウト(辺縁層におけるカハール・レチウス細胞が激減する)マウス[34]では、プレプレートスプリッティングは起こり、層構造は概ね正常に形成された。さらに、リーラーの大脳皮質スライス培養系に、全長リーリンや、リーリン中央部分断片を添加すると、リーラーのプレプレートスプリッティング異常を回復することができるという報告もある[35]。 これらの知見は、大脳皮質形成におけるリーリンの機能(少なくともプレプレートスプリッティングなどの一部の機能)には、リーリンが必ずしも表層側から分泌される必要がないことを示唆する。
精神神経疾患におけるリーリン
滑脳症
ヒトでのリーリンの欠損は、てんかん、認知障害や精神遅滞を呈する滑脳症を引き起こす[36]。リーリン欠損による滑脳症は、小脳がほとんど形成されないことが特徴である。
アルツハイマー病
リーリンとアルツハイマー病との関連は多数報告されており、アルツハイマー病患者の死後脳のアミロイドプラークにリーリンが検出されること[37]、アルツハイマー病患者の脳脊髄液におけるリーリンのN末端断片の増加[38]、リーリンの糖鎖修飾が健常者とは異なること[39]などがある。 近年、アルツハイマー病とリーリンとの関連を調べるために、in vitroの研究およびマウスを用いた研究が数多くなされてきた。例えば、リーリンによるDab1のリン酸化は、APP蛋白質の膜上での発現量とその分解を増大し、Aβの産生を減少させる[40][41]。また、リーリンのヘテロ欠損マウスでは、野生型マウスに比べ、早期にAβ沈着が検出される[42]。さらに、リーリンシグナルの低下がタウタンパク質の過剰なリン酸化を引き起こし、これがアルツハイマー病の増悪化を引き起こすという説もある[12]。これらの論文は、リーリンの量または機能の低下が、アルツハイマー病の増悪化の一因であることを示唆している。
統合失調症
ヒトにおける統合失調症の発症とリーリンのSNPを調べた研究は多く、そしてそのほとんどで弱いながらも相関が検出されている[43][44]。また、リーリンヘテロ欠損マウスではプレパルスインヒビションが異常であるという報告[45]もある。リーリンは発生から生後機能まで様々な場面で重要な働きをすると考えられるので、その機能低下が統合失調症につながることは想像しやすいことではある。しかし、今まで行われたヒト遺伝学的解析は小規模なものが多く、またマウスを用いた研究や分子レベルの研究も散発的であり再現性などが充分担保されていないので、リーリンが統合失調症発症に関与するか否かは明確とは言えない。
自閉症
近年の総説では、自閉症と関連が疑われる遺伝子のスコア付けが試みられている(72)が、リーリンはその中で最高スコアを得ている。また、リーリンヘテロ欠損マウスを用いて自閉症とリーリンを結びつける試みも少なからず行われている[46]。ヒトでも、リーリン遺伝子の多型と自閉症発症の相関に関して多くの人種で様々な研究が行われているが、肯定的見解と否定的見解がほぼ相半ばしている。
気分障害
双極性障害やうつ病においてもリーリンの関与は研究されており、患者死後脳の研究ではリーリンはこれらの患者ではわずかではあるが減少している[47][48]。また、リーリンにはCTRをコードするエキソンの直前で選択的スプライシングが生じ、CTRの無いアイソフォームが生じることが知られている。双極性障害の患者では、このタイプのmRNAの割合が減少していることが報告されている[49]。CTRを欠損するアイソフォームはシグナル活性が弱いので、双極性障害患者では相対的にリーリン機能は亢進していることになる。しかしこれは、リーリンの機能低下を補う代償機構の結果である可能性も残されている。
- ↑
D'Arcangelo, G., Miao, G.G., Chen, S.C., Soares, H.D., Morgan, J.I., & Curran, T. (1995).
A protein related to extracellular matrix proteins deleted in the mouse mutant reeler. Nature, 374(6524), 719-23. [PubMed:7715726] [WorldCat] [DOI] - ↑
Ogawa, M., Miyata, T., Nakajima, K., Yagyu, K., Seike, M., Ikenaka, K., ..., & Mikoshiba, K. (1995).
The reeler gene-associated antigen on Cajal-Retzius neurons is a crucial molecule for laminar organization of cortical neurons. Neuron, 14(5), 899-912. [PubMed:7748558] [WorldCat] [DOI] - ↑
D'Arcangelo, G., Miao, G.G., Chen, S.C., Soares, H.D., Morgan, J.I., & Curran, T. (1995).
A protein related to extracellular matrix proteins deleted in the mouse mutant reeler. Nature, 374(6524), 719-23. [PubMed:7715726] [WorldCat] [DOI] - ↑
Nogi, T., Sangawa, T., Tabata, S., Nagae, M., Tamura-Kawakami, K., Beppu, A., ..., & Takagi, J. (2008).
Novel affinity tag system using structurally defined antibody-tag interaction: application to single-step protein purification. Protein science : a publication of the Protein Society, 17(12), 2120-6. [PubMed:18787202] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Nakano, Y., Kohno, T., Hibi, T., Kohno, S., Baba, A., Mikoshiba, K., ..., & Hattori, M. (2007).
The extremely conserved C-terminal region of Reelin is not necessary for secretion but is required for efficient activation of downstream signaling. The Journal of biological chemistry, 282(28), 20544-52. [PubMed:17504759] [WorldCat] [DOI] - ↑
Derer, P., Derer, M., & Goffinet, A. (2001).
Axonal secretion of Reelin by Cajal-Retzius cells: evidence from comparison of normal and Reln(Orl) mutant mice. The Journal of comparative neurology, 440(2), 136-43. [PubMed:11745613] [WorldCat] [DOI] - ↑
Lambert de Rouvroit, C., de Bergeyck, V., Cortvrindt, C., Bar, I., Eeckhout, Y., & Goffinet, A.M. (1999).
Reelin, the extracellular matrix protein deficient in reeler mutant mice, is processed by a metalloproteinase. Experimental neurology, 156(1), 214-7. [PubMed:10192793] [WorldCat] [DOI] - ↑
Hisanaga, A., Morishita, S., Suzuki, K., Sasaki, K., Koie, M., Kohno, T., & Hattori, M. (2012).
A disintegrin and metalloproteinase with thrombospondin motifs 4 (ADAMTS-4) cleaves Reelin in an isoform-dependent manner. FEBS letters, 586(19), 3349-53. [PubMed:22819337] [WorldCat] [DOI] - ↑
Krstic, D., Rodriguez, M., & Knuesel, I. (2012).
Regulated proteolytic processing of Reelin through interplay of tissue plasminogen activator (tPA), ADAMTS-4, ADAMTS-5, and their modulators. PloS one, 7(10), e47793. [PubMed:23082219] [PMC] [WorldCat] [DOI] - ↑
Hibi, T., & Hattori, M. (2009).
The N-terminal fragment of Reelin is generated after endocytosis and released through the pathway regulated by Rab11. FEBS letters, 583(8), 1299-303. [PubMed:19303411] [WorldCat] [DOI] - ↑
Chameau, P., Inta, D., Vitalis, T., Monyer, H., Wadman, W.J., & van Hooft, J.A. (2009).
The N-terminal region of reelin regulates postnatal dendritic maturation of cortical pyramidal neurons. Proceedings of the National Academy of Sciences of the United States of America, 106(17), 7227-32. [PubMed:19366679] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Hiesberger, T., Trommsdorff, M., Howell, B.W., Goffinet, A., Mumby, M.C., Cooper, J.A., & Herz, J. (1999).
Direct binding of Reelin to VLDL receptor and ApoE receptor 2 induces tyrosine phosphorylation of disabled-1 and modulates tau phosphorylation. Neuron, 24(2), 481-9. [PubMed:10571241] [WorldCat] [DOI] - ↑
D'Arcangelo, G., Homayouni, R., Keshvara, L., Rice, D.S., Sheldon, M., & Curran, T. (1999).
Reelin is a ligand for lipoprotein receptors. Neuron, 24(2), 471-9. [PubMed:10571240] [WorldCat] [DOI] - ↑
Arnaud, L., Ballif, B.A., Förster, E., & Cooper, J.A. (2003).
Fyn tyrosine kinase is a critical regulator of disabled-1 during brain development. Current biology : CB, 13(1), 9-17. [PubMed:12526739] [WorldCat] [DOI] - ↑
Bock, H.H., & Herz, J. (2003).
Reelin activates SRC family tyrosine kinases in neurons. Current biology : CB, 13(1), 18-26. [PubMed:12526740] [WorldCat] [DOI] - ↑
Howell, B.W., Herrick, T.M., & Cooper, J.A. (1999).
Reelin-induced tyrosine [corrected] phosphorylation of disabled 1 during neuronal positioning. Genes & development, 13(6), 643-8. [PubMed:10090720] [PMC] [WorldCat] [DOI] - ↑
Trommsdorff, M., Gotthardt, M., Hiesberger, T., Shelton, J., Stockinger, W., Nimpf, J., ..., & Herz, J. (1999).
Reeler/Disabled-like disruption of neuronal migration in knockout mice lacking the VLDL receptor and ApoE receptor 2. Cell, 97(6), 689-701. [PubMed:10380922] [WorldCat] [DOI] - ↑
Sheldon, M., Rice, D.S., D'Arcangelo, G., Yoneshima, H., Nakajima, K., Mikoshiba, K., ..., & Curran, T. (1997).
Scrambler and yotari disrupt the disabled gene and produce a reeler-like phenotype in mice. Nature, 389(6652), 730-3. [PubMed:9338784] [WorldCat] [DOI] - ↑
Howell, B.W., Hawkes, R., Soriano, P., & Cooper, J.A. (1997).
Neuronal position in the developing brain is regulated by mouse disabled-1. Nature, 389(6652), 733-7. [PubMed:9338785] [WorldCat] [DOI] - ↑
Howell, B.W., Herrick, T.M., Hildebrand, J.D., Zhang, Y., & Cooper, J.A. (2000).
Dab1 tyrosine phosphorylation sites relay positional signals during mouse brain development. Current biology : CB, 10(15), 877-85. [PubMed:10959835] [WorldCat] [DOI] - ↑
Kuo, G., Arnaud, L., Kronstad-O'Brien, P., & Cooper, J.A. (2005).
Absence of Fyn and Src causes a reeler-like phenotype. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(37), 8578-86. [PubMed:16162939] [PMC] [WorldCat] [DOI] - ↑
Howell, B.W., Herrick, T.M., Hildebrand, J.D., Zhang, Y., & Cooper, J.A. (2000).
Dab1 tyrosine phosphorylation sites relay positional signals during mouse brain development. Current biology : CB, 10(15), 877-85. [PubMed:10959835] [WorldCat] [DOI] - ↑
Bock, H.H., Jossin, Y., Liu, P., Förster, E., May, P., Goffinet, A.M., & Herz, J. (2003).
Phosphatidylinositol 3-kinase interacts with the adaptor protein Dab1 in response to Reelin signaling and is required for normal cortical lamination. The Journal of biological chemistry, 278(40), 38772-9. [PubMed:12882964] [WorldCat] [DOI] - ↑
Ballif, B.A., Arnaud, L., Arthur, W.T., Guris, D., Imamoto, A., & Cooper, J.A. (2004).
Activation of a Dab1/CrkL/C3G/Rap1 pathway in Reelin-stimulated neurons. Current biology : CB, 14(7), 606-10. [PubMed:15062102] [WorldCat] [DOI] - ↑
Sekine, K., Kawauchi, T., Kubo, K., Honda, T., Herz, J., Hattori, M., ..., & Nakajima, K. (2012).
Reelin controls neuronal positioning by promoting cell-matrix adhesion via inside-out activation of integrin α5β1. Neuron, 76(2), 353-69. [PubMed:23083738] [PMC] [WorldCat] [DOI] - ↑
Franco, S.J., Martinez-Garay, I., Gil-Sanz, C., Harkins-Perry, S.R., & Müller, U. (2011).
Reelin regulates cadherin function via Dab1/Rap1 to control neuronal migration and lamination in the neocortex. Neuron, 69(3), 482-97. [PubMed:21315259] [PMC] [WorldCat] [DOI] - ↑
Jossin, Y., & Cooper, J.A. (2011).
Reelin, Rap1 and N-cadherin orient the migration of multipolar neurons in the developing neocortex. Nature neuroscience, 14(6), 697-703. [PubMed:21516100] [PMC] [WorldCat] [DOI] - ↑
Dulabon, L., Olson, E.C., Taglienti, M.G., Eisenhuth, S., McGrath, B., Walsh, C.A., ..., & Anton, E.S. (2000).
Reelin binds alpha3beta1 integrin and inhibits neuronal migration. Neuron, 27(1), 33-44. [PubMed:10939329] [WorldCat] [DOI] - ↑
Sanada, K., Gupta, A., & Tsai, L.H. (2004).
Disabled-1-regulated adhesion of migrating neurons to radial glial fiber contributes to neuronal positioning during early corticogenesis. Neuron, 42(2), 197-211. [PubMed:15091337] [WorldCat] [DOI] - ↑
Belvindrah, R., Graus-Porta, D., Goebbels, S., Nave, K.A., & Müller, U. (2007).
Beta1 integrins in radial glia but not in migrating neurons are essential for the formation of cell layers in the cerebral cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(50), 13854-65. [PubMed:18077697] [PMC] [WorldCat] [DOI] - ↑
Hack, I., Hellwig, S., Junghans, D., Brunne, B., Bock, H.H., Zhao, S., & Frotscher, M. (2007).
Divergent roles of ApoER2 and Vldlr in the migration of cortical neurons. Development (Cambridge, England), 134(21), 3883-91. [PubMed:17913789] [WorldCat] [DOI] - ↑
Magdaleno, S., Keshvara, L., & Curran, T. (2002).
Rescue of ataxia and preplate splitting by ectopic expression of Reelin in reeler mice. Neuron, 33(4), 573-86. [PubMed:11856531] [WorldCat] [DOI] - ↑
Yoshida, M., Assimacopoulos, S., Jones, K.R., & Grove, E.A. (2006).
Massive loss of Cajal-Retzius cells does not disrupt neocortical layer order. Development (Cambridge, England), 133(3), 537-45. [PubMed:16410414] [WorldCat] [DOI] - ↑
Meyer, G., Cabrera Socorro, A., Perez Garcia, C.G., Martinez Millan, L., Walker, N., & Caput, D. (2004).
Developmental roles of p73 in Cajal-Retzius cells and cortical patterning. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(44), 9878-87. [PubMed:15525772] [PMC] [WorldCat] [DOI] - ↑
Jossin, Y., Ignatova, N., Hiesberger, T., Herz, J., Lambert de Rouvroit, C., & Goffinet, A.M. (2004).
The central fragment of Reelin, generated by proteolytic processing in vivo, is critical to its function during cortical plate development. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(2), 514-21. [PubMed:14724251] [PMC] [WorldCat] [DOI] - ↑
Hong, S.E., Shugart, Y.Y., Huang, D.T., Shahwan, S.A., Grant, P.E., Hourihane, J.O., ..., & Walsh, C.A. (2000).
Autosomal recessive lissencephaly with cerebellar hypoplasia is associated with human RELN mutations. Nature genetics, 26(1), 93-6. [PubMed:10973257] [WorldCat] [DOI] - ↑
Wirths, O., Multhaup, G., Czech, C., Blanchard, V., Tremp, G., Pradier, L., ..., & Bayer, T.A. (2001).
Reelin in plaques of beta-amyloid precursor protein and presenilin-1 double-transgenic mice. Neuroscience letters, 316(3), 145-8. [PubMed:11744223] [WorldCat] [DOI] - ↑
Sáez-Valero, J., Costell, M., Sjögren, M., Andreasen, N., Blennow, K., & Luque, J.M. (2003).
Altered levels of cerebrospinal fluid reelin in frontotemporal dementia and Alzheimer's disease. Journal of neuroscience research, 72(1), 132-6. [PubMed:12645087] [WorldCat] [DOI] - ↑
Botella-López, A., Burgaya, F., Gavín, R., García-Ayllón, M.S., Gómez-Tortosa, E., Peña-Casanova, J., ..., & Sáez-Valero, J. (2006).
Reelin expression and glycosylation patterns are altered in Alzheimer's disease. Proceedings of the National Academy of Sciences of the United States of America, 103(14), 5573-8. [PubMed:16567613] [PMC] [WorldCat] [DOI] - ↑
Hoe, H.S., Tran, T.S., Matsuoka, Y., Howell, B.W., & Rebeck, G.W. (2006).
DAB1 and Reelin effects on amyloid precursor protein and ApoE receptor 2 trafficking and processing. The Journal of biological chemistry, 281(46), 35176-85. [PubMed:16951405] [WorldCat] [DOI] - ↑
Hoe, H.S., Minami, S.S., Makarova, A., Lee, J., Hyman, B.T., Matsuoka, Y., & Rebeck, G.W. (2008).
Fyn modulation of Dab1 effects on amyloid precursor protein and ApoE receptor 2 processing. The Journal of biological chemistry, 283(10), 6288-99. [PubMed:18089558] [WorldCat] [DOI] - ↑
Kocherhans, S., Madhusudan, A., Doehner, J., Breu, K.S., Nitsch, R.M., Fritschy, J.M., & Knuesel, I. (2010).
Reduced Reelin expression accelerates amyloid-beta plaque formation and tau pathology in transgenic Alzheimer's disease mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(27), 9228-40. [PubMed:20610758] [PMC] [WorldCat] [DOI] - ↑
Kuang, W.J., Sun, R.F., Zhu, Y.S., & Li, S.B. (2011).
A new single-nucleotide mutation (rs362719) of the reelin (RELN) gene associated with schizophrenia in female Chinese Han. Genetics and molecular research : GMR, 10(3), 1650-8. [PubMed:21863557] [WorldCat] [DOI] - ↑
Shifman, S., Johannesson, M., Bronstein, M., Chen, S.X., Collier, D.A., Craddock, N.J., ..., & Darvasi, A. (2008).
Genome-wide association identifies a common variant in the reelin gene that increases the risk of schizophrenia only in women. PLoS genetics, 4(2), e28. [PubMed:18282107] [PMC] [WorldCat] [DOI] - ↑
Barr, A.M., Fish, K.N., Markou, A., & Honer, W.G. (2008).
Heterozygous reeler mice exhibit alterations in sensorimotor gating but not presynaptic proteins. The European journal of neuroscience, 27(10), 2568-74. [PubMed:18547243] [WorldCat] [DOI] - ↑
Abrahams, B.S., & Geschwind, D.H. (2008).
Advances in autism genetics: on the threshold of a new neurobiology. Nature reviews. Genetics, 9(5), 341-55. [PubMed:18414403] [PMC] [WorldCat] [DOI] - ↑
Guidotti, A., Auta, J., Davis, J.M., Di-Giorgi-Gerevini, V., Dwivedi, Y., Grayson, D.R., ..., & DiGiorgi Gerevini, V. (2000).
Decrease in reelin and glutamic acid decarboxylase67 (GAD67) expression in schizophrenia and bipolar disorder: a postmortem brain study. Archives of general psychiatry, 57(11), 1061-9. [PubMed:11074872] [WorldCat] [DOI] - ↑
Fatemi, S.H., Earle, J.A., & McMenomy, T. (2000).
Reduction in Reelin immunoreactivity in hippocampus of subjects with schizophrenia, bipolar disorder and major depression. Molecular psychiatry, 5(6), 654-63, 571. [PubMed:11126396] [WorldCat] - ↑
Ovadia, G., & Shifman, S. (2011).
The genetic variation of RELN expression in schizophrenia and bipolar disorder. PloS one, 6(5), e19955. [PubMed:21603580] [PMC] [WorldCat] [DOI]