「シナプス顆粒」の版間の差分
細 シナプス小胞への転送ページ |
細編集の要約なし |
||
| (他の1人の利用者による、間の1版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/read0191133 熊丸 絵美]</font><br> | |||
''同志社大学 高等研究教育機構''<br> | |||
DOI XXXX/XXXX 原稿受付日:2013年9月30日 原稿完成日:2013年月日<br> | |||
担当編集委員:[http://researchmap.jp/Bito 尾藤 晴彦](東京大学 大学院医学系研究科 神経生化学分野)<br> | |||
</div> | |||
英: | |||
{{box|text= | |||
シナプス顆粒は、[[神経細胞]]の[[軸索]]終末である[[シナプス前終末]]に蓄積している分泌小胞の総称である。シナプス顆粒は、神経細胞の興奮に応じて[[シナプス前膜]]と[[膜融合]]を起こし、内容物([[神経伝達物質]])を[[シナプス間隙]]に放出([[エキソサイトーシス]])することによって、[[シナプス伝達]]を行う。シナプス前終末にはこれらの[[分泌小胞]]が多数密集して存在しており、[[wikipedia:ja:電子顕微鏡|電子顕微鏡]]像では顆粒状に観察される。[[海馬]]や[[大脳皮質]]に存在する1 μm程度のシナプス前終末では〜200個のシナプス顆粒が含まれているが、[[聴覚]]中枢に存在する[[calyx of Held]]などの巨大なシナプス前終末(10 μmほど)には1200〜2000個ものシナプス顆粒が含まれていると考えられている<ref><pubmed> 18817990 </pubmed></ref>。 | |||
}} | |||
==形態・電子顕微鏡像による分類== | |||
[[ファイル:EmiKumamaru Fig.jpg|thumb|350px|'''図.海馬シナプス電子顕微鏡像'''<BR>透明な顆粒がシナプス小胞、黒い顆粒が有芯小胞(矢頭)。文献<ref name=ref7><pubmed> 22398727 </pubmed></ref>より許可を得て転載 (Elsevier License ; 2903510133723)。 | |||
]] | |||
シナプス顆粒は直径〜50 nmの小さな[[シナプス小胞]] (synaptic vesicle; SV) と〜300 nmの大きな[[有芯小胞]] (dense core vesicle; DCV) に大別される<ref><pubmed> 19249357 </pubmed></ref>。電子顕微鏡像でシナプス小胞が透明な小胞に見えるのに対し、有芯小胞は電子密度が高く、黒く見えることから有芯と呼ばれる(右図)。有芯小胞は、〜300 nmの特に大きな小胞 (large dense core vesicle; LDCV) と小さい小胞 (〜80 nm) が区別される場合もある。この小さい有芯小胞については後述する。 | |||
多くのシナプス前終末にはシナプス小胞とLDCVの両方が含まれるが、シナプス小胞はシナプス前膜付近に多数存在するのに対し、LDCVはシナプス前膜から離れた場所に少数存在する。LDCVは[[神経ペプチド]]・[[ドーパミン]]などの[[アミン]]類や[[神経栄養因子]]を神経伝達物質として内包しているために、小胞内の電子密度が高くなっていると考えられている。一方、シナプス小胞は[[グルタミン酸]]、[[GABA]]、[[グリシン]]などの[[wikipedia:ja:アミノ酸|アミノ酸]]や[[アセチルコリン]]などの「古典的な」神経伝達物質を内包している。 | |||
80 nm程度の小さい有芯小胞は海馬では成熟途中のシナプスに多く見られ、成熟したシナプス前終末にはまれにしか見られない<ref><pubmed> 16797135 </pubmed></ref>。この小さな有芯小胞は[[bassoon]]や[[piccolo]]など、シナプス小胞に存在するタンパク質[[wikipedia:ja:抗体|抗体]]によって免疫陽性であるため、[[シナプス活性帯]]([[active zone]])へのタンパク質輸送に関わる[[輸送小胞]]ではないかと示唆されている<ref><pubmed> 11182086 </pubmed></ref>。また、[[交感神経]]のシナプスにおいては、[[ノルエピネフリン]]や[[セロトニン]]を含む60〜80 nmの有芯小胞が見られ、これをLDCVと区別して[[SDCV]] ([[small dense core vesicle]]) と呼ぶ場合もある。 | |||
==シナプス伝達におけるシナプス小胞と有芯小胞の相違点== | |||
シナプス小胞とLDCVは中に含まれる伝達物質の違いに加え、様々な性質が異なる。シナプス小胞が内包する神経伝達物質のグルタミン酸などは、主にシナプス後膜側の[[イオンチャネル]]に作用するため、直接的にシナプス後膜側に電気的なシナプス応答を引き起こす。一方、LDCVに含まれる伝達物質はシナプス後膜側の[[Gタンパク共役型受容体]]や[[神経栄養因子受容体]]に作用し、シナプス伝達の修飾を行う。 | |||
シナプス小胞は、シナプス前部の[[脱分極]]によって開いた[[電位依存性カルシウムチャネル]]から流入した[[Ca2+|Ca<sup>2+</sup>]]イオンに応じて[[SNARE複合体]]の構造変化が起こり、シナプス前膜と膜融合を起こし、エキソサイトーシスされる。LDCVの中枢神経系での伝達物質放出機構は明らかではないが、[[クロム親和性細胞]]を用いた研究から、シナプス小胞同様、SNARE複合体による膜融合で伝達物質放出を行っていると考えられている<ref><pubmed> 12062043 </pubmed></ref>。しかし、シナプス小胞とLDCVではCa<sup>2+</sup>イオンに対する応答性に違いがあることが知られている。伝達物質放出のためにシナプス小胞が局所での高濃度のCa<sup>2+</sup>イオン濃度上昇を必要とするのに対し、LDCVは持続的な低濃度のCa<sup>2+</sup>イオン濃度上昇を必要とする<ref><pubmed> 15572159 </pubmed></ref>。SNARE複合体に含まれる[[シナプトブレビン]]やCa<sup>2+</sup>センサーである[[シナプトタグミン]]などにはアイソフォームがあり、シナプス小胞とLDCVに存在するこれらのアイソフォームが異なる可能性が示唆されている<ref name=ref7 /> <ref><pubmed> 21551071 </pubmed></ref>。またCa<sup>2+</sup>イオン感受性タンパク質である[[CAPS]]はLDCVにのみ存在する。シナプス小胞とLDCVはこれらのタンパク質の違いによってCa<sup>2+</sup>イオンの感受性やエキソサイトーシス・エンドサイトーシスの速度に相違が生まれるのかもしれないが、今後の研究によるさらなる解明が期待される。 | |||
このようなシナプス活性帯からの距離的な差異や、活性化させる受容体の違い、またシナプス前膜と膜融合を起こすのに必要なカルシウムイオンの応答性の相違などによって、LDCV内の伝達物質はシナプス小胞内の神経伝達物質よりも遅い速度でシナプス後膜側に作用することとなる。さらに、シナプス小胞は伝達物質の放出後、エンドサイトーシスによって再回収(リサイクリング)されシナプス前終末で伝達物質の再充填が行われるのに対し、LDCVは一度きりの放出で、伝達物質が充填された新たなLDCVは[[トランスゴルジネットワーク]]から生成される、というように生成過程においても違いがある。シナプス前終末にシナプス小胞とLDCVの両方が存在するシナプスが脳の各部位で見つかっている。そのようなシナプスではひとつのシナプス前終末に神経伝達物質を2種類以上有することになるが、この伝達物質の組み合わせは脳の部位によって異なり、これがそれぞれのシナプスにおけるシナプス伝達の多様性に寄与しているかもしれない<ref><pubmed> 16847638 </pubmed></ref>。 | |||
==関連項目== | |||
*[[シナプス小胞]] | |||
*[[有芯小胞]] | |||
==参考文献== | |||
<references /> | |||
2013年10月1日 (火) 13:07時点における版
熊丸 絵美
同志社大学 高等研究教育機構
DOI XXXX/XXXX 原稿受付日:2013年9月30日 原稿完成日:2013年月日
担当編集委員:尾藤 晴彦(東京大学 大学院医学系研究科 神経生化学分野)
英:
シナプス顆粒は、神経細胞の軸索終末であるシナプス前終末に蓄積している分泌小胞の総称である。シナプス顆粒は、神経細胞の興奮に応じてシナプス前膜と膜融合を起こし、内容物(神経伝達物質)をシナプス間隙に放出(エキソサイトーシス)することによって、シナプス伝達を行う。シナプス前終末にはこれらの分泌小胞が多数密集して存在しており、電子顕微鏡像では顆粒状に観察される。海馬や大脳皮質に存在する1 μm程度のシナプス前終末では〜200個のシナプス顆粒が含まれているが、聴覚中枢に存在するcalyx of Heldなどの巨大なシナプス前終末(10 μmほど)には1200〜2000個ものシナプス顆粒が含まれていると考えられている[1]。
形態・電子顕微鏡像による分類
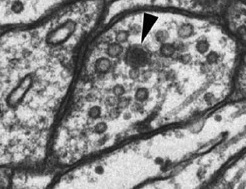
透明な顆粒がシナプス小胞、黒い顆粒が有芯小胞(矢頭)。文献[2]より許可を得て転載 (Elsevier License ; 2903510133723)。
シナプス顆粒は直径〜50 nmの小さなシナプス小胞 (synaptic vesicle; SV) と〜300 nmの大きな有芯小胞 (dense core vesicle; DCV) に大別される[3]。電子顕微鏡像でシナプス小胞が透明な小胞に見えるのに対し、有芯小胞は電子密度が高く、黒く見えることから有芯と呼ばれる(右図)。有芯小胞は、〜300 nmの特に大きな小胞 (large dense core vesicle; LDCV) と小さい小胞 (〜80 nm) が区別される場合もある。この小さい有芯小胞については後述する。
多くのシナプス前終末にはシナプス小胞とLDCVの両方が含まれるが、シナプス小胞はシナプス前膜付近に多数存在するのに対し、LDCVはシナプス前膜から離れた場所に少数存在する。LDCVは神経ペプチド・ドーパミンなどのアミン類や神経栄養因子を神経伝達物質として内包しているために、小胞内の電子密度が高くなっていると考えられている。一方、シナプス小胞はグルタミン酸、GABA、グリシンなどのアミノ酸やアセチルコリンなどの「古典的な」神経伝達物質を内包している。
80 nm程度の小さい有芯小胞は海馬では成熟途中のシナプスに多く見られ、成熟したシナプス前終末にはまれにしか見られない[4]。この小さな有芯小胞はbassoonやpiccoloなど、シナプス小胞に存在するタンパク質抗体によって免疫陽性であるため、シナプス活性帯(active zone)へのタンパク質輸送に関わる輸送小胞ではないかと示唆されている[5]。また、交感神経のシナプスにおいては、ノルエピネフリンやセロトニンを含む60〜80 nmの有芯小胞が見られ、これをLDCVと区別してSDCV (small dense core vesicle) と呼ぶ場合もある。
シナプス伝達におけるシナプス小胞と有芯小胞の相違点
シナプス小胞とLDCVは中に含まれる伝達物質の違いに加え、様々な性質が異なる。シナプス小胞が内包する神経伝達物質のグルタミン酸などは、主にシナプス後膜側のイオンチャネルに作用するため、直接的にシナプス後膜側に電気的なシナプス応答を引き起こす。一方、LDCVに含まれる伝達物質はシナプス後膜側のGタンパク共役型受容体や神経栄養因子受容体に作用し、シナプス伝達の修飾を行う。
シナプス小胞は、シナプス前部の脱分極によって開いた電位依存性カルシウムチャネルから流入したCa2+イオンに応じてSNARE複合体の構造変化が起こり、シナプス前膜と膜融合を起こし、エキソサイトーシスされる。LDCVの中枢神経系での伝達物質放出機構は明らかではないが、クロム親和性細胞を用いた研究から、シナプス小胞同様、SNARE複合体による膜融合で伝達物質放出を行っていると考えられている[6]。しかし、シナプス小胞とLDCVではCa2+イオンに対する応答性に違いがあることが知られている。伝達物質放出のためにシナプス小胞が局所での高濃度のCa2+イオン濃度上昇を必要とするのに対し、LDCVは持続的な低濃度のCa2+イオン濃度上昇を必要とする[7]。SNARE複合体に含まれるシナプトブレビンやCa2+センサーであるシナプトタグミンなどにはアイソフォームがあり、シナプス小胞とLDCVに存在するこれらのアイソフォームが異なる可能性が示唆されている[2] [8]。またCa2+イオン感受性タンパク質であるCAPSはLDCVにのみ存在する。シナプス小胞とLDCVはこれらのタンパク質の違いによってCa2+イオンの感受性やエキソサイトーシス・エンドサイトーシスの速度に相違が生まれるのかもしれないが、今後の研究によるさらなる解明が期待される。
このようなシナプス活性帯からの距離的な差異や、活性化させる受容体の違い、またシナプス前膜と膜融合を起こすのに必要なカルシウムイオンの応答性の相違などによって、LDCV内の伝達物質はシナプス小胞内の神経伝達物質よりも遅い速度でシナプス後膜側に作用することとなる。さらに、シナプス小胞は伝達物質の放出後、エンドサイトーシスによって再回収(リサイクリング)されシナプス前終末で伝達物質の再充填が行われるのに対し、LDCVは一度きりの放出で、伝達物質が充填された新たなLDCVはトランスゴルジネットワークから生成される、というように生成過程においても違いがある。シナプス前終末にシナプス小胞とLDCVの両方が存在するシナプスが脳の各部位で見つかっている。そのようなシナプスではひとつのシナプス前終末に神経伝達物質を2種類以上有することになるが、この伝達物質の組み合わせは脳の部位によって異なり、これがそれぞれのシナプスにおけるシナプス伝達の多様性に寄与しているかもしれない[9]。
関連項目
参考文献
- ↑
Smith, S.M., Renden, R., & von Gersdorff, H. (2008).
Synaptic vesicle endocytosis: fast and slow modes of membrane retrieval. Trends in neurosciences, 31(11), 559-68. [PubMed:18817990] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1
Dean, C., Dunning, F.M., Liu, H., Bomba-Warczak, E., Martens, H., Bharat, V., ..., & Chapman, E.R. (2012).
Axonal and dendritic synaptotagmin isoforms revealed by a pHluorin-syt functional screen. Molecular biology of the cell, 23(9), 1715-27. [PubMed:22398727] [PMC] [WorldCat] [DOI] - ↑
Park, Y., & Kim, K.T. (2009).
Short-term plasticity of small synaptic vesicle (SSV) and large dense-core vesicle (LDCV) exocytosis. Cellular signalling, 21(10), 1465-70. [PubMed:19249357] [WorldCat] [DOI] - ↑
Sorra, K.E., Mishra, A., Kirov, S.A., & Harris, K.M. (2006).
Dense core vesicles resemble active-zone transport vesicles and are diminished following synaptogenesis in mature hippocampal slices. Neuroscience, 141(4), 2097-106. [PubMed:16797135] [WorldCat] [DOI] - ↑
Zhai, R.G., Vardinon-Friedman, H., Cases-Langhoff, C., Becker, B., Gundelfinger, E.D., Ziv, N.E., & Garner, C.C. (2001).
Assembling the presynaptic active zone: a characterization of an active one precursor vesicle. Neuron, 29(1), 131-43. [PubMed:11182086] [WorldCat] [DOI] - ↑
Zhang, X., Kim-Miller, M.J., Fukuda, M., Kowalchyk, J.A., & Martin, T.F. (2002).
Ca2+-dependent synaptotagmin binding to SNAP-25 is essential for Ca2+-triggered exocytosis. Neuron, 34(4), 599-611. [PubMed:12062043] [WorldCat] [DOI] - ↑
Torrealba, F., & Carrasco, M.A. (2004).
A review on electron microscopy and neurotransmitter systems. Brain research. Brain research reviews, 47(1-3), 5-17. [PubMed:15572159] [DOI] - ↑
Zhang, Z., Wu, Y., Wang, Z., Dunning, F.M., Rehfuss, J., Ramanan, D., ..., & Jackson, M.B. (2011).
Release mode of large and small dense-core vesicles specified by different synaptotagmin isoforms in PC12 cells. Molecular biology of the cell, 22(13), 2324-36. [PubMed:21551071] [PMC] [WorldCat] [DOI] - ↑
Salio, C., Lossi, L., Ferrini, F., & Merighi, A. (2006).
Neuropeptides as synaptic transmitters. Cell and tissue research, 326(2), 583-98. [PubMed:16847638] [WorldCat] [DOI]