「Forkhead box protein P2」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/Taku-Sugiyama 杉山 拓]</font><br> | <font size="+1">[http://researchmap.jp/Taku-Sugiyama 杉山 拓]</font><br> | ||
''独立行政法人理化学研究所 脳科学総合研究センター''<br> | ''独立行政法人理化学研究所 脳科学総合研究センター''<br> | ||
<font size="+1">[http://researchmap.jp/noriko1128 大隅 典子]</font><br> | |||
''東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野''<br> | |||
DOI: 原稿受付日:2014年6月2日 原稿完成日:2014年月日<br> | DOI: 原稿受付日:2014年6月2日 原稿完成日:2014年月日<br> | ||
担当編集委員: | 担当編集委員:<br> | ||
</div> | </div> | ||
{{box|text= | {{box|text= | ||
FOXP2は数世代間にわたって[[発話障害]]または[[言語障害]]をもつ家系の遺伝子解析から見出され、現在、[[ヒト]]の発話・言語機能の発達に関与する[[遺伝子]]として着目されている。言語機能とFOXP2との関連が見出された結果、主に言語学と心理学が対象としていたヒトの言語に対して、広範な神経科学の側面からのアプローチが可能となった。FOXP2タンパクは[[DNA]]結合領域をもつ[[転写制御因子]]であり、多くの遺伝子の発現を制御する。近年、FOXP2の制御下にある遺伝子群が網羅的に解析され、遺伝子ネットワークの重要性に注目が集まっている。発生期から成体期[[哺乳類]]の[[神経系]]において、FOXP2/Foxp2の発現は領域特異的に認められているが、それぞれの領域におけるFOXP2/Foxp2の詳細な機能はまだ不明な点が多い。これらのFOXP2/Foxp2発現領域間に形成される神経回路モデルが提唱されており、今後の研究によってその意義が解明されることが期待される。また、Foxp2は進化的に保存された遺伝子であり、[[鳴禽類]]の[[歌学習]]に関わる脳領域に発現が認められ、その機能解析が精力的に行われている。鳴禽類の歌学習に関与する神経回路はヒトの[[前頭葉]]と[[線条体]]に相同であることから、鳴禽類Foxp2の研究によって、ヒトの脳とFOXP2との機能的な関連が見出される可能性も期待されている。 | |||
}} | }} | ||
==イントロダクション== | ==イントロダクション== | ||
言語は単なる音声ではなく、意思疎通を取るためのコミュニケーションツールの一つである。言語は、[[視覚]]や[[聴覚]]という[[感覚系]]を介して脳に情報を入力し、発話や筆記、[[ジェスチャー]]といった運動系によって出力される。感覚系と運動系の間の脳における情報処理は、言語における重要な特質である。これまで言語の研究は伝統的には、言語学や心理学の観点から為されてきたが、[[fMRI]]等の脳画像情報が得られるようになり、認知科学者も参画するようになった。さらに、ヒトの発話・言語機能の発達に関わる遺伝子FOXP2の発見により、言語の起源や獲得、神経生物学的側面についても研究が進むようになった。 | |||
==発話・言語機能発達に関わる遺伝子FOXP2の発見== | ==発話・言語機能発達に関わる遺伝子FOXP2の発見== | ||
1900年に、3世代のメンバー約半数に重篤な発話障害または言語障害がある家系(KE家)が報告された<ref><pubmed> 2332125 </pubmed></ref>。詳細な遺伝学的解析から、KE家の発話・言語障害の原因となる遺伝子座(SPCH1)が第7染色体長腕上の7q31という領域にあることが同定された<ref><pubmed> 9462748 </pubmed></ref>。さらに、KE家とは血縁関係になく、KE家と類似の発話・言語機能障害を持つC.S.氏の遺伝子を解析することにより、発話・言語機能障害の原因となる遺伝子領域が絞りこまれ、発話・言語障害の原因遺伝子としてFOXP2が同定された<ref><pubmed> 10880297 </pubmed></ref> <ref name=Lai_2001><pubmed> 11586359 </pubmed></ref>。ヒトFOXP2の相同遺伝子Foxp2は[[サル]]、[[マウス]] | 1900年に、3世代のメンバー約半数に重篤な発話障害または言語障害がある家系(KE家)が報告された<ref><pubmed> 2332125 </pubmed></ref>。詳細な遺伝学的解析から、KE家の発話・言語障害の原因となる遺伝子座(SPCH1)が第7染色体長腕上の7q31という領域にあることが同定された<ref><pubmed> 9462748 </pubmed></ref>。さらに、KE家とは血縁関係になく、KE家と類似の発話・言語機能障害を持つC.S.氏の遺伝子を解析することにより、発話・言語機能障害の原因となる遺伝子領域が絞りこまれ、発話・言語障害の原因遺伝子としてFOXP2が同定された<ref><pubmed> 10880297 </pubmed></ref> <ref name=Lai_2001><pubmed> 11586359 </pubmed></ref>。ヒトFOXP2の相同遺伝子Foxp2は[[サル]]、[[マウス]]、[[キンカチョウ]]等他の動物において同定されている<ref name=Ferland_2003><pubmed> 12687690 </pubmed></ref> <ref><pubmed> 18461604 </pubmed></ref> <ref name=Teramitsu_2004><pubmed> 15056695 </pubmed></ref>。 | ||
==FOXP2タンパクの構造とFOXP2遺伝子変異== | ==FOXP2タンパクの構造とFOXP2遺伝子変異== | ||
FOXP2/ | FOXP2/Foxp2遺伝子は[[Forkheadドメイン]]というDNA結合領域を持つ転写制御因子をコードしている<ref name=Lai_2001 /> <ref name=Shu_2001><pubmed> 11358962 </pubmed></ref> <ref><pubmed> 16407075 </pubmed></ref>。KE家の遺伝子変異はFOXP2配列の553番目の塩基が[[アルギニン]]から[[ヒスチジン]]に変わっており(R553H)、この遺伝子変異はKE家の中でも障害を抱えるメンバーのみに起こり、障害を抱えないKE家のメンバーは健常者と同様に遺伝子変異は見られなかった<ref name=French_2007><pubmed> 17619227 </pubmed></ref>。FOX遺伝子ファミリーにおいて、この553番目のアルギニンは不変部位であり、このアルギニンの隣には、Forkheadドメインの第3ヘリックスを構成するヒスチジンがある<ref><pubmed> 8332212 </pubmed></ref>。一方、C.S.氏の遺伝子変異はKE家の遺伝子変異とは異なり、FOXP2遺伝子上にて転座が生じたためにDNA結合領域が壊されている <ref name=Lai_2001 />。 | ||
==FOXP2に関係する遺伝子ネットワーク== | ==FOXP2に関係する遺伝子ネットワーク== | ||
FOXP2/Foxp2タンパクは転写制御因子として、標的遺伝子の転写調節領域に結合し、転写抑制の制御を行う<ref><pubmed> 14701752 </pubmed></ref> <ref name=Shu_2001 />。FOXP2/ | FOXP2/Foxp2タンパクは転写制御因子として、標的遺伝子の転写調節領域に結合し、転写抑制の制御を行う<ref><pubmed> 14701752 </pubmed></ref> <ref name=Shu_2001 />。FOXP2/Foxp2がどのような遺伝子の発現を制御しているかについて網羅的な解析がなされ、そのうちのいくつか([[APOD]], [[CCK]], [[CCK-AR]], [[CCND2]], [[CD5]], [[DISC1]], [[DRD2]], [[GABBR1]], [[MT2A]], [[NOS1]], [[PMX2B]], [[TDO2]], [[TIMELESS]], [[Wnt1|WNT1]], and [[ZNF74]])は言語発達との関連があると言われている<ref><pubmed> 17999357 </pubmed></ref> <ref><pubmed> 17999362 </pubmed></ref>。逆に、Foxp2自身を制御する上流因子もしくは相互作用する因子の候補として、脳の発生発達に重要な[[PAX6|Pax6]]が挙げられる<ref><pubmed> 21617155 </pubmed></ref>。 | ||
== | ==機能== | ||
[[ファイル:Sugiyama&Osumi_figure2.jpg|300px|thumb|'''図1.Foxp2の発現パターン'''<br> (A)マウス14日齢の大脳新皮質領域<br>(B)マウス30日齢の小脳皮質領域]] | [[ファイル:Sugiyama&Osumi_figure2.jpg|300px|thumb|'''図1.Foxp2の発現パターン'''<br> (A)マウス14日齢の大脳新皮質領域<br>(B)マウス30日齢の小脳皮質領域]] | ||
Foxp2の生体における機能を知るため、発生工学的に遺伝子機能を欠損させたノックアウトマウスや<ref name=French_2007 />、KE家に見られる遺伝子変異(R552H)を挿入したノックインマウス<ref name=Fujita_2008><pubmed> 18287060 </pubmed></ref> <ref name=Groszer_2008><pubmed> 18328704 </pubmed></ref>が作製された。Foxp2のノックアウトマウスでは小脳の縮小が見られた <ref name=French_2007 />。同様にFoxp2の変異ノックインホモ接合マウス(R552H/R552H)でも小脳の縮小、小脳[[プルキンエ細胞]] | Foxp2の生体における機能を知るため、発生工学的に遺伝子機能を欠損させたノックアウトマウスや<ref name=French_2007 />、KE家に見られる遺伝子変異(R552H)を挿入したノックインマウス<ref name=Fujita_2008><pubmed> 18287060 </pubmed></ref> <ref name=Groszer_2008><pubmed> 18328704 </pubmed></ref>が作製された。Foxp2のノックアウトマウスでは小脳の縮小が見られた <ref name=French_2007 />。同様にFoxp2の変異ノックインホモ接合マウス(R552H/R552H)でも小脳の縮小、小脳[[プルキンエ細胞]]数の減少、さらに[[樹状突起]]のシナプス後部に発現する[[シナプトフィジン]]の発現も減少していた<ref name=Fujita_2008 />。またR552H/R552Hマウスは新生仔が発する[[wikipedia:ja:超音波|超音波]]による鳴き声([[ultrasonic vocalization]], USV)の減少という表現型が得られた<ref name=Fujita_2008 />。一方、ヘテロ接合ノックインマウスR552H/+では、形態的に小脳は正常なマウスとほとんど変わらなかったが、行動学的には、全般的な[[運動機能]]の障害や、線条体と小脳の神経回路における[[シナプス可塑性]]の異常、ホモ接合ノックインマウスR552H/ R552H に比べてマイルドなUSVの異常が見られた<ref name=Fujita_2008 /> <ref name=Groszer_2008 />。 | ||
FOXP2/ | |||
==発現== | |||
FOXP2/Foxp2の発現部位に関しては、[[齧歯類]]の胚と成体、胎生期のヒトにおいて解析が為されている(鳴禽については別の項で記述する)。FOXP2/Foxp2は、[[感覚神経核]]、[[辺縁系]]神経核、大脳新皮質、そして運動機能に関わる領域(小脳や線条体、橋など)において広範な発現パターンを示す (表1)<ref name=Ferland_2003 /> <ref name=Gray_2008><pubmed> 18218908 </pubmed></ref> <ref><pubmed> 12876151 </pubmed></ref> <ref><pubmed> 19463901 </pubmed></ref> <ref><pubmed> 12815709 </pubmed></ref> <ref name=Teramitsu_2004 />。なお、Foxp2は脳だけでなく、[[肺]]や[[心臓]]、[[腸]]にも発現が見られ<ref name=Shu_2001 />、肺発生においては肺上皮細胞の分化にFoxp2が関与していることが報告されている <ref name=Shu_2001 />。またFoxp2は呼吸中枢の橋背側部にも発現が認められている <ref name=Gray_2008 />。図1にマウス脳におけるFoxp2発現パターンの例を示す。 | |||
{| class="wikitable" | {| class="wikitable" | ||
| 33行目: | 37行目: | ||
|'''・感覚神経核'''<br> | |'''・感覚神経核'''<br> | ||
ー ヒト(胎児期)および齧歯類(胚および成体)<br> | ー ヒト(胎児期)および齧歯類(胚および成体)<br> | ||
[[嗅球]]、[[上丘]]、[[下丘]]、[[視床]]([[VPL核]]、[[VPM核]]、[[外側膝状体|外側]]・[[内側膝状体]]) | |||
|- | |- | ||
|'''・辺縁系神経核'''<br> | |'''・辺縁系神経核'''<br> | ||
ー ヒト(胎児期)<br> | ー ヒト(胎児期)<br> | ||
視床([[AD核]]、[[MD核]])<br> | |||
ー 齧歯類(胚および成体)<br> | ー 齧歯類(胚および成体)<br> | ||
[[扁桃体]]、[[中隔核]]、視床、[[視床下部]]([[室傍核]]) | |||
|- | |- | ||
|''' | |'''・大脳[[新皮質]]'''<br> | ||
ー 齧歯類(胚および成体)<br> | ー 齧歯類(胚および成体)<br> | ||
第VI層 | 第VI層 | ||
| 47行目: | 51行目: | ||
|'''・運動機能に関わる領域'''<br> | |'''・運動機能に関わる領域'''<br> | ||
ー ヒト(胎児期)<br> | ー ヒト(胎児期)<br> | ||
[[淡蒼球]]内節、視床下部、視床([[VM]]、[[CM]]、[[束傍核]])<br> | |||
ー 齧歯類(胚および成体)<br> | ー 齧歯類(胚および成体)<br> | ||
[[線条体]]([[尾状核]]、[[被殻]])、[[側坐核]]、[[黒質]]、[[視床]](VM、CM、束傍核)<br> | |||
小脳(プルキンエ細胞)、橋(背側呼吸群)、[[下オリーブ核]]、[[脊髄]](腹側部) | |||
|- | |- | ||
|} | |} | ||
| 56行目: | 60行目: | ||
==FOXP2発現に依拠した神経回路モデル== | ==FOXP2発現に依拠した神経回路モデル== | ||
[[ファイル:Osumi_Foxp2_Fig4.jpg|300px|thumb|'''図2.鳴禽の歌学習に関わる神経回路の模式図''' ]] | [[ファイル:Osumi_Foxp2_Fig4.jpg|300px|thumb|'''図2.鳴禽の歌学習に関わる神経回路の模式図''' ]] | ||
Vargha-Khademらは、FOXP2を発現している脳領域間で形成される神経回路が発話・言語を制御する、という神経回路モデルを提唱している<ref><pubmed> 15685218 </pubmed></ref>。この神経回路モデルでは、前頭葉-線条体経路と前頭葉- | Vargha-Khademらは、FOXP2を発現している脳領域間で形成される神経回路が発話・言語を制御する、という神経回路モデルを提唱している<ref><pubmed> 15685218 </pubmed></ref>。この神経回路モデルでは、前頭葉-線条体経路と前頭葉-小脳経路の2つの経路がある(図2)。これらの神経回路において[[橋]][[灰白質]]以外は全てFOXP2の発現が見られる領域である。運動機能に関わる領域において、広範なFOXP2の発現が見られる意義は、まだ不明な点が多い。しかし、KE家での遺伝子変異の表現型が示すように、FOXP2を発現している神経細胞とその神経細胞によって構成される神経回路は、口腔や顔面の運動制御に重要な役割を果たしていると考えられる。 | ||
==Foxp2と鳴禽の歌学習== | ==Foxp2と鳴禽の歌学習== | ||
| 63行目: | 67行目: | ||
鳴禽は、生得的に歌うだけでなく、[[模倣]]することを通して歌学習を行う。鳴禽が歌うことに関わる脳領域にFoxp2の発現が見られることが報告されている(詳細は後述)。このことから種間を超えたFOXP2の類似点に注目が集まり、研究が進められてきた。進化の過程で哺乳類と鳥類が分かれたのは3億年前と言われている。鳴禽の一種であるゼブラフィンチとマウスのFoxp2タンパク質の違いは5アミノ酸であり、ゼブラフィンチとヒトでは8アミノ酸異なる<ref name=Haesler_2004><pubmed> 15056696 </pubmed></ref>。つまり、ヒトとゼブラフィンチの間でFOXP2タンパク質は98%以上が同一である。また、ゼブラフィンチ脳内でのFoxp2の発現パターンはヒト胎児脳の発現パターンと非常に類似していることが報告されている <ref name=Teramitsu_2004 />。 | 鳴禽は、生得的に歌うだけでなく、[[模倣]]することを通して歌学習を行う。鳴禽が歌うことに関わる脳領域にFoxp2の発現が見られることが報告されている(詳細は後述)。このことから種間を超えたFOXP2の類似点に注目が集まり、研究が進められてきた。進化の過程で哺乳類と鳥類が分かれたのは3億年前と言われている。鳴禽の一種であるゼブラフィンチとマウスのFoxp2タンパク質の違いは5アミノ酸であり、ゼブラフィンチとヒトでは8アミノ酸異なる<ref name=Haesler_2004><pubmed> 15056696 </pubmed></ref>。つまり、ヒトとゼブラフィンチの間でFOXP2タンパク質は98%以上が同一である。また、ゼブラフィンチ脳内でのFoxp2の発現パターンはヒト胎児脳の発現パターンと非常に類似していることが報告されている <ref name=Teramitsu_2004 />。 | ||
鳴禽の歌学習に関わる神経回路においてFoxp2が発現していることは非常に興味深い。ヒトの前頭葉- | 鳴禽の歌学習に関わる神経回路においてFoxp2が発現していることは非常に興味深い。ヒトの前頭葉-線条体経路と相同の神経回路が鳴禽の脳内に存在する。ヒトの大脳皮質に相当する鳥類の[[皮質領野]]([[high vocal center]]: [[HVC]])とヒトの線条体に相当する鳥類の領野XにFoxp2が発現している<ref name=Haesler_2004 />。HVCから[[領野X]]へ、領野Xは視床の[[背外側視床]]の[[内側核]](DLM核)へ、DLM核は皮質の前線条体の[[外側大細胞部]]([[LMAN核]])へと軸索が投射され、LMAN核は歌の生成に関わる神経回路に軸索投射する(図3)<ref name=Scharff_2004><pubmed> 15313783 </pubmed></ref>。またFoxp2は領野Xに発現があるだけでなく、鳴禽の歌学習時に発現量が上昇する<ref name=Haesler_2004 />。HVCとLMANからの投射がある[[終脳]]核(robustus arcopallialis: RA)は歌の機能に関わる[[運動ニューロン]]に投射する<ref name=Scharff_2004 /> <ref name=Teramitsu_2004 />。 | ||
==FOXP2の進化== | ==FOXP2の進化== | ||
ヒトのFOXP2タンパク質と、他の[[霊長類]]や哺乳類のFoxp2タンパク質とを比較した結果、FOXP2は最も保存されたタンパク質5%の中に含まれることが明らかにされた<ref name=Enard_2002><pubmed> 12192408 </pubmed></ref> <ref><pubmed> 21690130 </pubmed></ref> <ref name=Zhang_2002><pubmed> 12524352 </pubmed></ref>。またFOXP2のアミノ酸配列は人種間に差異がほとんど見られないことから、現代人においてFOXP2配列は保存されていると考えられる<ref name=Enard_2002 /> <ref name=Zhang_2002 />。ヒトとマウスの種が分かれたのは7000万年前と言われており、FOXP2遺伝子には多くの塩基置換が蓄積されてきたが、FOXP2タンパク質のアミノ酸配列に変化があったのは3箇所だけであり、変化のあった3箇所のうち2つがヒト特有で、[[チンパンジー]] | ヒトのFOXP2タンパク質と、他の[[霊長類]]や哺乳類のFoxp2タンパク質とを比較した結果、FOXP2は最も保存されたタンパク質5%の中に含まれることが明らかにされた<ref name=Enard_2002><pubmed> 12192408 </pubmed></ref> <ref><pubmed> 21690130 </pubmed></ref> <ref name=Zhang_2002><pubmed> 12524352 </pubmed></ref>。またFOXP2のアミノ酸配列は人種間に差異がほとんど見られないことから、現代人においてFOXP2配列は保存されていると考えられる<ref name=Enard_2002 /> <ref name=Zhang_2002 />。ヒトとマウスの種が分かれたのは7000万年前と言われており、FOXP2遺伝子には多くの塩基置換が蓄積されてきたが、FOXP2タンパク質のアミノ酸配列に変化があったのは3箇所だけであり、変化のあった3箇所のうち2つがヒト特有で、[[チンパンジー]]や[[オランウータン]]、[[ゴリラ]]には見られなかった<ref name=Enard_2002 /> <ref name=Zhang_2002 />。ヒト特有のFOXP2の変化が起きたのはチンパンジーと分かれた400~600万年前と推定されている。 | ||
FOXP2のアミノ酸置換をもとに予測されるのは、ヒト特有のアミノ酸置換がFOXP2の機能を変えたであろうということである。例えば325番目のアスパラギンからセリンへの置換は[[リン酸]]化の部位を付与し、[[転写抑制因子]]としての機能に影響を与えた可能性がある。しかしながら、ヒト特有のアミノ酸置換が現代人の言語・発話機能に与えた影響については未だ明らかにされていない。また、[[非コード領域]]における遺伝子変異が、どのようにFoxp2の発現領域を変えたかについても、まだ未知となっている<ref name=Enard_2002 /> <ref name=Zhang_2002 />。 | |||
==参考文献== | ==参考文献== | ||
2014年6月3日 (火) 09:48時点における版
杉山 拓
独立行政法人理化学研究所 脳科学総合研究センター
大隅 典子
東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野
DOI: 原稿受付日:2014年6月2日 原稿完成日:2014年月日
担当編集委員:
FOXP2は数世代間にわたって発話障害または言語障害をもつ家系の遺伝子解析から見出され、現在、ヒトの発話・言語機能の発達に関与する遺伝子として着目されている。言語機能とFOXP2との関連が見出された結果、主に言語学と心理学が対象としていたヒトの言語に対して、広範な神経科学の側面からのアプローチが可能となった。FOXP2タンパクはDNA結合領域をもつ転写制御因子であり、多くの遺伝子の発現を制御する。近年、FOXP2の制御下にある遺伝子群が網羅的に解析され、遺伝子ネットワークの重要性に注目が集まっている。発生期から成体期哺乳類の神経系において、FOXP2/Foxp2の発現は領域特異的に認められているが、それぞれの領域におけるFOXP2/Foxp2の詳細な機能はまだ不明な点が多い。これらのFOXP2/Foxp2発現領域間に形成される神経回路モデルが提唱されており、今後の研究によってその意義が解明されることが期待される。また、Foxp2は進化的に保存された遺伝子であり、鳴禽類の歌学習に関わる脳領域に発現が認められ、その機能解析が精力的に行われている。鳴禽類の歌学習に関与する神経回路はヒトの前頭葉と線条体に相同であることから、鳴禽類Foxp2の研究によって、ヒトの脳とFOXP2との機能的な関連が見出される可能性も期待されている。
イントロダクション
言語は単なる音声ではなく、意思疎通を取るためのコミュニケーションツールの一つである。言語は、視覚や聴覚という感覚系を介して脳に情報を入力し、発話や筆記、ジェスチャーといった運動系によって出力される。感覚系と運動系の間の脳における情報処理は、言語における重要な特質である。これまで言語の研究は伝統的には、言語学や心理学の観点から為されてきたが、fMRI等の脳画像情報が得られるようになり、認知科学者も参画するようになった。さらに、ヒトの発話・言語機能の発達に関わる遺伝子FOXP2の発見により、言語の起源や獲得、神経生物学的側面についても研究が進むようになった。
発話・言語機能発達に関わる遺伝子FOXP2の発見
1900年に、3世代のメンバー約半数に重篤な発話障害または言語障害がある家系(KE家)が報告された[1]。詳細な遺伝学的解析から、KE家の発話・言語障害の原因となる遺伝子座(SPCH1)が第7染色体長腕上の7q31という領域にあることが同定された[2]。さらに、KE家とは血縁関係になく、KE家と類似の発話・言語機能障害を持つC.S.氏の遺伝子を解析することにより、発話・言語機能障害の原因となる遺伝子領域が絞りこまれ、発話・言語障害の原因遺伝子としてFOXP2が同定された[3] [4]。ヒトFOXP2の相同遺伝子Foxp2はサル、マウス、キンカチョウ等他の動物において同定されている[5] [6] [7]。
FOXP2タンパクの構造とFOXP2遺伝子変異
FOXP2/Foxp2遺伝子はForkheadドメインというDNA結合領域を持つ転写制御因子をコードしている[4] [8] [9]。KE家の遺伝子変異はFOXP2配列の553番目の塩基がアルギニンからヒスチジンに変わっており(R553H)、この遺伝子変異はKE家の中でも障害を抱えるメンバーのみに起こり、障害を抱えないKE家のメンバーは健常者と同様に遺伝子変異は見られなかった[10]。FOX遺伝子ファミリーにおいて、この553番目のアルギニンは不変部位であり、このアルギニンの隣には、Forkheadドメインの第3ヘリックスを構成するヒスチジンがある[11]。一方、C.S.氏の遺伝子変異はKE家の遺伝子変異とは異なり、FOXP2遺伝子上にて転座が生じたためにDNA結合領域が壊されている [4]。
FOXP2に関係する遺伝子ネットワーク
FOXP2/Foxp2タンパクは転写制御因子として、標的遺伝子の転写調節領域に結合し、転写抑制の制御を行う[12] [8]。FOXP2/Foxp2がどのような遺伝子の発現を制御しているかについて網羅的な解析がなされ、そのうちのいくつか(APOD, CCK, CCK-AR, CCND2, CD5, DISC1, DRD2, GABBR1, MT2A, NOS1, PMX2B, TDO2, TIMELESS, WNT1, and ZNF74)は言語発達との関連があると言われている[13] [14]。逆に、Foxp2自身を制御する上流因子もしくは相互作用する因子の候補として、脳の発生発達に重要なPax6が挙げられる[15]。
機能
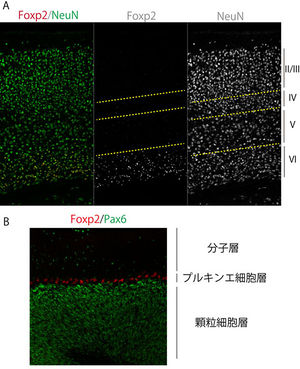
(A)マウス14日齢の大脳新皮質領域
(B)マウス30日齢の小脳皮質領域
Foxp2の生体における機能を知るため、発生工学的に遺伝子機能を欠損させたノックアウトマウスや[10]、KE家に見られる遺伝子変異(R552H)を挿入したノックインマウス[16] [17]が作製された。Foxp2のノックアウトマウスでは小脳の縮小が見られた [10]。同様にFoxp2の変異ノックインホモ接合マウス(R552H/R552H)でも小脳の縮小、小脳プルキンエ細胞数の減少、さらに樹状突起のシナプス後部に発現するシナプトフィジンの発現も減少していた[16]。またR552H/R552Hマウスは新生仔が発する超音波による鳴き声(ultrasonic vocalization, USV)の減少という表現型が得られた[16]。一方、ヘテロ接合ノックインマウスR552H/+では、形態的に小脳は正常なマウスとほとんど変わらなかったが、行動学的には、全般的な運動機能の障害や、線条体と小脳の神経回路におけるシナプス可塑性の異常、ホモ接合ノックインマウスR552H/ R552H に比べてマイルドなUSVの異常が見られた[16] [17]。
発現
FOXP2/Foxp2の発現部位に関しては、齧歯類の胚と成体、胎生期のヒトにおいて解析が為されている(鳴禽については別の項で記述する)。FOXP2/Foxp2は、感覚神経核、辺縁系神経核、大脳新皮質、そして運動機能に関わる領域(小脳や線条体、橋など)において広範な発現パターンを示す (表1)[5] [18] [19] [20] [21] [7]。なお、Foxp2は脳だけでなく、肺や心臓、腸にも発現が見られ[8]、肺発生においては肺上皮細胞の分化にFoxp2が関与していることが報告されている [8]。またFoxp2は呼吸中枢の橋背側部にも発現が認められている [18]。図1にマウス脳におけるFoxp2発現パターンの例を示す。
| ・感覚神経核 |
| ・辺縁系神経核 |
| ・大脳新皮質 ー 齧歯類(胚および成体) |
| ・運動機能に関わる領域 ー ヒト(胎児期) |
FOXP2発現に依拠した神経回路モデル
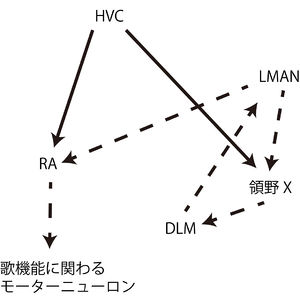
Vargha-Khademらは、FOXP2を発現している脳領域間で形成される神経回路が発話・言語を制御する、という神経回路モデルを提唱している[22]。この神経回路モデルでは、前頭葉-線条体経路と前頭葉-小脳経路の2つの経路がある(図2)。これらの神経回路において橋灰白質以外は全てFOXP2の発現が見られる領域である。運動機能に関わる領域において、広範なFOXP2の発現が見られる意義は、まだ不明な点が多い。しかし、KE家での遺伝子変異の表現型が示すように、FOXP2を発現している神経細胞とその神経細胞によって構成される神経回路は、口腔や顔面の運動制御に重要な役割を果たしていると考えられる。
Foxp2と鳴禽の歌学習
鳴禽は、生得的に歌うだけでなく、模倣することを通して歌学習を行う。鳴禽が歌うことに関わる脳領域にFoxp2の発現が見られることが報告されている(詳細は後述)。このことから種間を超えたFOXP2の類似点に注目が集まり、研究が進められてきた。進化の過程で哺乳類と鳥類が分かれたのは3億年前と言われている。鳴禽の一種であるゼブラフィンチとマウスのFoxp2タンパク質の違いは5アミノ酸であり、ゼブラフィンチとヒトでは8アミノ酸異なる[23]。つまり、ヒトとゼブラフィンチの間でFOXP2タンパク質は98%以上が同一である。また、ゼブラフィンチ脳内でのFoxp2の発現パターンはヒト胎児脳の発現パターンと非常に類似していることが報告されている [7]。
鳴禽の歌学習に関わる神経回路においてFoxp2が発現していることは非常に興味深い。ヒトの前頭葉-線条体経路と相同の神経回路が鳴禽の脳内に存在する。ヒトの大脳皮質に相当する鳥類の皮質領野(high vocal center: HVC)とヒトの線条体に相当する鳥類の領野XにFoxp2が発現している[23]。HVCから領野Xへ、領野Xは視床の背外側視床の内側核(DLM核)へ、DLM核は皮質の前線条体の外側大細胞部(LMAN核)へと軸索が投射され、LMAN核は歌の生成に関わる神経回路に軸索投射する(図3)[24]。またFoxp2は領野Xに発現があるだけでなく、鳴禽の歌学習時に発現量が上昇する[23]。HVCとLMANからの投射がある終脳核(robustus arcopallialis: RA)は歌の機能に関わる運動ニューロンに投射する[24] [7]。
FOXP2の進化
ヒトのFOXP2タンパク質と、他の霊長類や哺乳類のFoxp2タンパク質とを比較した結果、FOXP2は最も保存されたタンパク質5%の中に含まれることが明らかにされた[25] [26] [27]。またFOXP2のアミノ酸配列は人種間に差異がほとんど見られないことから、現代人においてFOXP2配列は保存されていると考えられる[25] [27]。ヒトとマウスの種が分かれたのは7000万年前と言われており、FOXP2遺伝子には多くの塩基置換が蓄積されてきたが、FOXP2タンパク質のアミノ酸配列に変化があったのは3箇所だけであり、変化のあった3箇所のうち2つがヒト特有で、チンパンジーやオランウータン、ゴリラには見られなかった[25] [27]。ヒト特有のFOXP2の変化が起きたのはチンパンジーと分かれた400~600万年前と推定されている。
FOXP2のアミノ酸置換をもとに予測されるのは、ヒト特有のアミノ酸置換がFOXP2の機能を変えたであろうということである。例えば325番目のアスパラギンからセリンへの置換はリン酸化の部位を付与し、転写抑制因子としての機能に影響を与えた可能性がある。しかしながら、ヒト特有のアミノ酸置換が現代人の言語・発話機能に与えた影響については未だ明らかにされていない。また、非コード領域における遺伝子変異が、どのようにFoxp2の発現領域を変えたかについても、まだ未知となっている[25] [27]。
参考文献
- ↑
Hurst, J.A., Baraitser, M., Auger, E., Graham, F., & Norell, S. (1990).
An extended family with a dominantly inherited speech disorder. Developmental medicine and child neurology, 32(4), 352-5. [PubMed:2332125] [WorldCat] [DOI] - ↑
Fisher, S.E., Vargha-Khadem, F., Watkins, K.E., Monaco, A.P., & Pembrey, M.E. (1998).
Localisation of a gene implicated in a severe speech and language disorder. Nature genetics, 18(2), 168-70. [PubMed:9462748] [WorldCat] [DOI] - ↑
Lai, C.S., Fisher, S.E., Hurst, J.A., Levy, E.R., Hodgson, S., Fox, M., ..., & Monaco, A.P. (2000).
The SPCH1 region on human 7q31: genomic characterization of the critical interval and localization of translocations associated with speech and language disorder. American journal of human genetics, 67(2), 357-68. [PubMed:10880297] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Lai, C.S., Fisher, S.E., Hurst, J.A., Vargha-Khadem, F., & Monaco, A.P. (2001).
A forkhead-domain gene is mutated in a severe speech and language disorder. Nature, 413(6855), 519-23. [PubMed:11586359] [WorldCat] [DOI] - ↑ 5.0 5.1
Ferland, R.J., Cherry, T.J., Preware, P.O., Morrisey, E.E., & Walsh, C.A. (2003).
Characterization of Foxp2 and Foxp1 mRNA and protein in the developing and mature brain. The Journal of comparative neurology, 460(2), 266-79. [PubMed:12687690] [WorldCat] [DOI] - ↑
Takahashi, K., Liu, F.C., Oishi, T., Mori, T., Higo, N., Hayashi, M., ..., & Takahashi, H. (2008).
Expression of FOXP2 in the developing monkey forebrain: comparison with the expression of the genes FOXP1, PBX3, and MEIS2. The Journal of comparative neurology, 509(2), 180-9. [PubMed:18461604] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2 7.3
Teramitsu, I., Kudo, L.C., London, S.E., Geschwind, D.H., & White, S.A. (2004).
Parallel FoxP1 and FoxP2 expression in songbird and human brain predicts functional interaction. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(13), 3152-63. [PubMed:15056695] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2 8.3
Shu, W., Yang, H., Zhang, L., Lu, M.M., & Morrisey, E.E. (2001).
Characterization of a new subfamily of winged-helix/forkhead (Fox) genes that are expressed in the lung and act as transcriptional repressors. The Journal of biological chemistry, 276(29), 27488-97. [PubMed:11358962] [WorldCat] [DOI] - ↑
Stroud, J.C., Wu, Y., Bates, D.L., Han, A., Nowick, K., Paabo, S., ..., & Chen, L. (2006).
Structure of the forkhead domain of FOXP2 bound to DNA. Structure (London, England : 1993), 14(1), 159-66. [PubMed:16407075] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
French, C.A., Groszer, M., Preece, C., Coupe, A.M., Rajewsky, K., & Fisher, S.E. (2007).
Generation of mice with a conditional Foxp2 null allele. Genesis (New York, N.Y. : 2000), 45(7), 440-6. [PubMed:17619227] [PMC] [WorldCat] [DOI] - ↑
Clark, K.L., Halay, E.D., Lai, E., & Burley, S.K. (1993).
Co-crystal structure of the HNF-3/fork head DNA-recognition motif resembles histone H5. Nature, 364(6436), 412-20. [PubMed:8332212] [WorldCat] [DOI] - ↑
Li, S., Weidenfeld, J., & Morrisey, E.E. (2004).
Transcriptional and DNA binding activity of the Foxp1/2/4 family is modulated by heterotypic and homotypic protein interactions. Molecular and cellular biology, 24(2), 809-22. [PubMed:14701752] [PMC] [WorldCat] [DOI] - ↑
Spiteri, E., Konopka, G., Coppola, G., Bomar, J., Oldham, M., Ou, J., ..., & Geschwind, D.H. (2007).
Identification of the transcriptional targets of FOXP2, a gene linked to speech and language, in developing human brain. American journal of human genetics, 81(6), 1144-57. [PubMed:17999357] [PMC] [WorldCat] [DOI] - ↑
Vernes, S.C., Spiteri, E., Nicod, J., Groszer, M., Taylor, J.M., Davies, K.E., ..., & Fisher, S.E. (2007).
High-throughput analysis of promoter occupancy reveals direct neural targets of FOXP2, a gene mutated in speech and language disorders. American journal of human genetics, 81(6), 1232-50. [PubMed:17999362] [PMC] [WorldCat] [DOI] - ↑
Coutinho, P., Pavlou, S., Bhatia, S., Chalmers, K.J., Kleinjan, D.A., & van Heyningen, V. (2011).
Discovery and assessment of conserved Pax6 target genes and enhancers. Genome research, 21(8), 1349-59. [PubMed:21617155] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2 16.3
Fujita, E., Tanabe, Y., Shiota, A., Ueda, M., Suwa, K., Momoi, M.Y., & Momoi, T. (2008).
Ultrasonic vocalization impairment of Foxp2 (R552H) knockin mice related to speech-language disorder and abnormality of Purkinje cells. Proceedings of the National Academy of Sciences of the United States of America, 105(8), 3117-22. [PubMed:18287060] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1
Groszer, M., Keays, D.A., Deacon, R.M., de Bono, J.P., Prasad-Mulcare, S., Gaub, S., ..., & Fisher, S.E. (2008).
Impaired synaptic plasticity and motor learning in mice with a point mutation implicated in human speech deficits. Current biology : CB, 18(5), 354-62. [PubMed:18328704] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1
Gray, P.A. (2008).
Transcription factors and the genetic organization of brain stem respiratory neurons. Journal of applied physiology (Bethesda, Md. : 1985), 104(5), 1513-21. [PubMed:18218908] [WorldCat] [DOI] - ↑
Lai, C.S., Gerrelli, D., Monaco, A.P., Fisher, S.E., & Copp, A.J. (2003).
FOXP2 expression during brain development coincides with adult sites of pathology in a severe speech and language disorder. Brain : a journal of neurology, 126(Pt 11), 2455-62. [PubMed:12876151] [WorldCat] [DOI] - ↑
Morikawa, Y., Hisaoka, T., & Senba, E. (2009).
Characterization of Foxp2-expressing cells in the developing spinal cord. Neuroscience, 162(4), 1150-62. [PubMed:19463901] [WorldCat] [DOI] - ↑
Takahashi, K., Liu, F.C., Hirokawa, K., & Takahashi, H. (2003).
Expression of Foxp2, a gene involved in speech and language, in the developing and adult striatum. Journal of neuroscience research, 73(1), 61-72. [PubMed:12815709] [WorldCat] [DOI] - ↑
Vargha-Khadem, F., Gadian, D.G., Copp, A., & Mishkin, M. (2005).
FOXP2 and the neuroanatomy of speech and language. Nature reviews. Neuroscience, 6(2), 131-8. [PubMed:15685218] [WorldCat] [DOI] - ↑ 23.0 23.1 23.2
Haesler, S., Wada, K., Nshdejan, A., Morrisey, E.E., Lints, T., Jarvis, E.D., & Scharff, C. (2004).
FoxP2 expression in avian vocal learners and non-learners. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(13), 3164-75. [PubMed:15056696] [PMC] [WorldCat] [DOI] - ↑ 24.0 24.1
Scharff, C., & White, S.A. (2004).
Genetic components of vocal learning. Annals of the New York Academy of Sciences, 1016, 325-47. [PubMed:15313783] [WorldCat] [DOI] - ↑ 25.0 25.1 25.2 25.3
Enard, W., Przeworski, M., Fisher, S.E., Lai, C.S., Wiebe, V., Kitano, T., ..., & Pääbo, S. (2002).
Molecular evolution of FOXP2, a gene involved in speech and language. Nature, 418(6900), 869-72. [PubMed:12192408] [WorldCat] [DOI] - ↑
Scharff, C., & Petri, J. (2011).
Evo-devo, deep homology and FoxP2: implications for the evolution of speech and language. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 366(1574), 2124-40. [PubMed:21690130] [PMC] [WorldCat] [DOI] - ↑ 27.0 27.1 27.2 27.3
Zhang, J., Webb, D.M., & Podlaha, O. (2002).
Accelerated protein evolution and origins of human-specific features: Foxp2 as an example. Genetics, 162(4), 1825-35. [PubMed:12524352] [PMC] [WorldCat]
28. ジョン・H・マーティン
マーティン 神経解剖学 テキストとアトラス
西村書店 2007