DISC1
久保 健一郎
慶應義塾大学 医学部
神谷 篤
ジョンズ・ホプキンス大学
DOI:10.14931/bsd.4825 原稿受付日:2014年3月25日 原稿完成日:2014年4月3日
担当編集委員:加藤 忠史(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:DISC1
同義語:Disrupted in schizophrenia 1
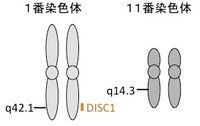
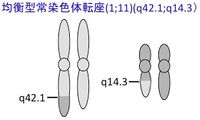
DISC1遺伝子は、染色体1番と11番の間での転座を有する、スコットランドの精神疾患多発家系から見いだされた。この転座によって染色体1番上で2つの遺伝子が破壊されると考えられ、そのうちの1つがDISC1である。DISC1からは複数のアイソフォームが翻訳されるが、主なアイソフォームとしては854アミノ酸からなるタンパク質が翻訳される。DISC1に結合する分子(DISC1 Interactome)として、微小管結合分子やシナプスにおけるシグナル伝達分子など、数多くの分子(GSK3β、NDEL1、PCM1、BBS、Girdin/KIAA1212、PDE4、KAL7、TNIKなど)が報告されている。DISC1は神経系において様々な機能を持つと考えられているが、その代表的な機能として、大脳新皮質や海馬の神経発達や、シナプスの制御が想定されている。
DISC1とは
DISC1遺伝子は、染色体1番と11番の間で均衡型常染色体転座(1;11)(q42.1;q14.3)を遺伝的に有する、スコットランドの精神疾患が集積する家系から見いだされた[1][2]。この家系の転座をもつ保因者29名のうち、21名に精神疾患の診断がなされ、そのうち、統合失調症が7名、双極性障害が1名、大うつ病が10名であった[3](表1)。それに対し、この家系の転座を持たない38名については、5名に精神疾患の診断がなされ、そのうちわけは、1名がアルコール依存、1名は青年期の行為−情緒障害、3名が小うつ病と、精神疾患としては比較的軽度の診断であった[3]。この家系での転座によって、染色体1番上の遺伝子が2つ破壊されると考えられ、その破壊される遺伝子はDISC1、DISC2と名付けられた[2]。このうち、DISC1は、主なアイソフォームとして854アミノ酸からなるタンパク質をコードする。一方、DISC2はDISC1とは逆方向のノンコーディングRNAをコードする。
なお、この転座は、特定の精神疾患への罹患に直接結びつくのではなく、この転座によって、精神疾患罹患のリスクを高めるエンドフェノタイプが生じると考えられる。実際、この転座を持つ保因者では、同じ家系内の非保因者よりも事象関連電位P300の振幅が有意に低下するとの報告もある[3]。
| 均衡型常染色体転座(1:11)(q42.1;q14.3)を有するスコットランドの家系のうち、 面接によって転座の保因状況と精神的な表現形が診断されたメンバー [67名] | |
| 非保因者 (家系内の、転座を有さないメンバー) [38名] |
転座保因者 (家系内の、転座を有するメンバー) [29名] |
|
|
| 青年期の行為-情緒障害(1例) 小うつ病(3例) アルコール依存(1例) |
統合失調症(7例) 双極性障害(1例) 反復性大うつ病(10例) 青年期の行為-情緒障害(2例) 小うつ病(1例) |
構造
DISC1からは、複数のアイソフォームが翻訳され、ヒトの脳では、多種類の異なったスプライスバリアントが発現する[4]。そのうち主なアイソフォームとしては、13個のエクソンから、854アミノ酸からなるタンパク質が翻訳される。この全長のDISC1タンパク質は100 kDa前後の分子量を持ち、N末領域とC末領域に大きく分けられる[2][5]。N末領域は、1〜350番目のアミノ酸残基からなり、他の分子との相同性が低い。C末領域は、350〜854番目のアミノ酸残基からなり、複数のαへリックス構造やコイルドーコイル構造(coiled-coil)を持つ。
DISC1発見の契機となった、スコットランドの家系での染色体転座では、DISC1の597番目と598番目のアミノ酸の間で切断が起きる。この結果、C末を欠いた597番目のアミノ酸までのDISC1タンパク質が発現してドミナントネガティブ(dominant negative)体として働く可能性[6]や、C末を欠いたDISC1タンパク質は分解されて結果としてハプロ不全(Haploinsufficiency)となる可能性が考えられている[7]。最近、1番染色体と11番染色体の融合タンパク質DISC1 Fusion Partner 1 (DISC1FP1)/DISC1-Boymaw fusion proteinが生成される可能性も指摘されている[8][9][10]。
また、DISC1は二量体もしくはそれ以上の多量体(オリゴマー)を形成すると考えられている。その際に、DISC1同士は、403〜504番目のアミノ酸を用いて相互作用する[6]。加えて、C末の640-854番目のアミノ酸もオリゴマー形成に関与しているとされる[11]。
マウスのDISC1相同遺伝子(ortholog)としてクローニングされたDisc1は851アミノ酸をコードし、ヒトのDISC1と60%程度の相同性を持つ[12][13]。C57BL/6のマウス系統とは異なり、129のマウス系統ではエクソン5に25塩基の欠損があることが知られる[14][15]。他の系統のマウスにもこの25塩基の欠損を有するものがあるため、注意が必要である[16]。ただし、マウスでも複数のスプライスアイソフォームがあることが知られており、25塩基の欠損を有するマウス系統においてDISC1アイソフォームの多くは発現していると考えられている[17]。
DISC1タンパク質に結合する分子
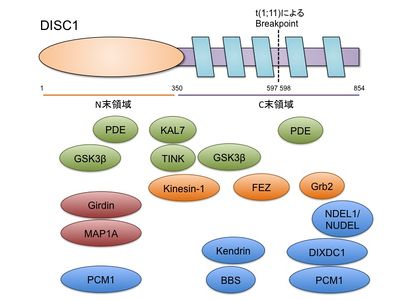
DISC1は足場タンパク質(scaffold)、もしくは、ハブタンパク質(hub)として機能すると考えられ、多くの結合分子(DISC1 interactome)が知られている[18][19]。これらの結合分子の探索がDISC1の機能の解明に大きな役割を果たしてきた(表2、図2)。
| 分子名 | DISC1上の結合部位 [アミノ酸残基] |
参考文献 |
| Nuclear distribution element-like 1 (NDEL1/NUDEL) | 802-835 | [13][20][21][6][22] |
| 微小管結合タンパク質1A (Microtubule-associated protein 1A; MAP1A) | 1-293 | [20] |
| Fasciculation and elongation protein zeta-1 (FEZ) | 446-633 | [23] |
| Kendrin/pericentrin-B | 446-533 | [24] |
| ホスホジエステラーゼ (phosphodiesterase type 4, PDE4) | 190-230、611-650など | [7][25] |
| キネシン1重鎖 | 341-400 | [26] |
| Growth factor receptor bound protein (Grb2) | 730-733, 731-734 | [27] |
| Bardet-Biedl syndrome protein (BBS)1、 BBS4、BBS8 | 394-600 | [28][29] |
| Pericentriolar material 1 (PCM1) | 1-348, 601-854 | [28] |
| グリコーゲン合成酵素キナーゼ3β (Glycogen synthase kinase 3β, GSK3β) | 1-220、356-595 | [30] |
| Girdin/KIAA1212 | 1-361 | [31][32] |
| Kalirin-7 (KAL7) | 350-394 | [33] |
| DIX domain containing 1 (DIXDC1) | 592-852 | [34] |
| TRAF2- and NCK- interacting protein kinase (TNIK) | 335-347 | [35] |
発現
組織分布
DISC1のmRNAは成体において、脳に加えて、心臓、胎盤、膵臓などに発現している[2]。成熟マウスでは、Disc1のmRNAは脳内に広く分布しており、海馬、小脳、大脳新皮質、嗅球にも発現が見られる[12]。発生段階のマウスの脳において、DISC1の免疫反応は大脳皮質、嗅球[36]や海馬[37]に認められる。脳のなかで、DISC1は神経細胞のみならず、アストロサイト、オリゴデンドロサイト、ミクログリアといったグリア系の細胞でも発現している[38][39][40]。
細胞内局在
DISC1は、発達段階の神経細胞において、NDEL1/NUDEL、Lissencephaly 1(LIS1)、14-3-3、dynactin、kendrinなどと結合/複合体を形成して、中心体(centrosome、microtubule-organizing center(MTOC)としても知られる)や微小管(microtubule)に存在する[20][24][6]。また、キネシン-1、Grb2と結合して軸索内を成長円錐(growth cone)に運ばれる[26][27]。
より成熟した神経細胞において、DISC1はPSD-95/カリリン-7と複合体を作り、シナプスに存在している[33]。シナプスではPDE4やTNIKとも結合する[7][35]。DISC1は興奮性のシナプスとともに、抑制性のシナプスにも局在する[41]。
DISC1のN末には核移行シグナル(nuclear localization signal、NLS)モチーフが存在し、少なくともDISC1の一部は核内に存在する[42]。DISC1のミトコンドリアへの局在も報告されている[43][44][45]。
機能
DISC1の結合タンパク質や発現・細胞内局在から示されるように、DISC1は神経系において多彩な機能を有していると考えられる。なかでも代表的な機能として、神経発達とシナプスの制御が挙げられる[19][9][46]。
上記の細胞内局在のうち、中心体や微小管、成長円錐への局在は、神経細胞の増殖や移動、樹状突起形成、軸索伸長といった、DISC1の神経発生過程での機能を示唆する。実際に、発達段階でのDISC1の機能阻害により、神経細胞の増殖の低下/早熟な神経への分化[30][29]、大脳新皮質[6][47][48]と海馬[49][50]の神経細胞移動の遅れ、樹状突起形成の障害[51]、軸索伸長の障害[23][13][26][27]が起きることが報告されている。ただし、成体での海馬歯状回における、新生神経細胞については、DISC1の機能阻害により、むしろ神経細胞の過剰な移動が生じる[52][31][32]。この過剰な移動は神経細胞層への組み込み(integration)の阻害を反映する可能性もある[52]。
また、シナプスへの局在やシナプス関連分子との結合から、DISC1はシナプスの維持や制御に関わると考えられている。DISC1の機能阻害により、短期的には樹状突起スパインの数と大きさが増加し、長期的にはスパインが小さくなる[33]。この際、DISC1は、カリリン-7(Rac1のGDP/GTP exchange factor、GEF)と結合してNMDA型グルタミン酸受容体の活性化によって起きるRac1の活性化を調節してシナプスを制御する。DISC1はTNIKとの結合によってもシナプスの維持に関わると考えられている[35]。
DISC1の修飾と機能への影響
他の分子との結合の調節に、DISC1の翻訳後修飾が関与することがある。例えば、マウスDISC1の710番目のセリン(S710、ヒトDISC1の713番目のセリンに相当)のリン酸化によって、結合分子が変化する[29]。増殖中の神経前駆細胞において、S710がリン酸化されていないときは、DISC1はGSK3βに結合してGSK3βの活性を抑制する。一方、分裂後の神経細胞において、S710がリン酸化されると、DISC1はBBS1に結合して中心体や微小管に分布し、神経細胞移動に関わる。このように、DISC1のリン酸化の制御によって、前駆細胞の分裂から神経細胞移動へ、発生段階のスイッチが行われると考えられる[29]。
関連語
参考文献
- ↑
St Clair, D., Blackwood, D., Muir, W., Carothers, A., Walker, M., Spowart, G., ..., & Evans, H.J. (1990).
Association within a family of a balanced autosomal translocation with major mental illness. Lancet (London, England), 336(8706), 13-6. [PubMed:1973210] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3
Millar, J.K., Wilson-Annan, J.C., Anderson, S., Christie, S., Taylor, M.S., Semple, C.A., ..., & Porteous, D.J. (2000).
Disruption of two novel genes by a translocation co-segregating with schizophrenia. Human molecular genetics, 9(9), 1415-23. [PubMed:10814723] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3
Blackwood, D.H., Fordyce, A., Walker, M.T., St Clair, D.M., Porteous, D.J., & Muir, W.J. (2001).
Schizophrenia and affective disorders--cosegregation with a translocation at chromosome 1q42 that directly disrupts brain-expressed genes: clinical and P300 findings in a family. American journal of human genetics, 69(2), 428-33. [PubMed:11443544] [PMC] [WorldCat] [DOI] - ↑
Nakata, K., Lipska, B.K., Hyde, T.M., Ye, T., Newburn, E.N., Morita, Y., ..., & Kleinman, J.E. (2009).
DISC1 splice variants are upregulated in schizophrenia and associated with risk polymorphisms. Proceedings of the National Academy of Sciences of the United States of America, 106(37), 15873-8. [PubMed:19805229] [PMC] [WorldCat] [DOI] - ↑
Soares, D.C., Carlyle, B.C., Bradshaw, N.J., & Porteous, D.J. (2011).
DISC1: Structure, Function, and Therapeutic Potential for Major Mental Illness. ACS chemical neuroscience, 2(11), 609-632. [PubMed:22116789] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3 6.4
Kamiya, A., Kubo, K., Tomoda, T., Takaki, M., Youn, R., Ozeki, Y., ..., & Sawa, A. (2005).
A schizophrenia-associated mutation of DISC1 perturbs cerebral cortex development. Nature cell biology, 7(12), 1167-78. [PubMed:16299498] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Millar, J.K., Pickard, B.S., Mackie, S., James, R., Christie, S., Buchanan, S.R., ..., & Porteous, D.J. (2005).
DISC1 and PDE4B are interacting genetic factors in schizophrenia that regulate cAMP signaling. Science (New York, N.Y.), 310(5751), 1187-91. [PubMed:16293762] [WorldCat] [DOI] - ↑
Zhou, X., Chen, Q., Schaukowitch, K., Kelsoe, J.R., & Geyer, M.A. (2010).
Insoluble DISC1-Boymaw fusion proteins generated by DISC1 translocation. Molecular psychiatry, 15(7), 669-72. [PubMed:20351725] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Brandon, N.J., & Sawa, A. (2011).
Linking neurodevelopmental and synaptic theories of mental illness through DISC1. Nature reviews. Neuroscience, 12(12), 707-22. [PubMed:22095064] [PMC] [WorldCat] [DOI] - ↑
Eykelenboom, J.E., Briggs, G.J., Bradshaw, N.J., Soares, D.C., Ogawa, F., Christie, S., ..., & Millar, J.K. (2012).
A t(1;11) translocation linked to schizophrenia and affective disorders gives rise to aberrant chimeric DISC1 transcripts that encode structurally altered, deleterious mitochondrial proteins. Human molecular genetics, 21(15), 3374-86. [PubMed:22547224] [PMC] [WorldCat] [DOI] - ↑
Leliveld, S.R., Hendriks, P., Michel, M., Sajnani, G., Bader, V., Trossbach, S., ..., & Korth, C. (2009).
Oligomer assembly of the C-terminal DISC1 domain (640-854) is controlled by self-association motifs and disease-associated polymorphism S704C. Biochemistry, 48(32), 7746-55. [PubMed:19583211] [WorldCat] [DOI] - ↑ 12.0 12.1
Ma, L., Liu, Y., Ky, B., Shughrue, P.J., Austin, C.P., & Morris, J.A. (2002).
Cloning and characterization of Disc1, the mouse ortholog of DISC1 (Disrupted-in-Schizophrenia 1). Genomics, 80(6), 662-72. [PubMed:12504857] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Ozeki, Y., Tomoda, T., Kleiderlein, J., Kamiya, A., Bord, L., Fujii, K., ..., & Sawa, A. (2003).
Disrupted-in-Schizophrenia-1 (DISC-1): mutant truncation prevents binding to NudE-like (NUDEL) and inhibits neurite outgrowth. Proceedings of the National Academy of Sciences of the United States of America, 100(1), 289-94. [PubMed:12506198] [PMC] [WorldCat] [DOI] - ↑
Koike, H., Arguello, P.A., Kvajo, M., Karayiorgou, M., & Gogos, J.A. (2006).
Disc1 is mutated in the 129S6/SvEv strain and modulates working memory in mice. Proceedings of the National Academy of Sciences of the United States of America, 103(10), 3693-7. [PubMed:16484369] [PMC] [WorldCat] [DOI] - ↑
Clapcote, S.J., & Roder, J.C. (2006).
Deletion polymorphism of Disc1 is common to all 129 mouse substrains: implications for gene-targeting studies of brain function. Genetics, 173(4), 2407-10. [PubMed:16751659] [PMC] [WorldCat] [DOI] - ↑
Kuroda, K., Yamada, S., Tanaka, M., Iizuka, M., Yano, H., Mori, D., ..., & Kaibuchi, K. (2011).
Behavioral alterations associated with targeted disruption of exons 2 and 3 of the Disc1 gene in the mouse. Human molecular genetics, 20(23), 4666-83. [PubMed:21903668] [WorldCat] [DOI] - ↑
Ishizuka, K., Chen, J., Taya, S., Li, W., Millar, J.K., Xu, Y., ..., & Sawa, A. (2007).
Evidence that many of the DISC1 isoforms in C57BL/6J mice are also expressed in 129S6/SvEv mice. Molecular psychiatry, 12(10), 897-9. [PubMed:17895924] [WorldCat] [DOI] - ↑
Camargo, L.M., Collura, V., Rain, J.C., Mizuguchi, K., Hermjakob, H., Kerrien, S., ..., & Brandon, N.J. (2007).
Disrupted in Schizophrenia 1 Interactome: evidence for the close connectivity of risk genes and a potential synaptic basis for schizophrenia. Molecular psychiatry, 12(1), 74-86. [PubMed:17043677] [WorldCat] [DOI] - ↑ 19.0 19.1
Porteous, D.J., Millar, J.K., Brandon, N.J., & Sawa, A. (2011).
DISC1 at 10: connecting psychiatric genetics and neuroscience. Trends in molecular medicine, 17(12), 699-706. [PubMed:22015021] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1 20.2
Morris, J.A., Kandpal, G., Ma, L., & Austin, C.P. (2003).
DISC1 (Disrupted-In-Schizophrenia 1) is a centrosome-associated protein that interacts with MAP1A, MIPT3, ATF4/5 and NUDEL: regulation and loss of interaction with mutation. Human molecular genetics, 12(13), 1591-608. [PubMed:12812986] [WorldCat] [DOI] - ↑
Brandon, N.J., Handford, E.J., Schurov, I., Rain, J.C., Pelling, M., Duran-Jimeniz, B., ..., & Whiting, P.J. (2004).
Disrupted in Schizophrenia 1 and Nudel form a neurodevelopmentally regulated protein complex: implications for schizophrenia and other major neurological disorders. Molecular and cellular neurosciences, 25(1), 42-55. [PubMed:14962739] [WorldCat] [DOI] - ↑
Kamiya, A., Tomoda, T., Chang, J., Takaki, M., Zhan, C., Morita, M., ..., & Sawa, A. (2006).
DISC1-NDEL1/NUDEL protein interaction, an essential component for neurite outgrowth, is modulated by genetic variations of DISC1. Human molecular genetics, 15(22), 3313-23. [PubMed:17035248] [WorldCat] [DOI] - ↑ 23.0 23.1
Miyoshi, K., Honda, A., Baba, K., Taniguchi, M., Oono, K., Fujita, T., ..., & Tohyama, M. (2003).
Disrupted-In-Schizophrenia 1, a candidate gene for schizophrenia, participates in neurite outgrowth. Molecular psychiatry, 8(7), 685-94. [PubMed:12874605] [WorldCat] [DOI] - ↑ 24.0 24.1
Miyoshi, K., Asanuma, M., Miyazaki, I., Diaz-Corrales, F.J., Katayama, T., Tohyama, M., & Ogawa, N. (2004).
DISC1 localizes to the centrosome by binding to kendrin. Biochemical and biophysical research communications, 317(4), 1195-9. [PubMed:15094396] [WorldCat] [DOI] - ↑
Murdoch, H., Mackie, S., Collins, D.M., Hill, E.V., Bolger, G.B., Klussmann, E., ..., & Houslay, M.D. (2007).
Isoform-selective susceptibility of DISC1/phosphodiesterase-4 complexes to dissociation by elevated intracellular cAMP levels. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(35), 9513-24. [PubMed:17728464] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1 26.2
Taya, S., Shinoda, T., Tsuboi, D., Asaki, J., Nagai, K., Hikita, T., ..., & Kaibuchi, K. (2007).
DISC1 regulates the transport of the NUDEL/LIS1/14-3-3epsilon complex through kinesin-1. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(1), 15-26. [PubMed:17202468] [PMC] [WorldCat] [DOI] - ↑ 27.0 27.1 27.2
Shinoda, T., Taya, S., Tsuboi, D., Hikita, T., Matsuzawa, R., Kuroda, S., ..., & Kaibuchi, K. (2007).
DISC1 regulates neurotrophin-induced axon elongation via interaction with Grb2. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(1), 4-14. [PubMed:17202467] [PMC] [WorldCat] [DOI] - ↑ 28.0 28.1
Kamiya, A., Tan, P.L., Kubo, K., Engelhard, C., Ishizuka, K., Kubo, A., ..., & Sawa, A. (2008).
Recruitment of PCM1 to the centrosome by the cooperative action of DISC1 and BBS4: a candidate for psychiatric illnesses. Archives of general psychiatry, 65(9), 996-1006. [PubMed:18762586] [PMC] [WorldCat] [DOI] - ↑ 29.0 29.1 29.2 29.3
Ishizuka, K., Kamiya, A., Oh, E.C., Kanki, H., Seshadri, S., Robinson, J.F., ..., & Sawa, A. (2011).
DISC1-dependent switch from progenitor proliferation to migration in the developing cortex. Nature, 473(7345), 92-6. [PubMed:21471969] [PMC] [WorldCat] [DOI] - ↑ 30.0 30.1
Mao, Y., Ge, X., Frank, C.L., Madison, J.M., Koehler, A.N., Doud, M.K., ..., & Tsai, L.H. (2009).
Disrupted in schizophrenia 1 regulates neuronal progenitor proliferation via modulation of GSK3beta/beta-catenin signaling. Cell, 136(6), 1017-31. [PubMed:19303846] [PMC] [WorldCat] [DOI] - ↑ 31.0 31.1
Enomoto, A., Asai, N., Namba, T., Wang, Y., Kato, T., Tanaka, M., ..., & Takahashi, M. (2009).
Roles of disrupted-in-schizophrenia 1-interacting protein girdin in postnatal development of the dentate gyrus. Neuron, 63(6), 774-87. [PubMed:19778507] [WorldCat] [DOI] - ↑ 32.0 32.1
Kim, J.Y., Duan, X., Liu, C.Y., Jang, M.H., Guo, J.U., Pow-anpongkul, N., ..., & Ming, G.L. (2009).
DISC1 regulates new neuron development in the adult brain via modulation of AKT-mTOR signaling through KIAA1212. Neuron, 63(6), 761-73. [PubMed:19778506] [PMC] [WorldCat] [DOI] - ↑ 33.0 33.1 33.2
Hayashi-Takagi, A., Takaki, M., Graziane, N., Seshadri, S., Murdoch, H., Dunlop, A.J., ..., & Sawa, A. (2010).
Disrupted-in-Schizophrenia 1 (DISC1) regulates spines of the glutamate synapse via Rac1. Nature neuroscience, 13(3), 327-32. [PubMed:20139976] [PMC] [WorldCat] [DOI] - ↑
Singh, K.K., Ge, X., Mao, Y., Drane, L., Meletis, K., Samuels, B.A., & Tsai, L.H. (2010).
Dixdc1 is a critical regulator of DISC1 and embryonic cortical development. Neuron, 67(1), 33-48. [PubMed:20624590] [PMC] [WorldCat] [DOI] - ↑ 35.0 35.1 35.2
Wang, Q., Charych, E.I., Pulito, V.L., Lee, J.B., Graziane, N.M., Crozier, R.A., ..., & Brandon, N.J. (2011).
The psychiatric disease risk factors DISC1 and TNIK interact to regulate synapse composition and function. Molecular psychiatry, 16(10), 1006-23. [PubMed:20838393] [PMC] [WorldCat] [DOI] - ↑
Schurov, I.L., Handford, E.J., Brandon, N.J., & Whiting, P.J. (2004).
Expression of disrupted in schizophrenia 1 (DISC1) protein in the adult and developing mouse brain indicates its role in neurodevelopment. Molecular psychiatry, 9(12), 1100-10. [PubMed:15381924] [WorldCat] [DOI] - ↑
Meyer, K.D., & Morris, J.A. (2008).
Immunohistochemical analysis of Disc1 expression in the developing and adult hippocampus. Gene expression patterns : GEP, 8(7-8), 494-501. [PubMed:18620078] [WorldCat] [DOI] - ↑
Seshadri, S., Kamiya, A., Yokota, Y., Prikulis, I., Kano, S., Hayashi-Takagi, A., ..., & Sawa, A. (2010).
Disrupted-in-Schizophrenia-1 expression is regulated by beta-site amyloid precursor protein cleaving enzyme-1-neuregulin cascade. Proceedings of the National Academy of Sciences of the United States of America, 107(12), 5622-7. [PubMed:20212127] [PMC] [WorldCat] [DOI] - ↑
Katsel, P., Tan, W., Abazyan, B., Davis, K.L., Ross, C., Pletnikov, M.V., & Haroutunian, V. (2011).
Expression of mutant human DISC1 in mice supports abnormalities in differentiation of oligodendrocytes. Schizophrenia research, 130(1-3), 238-49. [PubMed:21605958] [PMC] [WorldCat] [DOI] - ↑
Ma, T.M., Abazyan, S., Abazyan, B., Nomura, J., Yang, C., Seshadri, S., ..., & Pletnikov, M.V. (2013).
Pathogenic disruption of DISC1-serine racemase binding elicits schizophrenia-like behavior via D-serine depletion. Molecular psychiatry, 18(5), 557-67. [PubMed:22801410] [PMC] [WorldCat] [DOI] - ↑
Kirkpatrick, B., Xu, L., Cascella, N., Ozeki, Y., Sawa, A., & Roberts, R.C. (2006).
DISC1 immunoreactivity at the light and ultrastructural level in the human neocortex. The Journal of comparative neurology, 497(3), 436-50. [PubMed:16736468] [WorldCat] [DOI] - ↑
Sawamura, N., Ando, T., Maruyama, Y., Fujimuro, M., Mochizuki, H., Honjo, K., ..., & Sawa, A. (2008).
Nuclear DISC1 regulates CRE-mediated gene transcription and sleep homeostasis in the fruit fly. Molecular psychiatry, 13(12), 1138-48, 1069. [PubMed:18762802] [PMC] [WorldCat] [DOI] - ↑
James, R., Adams, R.R., Christie, S., Buchanan, S.R., Porteous, D.J., & Millar, J.K. (2004).
Disrupted in Schizophrenia 1 (DISC1) is a multicompartmentalized protein that predominantly localizes to mitochondria. Molecular and cellular neurosciences, 26(1), 112-22. [PubMed:15121183] [WorldCat] [DOI] - ↑
Brandon, N.J., Schurov, I., Camargo, L.M., Handford, E.J., Duran-Jimeniz, B., Hunt, P., ..., & Whiting, P.J. (2005).
Subcellular targeting of DISC1 is dependent on a domain independent from the Nudel binding site. Molecular and cellular neurosciences, 28(4), 613-24. [PubMed:15797709] [WorldCat] [DOI] - ↑
Park, Y.U., Jeong, J., Lee, H., Mun, J.Y., Kim, J.H., Lee, J.S., ..., & Park, S.K. (2010).
Disrupted-in-schizophrenia 1 (DISC1) plays essential roles in mitochondria in collaboration with Mitofilin. Proceedings of the National Academy of Sciences of the United States of America, 107(41), 17785-90. [PubMed:20880836] [PMC] [WorldCat] [DOI] - ↑
Narayan, S., Nakajima, K., & Sawa, A. (2013).
DISC1: a key lead in studying cortical development and associated brain disorders. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry, 19(5), 451-64. [PubMed:23300216] [PMC] [WorldCat] [DOI] - ↑
Kubo, K., Tomita, K., Uto, A., Kuroda, K., Seshadri, S., Cohen, J., ..., & Nakajima, K. (2010).
Migration defects by DISC1 knockdown in C57BL/6, 129X1/SvJ, and ICR strains via in utero gene transfer and virus-mediated RNAi. Biochemical and biophysical research communications, 400(4), 631-7. [PubMed:20807500] [PMC] [WorldCat] [DOI] - ↑
Singh, K.K., De Rienzo, G., Drane, L., Mao, Y., Flood, Z., Madison, J., ..., & Tsai, L.H. (2011).
Common DISC1 polymorphisms disrupt Wnt/GSK3β signaling and brain development. Neuron, 72(4), 545-58. [PubMed:22099458] [PMC] [WorldCat] [DOI] - ↑
Meyer, K.D., & Morris, J.A. (2009).
Disc1 regulates granule cell migration in the developing hippocampus. Human molecular genetics, 18(17), 3286-97. [PubMed:19502360] [PMC] [WorldCat] [DOI] - ↑
Tomita, K., Kubo, K., Ishii, K., & Nakajima, K. (2011).
Disrupted-in-Schizophrenia-1 (Disc1) is necessary for migration of the pyramidal neurons during mouse hippocampal development. Human molecular genetics, 20(14), 2834-45. [PubMed:21540240] [WorldCat] [DOI] - ↑
Niwa, M., Kamiya, A., Murai, R., Kubo, K., Gruber, A.J., Tomita, K., ..., & Nabeshima, T. (2010).
Knockdown of DISC1 by in utero gene transfer disturbs postnatal dopaminergic maturation in the frontal cortex and leads to adult behavioral deficits. Neuron, 65(4), 480-9. [PubMed:20188653] [PMC] [WorldCat] [DOI] - ↑ 52.0 52.1
Duan, X., Chang, J.H., Ge, S., Faulkner, R.L., Kim, J.Y., Kitabatake, Y., ..., & Song, H. (2007).
Disrupted-In-Schizophrenia 1 regulates integration of newly generated neurons in the adult brain. Cell, 130(6), 1146-58. [PubMed:17825401] [PMC] [WorldCat] [DOI]