(4人の利用者による、間の29版が非表示) 2行目:
2行目: <font size="+1">山崎 世和</font><br>
<font size="+1">山崎 世和</font><br>
''イェール大学''<br>
''イェール大学''<br>
DOI:<selfdoi /> 原稿受付日:2016年1月22日 原稿完成日:2016年3月4日<br>
DOI:<selfdoi /> 原稿受付日:2016年1月22日 原稿完成日:2016年月日 <br>
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br>
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br>
</div>
</div>
13行目:
13行目: {{box|text=
{{box|text=
コーニションは酵母から哺乳類まで保存されているタンパク質ファミリーである<ref name=ref1><pubmed>16396907</pubmed></ref>。その一部は、イオンチャネル型のグルタミン酸受容体と特異的に結合し、補助サブユニットとしてチャネル活性や細胞膜発現を制御すると考えられている。哺乳類CNIH2/3はAMPA型グルタミン酸受容体と結合しチャネル活性を制御することが<ref name=ref2><pubmed> 19265014</pubmed></ref> <ref name=ref3><pubmed>23522044</pubmed></ref>、線虫ホモログのCNI-1は グルタミン酸受容体GLR-1の局在を調整することが報告されている<ref name=ref4><pubmed>24094107</pubmed></ref>。
Cornichon、Cornichon homolog (CNIH)は酵母から哺乳類まで保存されているタンパク質ファミリーである <ref name=ref1><pubmed></pubmed></ref>。その一部は、イオンチャネル型のグルタミン酸受容体と特異的に結合し、補助サブユニットとしてチャネル活性や細胞膜発現を制御すると考えられている。哺乳類CNIH2/3はAMPA型グルタミン酸受容体と結合しチャネル活性を制御することが<ref name=ref2><pubmed></pubmed></ref> <ref name=ref3><pubmed></pubmed></ref>、線虫ホモログのCNI-1は グルタミン酸受容体GLR-1の局在を調整することが報告されている<ref name=ref4><pubmed></pubmed></ref>。
}}
{{GNF_Protein_box
| Name = Cornichon family AMPA receptor auxiliary protein 1
| image =
| image_source =
| PDB =
| HGNCid = 19431
| MGIid = 1277202
| Symbol = CNIH1
| AltSymbols =; CNIH; CNIH-1; CNIL; TGAM77
| IUPHAR =
| ChEMBL =
| OMIM = 611287
| ECnumber =
| Homologene = 4219
| GeneAtlas_image1 = PBB_GE_CNIH_201653_at_tn.png
| GeneAtlas_image2 =
| GeneAtlas_image3 =
| Protein_domain_image =
| Function =
| Component = {{GNF_GO|id=GO:0000139 |text = Golgi membrane}} {{GNF_GO|id=GO:0005789 |text = endoplasmic reticulum membrane}} {{GNF_GO|id=GO:0016021 |text = integral component of membrane}}
| Process = {{GNF_GO|id=GO:0006955 |text = immune response}} {{GNF_GO|id=GO:0007165 |text = signal transduction}} {{GNF_GO|id=GO:0016192 |text = vesicle-mediated transport}} {{GNF_GO|id=GO:0035556 |text = intracellular signal transduction}}
| Hs_EntrezGene = 10175
| Hs_Ensembl = ENSG00000100528
| Hs_RefseqmRNA = NM_001009551
| Hs_RefseqProtein = NP_005767
| Hs_GenLoc_db = hg38
| Hs_GenLoc_chr = 14
| Hs_GenLoc_start = 54423560
| Hs_GenLoc_end = 54441431
| Hs_Uniprot = O95406
| Mm_EntrezGene = 12793
| Mm_Ensembl = ENSMUSG00000015759
| Mm_RefseqmRNA = NM_009919
| Mm_RefseqProtein = NP_034049
| Mm_GenLoc_db = mm10
| Mm_GenLoc_chr = 14
| Mm_GenLoc_start = 46775582
| Mm_GenLoc_end = 46788411
| Mm_Uniprot = O35372
| path = PBB/10175
}}
{{GNF_Protein_box
| Name = Cornichon family AMPA receptor auxiliary protein 2
| image =
| image_source =
| PDB =
| HGNCid = 28744
| MGIid =
| Symbol = CNIH2
| AltSymbols =; CNIH-2; Cnil
| IUPHAR =
| ChEMBL =
| OMIM = 611288
| ECnumber =
| Homologene =
| GeneAtlas_image1 =
| GeneAtlas_image2 =
| GeneAtlas_image3 =
| Protein_domain_image =
| Function = {{GNF_GO|id=GO:0005515 |text = protein binding}}
| Component = {{GNF_GO|id=GO:0000139 |text = Golgi membrane}} {{GNF_GO|id=GO:0005789 |text = endoplasmic reticulum membrane}} {{GNF_GO|id=GO:0012507 |text = ER to Golgi transport vesicle membrane}} {{GNF_GO|id=GO:0014069 |text = postsynaptic density}} {{GNF_GO|id=GO:0030054 |text = cell junction}} {{GNF_GO|id=GO:0030425 |text = dendrite}} {{GNF_GO|id=GO:0032281 |text = AMPA glutamate receptor complex}} {{GNF_GO|id=GO:0033116 |text = endoplasmic reticulum-Golgi intermediate compartment membrane}} {{GNF_GO|id=GO:0043197 |text = dendritic spine}} {{GNF_GO|id=GO:0043198 |text = dendritic shaft}} {{GNF_GO|id=GO:0045211 |text = postsynaptic membrane}}
| Process = {{GNF_GO|id=GO:0006888 |text = ER to Golgi vesicle-mediated transport}} {{GNF_GO|id=GO:0018279 |text = protein N-linked glycosylation via asparagine}} {{GNF_GO|id=GO:0035249 |text = synaptic transmission, glutamatergic}} {{GNF_GO|id=GO:0035556 |text = intracellular signal transduction}} {{GNF_GO|id=GO:0042391 |text = regulation of membrane potential}} {{GNF_GO|id=GO:0043687 |text = post-translational protein modification}} {{GNF_GO|id=GO:0044267 |text = cellular protein metabolic process}} {{GNF_GO|id=GO:0048208 |text = COPII vesicle coating}} {{GNF_GO|id=GO:0061024 |text = membrane organization}} {{GNF_GO|id=GO:1902684 |text = negative regulation of receptor localization to synapse}} {{GNF_GO|id=GO:1903743 |text = negative regulation of anterograde synaptic vesicle transport}} {{GNF_GO|id=GO:2000310 |text = regulation of N-methyl-D-aspartate selective glutamate receptor activity}} {{GNF_GO|id=GO:2000311 |text = regulation of alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionate selective glutamate receptor activity}}
| Hs_EntrezGene = 254263
| Hs_Ensembl = ENSG00000174871
| Hs_RefseqmRNA = NM_182553
| Hs_RefseqProtein = NP_872359
| Hs_GenLoc_db = hg38
| Hs_GenLoc_chr = 11
| Hs_GenLoc_start = 66278190
| Hs_GenLoc_end = 66285301
| Hs_Uniprot = Q6PI25
| Mm_EntrezGene =
| Mm_Ensembl =
| Mm_RefseqmRNA =
| Mm_RefseqProtein =
| Mm_GenLoc_db =
| Mm_GenLoc_chr =
| Mm_GenLoc_start =
| Mm_GenLoc_end =
| Mm_Uniprot =
| path = PBB/254263
}}
{{GNF_Protein_box
| Name = Cornichon family AMPA receptor auxiliary protein 3
| image =
| image_source =
| PDB =
| HGNCid = 26802
| MGIid =
| Symbol = CNIH3
| AltSymbols =; CNIH-3
| IUPHAR =
| ChEMBL =
| OMIM = None
| ECnumber =
| Homologene =
| GeneAtlas_image1 =
| GeneAtlas_image2 =
| GeneAtlas_image3 =
| Protein_domain_image =
| Function = {{GNF_GO|id=GO:0016247 |text = channel regulator activity}}
| Component = {{GNF_GO|id=GO:0000139 |text = Golgi membrane}} {{GNF_GO|id=GO:0005789 |text = endoplasmic reticulum membrane}} {{GNF_GO|id=GO:0012507 |text = ER to Golgi transport vesicle membrane}} {{GNF_GO|id=GO:0030054 |text = cell junction}} {{GNF_GO|id=GO:0032281 |text = AMPA glutamate receptor complex}} {{GNF_GO|id=GO:0033116 |text = endoplasmic reticulum-Golgi intermediate compartment membrane}} {{GNF_GO|id=GO:0043198 |text = dendritic shaft}} {{GNF_GO|id=GO:0045211 |text = postsynaptic membrane}}
| Process = {{GNF_GO|id=GO:0006888 |text = ER to Golgi vesicle-mediated transport}} {{GNF_GO|id=GO:0018279 |text = protein N-linked glycosylation via asparagine}} {{GNF_GO|id=GO:0035249 |text = synaptic transmission, glutamatergic}} {{GNF_GO|id=GO:0035556 |text = intracellular signal transduction}} {{GNF_GO|id=GO:0042391 |text = regulation of membrane potential}} {{GNF_GO|id=GO:0043687 |text = post-translational protein modification}} {{GNF_GO|id=GO:0044267 |text = cellular protein metabolic process}} {{GNF_GO|id=GO:0048208 |text = COPII vesicle coating}} {{GNF_GO|id=GO:0061024 |text = membrane organization}} {{GNF_GO|id=GO:2000311 |text = regulation of alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionate selective glutamate receptor activity}}
| Hs_EntrezGene = 149111
| Hs_Ensembl = ENSG00000143786
| Hs_RefseqmRNA = NM_152495
| Hs_RefseqProtein = NP_689708
| Hs_GenLoc_db = hg38
| Hs_GenLoc_chr = 1
| Hs_GenLoc_start = 224434660
| Hs_GenLoc_end = 224740549
| Hs_Uniprot = Q8TBE1
| Mm_EntrezGene =
| Mm_Ensembl =
| Mm_RefseqmRNA =
| Mm_RefseqProtein =
| Mm_GenLoc_db =
| Mm_GenLoc_chr =
| Mm_GenLoc_start =
| Mm_GenLoc_end =
| Mm_Uniprot =
| path = PBB/149111
}}
{{GNF_Protein_box
| Name = Cornichon family AMPA receptor auxiliary protein 4
| image =
| image_source =
| PDB =
| HGNCid = 25013
| MGIid = 1925828
| Symbol = CNIH4
| AltSymbols =; CNIH-4; HSPC163
| IUPHAR =
| ChEMBL =
| OMIM =
| ECnumber =
| Homologene = 5932
| GeneAtlas_image1 = PBB_GE_CNIH4_218728_s_at_tn.png
| GeneAtlas_image2 =
| GeneAtlas_image3 =
| Protein_domain_image =
| Function = {{GNF_GO|id=GO:0005515 |text = protein binding}} {{GNF_GO|id=GO:0031730 |text = CCR5 chemokine receptor binding}}
| Component = {{GNF_GO|id=GO:0005783 |text = endoplasmic reticulum}} {{GNF_GO|id=GO:0005793 |text = endoplasmic reticulum-Golgi intermediate compartment}} {{GNF_GO|id=GO:0016021 |text = integral component of membrane}}
| Process = {{GNF_GO|id=GO:0006888 |text = ER to Golgi vesicle-mediated transport}} {{GNF_GO|id=GO:0015031 |text = protein transport}} {{GNF_GO|id=GO:0035556 |text = intracellular signal transduction}}
| Hs_EntrezGene = 29097
| Hs_Ensembl = ENSG00000143771
| Hs_RefseqmRNA = NM_001277197
| Hs_RefseqProtein = NP_001264126
| Hs_GenLoc_db = hg38
| Hs_GenLoc_chr = 1
| Hs_GenLoc_start = 224356850
| Hs_GenLoc_end = 224379459
| Hs_Uniprot = Q9P003
| Mm_EntrezGene = 98417
| Mm_Ensembl = ENSMUSG00000062169
| Mm_RefseqmRNA = NM_030131
| Mm_RefseqProtein = NP_084407
| Mm_GenLoc_db = mm10
| Mm_GenLoc_chr = 1
| Mm_GenLoc_start = 181144693
| Mm_GenLoc_end = 181168994
| Mm_Uniprot = Q9CX13
| path = PBB/29097
}}
}}
==イントロダクション==
==イントロダクション==
コーニションの[[ショウジョウバエ]]変異体は、[[gurken (grk)]](GRK、[[TGF様成長因子]])変異体と類似の卵軸形成異常を示す変異体として見出された<ref name=ref5><pubmed>2123463</pubmed></ref>。これらの変異体の卵は、[[背側付属器]](dorsal appendage)を欠損し長く伸びた形態を示す(gurkenはキュウリ(独)、cornichonはキュウリの漬物(仏)の意)。CNIはショウジョウバエにおいて小胞体からのGRKの搬出・分泌を制御する<ref name=ref1 />。
cornichon(cni)の [[ショウジョウバエ]]変異体は、gurken(grk、TGF様成長因子)変異体と類似の卵軸形成異常を示す変異体として見出された <ref name=ref5><pubmed></pubmed></ref>。これらの変異体の卵は、背足付属器(dorsal appendage)を欠損し長く伸びた形態を示す(gurkenはキュウリ(独)、cornichonはキュウリの漬物(仏)の意)。CNIはショウジョウバエにおいて小胞体からのGRKの搬出・ [[分泌 ]]を制御する <ref name=ref1 />。
一方で近年、哺乳類のCornichon homolog isoform 2/3(CNIH2/3)がイオンチャネル共役型の[[AMPA型グルタミン酸受容体]](AMPA受容体)の結合因子として同定された<ref name=ref2 />。
一方で近年、[[哺乳類]]のCornichon homolog isoform 2/3(CNIH2/3)が[[イオンチャネル]]共役型のAMPA型 [[グルタミン酸受容体 ]](AMPA受容体)の結合因子として同定された<ref name=ref2 />。
==構造==
==構造==
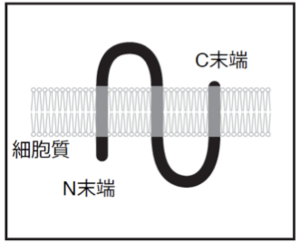
[[image:コーニション1.png|thumb|300px|'''図1.CNIH2の構造''']]
[[image:コーニション1.png|thumb|300px|'''図1.CNIH2の構造''']]
コーニションとそのホモログは3回膜貫通型タンパク質であり、N末端が細胞質側に突出した形をとっていると考えられている<ref name=ref1 />(TMHMM, TMpredによる膜貫通領域予測)。図1にCNIH2の模式図を示す。 CNIH2/3については、細胞外ループがAMPA受容体の機能制御に重要であることが報告されている<ref name=ref6><pubmed>21172611</pubmed></ref> <ref name=ref7><pubmed>25186755</pubmed></ref>。
Cornichonとそのホモログは3回膜貫通型タンパク質であり、N末端が細胞質側に突出した形をとっていると考えられている <ref name=ref1 />(TMHMM, TMpred)。図1にCNIH2の模式図を示す。
==ファミリー==
==ファミリー==
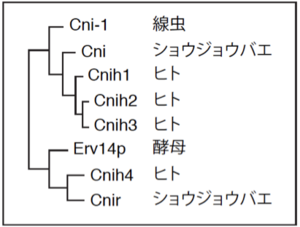
[[image:コーニション2.png|thumb|300px|'''図2.コーニションホモログの系統樹''']]
[[image:コーニション2.png|thumb|300px|'''図2.コーニションホモログの系統樹''']]
哺乳類においてはCNIH1-4の4つの分子が報告されている。ほかに、線虫ではコーニション-1(CNI-1)が1つ<ref name=ref4><pubmed>24094107</pubmed></ref>、ショウジョウバエではコーニション(CNI)とコーニション関連(CNIR)の2つが同定されており<ref name=ref1 />、[[酵母]]においてこれらと相同性の高い分子として[[Erv14p]]が知られている<ref name=ref8><pubmed>9732282</pubmed></ref>(図2)<ref name=ref1 />。
哺乳類においてはCNIH1-4の4つの分子が報告されている。ほかに、[[線虫]]ではCornichon -1(CNI-1)の1つ4、ショウジョウバエではCornichon(CNI)とCornichon related(CNIR)の2つが同定されており <ref name=ref1 />、酵母においてこれらと相同性の高い分子としてErv14pが知られている <ref name=ref6 ><pubmed></pubmed></ref>(図2)<ref name=ref1 />。
==分布==
==分布==
酵母、ショウジョウバエ、線虫、哺乳類において、蛍光タグなどとの融合タンパク質の発現によって、[[小胞体]]と[[ゴルジ体]] への局在が示されている<ref name=ref1 /> <ref name=ref4 /> <ref name=ref8 />。また線虫や哺乳類においてCNI-1、CNIH2/3は、細胞表面・[[シナプス]]へも局在することが示唆されており<ref name=ref4 /> <ref name=ref6><pubmed>21172611</pubmed></ref>、実際にCNIH2/3遺伝子欠損マウスがAMPA型グルタミン酸受容体のチャネル特性を変化させることから<ref name=ref3 />、CNIH2/3とAMPA型グルタミン酸受容体は細胞表面やシナプスにおいて共局在すると考えられている。ただし、内在性CNIH2/3が、脳内において小胞体・ゴルジ体・細胞表面・シナプスのどの部位に局在するのかは示されていない。
酵母、ショウジョウバエ、線虫、哺乳類において、蛍光タグなどとの融合タンパク質の発現によって、小胞体と [[ゴルジ体]] への局在が示されている<ref name=ref1 /> <ref name=ref4 /> <ref name=ref6 />。また線虫や哺乳類においてCNI-1、CNIH2/3は、細胞表面・[[シナプス]]へも局在することが示唆されており<ref name=ref4 /> <ref name=ref7 ><pubmed></pubmed></ref>、実際にCNIH2/3遺伝子欠損[[マウス]]がAMPA受容体のチャネル特性を変化させることから <ref name=ref3 />、CNIH2/3とAMPA受容体は細胞表面やシナプスにおいて共局在すると考えられている。ただし、内在性CNIH2 /3の脳内分子局在は示されていない。
組織レベルでは、 哺乳類ではCNIH2/3 [[mRNA]]が脳において、CNIH1 mRNAが末梢の様々な組織において<ref name=ref9><pubmed>10209299</pubmed></ref>発現することが、それぞれ[[ノザンブロット]]、[[in situハイブリダイザーション]]によって示されている(Allen Brain Atlas)。CNIH2については脳、特に[[海馬]]において強く発現していることがタンパク質レベルで示されており<ref name=ref6><pubmed>21172611</pubmed></ref>、これはin situハイブリダイザーションの結果と一致する 。また、内在性プロモーターを用いた[[トランスジェニック動物]]によって、[[wj:生殖細胞|生殖細胞]]系・[[wj:体細胞濾胞上皮|体細胞濾胞上皮]]・成体体細胞(ショウジョウバエ)<ref name=ref1 />、[[GLR-1]]陽性細胞を含む神経系の細胞(線虫)<ref name=ref4 />で発現が確認されている。
組織レベルでは、 哺乳類では内在性 [[mRNA]]の発現が、CNIH2/3は脳において、CNIH1は末梢の様々な組織において <ref name=ref8 ><pubmed></pubmed></ref>、それぞれ [[ノザンブロット]]、in situ hybridizationによって示されている(Allen Brain Atlas)。CNIH2については脳、特に[[海馬]]において強く発現していることがタンパク質レベルで示されており<ref name=ref9 ><pubmed></pubmed></ref>、これはin situ hybridizationの結果と一致する 。また、内在性 [[プロモーター ]]を用いた [[トランスジェニック動物 ]]によって、生殖細胞系・胚濾胞上皮細胞・成体体細胞(ショウジョウバエ) <ref name=ref1 />、GLR -1陽性細胞を含む神経系の細胞(線虫) <ref name=ref4 />で発現が確認されている。
==機能==
==機能==
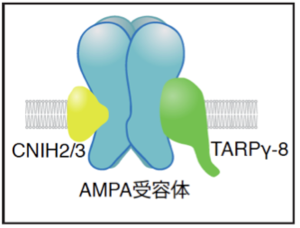
[[image:コーニション3.png|thumb|300px|'''図3.AMPA型グルタミン酸受容体機能複合体''']]
[[image:コーニション3.png|thumb|300px|'''図3.AMPA受容体機能複合体 ''']]
哺乳類においてCNIH2/3がAMPA型グルタミン酸受容体と直接結合し、補助サブユニットとして機能することが報告されている<ref name=ref3 /> <ref name=ref4 />。CNIH2/3は海馬に強く発現しており、別の補助サブユニット([[transmembrane AMPA receptor regulatory protein]] : [[TARP]])の海馬アイソフォームである[[TARPγ-8]]とともに図3のような3者AMPA型グルタミン酸受容体機能複合体を形成することで、チャネル特性や細胞表面発現などの生理機能を制御していると考えられている<ref name=ref3 /> <ref name=ref4 />。
哺乳類においてCNIH2/3がAMPA受容体と直接結合し、補助サブユニットとして機能することが報告されている <ref name=ref2 /> <ref name=ref3 />。CNIH2/3は海馬に強く発現しており、別の補助サブユニットTARP(Transmembrane AMPA receptor regulatory protein)の海馬アイソフォームであるTARPγ -8とともに図3のような3者AMPA受容体機能複合体を形成することで、チャネル特性や細胞表面発現などの生理機能を制御していると考えられている <ref name=ref3 /> <ref name=ref4 />。
一方、ショウジョウバエのcni変異体の卵は軸形成異常を示し、背足付属器が欠損し長く伸びた形態となる<ref name=ref5 />。この表現型はTGF様成長因子grkとその[[受容体]][[torpedo]]の変異体においても観察される<ref name=ref10><pubmed>3107840</pubmed></ref>。cni変異体ではGRKの局在・分泌に異常が見られることからCNIはGRKの小胞体からの搬出を制御していると考えられている<ref name=ref1 />。
一方、ショウジョウバエのcni変異体の卵は軸形成異常を示し、背足付属器が欠損し長く伸びた形態となる<ref name=ref5 />。この表現型はTGF様成長因子grkとその受容体torpedoの変異体においても観察される <ref name=ref10><pubmed></pubmed></ref>。cni変異体ではGRKの局在・分泌に異常が見られることからCNIはGRKの小胞体からの搬出を制御していると考えられている<ref name=ref1 />。
===CNIH2/3欠損マウス===
===CNIH2/3欠損マウス===
CNIH2/3の[[条件付き遺伝子欠損マウス]]が作出、解析されている<ref name=ref3 />。[[Cre]]組換え酵素発現[[AAV]]の導入、または[[NEX-Cre]]によってCNIH2を欠損した神経細胞は、AMPA型グルタミン酸受容体依存的シナプス後電流の振幅減少およびシナプス減衰速度短縮の表現型を示すことから、CNIH2はAMPA型グルタミン酸受容体のシナプスにおけるチャネル活性を制御することが明らかとなった。またCNIH2とCNIH3の同時欠損によってこれらの表現型が増強することから、CNIH2とCNIH3は相補的に機能していると考えられる。
CNIH2/3の条件付き遺伝子欠損マウスが作出、解析されている <ref name=ref3 />。Cre組換え酵素発現AAVの導入、またはNex -CreによってCNIH2を欠損した神経細胞は、AMPA受容体依存的シナプス後電流の振幅減少およびシナプス減衰速度短縮の表現型を示すことから、CNIH2はAMPA受容体のシナプスにおけるチャネル活性を制御することが明らかとなった。またCNIH2とCNIH3の同時欠損によってこれらの表現型が増強することから、CNIH2とCNIH3は相補的に機能していると考えられる。
===線虫cni-1変異体===
===線虫cni-1変異体===
線虫cni-1変異体は、個体の後方移動の頻度が増加する表現型を示し、これはグルタミン酸受容体を過剰刺激した時の表現型と一致する<ref name=ref4 />。実際、cni-1変異体ではシナプスに局在するGLR-1の量が増加し、グルタミン酸に対する神経細胞の応答が増強される<ref name=ref4 />。また線虫神経細胞への過剰発現や[[アフリカツメガエル]]卵母細胞を用いた実験で、CNI-1がGLR-1のシナプス発現量、細胞表面発現量を減少させることが明らかとなった<ref name=ref4 />。これらの結果から線虫においてはCNI-1がグルタミン酸受容体の細胞表面への発現を制御することで、神経細胞のグルタミン酸受容体依存的な興奮活性を調節していると考えられている。
線虫cni-1変異体は、個体の後方移動の頻度が増加する表現型を示し、これは[[グルタミン酸]]受容体を過剰刺激した時の表現型と一致する <ref name=ref4 />。実際、cni-1変異体ではシナプスに局在するGLR-1の量が増加し、グルタミン酸に対する神経細胞の応答が増強される<ref name=ref4 />。また線虫神経細胞への過剰発現や[[アフリカツメガエル]]卵母細胞を用いた実験で、CNI-1がGLR-1のシナプス発現量、細胞表面発現量を減少させることが明らかとなった<ref name=ref4 />。これらの結果から線虫においてはCNI-1がグルタミン酸受容体の細胞表面への発現を制御することで、神経細胞のグルタミン酸受容体依存的な興奮活性を調節していると考えられている。
===AMPA受容体とCNIH2/3の結合についての議論===
図3に示すように、海馬においてAMPA受容体機能複合体はAMPA受容体であるGluAサブユニット4量体、TARP、CNIHによって形成されている。AMPA受容体は、海馬においてGluA1/2のヘテロマー、GluA2/3のヘテロマーが主に存在する。Herringらのグループは野生型マウスの海馬でGluA2と免疫共沈降されるCNIH2/3がGluA1欠損マウスでは共沈降されなくなることから、CNIH2/3はGluA1と選択的に結合していると議論している<ref name=ref3 />。一方で、CNIH2/3の発現にはAMPA受容体との結合が必須であるにもかかわらずGluA1欠損マウスの海馬においてもCNIH2/3のタンパク発現が消失しないことから、GluA1以外のサブユニットもCNIH2/3に結合していると考えられている。実際、GluA2欠損マウスにおいてCNIH2/3のタンパク発現が減少するなど、GluA1と結合していないCNIH2/3の存在を支持する報告がなされている<ref name=ref11><pubmed>24853943</pubmed></ref>。
==関連項目==
==関連項目==
山崎 世和 イェール大学 柚崎 通介 (慶應義塾大学 医学部生理学)
同義語:コーニションホモログ
英語名: Cornichon, Cornichon homolog
英略称: CNI, CNIH
Cornichon、Cornichon homolog (CNIH)は酵母から哺乳類まで保存されているタンパク質ファミリーである[ 1] [ 2] [ 3] [ 4]
イントロダクション cornichon(cni)のショウジョウバエ 変異体は、gurken(grk、TGF様成長因子)変異体と類似の卵軸形成異常を示す変異体として見出された[ 5] 分泌 を制御する[ 1]
一方で近年、哺乳類 のCornichon homolog isoform 2/3(CNIH2/3)がイオンチャネル 共役型のAMPA型グルタミン酸受容体 (AMPA受容体)の結合因子として同定された[ 2]
構造 図1.CNIH2の構造 Cornichonとそのホモログは3回膜貫通型タンパク質であり、N末端が細胞質側に突出した形をとっていると考えられている[ 1]
ファミリー 図2.コーニションホモログの系統樹 哺乳類においてはCNIH1-4の4つの分子が報告されている。ほかに、線虫 ではCornichon-1(CNI-1)の1つ4、ショウジョウバエではCornichon(CNI)とCornichon related(CNIR)の2つが同定されており[ 1] [ 6] [ 1]
分布 酵母、ショウジョウバエ、線虫、哺乳類において、蛍光タグなどとの融合タンパク質の発現によって、小胞体とゴルジ体 への局在が示されている[ 1] [ 4] [ 6] シナプス へも局在することが示唆されており[ 4] [ 7] マウス がAMPA受容体のチャネル特性を変化させることから[ 3]
組織レベルでは、 哺乳類では内在性mRNA の発現が、CNIH2/3は脳において、CNIH1は末梢の様々な組織において[ 8] ノザンブロット 、in situ hybridizationによって示されている(Allen Brain Atlas)。CNIH2については脳、特に海馬 において強く発現していることがタンパク質レベルで示されており[ 9] プロモーター を用いたトランスジェニック動物 によって、生殖細胞系・胚濾胞上皮細胞・成体体細胞(ショウジョウバエ)[ 1] [ 4]
機能 図3.AMPA受容体機能複合体 哺乳類においてCNIH2/3がAMPA受容体と直接結合し、補助サブユニットとして機能することが報告されている[ 2] [ 3] [ 3] [ 4]
一方、ショウジョウバエのcni変異体の卵は軸形成異常を示し、背足付属器が欠損し長く伸びた形態となる[ 5] [ 10] [ 1]
CNIH2/3欠損マウス CNIH2/3の条件付き遺伝子欠損マウスが作出、解析されている[ 3]
線虫cni-1変異体 線虫cni-1変異体は、個体の後方移動の頻度が増加する表現型を示し、これはグルタミン酸 受容体を過剰刺激した時の表現型と一致する[ 4] [ 4] アフリカツメガエル 卵母細胞を用いた実験で、CNI-1がGLR-1のシナプス発現量、細胞表面発現量を減少させることが明らかとなった[ 4]
関連項目 参考文献