「SNAP-25」の版間の差分
細 →機能 |
細編集の要約なし |
||
| (3人の利用者による、間の14版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/coco 高橋 正身]</font><br> | <font size="+1">[http://researchmap.jp/coco 高橋 正身]</font><br> | ||
''北里大学医学部''<br> | ''北里大学医学部''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年1月29日 原稿完成日:2016年月日<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
英語名:SNAP-25 (synaptosomal-associated protein 25) | |||
{{box|text= | {{box|text= | ||
SNAP-25は脳や内分泌細胞に特異的に発現する206アミノ酸からなるタンパク質で、細胞膜に局在するt-SNAREタンパク質として細胞膜で起こる開口放出に不可欠な役割を果たしている。分子内に二つのSNAREモチーフを持ち、開口放出に不可欠なSNARE複合体を構成する4本のへリックスのうち、QbおよびQcの2本のへリックスを供出する。SNAP-25は開口放出による神経伝達物質や水溶性ホルモンの分泌に関わると共に、細胞膜へのタンパク質の組み込みや細胞膜の伸長などにも関与している。さらにイオンチャネルに結合し、その機能を調節する働きも持っている。SNAP-25の機能はリン酸化やパルミトイル化などの翻訳後修飾や、活性型Gタンパク質やシナプトタグミンなどの調節タンパク質の結合によって制御されている。SNAP-25の非翻訳領域の遺伝子変異と注意欠陥・多動性障害や統合失調症などとの関連が示されており、少なくとも一部はSNAP-25タンパク質の発現量の低下が原因である可能性が考えられる。さらに遺伝子改変マウスを用いた研究やヒト患者の解析から、てんかん発症との関わりも示されている。 | SNAP-25は脳や内分泌細胞に特異的に発現する206アミノ酸からなるタンパク質で、細胞膜に局在するt-SNAREタンパク質として細胞膜で起こる開口放出に不可欠な役割を果たしている。分子内に二つのSNAREモチーフを持ち、開口放出に不可欠なSNARE複合体を構成する4本のへリックスのうち、QbおよびQcの2本のへリックスを供出する。SNAP-25は開口放出による神経伝達物質や水溶性ホルモンの分泌に関わると共に、細胞膜へのタンパク質の組み込みや細胞膜の伸長などにも関与している。さらにイオンチャネルに結合し、その機能を調節する働きも持っている。SNAP-25の機能はリン酸化やパルミトイル化などの翻訳後修飾や、活性型Gタンパク質やシナプトタグミンなどの調節タンパク質の結合によって制御されている。SNAP-25の非翻訳領域の遺伝子変異と注意欠陥・多動性障害や統合失調症などとの関連が示されており、少なくとも一部はSNAP-25タンパク質の発現量の低下が原因である可能性が考えられる。さらに遺伝子改変マウスを用いた研究やヒト患者の解析から、てんかん発症との関わりも示されている。 | ||
}} | }} | ||
| 58行目: | 16行目: | ||
==イントロダクション== | ==イントロダクション== | ||
脳特異的に発現する遺伝子をスクリーニングする過程で、206アミノ酸からなり[[シナプス前膜]] | 脳特異的に発現する遺伝子をスクリーニングする過程で、206アミノ酸からなり[[シナプス前膜]]に局在する25kDaのタンパク質として同定され、synaptosomal-associated protein 25と命名された<ref name=ref1><pubmed></pubmed></ref>。一方SNAP-25は新規に合成され速い[[軸索]]流で運ばれる主要なタンパク質としても同定されている<ref name=ref2><pubmed></pubmed></ref>。CHO細胞を用いて[[ゴルジ]][[小胞輸送]]を研究していたRothmanらは、[[ゴルジ体]]の小胞輸送に必須なタンパク質であるNSF/αSNAP複合体に結合するタンパク質としてSNAP-25および[[シンタキシン]]1、VAMP-2を脳から単離しSNAP receptors (SNAREs) と名付けた<ref name=ref3><pubmed></pubmed></ref>。X線解析の結果これらSNAREタンパク質はそれぞれSNAREモチーフと呼ばれる構造を持ち、SNARE複合体を形成することが示された<ref name=ref4><pubmed></pubmed></ref>。SNAP-25がE型[[ボツリヌス毒素]]によって切断を受けるとSNARE複合体形成が阻害され[[開口放出]]機能が阻害されることや<ref name=ref5><pubmed></pubmed></ref>、SNAP-25の[[ノックアウトマウス]]では[[CA2|Ca2]]+誘発性の神経伝達物質放出が見られないことなどから<ref name=ref6><pubmed></pubmed></ref>、SNAP-25はシンタキシン1やVAMP-2と同様に開口放出による神経伝達物質放出に必須なタンパク質であると結論されている。さらにSNAP-25は開口放出による[[細胞膜]]へのタンパク質の組み込みや細胞膜の伸展のほか、Caチャネルへの直接結合を介したチャネル機能制御などにも関わっていると考えられている。 | ||
==サブファミリー== | ==サブファミリー== | ||
SNAP- | SNAP-25の[[翻訳]]領域は8つのエクソンから構成されるが、4億年前に起こった硬骨魚の出現初期にエクソン5の重複が起こり、SNAP-25aとSNAP-25bのスプライシングバリアントが作られた<ref name=ref7><pubmed></pubmed></ref>。SNAP-25のアミノ酸配列は良く保存されており、[[ヒト]]、[[マウス]]、ニワトリでは100%同一である。一方、軟骨魚類であるシビレエイ(Torpedo)および無[[脊椎動物]]である[[ショウジョウバエ]]のSNAP-25 はマウスのアミノ酸配列とそれぞれ81% および61% 同一である。SNAP-25の発現は神経系や内[[分泌]]細胞に特異的に見られるが<ref name=ref8><pubmed></pubmed></ref>、ユビキタスに発現するファミリー分子としてSNAP-23が見出されている<ref name=ref9><pubmed></pubmed></ref>。 | ||
これら3種類のアイソフォームはいずれも神経伝達物質放出を引き起こす機能を持っているが、SNAP-25bのみが[[ | これら3種類のアイソフォームはいずれも神経伝達物質放出を引き起こす機能を持っているが、SNAP-25bのみが[[シナプトタグミン]]1および2と結合してCa2+依存的に起こる同期した放出を引き起こすことができる<ref name=ref10><pubmed></pubmed></ref> <ref name=ref11><pubmed></pubmed></ref>。それに対してSNAP-23はシナプトタグミン7と結合し、持続的に起こる同期しない放出に関わることが示されている<ref name=ref12><pubmed></pubmed></ref>。SNAP-25aは進化の過程でSNAP-23とSNAP-25が分かれた後に作られている。SNAP-25aはSNAP-23と同様に同期した放出を引き起こすことはない点でSNAP-23と似ているが、脳においてSNAP-23とどのような機能的な違いを持っているかについては明らではない<ref name=ref8 />。 | ||
分子内に2つのSNAREモチーフを持つタンパク質としてSNAP-29<ref name=ref13><pubmed></pubmed></ref>とSNAP-47<ref name=ref14><pubmed></pubmed></ref>が知られている。これらのタンパク質は[[パルミトイル化]]されたシステイン残基を持っていない点でSNAP-25やSNAP-23とは異なるが、細胞内小胞輸送に関わる可能性が示唆されている。 | |||
==構造== | ==構造== | ||
SNAP-25およびSNAP- | SNAP-25およびSNAP-23はN末側およびC末側の2か所にSNAREモチーフを持っており、SNARE複合体形成時にはQcおよびQbの2本のへリックスを供出する<ref name=ref4 /> <ref name=ref15><pubmed></pubmed></ref> <ref name=ref16><pubmed></pubmed></ref>。シンタキシンやVAMP-2とは異なり細胞膜を貫通するへリックス構造は持っていないが、分子の中央部付近にパルミトイル化されたシステインクラスターを有しており、細胞膜に係留されている<ref name=ref2 /> <ref name=ref17><pubmed></pubmed></ref> <ref name=ref18><pubmed></pubmed></ref>。パルミトイル化はダイナミックに制御されており<ref name=ref19><pubmed></pubmed></ref>、パルミトイル化にはDHHC palmitoyl transferaseが、脱パルミトイル化にはpalmitoyl-protein thioesterase 1が関わっている<ref name=ref20><pubmed></pubmed></ref>。 | ||
SNAP-25のC末端付近のGln197-Arg198、Arg180-Ile181およびArg198-Ala199間のペプチド結合がA型(BoNT/A)、E型(BoNT/E)およびC型ボツリヌス毒素(BoNT/C)によって特異的に切断される。マウスのSNAP-23はBoNT/AやBoNT/Eで切断されるがヒトのSNAP-23は切断されない<ref name=ref21><pubmed></pubmed></ref>。SNAP-25がBoNT/Eで切断を受けると開口放出による神経伝達物質放出が抑制され、BoNT/AでC末が切断されると放出のCa2+依存性が変化する<ref name=ref22><pubmed></pubmed></ref> <ref name=ref23><pubmed></pubmed></ref>。これらのことからSNAP-25のC末端付近の構造はSNAP-25の機能にとって不可欠な役割を果たしていると考えられている。SNAP-25のC末端付近にあるArg198やLys201に変異を加えて正電荷を無くすと放出速度や放出頻度の低下が起こる<ref name=ref24><pubmed></pubmed></ref>。またSer187がプロテインキナーゼC(PKC)によってリン酸化されるとシンタキシンとの結合が強まり、Ca2+非依存的なシナプトタグミン1との結合が低下する<ref name=ref25><pubmed></pubmed></ref> <ref name=ref26><pubmed></pubmed></ref>。SNAP-25は[[cAMP依存性タンパク質キナーゼ]]([[PKA]])によってもThr138がリン酸化されるが、この場合にはシンタキシンおよびシナプトタグミン1との結合はいずれも抑制される<ref name=ref26 />。[[セロトニン]]などのメタボリックレセプターが活性化されると、開口放出による神経伝達物質放出が抑制されることが知られている。活性化型Gタンパク質であるGβγはSNAP-25と直接結合し、結合部位としてAsp99, Lys102, Arg198, Lys201を含む膜に近い部位と、Arg135、Arg136、Arg161、Arg142を含む2か所が同定され、セロトニンレセプターの活性化に伴う放出抑制にはC末端に近いArg198, Lys201へのGβγの結合が関与することが示されている<ref name=ref27><pubmed></pubmed></ref>。 | |||
SNAREタンパク質による神経伝達物質放出はCa2+[[イオン]]によって誘発され、その場合のCa2+センサーとしてはシナプトタグミンが同定されている<ref name=ref28><pubmed></pubmed></ref>。シナプトタグミン1との結合部位としてAsp51, Glu52, Glu55<ref name=ref29><pubmed></pubmed></ref>およびAsp172, Asp179, Asp186, Asp193<ref name=ref30><pubmed></pubmed></ref>が同定されている。いずれも変異を加えるとPC12細胞からの放出が抑制される。膜容量測定による時間分解能の良いアッセイではAsp51, Glu52, Glu55がCa2+依存性放出に必須でAsp172, Asp179, Asp186, Asp193はフュージョン誘発にあまり影響しないが、[[放出可能プール]](readily releasable pool)を少し減少させる ことが示されている<ref name=ref31><pubmed></pubmed></ref>。 | |||
SNAP-25結合タンパク質としてSnapinが同定されている。[[線虫]]([[C. elegans]] )を用いた研究ではSnapinはSNAP-25に結合してSNARE複合体を安定化させる役割を持つと考えられているが<ref name=ref32><pubmed></pubmed></ref>、SNAP-25上の結合部位は特定されていない。 | |||
==発現== | ==発現== | ||
SNAP-25は脳と内分泌細胞に発現するが<ref name=ref1 /> | SNAP-25は脳と内分泌細胞に発現するが<ref name=ref1 />[[外分泌]]細胞での発現は確認されていない。それに対しSNAP-23は脳を含めユビキタスに発現している<ref name=ref9 />。脳でのSNAP-25a、SNAP-25bおよびSNAP-23の局在は大きく異なっている。SNAP-25bは脳全体にわたって[[シナプス]]が豊富な部位に多く発現しているが、線維束にも見いだされている。それに対しSNAP-25aとSNAP-23は脳の特定の領域にかたよって発現している<ref name=ref8 />。SNAP-23の発現量は発達に伴いほとんど変化しないが、SNAP-25bは生後数週間に発現量が大きく増加する。それに対してSNAP-25aは生後の発達期に一時的に発現が高まる<ref name=ref8 />。SNAP-25は生後発達以降に重要な役割を果たしており、SNAP-25のノックアウトマウスは[[胎生期]]の発達には特に異常は認められていないが、出生直後に呼吸不全で死亡する<ref name=ref6 />。 | ||
==機能== | ==機能== | ||
SNAP-25はt- | SNAP-25はt-SNAREタンパク質として開口放出による神経伝達物質放出や水溶[[性ホルモン]]の分泌に不可欠な役割を果たしている<ref name=ref4 /> <ref name=ref15 /> <ref name=ref16 />。SNARE複合体形成に際しては、構成する4本のへリックスの中でQcおよびQbの2本のへリックスを供出する。SNAP-25がBoNT/Eで切断を受けると神経伝達物質放出が見られなくなることや<ref name=ref5 />、SNAP-25のKOマウスではCa2+誘発性の神経伝達物質放出が見られないこと<ref name=ref6 />、SNAP-25とsyntaxinを組み込んだリポゾームをVAMP-2を組み込んだリポゾームを混ぜるとリポゾーム同士の[[膜融合]]が起こることなどから<ref name=ref33><pubmed></pubmed></ref>、SNAP-25は開口放出による神経伝達物質放出に必須なタンパク質であると結論されている。SNAP-25は内分泌細胞にも発現し、水溶性ホルモン分泌に不可欠な役割を果たしている。 | ||
開口放出は小胞内の内容物を放出する以外にも、小胞膜上のタンパク質を細胞膜に組み込んだり、細胞膜を伸長させたりする機能も持っている。SNAP- | 開口放出は小胞内の内容物を放出する以外にも、小胞膜上のタンパク質を細胞膜に組み込んだり、細胞膜を伸長させたりする機能も持っている。SNAP-25は電位依存性のCaチャネルや[[アクアポリン]]などのチャネルタンパク質やNMDA型およびAMPA型[[グルタミン酸]]レセプターなどの細胞膜への組み込みに関与していることが示されている<ref name=ref34><pubmed></pubmed></ref> <ref name=ref35><pubmed></pubmed></ref> <ref name=ref36><pubmed></pubmed></ref> <ref name=ref37><pubmed></pubmed></ref> <ref name=ref38><pubmed></pubmed></ref> <ref name=ref39><pubmed></pubmed></ref> <ref name=ref40><pubmed></pubmed></ref> <ref name=ref41><pubmed></pubmed></ref>。さらにSNAP-25は[[成長円錐]]にも局在し、成長円錐の伸長に関わるほか<ref name=ref42><pubmed></pubmed></ref>、アダプタータンパク質であるp140Capと相互作用してスパインの形成にも関与することが示されている<ref name=ref43><pubmed></pubmed></ref>。しかしSNAP-25のノックアウトマウスでは、出生時に脳の構造に異常は認められないことから、これらの機能は出生後に起こるシナプス可塑性に関わっている可能性が高い。 | ||
SNAP-25は[[イオンチャネル]]の機能制御にも直接関わることも知られており、P/Q型、N型およびT型Caチャネルなどに結合し<ref name=ref44><pubmed></pubmed></ref>、不活性化の電位依存性をシフトさせたり<ref name=ref45><pubmed></pubmed></ref> <ref name=ref46><pubmed></pubmed></ref>[[Kチャネル]]機能の制御に関わることが示されている<ref name=ref47><pubmed></pubmed></ref> <ref name=ref48><pubmed></pubmed></ref> <ref name=ref49><pubmed></pubmed></ref>。 | |||
SNAP-25は[[イオンチャネル]] | |||
==疾患との関連== | ==疾患との関連== | ||
SNAP-25の3' 側および5’側の非翻訳領域の1塩基変異が、[[注意欠陥・多動性障害]]([[ADHD]])と関連があることが統計学的解析から示されている<ref name=ref50><pubmed> | SNAP-25の3' 側および5’側の非翻訳領域の1塩基変異が、[[注意欠陥・多動性障害]]([[ADHD]])と関連があることが統計学的解析から示されている<ref name=ref50><pubmed></pubmed></ref> <ref name=ref51><pubmed></pubmed></ref> <ref name=ref52><pubmed></pubmed></ref>。SNAP-25を含む領域の[[染色体]]欠失を起こした自然発症のColobomaマウスはSNAP-25の発現が半減し多動性を示す<ref name=ref53><pubmed></pubmed></ref>。しかしSNAP-25のノックアウトマウスのヘテロ接合体はSNAP-25の発現量が半減しているが多動は示さないことから<ref name=ref6 />、多動性の発現はSNAP-25の発現低下のみに起因するものではないと考えられる。3' 側あるいは5’側の非翻訳領域の1塩基変異が繊維筋痛症患者で見られる精神症状や<ref name=ref54><pubmed></pubmed></ref>、ADHD患者などで見られる[[衝動性]]にも関連が見出されている<ref name=ref55><pubmed></pubmed></ref>。さらに健常人の気質に関してもSNAP-25のSNPSとの相関が見られる<ref name=ref56><pubmed></pubmed></ref>。 | ||
= | 非翻訳領域の変異の一部はSNAP-25の発現低下を引き起こして表現型を表している可能性がある<ref name=ref57><pubmed></pubmed></ref>。統合失調症や躁病患者の脳では、前頭皮質や[[海馬]]の異なる部域でSNAP-25の発現低下が見られる<ref name=ref58><pubmed></pubmed></ref> <ref name=ref59><pubmed></pubmed></ref> <ref name=ref60><pubmed></pubmed></ref>。[[脳血管性認知症]]の脳でSNAP-25の量が低下している<ref name=ref61><pubmed></pubmed></ref>。[[自閉症]]患者の認知機能の低下にSNAP-25の発現低下が関係している<ref name=ref62><pubmed></pubmed></ref>。 | ||
SNAP-25KOマウスのヘテロ接合体では、重篤ではないが[[脳波]]に異常発火が見られる<ref name=ref63><pubmed></pubmed></ref>。SNAP-25bをSNAP-25aに置き換えたマウス<ref name=ref64><pubmed></pubmed></ref>やリン酸化部位に変異を加えたマウスでは<ref name=ref65><pubmed></pubmed></ref>SNAP-25の発現低下と機能低下が起こっているが、生後3週くらいからてんかん発作を多発するようになる。重篤な全身発作を多発するヒトの患者でVal48がPheに変異していることが見出されている<ref name=ref66><pubmed></pubmed></ref>。いずれの場合も、てんかん発症がSNAP-25のどのような機能の異常に起因しているかは明らかではない。 | |||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2016年1月29日 (金) 13:21時点における版
英語名:SNAP-25 (synaptosomal-associated protein 25)
SNAP-25は脳や内分泌細胞に特異的に発現する206アミノ酸からなるタンパク質で、細胞膜に局在するt-SNAREタンパク質として細胞膜で起こる開口放出に不可欠な役割を果たしている。分子内に二つのSNAREモチーフを持ち、開口放出に不可欠なSNARE複合体を構成する4本のへリックスのうち、QbおよびQcの2本のへリックスを供出する。SNAP-25は開口放出による神経伝達物質や水溶性ホルモンの分泌に関わると共に、細胞膜へのタンパク質の組み込みや細胞膜の伸長などにも関与している。さらにイオンチャネルに結合し、その機能を調節する働きも持っている。SNAP-25の機能はリン酸化やパルミトイル化などの翻訳後修飾や、活性型Gタンパク質やシナプトタグミンなどの調節タンパク質の結合によって制御されている。SNAP-25の非翻訳領域の遺伝子変異と注意欠陥・多動性障害や統合失調症などとの関連が示されており、少なくとも一部はSNAP-25タンパク質の発現量の低下が原因である可能性が考えられる。さらに遺伝子改変マウスを用いた研究やヒト患者の解析から、てんかん発症との関わりも示されている。
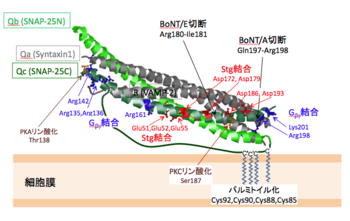
SNAP-25のN末側(Qb)およびC末側(Qc)のSNAREモチーフを緑色で、シンタキシン1およびVAMP-2のSNAREモチーフを灰色で示してある。各へリックスのN末端はすべて左側にある。
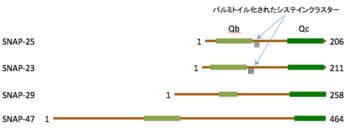
分子内に2つのSNAREモチーフを持っている。SNAP-25とSNAP-23は分子の中央付近にパルミトイル化されたシステインクラスターを持ち、細胞膜に係留されている。
イントロダクション
脳特異的に発現する遺伝子をスクリーニングする過程で、206アミノ酸からなりシナプス前膜に局在する25kDaのタンパク質として同定され、synaptosomal-associated protein 25と命名された[1]。一方SNAP-25は新規に合成され速い軸索流で運ばれる主要なタンパク質としても同定されている[2]。CHO細胞を用いてゴルジ小胞輸送を研究していたRothmanらは、ゴルジ体の小胞輸送に必須なタンパク質であるNSF/αSNAP複合体に結合するタンパク質としてSNAP-25およびシンタキシン1、VAMP-2を脳から単離しSNAP receptors (SNAREs) と名付けた[3]。X線解析の結果これらSNAREタンパク質はそれぞれSNAREモチーフと呼ばれる構造を持ち、SNARE複合体を形成することが示された[4]。SNAP-25がE型ボツリヌス毒素によって切断を受けるとSNARE複合体形成が阻害され開口放出機能が阻害されることや[5]、SNAP-25のノックアウトマウスではCa2+誘発性の神経伝達物質放出が見られないことなどから[6]、SNAP-25はシンタキシン1やVAMP-2と同様に開口放出による神経伝達物質放出に必須なタンパク質であると結論されている。さらにSNAP-25は開口放出による細胞膜へのタンパク質の組み込みや細胞膜の伸展のほか、Caチャネルへの直接結合を介したチャネル機能制御などにも関わっていると考えられている。
サブファミリー
SNAP-25の翻訳領域は8つのエクソンから構成されるが、4億年前に起こった硬骨魚の出現初期にエクソン5の重複が起こり、SNAP-25aとSNAP-25bのスプライシングバリアントが作られた[7]。SNAP-25のアミノ酸配列は良く保存されており、ヒト、マウス、ニワトリでは100%同一である。一方、軟骨魚類であるシビレエイ(Torpedo)および無脊椎動物であるショウジョウバエのSNAP-25 はマウスのアミノ酸配列とそれぞれ81% および61% 同一である。SNAP-25の発現は神経系や内分泌細胞に特異的に見られるが[8]、ユビキタスに発現するファミリー分子としてSNAP-23が見出されている[9]。
これら3種類のアイソフォームはいずれも神経伝達物質放出を引き起こす機能を持っているが、SNAP-25bのみがシナプトタグミン1および2と結合してCa2+依存的に起こる同期した放出を引き起こすことができる[10] [11]。それに対してSNAP-23はシナプトタグミン7と結合し、持続的に起こる同期しない放出に関わることが示されている[12]。SNAP-25aは進化の過程でSNAP-23とSNAP-25が分かれた後に作られている。SNAP-25aはSNAP-23と同様に同期した放出を引き起こすことはない点でSNAP-23と似ているが、脳においてSNAP-23とどのような機能的な違いを持っているかについては明らではない[8]。
分子内に2つのSNAREモチーフを持つタンパク質としてSNAP-29[13]とSNAP-47[14]が知られている。これらのタンパク質はパルミトイル化されたシステイン残基を持っていない点でSNAP-25やSNAP-23とは異なるが、細胞内小胞輸送に関わる可能性が示唆されている。
構造
SNAP-25およびSNAP-23はN末側およびC末側の2か所にSNAREモチーフを持っており、SNARE複合体形成時にはQcおよびQbの2本のへリックスを供出する[4] [15] [16]。シンタキシンやVAMP-2とは異なり細胞膜を貫通するへリックス構造は持っていないが、分子の中央部付近にパルミトイル化されたシステインクラスターを有しており、細胞膜に係留されている[2] [17] [18]。パルミトイル化はダイナミックに制御されており[19]、パルミトイル化にはDHHC palmitoyl transferaseが、脱パルミトイル化にはpalmitoyl-protein thioesterase 1が関わっている[20]。
SNAP-25のC末端付近のGln197-Arg198、Arg180-Ile181およびArg198-Ala199間のペプチド結合がA型(BoNT/A)、E型(BoNT/E)およびC型ボツリヌス毒素(BoNT/C)によって特異的に切断される。マウスのSNAP-23はBoNT/AやBoNT/Eで切断されるがヒトのSNAP-23は切断されない[21]。SNAP-25がBoNT/Eで切断を受けると開口放出による神経伝達物質放出が抑制され、BoNT/AでC末が切断されると放出のCa2+依存性が変化する[22] [23]。これらのことからSNAP-25のC末端付近の構造はSNAP-25の機能にとって不可欠な役割を果たしていると考えられている。SNAP-25のC末端付近にあるArg198やLys201に変異を加えて正電荷を無くすと放出速度や放出頻度の低下が起こる[24]。またSer187がプロテインキナーゼC(PKC)によってリン酸化されるとシンタキシンとの結合が強まり、Ca2+非依存的なシナプトタグミン1との結合が低下する[25] [26]。SNAP-25はcAMP依存性タンパク質キナーゼ(PKA)によってもThr138がリン酸化されるが、この場合にはシンタキシンおよびシナプトタグミン1との結合はいずれも抑制される[26]。セロトニンなどのメタボリックレセプターが活性化されると、開口放出による神経伝達物質放出が抑制されることが知られている。活性化型Gタンパク質であるGβγはSNAP-25と直接結合し、結合部位としてAsp99, Lys102, Arg198, Lys201を含む膜に近い部位と、Arg135、Arg136、Arg161、Arg142を含む2か所が同定され、セロトニンレセプターの活性化に伴う放出抑制にはC末端に近いArg198, Lys201へのGβγの結合が関与することが示されている[27]。
SNAREタンパク質による神経伝達物質放出はCa2+イオンによって誘発され、その場合のCa2+センサーとしてはシナプトタグミンが同定されている[28]。シナプトタグミン1との結合部位としてAsp51, Glu52, Glu55[29]およびAsp172, Asp179, Asp186, Asp193[30]が同定されている。いずれも変異を加えるとPC12細胞からの放出が抑制される。膜容量測定による時間分解能の良いアッセイではAsp51, Glu52, Glu55がCa2+依存性放出に必須でAsp172, Asp179, Asp186, Asp193はフュージョン誘発にあまり影響しないが、放出可能プール(readily releasable pool)を少し減少させる ことが示されている[31]。
SNAP-25結合タンパク質としてSnapinが同定されている。線虫(C. elegans )を用いた研究ではSnapinはSNAP-25に結合してSNARE複合体を安定化させる役割を持つと考えられているが[32]、SNAP-25上の結合部位は特定されていない。
発現
SNAP-25は脳と内分泌細胞に発現するが[1]外分泌細胞での発現は確認されていない。それに対しSNAP-23は脳を含めユビキタスに発現している[9]。脳でのSNAP-25a、SNAP-25bおよびSNAP-23の局在は大きく異なっている。SNAP-25bは脳全体にわたってシナプスが豊富な部位に多く発現しているが、線維束にも見いだされている。それに対しSNAP-25aとSNAP-23は脳の特定の領域にかたよって発現している[8]。SNAP-23の発現量は発達に伴いほとんど変化しないが、SNAP-25bは生後数週間に発現量が大きく増加する。それに対してSNAP-25aは生後の発達期に一時的に発現が高まる[8]。SNAP-25は生後発達以降に重要な役割を果たしており、SNAP-25のノックアウトマウスは胎生期の発達には特に異常は認められていないが、出生直後に呼吸不全で死亡する[6]。
機能
SNAP-25はt-SNAREタンパク質として開口放出による神経伝達物質放出や水溶性ホルモンの分泌に不可欠な役割を果たしている[4] [15] [16]。SNARE複合体形成に際しては、構成する4本のへリックスの中でQcおよびQbの2本のへリックスを供出する。SNAP-25がBoNT/Eで切断を受けると神経伝達物質放出が見られなくなることや[5]、SNAP-25のKOマウスではCa2+誘発性の神経伝達物質放出が見られないこと[6]、SNAP-25とsyntaxinを組み込んだリポゾームをVAMP-2を組み込んだリポゾームを混ぜるとリポゾーム同士の膜融合が起こることなどから[33]、SNAP-25は開口放出による神経伝達物質放出に必須なタンパク質であると結論されている。SNAP-25は内分泌細胞にも発現し、水溶性ホルモン分泌に不可欠な役割を果たしている。
開口放出は小胞内の内容物を放出する以外にも、小胞膜上のタンパク質を細胞膜に組み込んだり、細胞膜を伸長させたりする機能も持っている。SNAP-25は電位依存性のCaチャネルやアクアポリンなどのチャネルタンパク質やNMDA型およびAMPA型グルタミン酸レセプターなどの細胞膜への組み込みに関与していることが示されている[34] [35] [36] [37] [38] [39] [40] [41]。さらにSNAP-25は成長円錐にも局在し、成長円錐の伸長に関わるほか[42]、アダプタータンパク質であるp140Capと相互作用してスパインの形成にも関与することが示されている[43]。しかしSNAP-25のノックアウトマウスでは、出生時に脳の構造に異常は認められないことから、これらの機能は出生後に起こるシナプス可塑性に関わっている可能性が高い。
SNAP-25はイオンチャネルの機能制御にも直接関わることも知られており、P/Q型、N型およびT型Caチャネルなどに結合し[44]、不活性化の電位依存性をシフトさせたり[45] [46]Kチャネル機能の制御に関わることが示されている[47] [48] [49]。
疾患との関連
SNAP-25の3' 側および5’側の非翻訳領域の1塩基変異が、注意欠陥・多動性障害(ADHD)と関連があることが統計学的解析から示されている[50] [51] [52]。SNAP-25を含む領域の染色体欠失を起こした自然発症のColobomaマウスはSNAP-25の発現が半減し多動性を示す[53]。しかしSNAP-25のノックアウトマウスのヘテロ接合体はSNAP-25の発現量が半減しているが多動は示さないことから[6]、多動性の発現はSNAP-25の発現低下のみに起因するものではないと考えられる。3' 側あるいは5’側の非翻訳領域の1塩基変異が繊維筋痛症患者で見られる精神症状や[54]、ADHD患者などで見られる衝動性にも関連が見出されている[55]。さらに健常人の気質に関してもSNAP-25のSNPSとの相関が見られる[56]。
非翻訳領域の変異の一部はSNAP-25の発現低下を引き起こして表現型を表している可能性がある[57]。統合失調症や躁病患者の脳では、前頭皮質や海馬の異なる部域でSNAP-25の発現低下が見られる[58] [59] [60]。脳血管性認知症の脳でSNAP-25の量が低下している[61]。自閉症患者の認知機能の低下にSNAP-25の発現低下が関係している[62]。
SNAP-25KOマウスのヘテロ接合体では、重篤ではないが脳波に異常発火が見られる[63]。SNAP-25bをSNAP-25aに置き換えたマウス[64]やリン酸化部位に変異を加えたマウスでは[65]SNAP-25の発現低下と機能低下が起こっているが、生後3週くらいからてんかん発作を多発するようになる。重篤な全身発作を多発するヒトの患者でVal48がPheに変異していることが見出されている[66]。いずれの場合も、てんかん発症がSNAP-25のどのような機能の異常に起因しているかは明らかではない。
参考文献
- ↑ 1.0 1.1 Resource not found in PubMed.
- ↑ 2.0 2.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 4.0 4.1 4.2 Resource not found in PubMed.
- ↑ 5.0 5.1 Resource not found in PubMed.
- ↑ 6.0 6.1 6.2 6.3 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 8.0 8.1 8.2 8.3 Resource not found in PubMed.
- ↑ 9.0 9.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 15.0 15.1 Resource not found in PubMed.
- ↑ 16.0 16.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 26.0 26.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.