「Αアクチニン」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の39版が非表示) | |||
| 1行目: | 1行目: | ||
== | <div align="right"> | ||
<font size="+1">[http://researchmap.jp/read0213072 丸山 敬]</font><br> | |||
''埼玉医科大学 医学部 医学部 薬理学''<br> | |||
<font size="+1">[http://www.kitasato-u.ac.jp/sci/resea/seibutsu/kino/Home.html 太田 安隆]</font><br> | |||
''北里大学理学部生物科学科 生体機能学講座 ''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年3月12日 原稿完成日:2013年6月6日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所) | |||
</div> | |||
英語名:α-actinin | |||
{{box|text= αアクチニンは1965年に発見された[[アクチン]]結合タンパク質である。非骨格筋型は[[カルシウム]]制御を受けている。脳には骨格筋型も存在し、細胞骨格の一員として様々な生理機能に関与している。骨格筋からアクチン結合タンパク質として、その後、βアクチニン(CapZ)、γアクチニン、EUアクチンが報告されているが、αアクチニンとは全く別種のタンパク質と考えられる。}} | |||
{{lowercase title}} | |||
== | {{PBB|geneid=87}} | ||
{{PBB|geneid=88}} | |||
{{PBB|geneid=89}} | |||
{{PBB|geneid=81}} | |||
==研究の歴史== | |||
α-アクチニンは1965年に[[wikipedia:JA:江橋節郎|江橋節郎]]、文子夫妻と[[wikipedia:JA:丸山工作|丸山工作]]により[[骨格筋]]の粗精製[[アクチン]]より[[カルシウム]]制御因子([[トロポニン]])の生成過程で超沈殿(アクチンと[[ミオシン]]が[[wikipedia:JA:ATP|ATP]]付加により形成する凝集体を吸光度として測定する)を促進する活性因子として分離された<ref><pubmed>5857104</pubmed></ref>最初のアクチン結合タンパク質である。当時のアミノ酸組成分析(今では古典的な各アミノ酸の含有量をスター図で示す比較法)ではアクチンと類似しているデータが得られたために、アクチニンと命名された <ref><pubmed>12076539</pubmed></ref>。 | |||
==構造== | |||
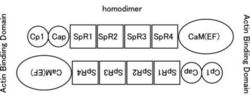
分子量は〜100kDaであり、[[カルポニン]]様ドメイン、[[スペクトリン]]様繰り返し配列(SpR)、EFハンド(骨格筋タイプではCa結合能を失っている)を持つカルモジュリン様ドメイン(CaM)からなる。二つの分子がN末端とC末端をアンチパラレルに結合したホモダイマーとなり、その両端がアクチン結合能を持つ。逆平行に結合したホモダイマーとして存在する。 | |||
ACTN1と4のC末端[[カルモジュリン]]様ドメインのEFハンドは機能しており、カルシウムを結合するカルシウム制御性因子である。骨格筋型のACTN2と3の[[wikipedia:JA:EFハンド|EFハンド]]はカルシウム結合能を失っている。 | |||
<gallery widths=250px> | |||
Image:ActinBindingDomain.png|<b>図1.αアクチニンの構造</b><br>カルポニン様ドメイン、スペクトリン様繰り返し配列(SpR)、EFハンド(骨格筋タイプではCa結合能を失っている)を持つカルモジュリン様ドメイン(CaM)からなる。二つの分子がN末端とC末端をアンチパラレルに結合したホモダイマーとなり、その両端がアクチン結合能を持つ。 | |||
</gallery> | |||
==ファミリー== | |||
ヒトのαアクチニンにはACTN1、2、3、4の4個が見出されている。 | |||
==発現== | |||
代表的なアクチン結合タンパク質の名に恥じず、αアクチニンは基本的にはアクチン線維と共存している。アクチン線維の構造の制御と他のタンパク質をアクチン線維([[細胞骨格]])に結合する[[足場/骨格タンパク質]](scaffold protein)として機能している。[[シナプス]]においては[[シナプス後膜]] (post-synaptic densities、[[PSD]])に局在しアクチン線維と[[NMDA受容体]]の連絡に関与していると考えられている。ACTN2は[[海馬]]の[[歯状回]]([[dentate gyrus]])で[[CA1]]より強く発現している<ref><pubmed>9454847</pubmed></ref>。 | |||
{| cellspacing="1" cellpadding="1" border="1" | |||
|+'''表.アクチニンサブタイプの分布、Ca結合能、ノックアウトマウスでの表現型''' | |||
|- | |||
| <br> | |||
| 分布 | |||
| Ca結合能 | |||
| 遺伝子異常 | |||
|- | |||
| [http://mouse.brain-map.org/experiment/show/74514369 ACTN1] | |||
| 骨格筋以外の細胞([[wikipedia:JA:平滑筋|平滑筋]]を含む)比較的[[細胞膜]]直下に局在。いわゆる"non-muscle" α-actinin | |||
| (+)<br>カルシウムが結合するとアクチン結合能が低下する | |||
| ノックアウトマウスは [[PubMed]]、MGI[[検索]](2012年2月)で見いだされず。<br> | |||
|- | |||
| [http://mouse.brain-map.org/gene/show/11260 ACTN2] | |||
| 骨格筋(全て)、心筋、脳 いわゆる"muscle" α-actinin | |||
| (-) | |||
| ヒト心筋症で変異が見出されている。[[ゼブラフィッシュ]]のノックアウトでは骨格筋と心筋の形成不全が生じた <ref><pubmed>22253474</pubmed></ref>。 | |||
|- | |||
| [http://mouse.brain-map.org/gene/show/11262 ACTN3] | |||
| 骨格筋(glycolytic muscle、[[wikipedia:JA:速筋|速筋]]のみ)。いわゆる"muscle" α-actinin<br> | |||
| (-) | |||
| 欧州人では18%程度が[[wikipedia:JA:停止コドン|停止コドン]]挿入により欠落しているが、正常型とほとんど速筋に違いは見られない。マウスでは速筋の代謝が[[wikipedia:JA:遅筋|遅筋]]的に変化することが示された<ref><pubmed>21933355</pubmed></ref>。 | |||
|- | |||
| [http://mouse.brain-map.org/gene/show/38054 ACTN4] | |||
| 骨格筋以外の細胞(平滑筋を含む)比較的細胞質/核に局在。いわゆる"non-muscle"α-actinin | |||
| (+)<br>カルシウムが結合するとアクチン結合能が低下する<br> | |||
| 一部の優性遺伝の[[wikipedia:JA:巣状文節性糸球体硬化症|巣状文節性糸球体硬化症]] (focal and segmental glomerulosclerosis)で変異が見出されている。ノックアウトマウスでも糸球体病変が出現する<ref><pubmed>12782671</pubmed></ref>。 | |||
|} | |||
遺伝子名は[http://mouse.brain-map.org/ Allen Brain Atlas]にリンクしている。 | |||
==機能== | |||
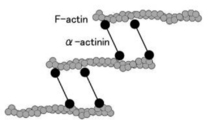
αアクチニンはアクチン結合タンパク質でありF-actin(線維状アクチン)を架橋する、いわゆる細胞骨格タンパク質である。細胞骨格を介して数多くの機能に間接的に直接的に関与している<ref><pubmed>21241830</pubmed></ref>。 | |||
===シグナル伝達=== | |||
αアクチニンは[[シグナル伝達]]に関与する分子群の[[足場タンパク質]]として機能している。また、様々なシグナル伝達経路でその機能が調節されている。 | |||
#プロテアーゼ(カルパイン)を介した制御<br>αアクチニンは[[MAPKKK]]である[[MEKK1]]に結合し,MEKK1を介したカルパインの活性化を制御している。 | |||
#[[イノシトールリン]]脂質を介したシグナル伝達<br>αアクチニンは[[PIP2]]や[[PIP3]]に結合し、これらの結合はαアクチニンの[[インテグリン]]に対する結合を阻害し、またアクチン線維架橋能も低下する。また、αアクチニンは[[PI3キナーゼ]]の調節サブユニットに直接結合する。 | |||
#タンパク質キナーゼによるリン酸化<br>αアクチニンは[[FAK]] ([[focal adhesion kinase]])などの[[チロシンキナーゼ]]でリン酸化される。 | |||
#カルシウムイオンを介した調節<br>非筋型αアクチニンはカルシウムイオンと結合するとアクチン線維に対する結合能が低下する。 | |||
===シナプスに於ける機能=== | |||
αアクチニンはシナプスにおいて相互作用する分子が複数同定されており、シナプスにおいて重要な働きをしていると考えられている。 | |||
#NMDA受容体<br>ACTN2はNMDA受容体とシナプス後膜で特異的に結合している。この結合は、Ca/[[CaM]]で阻害されるので、NMDA受容体に抑制的に働いていると考えられている。 | |||
#Densin<br>Densinは膜貫通型糖タンパク質で細胞質側に[[PDZドメイン]]をもち、PSDに発現している。αアクチニンはDensinと特異的に結合している。また[[Densin]]はCaMKIIとも結合するので、ACTN-CaMKII-Densin複合体がシナプスの機能に関与していると考えられている。 | |||
#A2A受容体<br>αアクチニンは[[アデノシン]][[A2A受容体]]に結合し、A2A受容体の凝集と細胞内移行(internalization)に関与していると考えられている。 | |||
<gallery widths=250px> | |||
Image:AlphaActin.png|<b>図2.αアクチニンによるF-actinの束化</b><br>αアクチンはアクチン結合蛋白質であり、Fアクチン(線維状アクチン)を束ねる。 | |||
</gallery> | |||
==疾患との関わり== | |||
細胞骨格と[[wikipedia:ja:悪性腫瘍|悪性腫瘍]]はその浸潤や増殖の過程で様々な関係が報告されていている。いわゆる細胞骨格タンパク質が転写制御を行うことが見いだされているが<ref><pubmed>20593452</pubmed></ref>、αアクチニンについても[[転写]]を活性化することが報告されている<ref name=ref100><pubmed>20037648</pubmed></ref>。[[脳腫瘍]]との関連では、たとえば脳腫瘍のなかで最も悪性の[[glioblastoma]]の浸潤との関連が指摘されている<ref name=ref100 />。 | |||
==その他のアクチニンと名称がつく分子== | |||
===βアクチニン=== | |||
丸山工作らが報告したβアクチニンは分子量3万程度の2個のサブユニットからなるヘテロダイマーである。当初、βアクチニンは骨格筋のZ膜側とは反対側(矢じり端<*注1>)に結合して、アクチンフィラメントの長さを一定に保つ機能が推定されていた。1981年にはProc Natl Acad Sciにβアクチニンは[[wikipedia:JA:アルブミン|アルブミン]]であるという論文が掲載されたが、さすがにこれは誤報であった<*注2>。しかし、1987年にZ膜から反矢じり端結合タンパク質が精製され、[[CapZ]]と命名された。CapZはβアクチニンに他ならなかった。βアクチニンが矢じり端に結合すると思われたのは混和タンパク質([[トロポモジュリン]])によるものと結論された。このためβアクチニンの名前はほぼ消滅し、現在はCapZが定着している。 | |||
CapZは骨格筋と[[wikipedia:JA:心筋|心筋]]で見いだされおり、[[wikipedia:JA:Z膜|Z膜]]へアクチン線維を固定化している。マウスではCapZの部分欠損は[[プロテインキナーゼ]]C系シグナル伝達が低下し、心筋肥大と生後早期死亡をもたらす<ref><pubmed>22155006</pubmed></ref>。 | |||
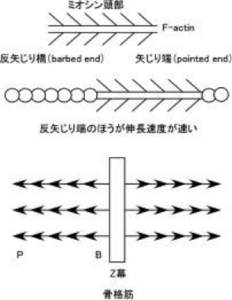
<*注1> F(線維状)アクチンには方向性があり、ミオシン頭部を結合させると矢じり構造を示す。この矢印の先端側を矢じり端(pointed end、P端、-端)、その反対側を反矢じり端(barbed end、B端、+端)という。アクチンの重合速度(線維の伸長速度)は反矢じり端のほうが早い(アクチンモノマーが結合しやすい、5~10倍)ことから、反矢じり端は+端とも表現される。骨格筋ではアクチンはZ膜に反矢じり端を埋め込むように固定され、矢じり端は自由端となっている。 | |||
<*注2> 丸山工作は反論の論文をProc Natl Acad Sci誌が掲載を認めないことに不満を唱えた。結局、反論論文はJ. Biochem<ref><pubmed>7298603</pubmed></ref>に掲載された。 | |||
<gallery widths=250px heights=300px> | |||
Image:betaactin.png|'''図3.アクチン線維(F-actin)の方向性'''<br>アクチン線維にミオシン頭部を結合させて電子顕微鏡で観察すると鏃(やじり)構造が観察される。矢印の頭部にあたる端を矢じり端、反対の尾部にあたる端を反矢じり端という。</gallery> | |||
===Euアクチニンとγアクチニン=== | |||
丸山工作の一派により、ウサギ骨格筋からγアクチニン<ref><pubmed>1002672</pubmed></ref>とニワトリ骨格筋からEuアクチニン<ref><pubmed>6783638</pubmed></ref>が報告されている。それぞれ1報告のみであり、クローニングもされておらず、詳細は不明である。 | |||
==関連項目== | |||
*[[アクチン]] | |||
*[[マイクロフィラメント]] | |||
*[[細胞骨格]] | |||
== 参考文献 == | |||
<references /> | |||
2018年3月3日 (土) 10:30時点における最新版
丸山 敬
埼玉医科大学 医学部 医学部 薬理学
太田 安隆
北里大学理学部生物科学科 生体機能学講座
DOI:10.14931/bsd.87 原稿受付日:2012年3月12日 原稿完成日:2013年6月6日
担当編集委員:林 康紀(独立行政法人理化学研究所)
英語名:α-actinin
αアクチニンは1965年に発見されたアクチン結合タンパク質である。非骨格筋型はカルシウム制御を受けている。脳には骨格筋型も存在し、細胞骨格の一員として様々な生理機能に関与している。骨格筋からアクチン結合タンパク質として、その後、βアクチニン(CapZ)、γアクチニン、EUアクチンが報告されているが、αアクチニンとは全く別種のタンパク質と考えられる。
| Actinin, alpha 2 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
PDB rendering based on 1h8b. | |||||||||||||
| |||||||||||||
| Identifiers | |||||||||||||
| Symbols | ACTN2; CMD1AA | ||||||||||||
| External IDs | OMIM: 102573 MGI: 109192 HomoloGene: 31016 GeneCards: ACTN2 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
 | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 88 | 11472 | |||||||||||
| Ensembl | ENSG00000077522 | ENSMUSG00000052374 | |||||||||||
| UniProt | P35609 | D3YY95 | |||||||||||
| RefSeq (mRNA) | NM_001103.2 | NM_033268.4 | |||||||||||
| RefSeq (protein) | NP_001094.1 | NP_150371.4 | |||||||||||
| Location (UCSC) |
Chr 1: 236.85 – 236.93 Mb |
Chr 13: 12.36 – 12.43 Mb | |||||||||||
| PubMed search | [3] | [4] | |||||||||||
| Actinin, alpha 3 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
PDB rendering based on 1tjt. | |||||||||||||
| |||||||||||||
| Identifiers | |||||||||||||
| Symbols | ACTN3; MGC117002; MGC117005 | ||||||||||||
| External IDs | OMIM: 102574 MGI: 99678 HomoloGene: 862 GeneCards: ACTN3 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 89 | 11474 | |||||||||||
| Ensembl | ENSG00000248746 | ENSMUSG00000006457 | |||||||||||
| UniProt | D6RH00 | Q14DS8 | |||||||||||
| RefSeq (mRNA) | NM_001104 | NM_013456.1 | |||||||||||
| RefSeq (protein) | NP_001095 | NP_038484.1 | |||||||||||
| Location (UCSC) |
Chr 11: 66.31 – 66.33 Mb |
Chr 19: 4.86 – 4.88 Mb | |||||||||||
| PubMed search | [5] | [6] | |||||||||||
| Actinin, alpha 4 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
PDB rendering based on 1wlx. | |||||||||||||
| |||||||||||||
| Identifiers | |||||||||||||
| Symbols | ACTN4; ACTININ-4; FSGS; FSGS1 | ||||||||||||
| External IDs | OMIM: 604638 MGI: 1890773 HomoloGene: 55857 GeneCards: ACTN4 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 81 | 60595 | |||||||||||
| Ensembl | ENSG00000130402 | ENSMUSG00000054808 | |||||||||||
| UniProt | O43707 | P57780 | |||||||||||
| RefSeq (mRNA) | NM_004924.4 | NM_021895.2 | |||||||||||
| RefSeq (protein) | NP_004915.2 | NP_068695.1 | |||||||||||
| Location (UCSC) |
Chr 19: 39.14 – 39.22 Mb |
Chr 7: 29.68 – 29.75 Mb | |||||||||||
| PubMed search | [7] | [8] | |||||||||||
研究の歴史
α-アクチニンは1965年に江橋節郎、文子夫妻と丸山工作により骨格筋の粗精製アクチンよりカルシウム制御因子(トロポニン)の生成過程で超沈殿(アクチンとミオシンがATP付加により形成する凝集体を吸光度として測定する)を促進する活性因子として分離された[1]最初のアクチン結合タンパク質である。当時のアミノ酸組成分析(今では古典的な各アミノ酸の含有量をスター図で示す比較法)ではアクチンと類似しているデータが得られたために、アクチニンと命名された [2]。
構造
分子量は〜100kDaであり、カルポニン様ドメイン、スペクトリン様繰り返し配列(SpR)、EFハンド(骨格筋タイプではCa結合能を失っている)を持つカルモジュリン様ドメイン(CaM)からなる。二つの分子がN末端とC末端をアンチパラレルに結合したホモダイマーとなり、その両端がアクチン結合能を持つ。逆平行に結合したホモダイマーとして存在する。
ACTN1と4のC末端カルモジュリン様ドメインのEFハンドは機能しており、カルシウムを結合するカルシウム制御性因子である。骨格筋型のACTN2と3のEFハンドはカルシウム結合能を失っている。
-
図1.αアクチニンの構造
カルポニン様ドメイン、スペクトリン様繰り返し配列(SpR)、EFハンド(骨格筋タイプではCa結合能を失っている)を持つカルモジュリン様ドメイン(CaM)からなる。二つの分子がN末端とC末端をアンチパラレルに結合したホモダイマーとなり、その両端がアクチン結合能を持つ。
ファミリー
ヒトのαアクチニンにはACTN1、2、3、4の4個が見出されている。
発現
代表的なアクチン結合タンパク質の名に恥じず、αアクチニンは基本的にはアクチン線維と共存している。アクチン線維の構造の制御と他のタンパク質をアクチン線維(細胞骨格)に結合する足場/骨格タンパク質(scaffold protein)として機能している。シナプスにおいてはシナプス後膜 (post-synaptic densities、PSD)に局在しアクチン線維とNMDA受容体の連絡に関与していると考えられている。ACTN2は海馬の歯状回(dentate gyrus)でCA1より強く発現している[3]。
| 分布 | Ca結合能 | 遺伝子異常 | |
| ACTN1 | 骨格筋以外の細胞(平滑筋を含む)比較的細胞膜直下に局在。いわゆる"non-muscle" α-actinin | (+) カルシウムが結合するとアクチン結合能が低下する |
ノックアウトマウスは PubMed、MGI検索(2012年2月)で見いだされず。 |
| ACTN2 | 骨格筋(全て)、心筋、脳 いわゆる"muscle" α-actinin | (-) | ヒト心筋症で変異が見出されている。ゼブラフィッシュのノックアウトでは骨格筋と心筋の形成不全が生じた [4]。 |
| ACTN3 | 骨格筋(glycolytic muscle、速筋のみ)。いわゆる"muscle" α-actinin |
(-) | 欧州人では18%程度が停止コドン挿入により欠落しているが、正常型とほとんど速筋に違いは見られない。マウスでは速筋の代謝が遅筋的に変化することが示された[5]。 |
| ACTN4 | 骨格筋以外の細胞(平滑筋を含む)比較的細胞質/核に局在。いわゆる"non-muscle"α-actinin | (+) カルシウムが結合するとアクチン結合能が低下する |
一部の優性遺伝の巣状文節性糸球体硬化症 (focal and segmental glomerulosclerosis)で変異が見出されている。ノックアウトマウスでも糸球体病変が出現する[6]。 |
遺伝子名はAllen Brain Atlasにリンクしている。
機能
αアクチニンはアクチン結合タンパク質でありF-actin(線維状アクチン)を架橋する、いわゆる細胞骨格タンパク質である。細胞骨格を介して数多くの機能に間接的に直接的に関与している[7]。
シグナル伝達
αアクチニンはシグナル伝達に関与する分子群の足場タンパク質として機能している。また、様々なシグナル伝達経路でその機能が調節されている。
- プロテアーゼ(カルパイン)を介した制御
αアクチニンはMAPKKKであるMEKK1に結合し,MEKK1を介したカルパインの活性化を制御している。 - イノシトールリン脂質を介したシグナル伝達
αアクチニンはPIP2やPIP3に結合し、これらの結合はαアクチニンのインテグリンに対する結合を阻害し、またアクチン線維架橋能も低下する。また、αアクチニンはPI3キナーゼの調節サブユニットに直接結合する。 - タンパク質キナーゼによるリン酸化
αアクチニンはFAK (focal adhesion kinase)などのチロシンキナーゼでリン酸化される。 - カルシウムイオンを介した調節
非筋型αアクチニンはカルシウムイオンと結合するとアクチン線維に対する結合能が低下する。
シナプスに於ける機能
αアクチニンはシナプスにおいて相互作用する分子が複数同定されており、シナプスにおいて重要な働きをしていると考えられている。
- NMDA受容体
ACTN2はNMDA受容体とシナプス後膜で特異的に結合している。この結合は、Ca/CaMで阻害されるので、NMDA受容体に抑制的に働いていると考えられている。 - Densin
Densinは膜貫通型糖タンパク質で細胞質側にPDZドメインをもち、PSDに発現している。αアクチニンはDensinと特異的に結合している。またDensinはCaMKIIとも結合するので、ACTN-CaMKII-Densin複合体がシナプスの機能に関与していると考えられている。 - A2A受容体
αアクチニンはアデノシンA2A受容体に結合し、A2A受容体の凝集と細胞内移行(internalization)に関与していると考えられている。
-
図2.αアクチニンによるF-actinの束化
αアクチンはアクチン結合蛋白質であり、Fアクチン(線維状アクチン)を束ねる。
疾患との関わり
細胞骨格と悪性腫瘍はその浸潤や増殖の過程で様々な関係が報告されていている。いわゆる細胞骨格タンパク質が転写制御を行うことが見いだされているが[8]、αアクチニンについても転写を活性化することが報告されている[9]。脳腫瘍との関連では、たとえば脳腫瘍のなかで最も悪性のglioblastomaの浸潤との関連が指摘されている[9]。
その他のアクチニンと名称がつく分子
βアクチニン
丸山工作らが報告したβアクチニンは分子量3万程度の2個のサブユニットからなるヘテロダイマーである。当初、βアクチニンは骨格筋のZ膜側とは反対側(矢じり端<*注1>)に結合して、アクチンフィラメントの長さを一定に保つ機能が推定されていた。1981年にはProc Natl Acad Sciにβアクチニンはアルブミンであるという論文が掲載されたが、さすがにこれは誤報であった<*注2>。しかし、1987年にZ膜から反矢じり端結合タンパク質が精製され、CapZと命名された。CapZはβアクチニンに他ならなかった。βアクチニンが矢じり端に結合すると思われたのは混和タンパク質(トロポモジュリン)によるものと結論された。このためβアクチニンの名前はほぼ消滅し、現在はCapZが定着している。
CapZは骨格筋と心筋で見いだされおり、Z膜へアクチン線維を固定化している。マウスではCapZの部分欠損はプロテインキナーゼC系シグナル伝達が低下し、心筋肥大と生後早期死亡をもたらす[10]。
<*注1> F(線維状)アクチンには方向性があり、ミオシン頭部を結合させると矢じり構造を示す。この矢印の先端側を矢じり端(pointed end、P端、-端)、その反対側を反矢じり端(barbed end、B端、+端)という。アクチンの重合速度(線維の伸長速度)は反矢じり端のほうが早い(アクチンモノマーが結合しやすい、5~10倍)ことから、反矢じり端は+端とも表現される。骨格筋ではアクチンはZ膜に反矢じり端を埋め込むように固定され、矢じり端は自由端となっている。
<*注2> 丸山工作は反論の論文をProc Natl Acad Sci誌が掲載を認めないことに不満を唱えた。結局、反論論文はJ. Biochem[11]に掲載された。
-
図3.アクチン線維(F-actin)の方向性
アクチン線維にミオシン頭部を結合させて電子顕微鏡で観察すると鏃(やじり)構造が観察される。矢印の頭部にあたる端を矢じり端、反対の尾部にあたる端を反矢じり端という。
Euアクチニンとγアクチニン
丸山工作の一派により、ウサギ骨格筋からγアクチニン[12]とニワトリ骨格筋からEuアクチニン[13]が報告されている。それぞれ1報告のみであり、クローニングもされておらず、詳細は不明である。
関連項目
参考文献
- ↑
Ebashi, S., & Ebashi, F. (1965).
Alpha-actinin, a new structural protein from striated muscle. I. Preparation and action on actomyosinàtp interaction. Journal of biochemistry, 58(1), 7-12. [PubMed:5857104] [WorldCat] [DOI] - ↑
Maruyama, K. (2002).
beta-Actinin, Cap Z, connectin and titin: what's in a name? Trends in biochemical sciences, 27(5), 264-6. [PubMed:12076539] [WorldCat] [DOI] - ↑
Wyszynski, M., Kharazia, V., Shanghvi, R., Rao, A., Beggs, A.H., Craig, A.M., ..., & Sheng, M. (1998).
Differential regional expression and ultrastructural localization of alpha-actinin-2, a putative NMDA receptor-anchoring protein, in rat brain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 18(4), 1383-92. [PubMed:9454847] [WorldCat] - ↑
Gupta, V., Discenza, M., Guyon, J.R., Kunkel, L.M., & Beggs, A.H. (2012).
α-Actinin-2 deficiency results in sarcomeric defects in zebrafish that cannot be rescued by α-actinin-3 revealing functional differences between sarcomeric isoforms. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 26(5), 1892-908. [PubMed:22253474] [PMC] [WorldCat] [DOI] - ↑
Vincent, B., Windelinckx, A., Van Proeyen, K., Masschelein, E., Nielens, H., Ramaekers, M., ..., & Thomis, M. (2012).
Alpha-actinin-3 deficiency does not significantly alter oxidative enzyme activity in fast human muscle fibres. Acta physiologica (Oxford, England), 204(4), 555-61. [PubMed:21933355] [WorldCat] [DOI] - ↑
Kos, C.H., Le, T.C., Sinha, S., Henderson, J.M., Kim, S.H., Sugimoto, H., ..., & Pollak, M.R. (2003).
Mice deficient in alpha-actinin-4 have severe glomerular disease. The Journal of clinical investigation, 111(11), 1683-90. [PubMed:12782671] [PMC] [WorldCat] [DOI] - ↑
Oikonomou, K.G., Zachou, K., & Dalekos, G.N. (2011).
Alpha-actinin: a multidisciplinary protein with important role in B-cell driven autoimmunity. Autoimmunity reviews, 10(7), 389-96. [PubMed:21241830] [WorldCat] [DOI] - ↑
Skarp, K.P., & Vartiainen, M.K. (2010).
Actin on DNA-an ancient and dynamic relationship. Cytoskeleton (Hoboken, N.J.), 67(8), 487-95. [PubMed:20593452] [WorldCat] [DOI] - ↑ 9.0 9.1
Sen, S., Dong, M., & Kumar, S. (2009).
Isoform-specific contributions of alpha-actinin to glioma cell mechanobiology. PloS one, 4(12), e8427. [PubMed:20037648] [PMC] [WorldCat] [DOI] - ↑
Yang, F.H., & Pyle, W.G. (2012).
Reduced cardiac CapZ protein protects hearts against acute ischemia-reperfusion injury and enhances preconditioning. Journal of molecular and cellular cardiology, 52(3), 761-72. [PubMed:22155006] [WorldCat] [DOI] - ↑
Maruyama, K., & Kimura, S. (1981).
Muscle beta-actinin is not chicken serum albumin. Journal of biochemistry, 90(2), 563-6. [PubMed:7298603] [WorldCat] [DOI] - ↑
Kuroda, M., & Maruyama, K. (1976).
Gamma-Actinin, a new regulatory protein from rabbit skeletal muscle. I. Purification and characterization. Journal of biochemistry, 80(2), 315-22. [PubMed:1002672] [WorldCat] [DOI] - ↑
Kuroda, M., Tanaka, T., & Masaki, T. (1981).
Eu-actinin, a new structural protein of the Z-line of striated muscles. Journal of biochemistry, 89(1), 297-310. [PubMed:6783638] [WorldCat] [DOI]