「抗NMDA受容体脳炎」の版間の差分
細 →予後 |
|||
| (同じ利用者による、間の7版が非表示) | |||
| 6行目: | 6行目: | ||
</div> | </div> | ||
英語名:NMDAR encephalitis, | 英語名:NMDAR encephalitis, Anti-NMDAR autoimmune encephalitis, Anti-NMDA Receptor encephalitis, | ||
同義語:NMDAR脳炎 | 同義語:NMDAR脳炎 | ||
| 25行目: | 25行目: | ||
=== NMDA受容体抗体の疾患特異性に関する概念の推移 === | === NMDA受容体抗体の疾患特異性に関する概念の推移 === | ||
抗NMDA受容体脳炎の原著報告から数年間は、cell-based assayのNMDA受容体抗体は抗NMDA受容体脳炎の特異的診断マーカーと考えられていたが、最近では多様な疾患で検出され、診断マ-カーというよりは、免疫介在病態を示唆する病態マーカーとなっている('''表''')。 | 抗NMDA受容体脳炎の原著報告から数年間は、cell-based assayのNMDA受容体抗体は抗NMDA受容体脳炎の特異的診断マーカーと考えられていたが、最近では多様な疾患で検出され、診断マ-カーというよりは、免疫介在病態を示唆する病態マーカーとなっている('''表''')。 | ||
[[ファイル:Takahashi anti NMDAR encephalitis Fig2.png|サムネイル|'''図2. 抗NMDA受容体脳炎の経過'''<br> | [[ファイル:Takahashi anti NMDAR encephalitis Fig2.png|サムネイル|'''図2. 抗NMDA受容体脳炎の経過'''<br><ref name=高橋幸利、他2016></ref><ref name=Dalmau2018><pubmed>29490181</pubmed></ref>を改変、引用。]] | ||
[[ファイル:Takahashi anti NMDAR encephalitis Fig3.png|サムネイル|'''図3. 抗NMDA受容体脳炎の診断基準'''<br> | [[ファイル:Takahashi anti NMDAR encephalitis Fig3.png|サムネイル|'''図3. 抗NMDA受容体脳炎の診断基準'''<br>Dalmau J, et al., Lancet Neurol. 2019; 18(11): 1045-1057<ref name=Dalmau2019><pubmed>31326280</pubmed></ref>を一部改変. ]] | ||
{| class="wikitable" | {| class="wikitable" | ||
|+表. Cell-based assayによるNMDA受容体抗体陽性疾患 | |+表. Cell-based assayによるNMDA受容体抗体陽性疾患 | ||
| 37行目: | 37行目: | ||
| マダニ媒介性脳炎 ||<ref name=Cavaliere2019><pubmed>30913507</pubmed></ref> | | マダニ媒介性脳炎 ||<ref name=Cavaliere2019><pubmed>30913507</pubmed></ref> | ||
|- | |- | ||
| | | 硬直とミオクローヌスを伴う進行性脳脊髄炎 ||<ref name=Turner2011><pubmed>21775733</pubmed></ref> | ||
|- | |- | ||
| | | てんかん ||<ref name=Niehusmann2009><pubmed>19364930</pubmed></ref> | ||
|- | |- | ||
| 小児てんかん ||<ref name=Suleiman2013><pubmed>24151870</pubmed></ref> | | 小児てんかん ||<ref name=Suleiman2013><pubmed>24151870</pubmed></ref> | ||
|- | |- | ||
| | | クロイツフェルト・ヤコブ病 ||<ref name=Fujita2012><pubmed>22057403</pubmed></ref> | ||
|- | |- | ||
| | | ミトコンドリア脳筋症(MELAS) ||<ref name=Finke2012><pubmed>21898136</pubmed></ref> | ||
|- | |- | ||
| | | 統合失調症 ||<ref name=Zandi2011><pubmed>20972895</pubmed></ref> | ||
|- | |- | ||
| 統合失調症など ||<ref name=Tsutsui2012><pubmed>22569157</pubmed></ref> | | 統合失調症など ||<ref name=Tsutsui2012><pubmed>22569157</pubmed></ref> | ||
|- | |- | ||
| | | 抗甲状腺抗体を伴う精神病患者 ||<ref name=Chiba2013><pubmed>23142717</pubmed></ref> | ||
|- | |- | ||
| | | 緩徐認知障害 ||<ref name=Pruss2012b><pubmed>22539565</pubmed></ref> | ||
|- | |- | ||
| | | 空間認知障害を伴う全身性紅斑性狼瘡 ||<ref name=Chang2015><pubmed>26286205</pubmed></ref> | ||
|- | |- | ||
| | | 姿勢性頻脈症候群(POTS) ||<ref name=Blitshteyn2017><pubmed>27561785</pubmed></ref> | ||
|- | |- | ||
| | | 膠芽腫 ||<ref name=Fujii2013>'''藤井裕樹、他 (2013)'''<br>卵巣奇形腫を合併し抗NMDA受容体抗体陽性のglioblastomaの1例、臨床神経 53: 712-715.<br><pubmed>24097319</pubmed></ref> | ||
|- | |- | ||
| | | 脱髄症候群を重複する疾患 ||<ref name=Titulaer2014><pubmed>24700511</pubmed></ref> | ||
|- | |- | ||
| 健常者(血清) ||<ref name=Dahm2014><pubmed>24853231</pubmed></ref> | | 健常者(血清) ||<ref name=Dahm2014><pubmed>24853231</pubmed></ref> | ||
|} | |} | ||
== 診断 == | == 診断 == | ||
| 77行目: | 76行目: | ||
=== 髄液検査 === | === 髄液検査 === | ||
髄液細胞数は95%の症例で増加するが<ref name=Titulaer2014><pubmed>24700511</pubmed></ref>、50 /mm<sup>3</sup>程度の増加にとどまることが多く、蛋白質は60 mg/ | 髄液細胞数は95%の症例で増加するが<ref name=Titulaer2014><pubmed>24700511</pubmed></ref>、50 /mm<sup>3</sup>程度の増加にとどまることが多く、蛋白質は60 mg/dl程度の増加、IgGは6.0 mg/dl程度の増加を示す<ref name=高橋幸利、他2014></ref>。 | ||
=== 画像検査 === | === 画像検査 === | ||
| 103行目: | 102行目: | ||
抗NMDA受容体脳炎501例の検討では、394例は[[modified Rankin Scale]] (mRS)でmRS0-2に回復し、約80%は軽度の障害で自立した生活が可能となるが、30例が死亡し、45例が再発している<ref name=Titulaer2013></ref>。髄液GluN2B抗体(ELISA)高値のNHALE100例(日本)の検討では、死亡率は5%で、[[wj:日常生活動作|日常生活動作]] ([[wj:ADL|ADL]])の障害は27.4%に、てんかん発作が21.1%に、精神障害が30.4%に、認知機能障害が42.9%に、運動機能障害が18.9%に後遺症として見られている<ref name=高橋幸利2016>'''高橋幸利 (2016)'''<br>非ヘルペス性急性辺縁系脳炎157例の検討:急性期治療と予後. Neuroinfection 21:121-127. </ref>。 | 抗NMDA受容体脳炎501例の検討では、394例は[[modified Rankin Scale]] (mRS)でmRS0-2に回復し、約80%は軽度の障害で自立した生活が可能となるが、30例が死亡し、45例が再発している<ref name=Titulaer2013></ref>。髄液GluN2B抗体(ELISA)高値のNHALE100例(日本)の検討では、死亡率は5%で、[[wj:日常生活動作|日常生活動作]] ([[wj:ADL|ADL]])の障害は27.4%に、てんかん発作が21.1%に、精神障害が30.4%に、認知機能障害が42.9%に、運動機能障害が18.9%に後遺症として見られている<ref name=高橋幸利2016>'''高橋幸利 (2016)'''<br>非ヘルペス性急性辺縁系脳炎157例の検討:急性期治療と予後. Neuroinfection 21:121-127. </ref>。 | ||
[[ファイル:Takahashi anti NMDAR encephalitis Fig4.png|サムネイル|'''図4. NMDA受容体抗体の作用''' | [[ファイル:Takahashi anti NMDAR encephalitis Fig4.png|サムネイル|'''図4. NMDA受容体抗体の作用''']] | ||
== 病態生理 == | == 病態生理 == | ||
MMDA受容体に対する自己抗体が病態の中核を司る免疫介在性の脳炎である。 | MMDA受容体に対する自己抗体が病態の中核を司る免疫介在性の脳炎である。 | ||
2020年10月3日 (土) 19:30時点における版
高橋幸利
国立病院機構 静岡てんかん・神経医療センター
DOI:10.14931/bsd.9427 原稿受付日:2020年9月26日 原稿完成日:2020年10月3日
担当編集委員:漆谷 真(滋賀医科大学 脳神経内科)
英語名:NMDAR encephalitis, Anti-NMDAR autoimmune encephalitis, Anti-NMDA Receptor encephalitis,
同義語:NMDAR脳炎
NMDA受容体に対する自己抗体が病態の中核を司る免疫介在性の脳炎で、小児から高齢者まで幅広く罹患する。小児では非傍腫瘍性が多くを占めるが、成人女性では傍腫瘍性(アジア人では卵巣奇形腫)の頻度が比較的高い。小児ではけいれんなどの急性発作で、成人では辺縁系症状に該当する行動変化で発症することが多い。免疫修飾治療、傍腫瘍症例では腫瘍摘出が有効である。再発することがあるが、初発時に比べると症状が軽い。
抗NMDA受容体脳炎とは
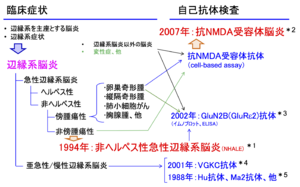
*1:楠原らは1994年にHSV陰性で腫瘍の合併のない症例群を非ヘルペス性急性辺縁系脳炎(non-herpetic acute limbic encephalitis, NHALE)として報告[1]。
*2:Dalmauらは2007年にNMDAR抗体陽性の12例の卵巣奇形腫合併辺縁系脳炎を報告[2]。
*3:高橋幸利らは小児期の中枢神経系感染症による難治てんかんでGluRε2抗体の存在を報告[3]。
*4: Buckley Cらは非傍腫瘍性症例でVGKC抗体を報告[4]。
*5: Anderson NEらは, 傍腫瘍性症例でHu抗体などを報告[5]。
文献[6]を改変.
原著報告と疾患概念の推移
辺縁系脳炎は海馬・扁桃体などの辺縁系を主座とする脳炎で、辺縁系症状と呼ばれる特徴的な症状が診断のポイントとなるが、傍腫瘍性と非傍腫瘍性に分類される(図1)[6]。非傍腫瘍性では単純ヘルペスウイルス(HSV)脳炎が多いが、1994年にHSV陰性で腫瘍の合併もない症例群が非ヘルペス性急性辺縁系脳炎(non-herpetic acute limbic encephalitis、NHALE)として報告された[1]。NMDA型グルタミン酸受容体のサブユニットのひとつであるGluN2B(GluRε2、NR2B)全長蛋白質を抗原とする抗体のイムノブロット法による検出系が確立され[7]、急性脳炎症例でGluN2B抗体が存在する症例が2002-2005年に報告され、その後NHALEの多数例で検出されている[3][8]。
2007年、卵巣奇形腫を伴う傍腫瘍性脳炎(paraneoplastic encephalitis with ovarian teratoma)症例12例の血清・髄液中に、HEK細胞に発現させた[GluN1(NR1)+GluN2B(GluN2A)]のNMDA型グルタミン酸受容体複合体抗原とのみ反応する抗体が存在すると、Dalmauらが報告した[2]。このNMDA受容体複合体に対する抗体は、GluN1あるいはGluN2Bの単独サブユニットを発現させた細胞とは反応しないが二つのサブユニットを含む複合体とは反応することが特徴とされたが、単独のNMDA型グルタミン酸受容体のサブユニットでは細胞表面に発現しにくいための誤解であった[9][10]。その後、抗NMDA受容体脳炎の主たる神経抗体はGluN1抗体と考えられるようになっている[11][12]。
NMDA型グルタミン酸受容体分子を発現させた細胞を用いたcell-based assayによるNMDA受容体抗体(NMDA受容体複合体抗体あるいはGluN1抗体)の測定が広く行われるようになると、抗NMDA受容体脳炎の臨床スペクトラムは幅広くなり、腫瘍の合併率は原著の100%から徐々に低下し、2013年の報告では38%となっている[13]。腫瘍の94%は卵巣奇形腫で、2%は卵巣以外の奇形腫、4%は肺、乳房などの腫瘍、卵巣がん、胸腺がん、すい臓がんからなる。また、小児例の報告も増え、成人とは発病症状が異なることが分かってきた。
非ヘルペス性急性辺縁系脳炎(NHALE)との関係
定義的には、cell-based assayによるNMDA受容体抗体(NMDA受容体複合体抗体あるいはGluN1抗体)陽性の急性脳炎を抗NMDA受容体脳炎と呼び、HSVなどのウイルス感染が否定でき、辺縁系症状で始まる非傍腫瘍性急性脳炎をNHALEと呼ぶ(図1)。抗NMDA受容体脳炎は抗体からの命名、NHALEは発病症状等からの命名で、両者の重なりは大きい。NHALEの自己抗体の報告の多くはNMDA型グルタミン酸受容体に対する抗体で、イムノブロット法によるGluN2B(GluRε2)抗体、ELISAによるGluN2B-NT2抗体、GluN1-NT抗体、cell-based assayによるNMDA受容体抗体などである。NMDA型グルタミン酸受容体 以外では電位依存性カリウムチャネル (VGKC)抗体やN-terminal α-enolase (NAE)抗体陽性のNHALEが知られている[14]。抗NMDA受容体脳炎の非傍腫瘍性成人例の多くは辺縁系症状で発症するので、NHALEの診断基準を満たす。
NMDA受容体抗体の疾患特異性に関する概念の推移
抗NMDA受容体脳炎の原著報告から数年間は、cell-based assayのNMDA受容体抗体は抗NMDA受容体脳炎の特異的診断マーカーと考えられていたが、最近では多様な疾患で検出され、診断マ-カーというよりは、免疫介在病態を示唆する病態マーカーとなっている(表)。

[14][15]を改変、引用。
Dalmau J, et al., Lancet Neurol. 2019; 18(11): 1045-1057[16]を一部改変.
| 疾患 | 文献 |
|---|---|
| 卵巣奇形腫を伴うNMDAR脳炎 | [2] |
| 単純ヘルペス (HSV1)脳炎 | [17][18] |
| マダニ媒介性脳炎 | [19] |
| 硬直とミオクローヌスを伴う進行性脳脊髄炎 | [20] |
| てんかん | [21] |
| 小児てんかん | [22] |
| クロイツフェルト・ヤコブ病 | [23] |
| ミトコンドリア脳筋症(MELAS) | [24] |
| 統合失調症 | [25] |
| 統合失調症など | [26] |
| 抗甲状腺抗体を伴う精神病患者 | [27] |
| 緩徐認知障害 | [28] |
| 空間認知障害を伴う全身性紅斑性狼瘡 | [29] |
| 姿勢性頻脈症候群(POTS) | [30] |
| 膠芽腫 | [31] |
| 脱髄症候群を重複する疾患 | [32] |
| 健常者(血清) | [33] |
診断
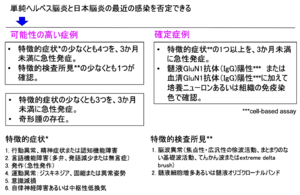
急性脳炎症状で発病するが、その直前に発熱、頭痛、髄膜炎などを呈する先行症状期が存在することがある(図2)。先行症状期から急性期の脳炎症状に移行する特徴的な経過で、抗NMDA受容体脳炎を疑うことができる。急性期の臨床症状、髄液検査、脳波検査、cell-based assayによるGluN1抗体などで総合的に診断するが、診断基準ではGluN1抗体の証明がない場合は可能性の高い症例となり、GluN1抗体が確認された場合は確定症例となる(図3)[16]。 感染病原体による1次性脳炎と異なり、免疫修飾治療が抗NMDA受容体脳炎には適応となり、予後を規定するので、GluN1抗体などによる早期診断が重要である。また、卵巣奇形腫などのスクリーニングも早期に必要となる。
臨床症状
急性期の脳炎症状には、行動異常、精神症状(思考滅裂、興奮状態、幻聴、幻臭、統合失調症状、せん妄、性欲亢進など)または認知機能障害が含まれる[14]。認知機能障害には、短期記憶障害や車が運転できなくなるなどの実行障害が含まれる。発作(急性発作)には痙攣を伴うものが多いが、痙攣のない意識減損のみの発作も存在する。病期が進むと発作が群発あるいは重積するようになる。意識障害が重度になると、顔面特に口部や舌の不随意な動きが出現し、ジスキネジア、自動症と呼ばれるゆっくりとした特徴的な運動異常が見られることが多いが、オピストトーヌスや舞踏病など種々の運動異常が出現しうる。四肢にも持続性のミオクローヌスや固縮などの異常が出現する症例もある。経過中に突然、徐脈や中枢性無呼吸といった自律神経異常が出現する症例もある。
成人の2/3が行動異常で発病するのに対し、患者の約40%を占める小児例では、行動異常以外の発作(急性発作)や意識障害で発病することが多く、辺縁系脳炎の病型をとらない場合があることに注意する[32]。
髄液検査
髄液細胞数は95%の症例で増加するが[32]、50 /mm3程度の増加にとどまることが多く、蛋白質は60 mg/dl程度の増加、IgGは6.0 mg/dl程度の増加を示す[6]。
画像検査
急性期のMRIでは正常が70%と多い[15]が、diffusion画像あるいはFLAIR画像で海馬などを主体に15%程度に高信号病変が出現、重症例では大脳皮質などにも高信号病変が出現することがある[6]。重症例では、回復期以降大脳萎縮は回復するが、小脳萎縮が出現することがある[34]。
脳波検査
急性期は焦点性の徐波から始まり、進行すると広汎性の徐波、時に棘波や棘徐波などのてんかん発射が出現、さらに進行するとextreme delta brushが出現する。extreme delta brushは30.4%に出現するとされ、burst and slow complexesとも呼ばれている[35][36]。
鑑別診断
成人では辺縁系症状を呈しやすい単純ヘルペス脳炎と日本脳炎を、先ず否定する必要がある。小児では発作が初発症状となることも多いので、ウイルス性や細菌性の脳炎(髄膜脳炎)が幅広く鑑別の対照となる。また、無熱発作の場合ではてんかんを鑑別する必要がある場合もある。
免疫マーカー
髄液のcell-based assayによるIgG型NMDA受容体抗体(NMDA受容体複合体抗体あるいはGluN1抗体)陽性が診断には重要である。血清でのNMDA受容体抗体は疑陽性が多く、23.2%は自己免疫疾患ではなかったとされている[37]。NMDA受容体抗体の髄液の感度は100.0%、血清の感度は85.6%とされていて、髄液抗体は再発の予測に役立つ場合がある[38]。NMDA受容体抗体の疑陽性による誤診を防ぐためには、脳を用いた免疫染色での染色パタンの検討が重要とされている[16]。健常対照の血清にはNMDA型グルタミン酸受容体やCaspr2やARHGAP26などに対する抗体が存在しcell-based assayで陽性になることが知られている[33]。血清での抗体陽性は、症状などを含めてその意義を慎重に検討する。
治療と予後
成人の辺縁系症状で発症した症例では、先ず辺縁系脳炎の病因として多いHSVを念頭にアシクロビルを開始し、HSV感染が髄液PCRなどで否定できた時点で中止し、免疫修飾治療(ステロイドパルス治療や免疫グロブリン静注療法(IVIg)治療など)や血漿交換を行う。卵巣奇形腫を合併する場合は、早期の核出術が病勢を好転させることがある[33]。
1次免疫修飾治療
メチルプレドニゾロンなどを用いたステロイド治療、IVIg、免疫吸着療法が該当する。非傍腫瘍症例では、ステロイド治療(87%)、IVIg(73%)、血漿交換(26%)が選択されている[13]。傍腫瘍例では外科切除を96%が受けている。1次免疫修飾治療が有効であった症例では60%以上が無症状に回復している。
2次免疫修飾治療
リツキシマブとサイクロフォスファミドが該当する。リツキシマブ治療を20%が受け、サイクロフォスファミド治療を16%が受けている[13]。1次免疫修飾治療が無効で2次免疫修飾治療を受けなかった症例では20%程度が無症状に回復、1次免疫修飾治療が無効で2次免疫修飾治療を受けた症例では35%程度が無症状に回復しており、2次免疫修飾治療は有用である。
予後
抗NMDA受容体脳炎501例の検討では、394例はmodified Rankin Scale (mRS)でmRS0-2に回復し、約80%は軽度の障害で自立した生活が可能となるが、30例が死亡し、45例が再発している[13]。髄液GluN2B抗体(ELISA)高値のNHALE100例(日本)の検討では、死亡率は5%で、日常生活動作 (ADL)の障害は27.4%に、てんかん発作が21.1%に、精神障害が30.4%に、認知機能障害が42.9%に、運動機能障害が18.9%に後遺症として見られている[39]。
病態生理
MMDA受容体に対する自己抗体が病態の中核を司る免疫介在性の脳炎である。
NMDA受容体抗体の機能
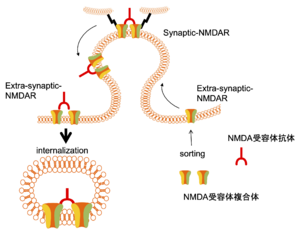
NMDA受容体抗体が主にシナプス外にあるNMDA受容体複合体を架橋し、細胞表面から内在化することにより、NMDA受容体拮抗作用をもたらすと考えられている(図4)[40]。NMDA受容体抗体を含む患者検体を用いた研究では、シナプス構造などには影響しないが、NMDA受容体電流を抑制し[40]、長期増強現象 (LTP)を抑制する[41]。遺伝子組み換え抗体の移入研究では、マウス海馬のシナプスNMDA型グルタミン酸受容体を減少させ、記憶の障害をもたらす[42]。ウサギ抗ヒトGluN1抗体はマウス海馬への移入で、長期記憶、社会的交流を阻害する[43]。
NMDA受容体抗体の産生
抗NMDA受容体脳炎に高頻度に合併する卵巣奇形腫では、GluN2B、GluA1、GluA2/3などの神経分子の発現があり、対照卵巣にもGluN2Bの発現が報告されており、これらの神経分子が抗原となってNMDA型グルタミン酸受容体抗体が産生されていると考えられている[44]。髄液GluN2B抗体(ELISA)高値のNHALE42例(日本)の検討では、先行症状期に末梢血リンパ球、血小板が減少するが[6]、リンパ球や血小板にもNMDA型グルタミン酸受容体が発現していて、非傍腫瘍症例の抗原となっている可能性がある[45] [46]。
感染性脳炎とNMDA受容体抗体
抗NMDA受容体脳炎は、当初は感染性の脳炎とは無関係と考えられていたが、HSV脳炎の回復期に脳炎症状が再発し、NMDA受容体抗体が陽性となる症例[18]の報告を皮切りに、HSV以外の中枢神経系感染症後においても抗NMDA受容体脳炎が発症することが報告されるようになっている[19]。HSV脳炎では27%が抗NMDA受容体脳炎を含む自己免疫性脳炎を続発するので、脳炎症状が再燃した際には、HSV脳炎の再燃か、自己免疫病態の続発かを検討する。自己免疫脳炎が続発する病態では、感染ウイルスの抗原提示で自己抗体が産生されたのか?脳炎により破壊された脳からNMDA型グルタミン酸受容体などが抗原提示されて抗体ができるのか?今後の解明が待たれる。意識障害や痙攣重積で発症する脳炎では回復期からIgM型のGluN2B抗体(イムノブロット)が産生されることから、破壊された脳からのNMDA型グルタミン酸受容体などが抗原となっている可能性が推測される[47]。
疫学
英国の調査では203例の脳炎症例中、感染性脳炎が86例(42%)、42例(21%)が免疫介在性脳炎で、9例(4%)が抗NMDA受容体脳炎である[48]。
参考文献
- ↑ 1.0 1.1 楠原智彦、他 (1994)
非ヘルペス性急性辺縁系脳炎の存在について. 臨床神経 34:1083-1088. - ↑ 2.0 2.1 2.2
Dalmau, J., Tüzün, E., Wu, H.Y., Masjuan, J., Rossi, J.E., Voloschin, A., ..., & Lynch, D.R. (2007).
Paraneoplastic anti-N-methyl-D-aspartate receptor encephalitis associated with ovarian teratoma. Annals of neurology, 61(1), 25-36. [PubMed:17262855] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1 高橋幸利 (2002)
小児期の中枢神経系感染症による難治てんかんにおける抗GluRε2自己抗体の存在. 日本小児科学会誌 106:1402-1411. - ↑
Buckley, C., Oger, J., Clover, L., Tüzün, E., Carpenter, K., Jackson, M., & Vincent, A. (2001).
Potassium channel antibodies in two patients with reversible limbic encephalitis. Annals of neurology, 50(1), 73-8. [PubMed:11456313] [WorldCat] [DOI] - ↑
Anderson, N.E., Rosenblum, M.K., Graus, F., Wiley, R.G., & Posner, J.B. (1988).
Autoantibodies in paraneoplastic syndromes associated with small-cell lung cancer. Neurology, 38(9), 1391-8. [PubMed:2842702] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3 6.4 高橋幸利、他 (2014)
神経疾患とNMDA型グルタミン酸受容体抗体. 日本小児科学会誌118:1695-1707. - ↑
Takahashi, Y., Mori, H., Mishina, M., Watanabe, M., Fujiwara, T., Shimomura, J., ..., & Kondo, N. (2003).
Autoantibodies to NMDA receptor in patients with chronic forms of epilepsia partialis continua. Neurology, 61(7), 891-6. [PubMed:14557555] [WorldCat] [DOI] - ↑
Takahashi, Y., Mori, H., Mishina, M., Watanabe, M., Kondo, N., Shimomura, J., ..., & Fujiwara, T. (2005).
Autoantibodies and cell-mediated autoimmunity to NMDA-type GluRepsilon2 in patients with Rasmussen's encephalitis and chronic progressive epilepsia partialis continua. Epilepsia, 46 Suppl 5, 152-8. [PubMed:15987271] [WorldCat] [DOI] - ↑
Groc, L., Heine, M., Cousins, S.L., Stephenson, F.A., Lounis, B., Cognet, L., & Choquet, D. (2006).
NMDA receptor surface mobility depends on NR2A-2B subunits. Proceedings of the National Academy of Sciences of the United States of America, 103(49), 18769-74. [PubMed:17124177] [PMC] [WorldCat] [DOI] - ↑
Takahashi, Y. (2008).
Epitope of autoantibodies to N-methyl-D-aspartate receptor heteromers in paraneoplastic limbic encephalitis. Annals of neurology, 64(1), 110-1; author reply 111-2. [PubMed:18350587] [WorldCat] [DOI] - ↑
Dalmau, J., Gleichman, A.J., Hughes, E.G., Rossi, J.E., Peng, X., Lai, M., ..., & Lynch, D.R. (2008).
Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies. The Lancet. Neurology, 7(12), 1091-8. [PubMed:18851928] [PMC] [WorldCat] [DOI] - ↑
Vincent, A., Bien, C.G., Irani, S.R., & Waters, P. (2011).
Autoantibodies associated with diseases of the CNS: new developments and future challenges. The Lancet. Neurology, 10(8), 759-72. [PubMed:21777830] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2 13.3
Titulaer, M.J., McCracken, L., Gabilondo, I., Armangué, T., Glaser, C., Iizuka, T., ..., & Dalmau, J. (2013).
Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study. The Lancet. Neurology, 12(2), 157-65. [PubMed:23290630] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2 高橋幸利、他 (2016)
自己免疫性脳炎/脳症. 神経治療学 33:19-26. - ↑ 15.0 15.1
Dalmau, J., & Graus, F. (2018).
Antibody-Mediated Encephalitis. The New England journal of medicine, 378(9), 840-851. [PubMed:29490181] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2
Dalmau, J., Armangué, T., Planagumà, J., Radosevic, M., Mannara, F., Leypoldt, F., ..., & Graus, F. (2019).
An update on anti-NMDA receptor encephalitis for neurologists and psychiatrists: mechanisms and models. The Lancet. Neurology, 18(11), 1045-1057. [PubMed:31326280] [WorldCat] [DOI] - ↑
Prüss, H., Höltje, M., Maier, N., Gomez, A., Buchert, R., Harms, L., ..., & Wandinger, K.P. (2012).
IgA NMDA receptor antibodies are markers of synaptic immunity in slow cognitive impairment. Neurology, 78(22), 1743-53. [PubMed:22539565] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1
Armangue, T., Spatola, M., Vlagea, A., Mattozzi, S., Cárceles-Cordon, M., Martinez-Heras, E., ..., & Spanish Herpes Simplex Encephalitis Study Group (2018).
Frequency, symptoms, risk factors, and outcomes of autoimmune encephalitis after herpes simplex encephalitis: a prospective observational study and retrospective analysis. The Lancet. Neurology, 17(9), 760-772. [PubMed:30049614] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Cavaliere, E., Nosadini, M., Pelizza, M.F., Ventura, G., Toldo, I., & Sartori, S. (2019).
Anti-NMDAR encephalitis preceded by non-herpetic central nervous system infection: Systematic literature review and first case of tick-borne encephalitis triggering anti-NMDAR encephalitis. Journal of neuroimmunology, 332, 1-7. [PubMed:30913507] [WorldCat] [DOI] - ↑
Turner, M.R., Irani, S.R., Leite, M.I., Nithi, K., Vincent, A., & Ansorge, O. (2011).
Progressive encephalomyelitis with rigidity and myoclonus: glycine and NMDA receptor antibodies. Neurology, 77(5), 439-43. [PubMed:21775733] [PMC] [WorldCat] [DOI] - ↑
Niehusmann, P., Dalmau, J., Rudlowski, C., Vincent, A., Elger, C.E., Rossi, J.E., & Bien, C.G. (2009).
Diagnostic value of N-methyl-D-aspartate receptor antibodies in women with new-onset epilepsy. Archives of neurology, 66(4), 458-64. [PubMed:19364930] [WorldCat] [DOI] - ↑
Suleiman, J., Wright, S., Gill, D., Brilot, F., Waters, P., Peacock, K., ..., & Lang, B. (2013).
Autoantibodies to neuronal antigens in children with new-onset seizures classified according to the revised ILAE organization of seizures and epilepsies. Epilepsia, 54(12), 2091-100. [PubMed:24151870] [WorldCat] [DOI] - ↑
Fujita, K., Yuasa, T., Takahashi, Y., Tanaka, K., Hashiguchi, S., Adachi, K., ..., & Kaji, R. (2012).
Detection of anti-glutamate receptor ε2 and anti-N-methyl-D: -aspartate receptor antibodies in a patient with sporadic Creutzfeldt-Jakob disease. Journal of neurology, 259(5), 985-8. [PubMed:22057403] [WorldCat] [DOI] - ↑
Finke, C., Prüss, H., Scheel, M., Ostendorf, F., Harms, L., Borowski, K., ..., & Ploner, C.J. (2012).
Anti-NMDA receptor antibodies in a case of MELAS syndrome. Journal of neurology, 259(3), 582-4. [PubMed:21898136] [WorldCat] [DOI] - ↑
Zandi, M.S., Irani, S.R., Lang, B., Waters, P., Jones, P.B., McKenna, P., ..., & Lennox, B.R. (2011).
Disease-relevant autoantibodies in first episode schizophrenia. Journal of neurology, 258(4), 686-8. [PubMed:20972895] [PMC] [WorldCat] [DOI] - ↑
Tsutsui, K., Kanbayashi, T., Tanaka, K., Boku, S., Ito, W., Tokunaga, J., ..., & Nishino, S. (2012).
Anti-NMDA-receptor antibody detected in encephalitis, schizophrenia, and narcolepsy with psychotic features. BMC psychiatry, 12, 37. [PubMed:22569157] [PMC] [WorldCat] [DOI] - ↑
Chiba, Y., Katsuse, O., Takahashi, Y., Yoneda, M., Kunii, M., Ihata, A., ..., & Hirayasu, Y. (2013).
Anti-glutamate receptor ɛ2 antibodies in psychiatric patients with anti-thyroid autoantibodies--a prevalence study in Japan. Neuroscience letters, 534, 217-22. [PubMed:23142717] [WorldCat] [DOI] - ↑
Prüss, H., Höltje, M., Maier, N., Gomez, A., Buchert, R., Harms, L., ..., & Wandinger, K.P. (2012).
IgA NMDA receptor antibodies are markers of synaptic immunity in slow cognitive impairment. Neurology, 78(22), 1743-53. [PubMed:22539565] [PMC] [WorldCat] [DOI] - ↑
Chang, E.H., Volpe, B.T., Mackay, M., Aranow, C., Watson, P., Kowal, C., ..., & Diamond, B. (2015).
Selective Impairment of Spatial Cognition Caused by Autoantibodies to the N-Methyl-D-Aspartate Receptor. EBioMedicine, 2(7), 755-64. [PubMed:26286205] [PMC] [WorldCat] [DOI] - ↑
Blitshteyn, S., & Brook, J. (2017).
Postural tachycardia syndrome (POTS) with anti-NMDA receptor antibodies after human papillomavirus vaccination. Immunologic research, 65(1), 282-284. [PubMed:27561785] [WorldCat] [DOI] - ↑ 藤井裕樹、他 (2013)
卵巣奇形腫を合併し抗NMDA受容体抗体陽性のglioblastomaの1例、臨床神経 53: 712-715.
Fujii, H., Kubo, S., Yunoki, T., Sato, K., Takamatsu, K., Tanaka, K., ..., & Kuriyama, M. (2013).
[Glioblastoma with ovarian teratoma having N-methyl-D-aspartate receptor (NMDAR) antibody in CSF--a case report]. Rinsho shinkeigaku = Clinical neurology, 53(9), 712-5. [PubMed:24097319] [WorldCat] [DOI] - ↑ 32.0 32.1 32.2
Titulaer, M.J., Höftberger, R., Iizuka, T., Leypoldt, F., McCracken, L., Cellucci, T., ..., & Dalmau, J. (2014).
Overlapping demyelinating syndromes and anti–N-methyl-D-aspartate receptor encephalitis. Annals of neurology, 75(3), 411-28. [PubMed:24700511] [PMC] [WorldCat] [DOI] - ↑ 33.0 33.1 33.2
Dahm, L., Ott, C., Steiner, J., Stepniak, B., Teegen, B., Saschenbrecker, S., ..., & Ehrenreich, H. (2014).
Seroprevalence of autoantibodies against brain antigens in health and disease. Annals of neurology, 76(1), 82-94. [PubMed:24853231] [WorldCat] [DOI] - ↑
Iizuka, T., Kaneko, J., Tominaga, N., Someko, H., Nakamura, M., Ishima, D., ..., & Nishiyama, K. (2016).
Association of Progressive Cerebellar Atrophy With Long-term Outcome in Patients With Anti-N-Methyl-d-Aspartate Receptor Encephalitis. JAMA neurology, 73(6), 706-13. [PubMed:27111481] [PMC] [WorldCat] [DOI] - ↑
Schmitt, S.E., Pargeon, K., Frechette, E.S., Hirsch, L.J., Dalmau, J., & Friedman, D. (2012).
Extreme delta brush: a unique EEG pattern in adults with anti-NMDA receptor encephalitis. Neurology, 79(11), 1094-100. [PubMed:22933737] [PMC] [WorldCat] [DOI] - ↑
Ikeda, A., Matsui, M., Hase, Y., Hitomi, T., Takahashi, Y., Shibasaki, H., & Shimohama, S. (2006).
"Burst and slow complexes" in nonconvulsive epileptic status. Epileptic disorders : international epilepsy journal with videotape, 8(1), 61-4. [PubMed:16567328] [WorldCat] - ↑
Zandi, M.S., Paterson, R.W., Ellul, M.A., Jacobson, L., Al-Diwani, A., Jones, J.L., ..., & Vincent, A. (2015).
Clinical relevance of serum antibodies to extracellular N-methyl-D-aspartate receptor epitopes. Journal of neurology, neurosurgery, and psychiatry, 86(7), 708-13. [PubMed:25246644] [PMC] [WorldCat] [DOI] - ↑
Gresa-Arribas, N., Titulaer, M.J., Torrents, A., Aguilar, E., McCracken, L., Leypoldt, F., ..., & Dalmau, J. (2014).
Antibody titres at diagnosis and during follow-up of anti-NMDA receptor encephalitis: a retrospective study. The Lancet. Neurology, 13(2), 167-77. [PubMed:24360484] [PMC] [WorldCat] [DOI] - ↑ 高橋幸利 (2016)
非ヘルペス性急性辺縁系脳炎157例の検討:急性期治療と予後. Neuroinfection 21:121-127. - ↑ 40.0 40.1
Hughes, E.G., Peng, X., Gleichman, A.J., Lai, M., Zhou, L., Tsou, R., ..., & Balice-Gordon, R.J. (2010).
Cellular and synaptic mechanisms of anti-NMDA receptor encephalitis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(17), 5866-75. [PubMed:20427647] [PMC] [WorldCat] [DOI] - ↑
Zhang, Q., Tanaka, K., Sun, P., Nakata, M., Yamamoto, R., Sakimura, K., ..., & Kato, N. (2012).
Suppression of synaptic plasticity by cerebrospinal fluid from anti-NMDA receptor encephalitis patients. Neurobiology of disease, 45(1), 610-5. [PubMed:22008231] [WorldCat] [DOI] - ↑
Malviya, M., Barman, S., Golombeck, K.S., Planagumà, J., Mannara, F., Strutz-Seebohm, N., ..., & Goebels, N. (2017).
NMDAR encephalitis: passive transfer from man to mouse by a recombinant antibody. Annals of clinical and translational neurology, 4(11), 768-783. [PubMed:29159189] [PMC] [WorldCat] [DOI] - ↑ Takahashi Y, et al. (2016)
Passive transfer of rabbit antibodies against human NMDA-type GluR into mice: effect of antibodies to GluN1, Clinical and Experimental Neuroimmunology 2016; 7: 381 - ↑
Tachibana, N., Shirakawa, T., Ishii, K., Takahashi, Y., Tanaka, K., Arima, K., ..., & Ikeda, S. (2010).
Expression of various glutamate receptors including N-methyl-D-aspartate receptor (NMDAR) in an ovarian teratoma removed from a young woman with anti-NMDAR encephalitis. Internal medicine (Tokyo, Japan), 49(19), 2167-73. [PubMed:20930449] [WorldCat] [DOI] - ↑
Miglio, G., Varsaldi, F., & Lombardi, G. (2005).
Human T lymphocytes express N-methyl-D-aspartate receptors functionally active in controlling T cell activation. Biochemical and biophysical research communications, 338(4), 1875-83. [PubMed:16289038] [WorldCat] [DOI] - ↑
Mahaut-Smith, M.P. (2012).
The unique contribution of ion channels to platelet and megakaryocyte function. Journal of thrombosis and haemostasis : JTH, 10(9), 1722-32. [PubMed:22741535] [WorldCat] [DOI] - ↑ Takahashi, Y. (2006)
Infections as causative factors of epilepsy. Future Neurology 1:290-302. - ↑
Granerod, J., Ambrose, H.E., Davies, N.W., Clewley, J.P., Walsh, A.L., Morgan, D., ..., & UK Health Protection Agency (HPA) Aetiology of Encephalitis Study Group (2010).
Causes of encephalitis and differences in their clinical presentations in England: a multicentre, population-based prospective study. The Lancet. Infectious diseases, 10(12), 835-44. [PubMed:20952256] [WorldCat] [DOI]