「スフィンゴミエリン」の版間の差分
細編集の要約なし |
|||
| (同じ利用者による、間の1版が非表示) | |||
| 74行目: | 74行目: | ||
細胞膜外層のスフィンゴミエリンをフリップし、内層のスフィンゴミエリンプールを生じる[[PMP2]]をコードする遺伝子は、遺伝性の運動・感覚性神経障害、[[シャルコー・マリー・トゥース病]]([[Charcot-Marie-Tooth disease]]; [[CMT]])のうち、脱髄が顕著な[[CMT1]]の原因遺伝子の一つとして知られている。PMP2の点変異I43NはCMT1家系で[[常染色体顕性]]の病因性変異であることが示唆されている<ref name=Gonzaga-Jauregui2015><pubmed>26257172</pubmed></ref><ref name=Hong2016><pubmed>26828946</pubmed></ref>。PMP2 I43Nは野生型タンパク質に比べ、PI(4,5)P2へ高い親和性を示し、スフィンゴミエリンのフリップを亢進する、[[機能獲得]]型変異であることが示唆された<ref name=Abe2021><pubmed>34758297</pubmed></ref>。 | 細胞膜外層のスフィンゴミエリンをフリップし、内層のスフィンゴミエリンプールを生じる[[PMP2]]をコードする遺伝子は、遺伝性の運動・感覚性神経障害、[[シャルコー・マリー・トゥース病]]([[Charcot-Marie-Tooth disease]]; [[CMT]])のうち、脱髄が顕著な[[CMT1]]の原因遺伝子の一つとして知られている。PMP2の点変異I43NはCMT1家系で[[常染色体顕性]]の病因性変異であることが示唆されている<ref name=Gonzaga-Jauregui2015><pubmed>26257172</pubmed></ref><ref name=Hong2016><pubmed>26828946</pubmed></ref>。PMP2 I43Nは野生型タンパク質に比べ、PI(4,5)P2へ高い親和性を示し、スフィンゴミエリンのフリップを亢進する、[[機能獲得]]型変異であることが示唆された<ref name=Abe2021><pubmed>34758297</pubmed></ref>。 | ||
==== アルツハイマー病 ==== | ==== アルツハイマー病 ==== | ||
[[アルツハイマー病]] | [[アルツハイマー病]]において、スフィンゴミエリンとコレステロールレベルが、[[γ―セクレターゼ]]の活性制御を通して、[[アミロイドβ前駆体タンパク質]]([[APP]])の[[アミロイドβ]]([[Aβ]])への切断をコントロールすること、また異なる切断産物が代謝酵素の制御を通じて、スフィンゴミエリンとコレステロールレベルを変化させることが報告されている<ref name=Grimm2005><pubmed>16227967</pubmed></ref>。 | ||
==== ニーマン・ピック病 ==== | ==== ニーマン・ピック病 ==== | ||
[[aSMase]](遺伝子[[SMPD1]])はリソソームにおいて、スフィンゴミエリンの異化を担う[[スフィンゴミエリンホスホジエステラーゼ]]([[sphingomyelin phosphodiesterase]], E.C. 3.1.4.12)であるが、常染色体劣性リソソーム病である[[ニーマン・ピック病]]A型およびB型([[Niemann-Pick disease]] type A/B, NPA/B)の原因遺伝子でもある<ref name=Schuchman2017><pubmed>28164782</pubmed></ref>。A型患者細胞では、酵素活性欠損により<ref name=Brady1966><pubmed>5220952</pubmed></ref>、基質であるスフィンゴミエリンがエンドソーム/リソソームに蓄積する<ref name=Kiyokawa2005><pubmed>15840575</pubmed></ref><ref name=Kiyokawa2004><pubmed>15274631</pubmed></ref><ref name=Yamaji1998><pubmed>9478988</pubmed></ref>。A型の患者は、生後1年以内に[[肝脾腫]]や発育不良を示し、急速に進行する神経変性を伴い、発達遅延が著しく、3年以内に死亡する。B型の患者では、中枢神経系の異常は見られないが、重度の肝脾腫や[[肝不全]]が現れ、血中の中性脂肪や低密度リポタンパク質(LDL) コレステロールレベルが高くなる<ref name=Schuchman2017><pubmed>28164782</pubmed></ref>。当該疾患では、後期エンドソーム・リソソームに局在するコレステロールトランスポーターNPC1、NPC2欠損によるニーマンピック病C型と同様、コレステロールの蓄積が観察されるが、これはaSMase欠損により蓄積したスフィンゴミエリンがコレステロールと相互作用することにより、NPC2によるコレステロール輸送を阻害していると考えられる<ref name=Oninla2014><pubmed>25339683</pubmed></ref>。 | [[aSMase]](遺伝子[[SMPD1]])はリソソームにおいて、スフィンゴミエリンの異化を担う[[スフィンゴミエリンホスホジエステラーゼ]]([[sphingomyelin phosphodiesterase]], E.C. 3.1.4.12)であるが、常染色体劣性リソソーム病である[[ニーマン・ピック病]]A型およびB型([[Niemann-Pick disease]] type A/B, NPA/B)の原因遺伝子でもある<ref name=Schuchman2017><pubmed>28164782</pubmed></ref>。A型患者細胞では、酵素活性欠損により<ref name=Brady1966><pubmed>5220952</pubmed></ref>、基質であるスフィンゴミエリンがエンドソーム/リソソームに蓄積する<ref name=Kiyokawa2005><pubmed>15840575</pubmed></ref><ref name=Kiyokawa2004><pubmed>15274631</pubmed></ref><ref name=Yamaji1998><pubmed>9478988</pubmed></ref>。A型の患者は、生後1年以内に[[肝脾腫]]や発育不良を示し、急速に進行する神経変性を伴い、発達遅延が著しく、3年以内に死亡する。B型の患者では、中枢神経系の異常は見られないが、重度の肝脾腫や[[肝不全]]が現れ、血中の中性脂肪や低密度リポタンパク質(LDL) コレステロールレベルが高くなる<ref name=Schuchman2017><pubmed>28164782</pubmed></ref>。当該疾患では、後期エンドソーム・リソソームに局在するコレステロールトランスポーターNPC1、NPC2欠損によるニーマンピック病C型と同様、コレステロールの蓄積が観察されるが、これはaSMase欠損により蓄積したスフィンゴミエリンがコレステロールと相互作用することにより、NPC2によるコレステロール輸送を阻害していると考えられる<ref name=Oninla2014><pubmed>25339683</pubmed></ref>。 | ||
| 94行目: | 95行目: | ||
==== インフルエンザA型ウイルス ==== | ==== インフルエンザA型ウイルス ==== | ||
[[インフルエンザA型ウイルス]](IAV)もまた、感染細胞の細胞膜上の脂質マイクロドメイン“脂質ラフト”の感染と出芽への関与が報告されている<ref name=Eierhoff2010><pubmed>20844577</pubmed></ref><ref name=Verma2018><pubmed>30453689</pubmed></ref> | [[インフルエンザA型ウイルス]](IAV)もまた、感染細胞の細胞膜上の脂質マイクロドメイン“脂質ラフト”の感染と出芽への関与が報告されている<ref name=Eierhoff2010><pubmed>20844577</pubmed></ref><ref name=Verma2018><pubmed>30453689</pubmed></ref>。スフィンゴミエリン特異的な関与については、遺伝的あるいは薬理的にSMS1を阻害した細胞では、新しいウイルス粒子の成熟と産生が遅れることが報告されている <ref name=Tafesse2013><pubmed>23576732</pubmed></ref>。ウイルス粒子のスフィンゴミエリナーゼ処理は、感染性を低下し、ウイルスの膜への付着と細胞内への取り込みを阻害した。また、細胞のスフィンゴミエリナーゼ処理は、ウイルス感染、取り込みを減少し、細胞への外来性のスフィンゴミエリン添加は感染を亢進した<ref name=Audi2020><pubmed>32425895</pubmed></ref>。またスフィンゴミエリンとコレステロールの複合体に特異的に結合するタンパク質、[[Nakanori]]により[[MDCK細胞]]からのウイルスの出芽が抑えられた<ref name=Makino2017><pubmed>27492925</pubmed></ref> | ||
=== その他 === | === その他 === | ||
2025年5月4日 (日) 22:35時点における最新版
冨重 斉生、小林 俊秀
ストラスブール大学薬学部
DOI:10.14931/bsd.11034 原稿受付日:2025年4月22日 原稿完成日:2025年5月3日
担当編集委員:古屋敷 智之(神戸大学大学院医学研究科・医学部 薬理学分野)
英:sphingomyelin 独:Sphingomyelin 仏:sphingomyéline
スフィンゴミエリンとは、スフィンゴイド塩基に脂肪酸がアミド結合した構造を持つ、哺乳動物細胞膜の主要構成スフィンゴリン脂質である。特に神経細胞の軸索を覆うミエリン鞘に豊富に存在し、細胞膜の構造維持やシグナル伝達に重要な役割を果たす。また、スフィンゴミエリンはセラミドやスフィンゴシン-1-リン酸などの生理活性脂質の前駆体としても機能し、細胞の増殖や分化、アポトーシスなどの調節に関与する。その代謝異常は、アルツハイマー病やニーマン・ピック病などの神経疾患との関連が指摘されている。さらに、スフィンゴミエリンはコレステロールとともに脂質ラフトと呼ばれる膜ドメインを形成し、タンパク質の膜分布や細胞機能の制御に寄与している。
スフィンゴミエリンとは
1880年代にドイツの化学者Johann L. W. Thudicamによって脳組織から単離された脂質で、その謎の多い性質からギリシャ神話のスフィンクスになぞらえて、スフィンゴミエリンと名付けられた[1]。
スフィンゴミエリンは細胞に豊富な膜構成脂質で、哺乳類[2]から線虫[3]、マラリア寄生虫Plasmodium falciparum[4]のような原生動物類まで、さまざまな生物種に存在している[5]。主要な膜構成スフィンゴ脂質の一つであり、多くの哺乳動物組織において全リン脂質の2-15%を占める[6]。特に、赤血球、水晶体、末梢神経組織、脳などで高いレベルで存在する[6][7]。その名前の元となったミエリン鞘においても検出される。
スフィンゴミエリンはコレステロールとともに脂質ラフトとも呼ばれる膜ドメインの形成を通してタンパク質の膜分布を制御し、シグナル伝達等の細胞機能に関与していると考えられている。また、単に細胞膜の主要構成脂質であるだけでなく、セラミドやスフィンゴシン-1-リン酸などのような生理活性脂質のリザーバーとしても重要である。
スフィンゴミエリンの代謝酵素とこれら生理活性脂質がうつ病・統合失調症やアルツハイマー病など様々な精神・神経疾患に関与することが報告されている[8][9]。
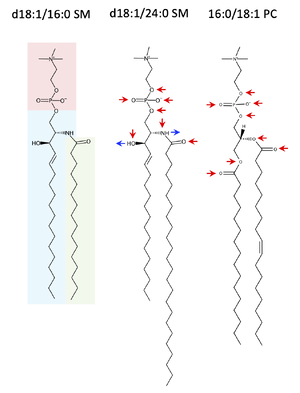
左から、d18:1/16:0 スフィンゴミエリン、d18:1/24:0 スフィンゴミエリン、16:0/18:1 PCの構造。赤、青、緑網掛けは、それぞれ、ホスホコリン極性頭部、スフィンゴシン、アシル鎖部分を示す。赤、青矢印は、それぞれ水素結合受容基、供与基を示す。
基本骨格
スフィンゴミエリンの構造は1927年にN-acyl-sphingosine-1-phosphorylcholine (ceramide-1-phosphorylcholine)であることが報告された[10]。すなわち、極性頭部であるホスホコリンが、リン酸ジエステル結合によってセラミドの水酸基と縮合した構造をとる(図1)。セラミド部分は、長鎖塩基のアミド基に様々な鎖長の脂肪酸がアミド結合した構造(N-アシル鎖)をとり、長鎖塩基は鎖長C18で、4位と5位の間にトランス二重結合をもつ、スフィンゴシン(sphingosine; 1,3-dihydroxy-2-amino-4-octadecene, d18:1)であることが多い。二重結合の飽和したジヒドロスフィンゴシン(dihydrosphingosine/sphinganine, d18:0)もまた少量であるが存在する。
また、天然のスフィンゴミエリンの立体配置は、D-erythroであり、炭素骨格2位と3位の炭素に付加したアミド基と水酸基がそれぞれ2S、3Rの配置をとる[11]。N-アシル鎖の主要構成種は、飽和直鎖状の長鎖脂肪酸であるパルミチン酸(palmitic acid, C16:0)、ステアリン酸(stearic acid, C18:0)や極長鎖脂肪酸であるリグノセリン酸(lignoceric acid, C24:0)の他、一価不飽和のネルボン酸(nervonic acid, C24:1∆15c)も一般的である[12][13]が、4位の炭素に水酸基が付加したものや、トランス二重結合が完全に飽和したジヒドロスフィンゴミエリンも存在する。表皮角化細胞や男性生殖細胞では、極長鎖よりも長い(C26-C36)超長鎖脂肪酸をもつものが存在する[14]。
同じ極性頭部、ホスホコリンを持つグリセロリン脂質、ホスファチジルコリン(PC)と異なり、スフィンゴミエリンは水素結合供与基(2位のアミノ基と3位の水酸基)を有しており(図1)、分子内、分子間で水素結合ネットワークを形成しうる[15][16]。この性質が以下に述べるコレステロールとの相互作用による秩序液体(liquid-ordered (Lo))ドメインの形成において重要である。
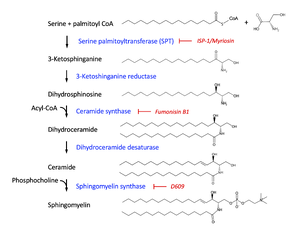
スフィンゴミエリンとその前駆体、反応を担う酵素とその阻害剤をそれぞれ、黒、青、赤字で示す。
生合成
生合成経路の細胞局在
スフィンゴミエリンの生合成は、小胞体における前駆体セラミド合成、ゴルジ体へのセラミドの輸送とゴルジ体におけるスフィンゴミエリン合成、と異なるコンパートメントにまたがり進行する。一連の反応は、小胞体の複数回膜貫通タンパク質である、セリンパルミトイルトランスフェラーゼを含む複合体によるL-セリンとパルミトイルCoAの縮合から始まる。この反応産物3-ケト-スフィンガニンは、3-ケト-スフィンガニンレダクターゼによりジヒドロスフィンゴシン/スフィンガニンへ還元された後、セラミド合成酵素によりアシル化され、ジヒドロセラミドが生じる。セラミド合成酵素は、哺乳動物細胞では、異なる基質特異性を持つ6種の酵素からなるファミリーを形成し、スフィンゴミエリンのアシル鎖長を決定している。ジヒドロセラミドの長鎖塩基の4、5位の間にトランス二重結合がジヒドロセラミド不飽和化酵素により導入され、セラミドが合成される[17](図2)。
セラミドは、セラミド輸送タンパク質CERTによって、小胞体とトランスゴルジ領域間の膜接触部位(membrane contact sites)において小胞輸送非依存に輸送される[17][15]。長鎖セラミド(C14:0, C16:0, C18:0, C20:0)がCERTの主要なリガンドである[18]のに対し、極長鎖セラミド(C24)は小胞輸送によってゴルジ体へ運ばれることが最近報告されている[19][20][21]。ゴルジ体に輸送されたセラミドへ、スフィンゴミエリン合成酵素(sphingomyelin synthase or phosphatidylcholine:ceramide cholinephosphotransferase)によって、ホスファチジルコリン由来のホスホコリンが付加されることにより、スフィンゴミエリンが生合成される(図2)。この際、PCからホスホコリンが除かれることにより、ジアシルグリセロールが副産物として生成される。
スフィンゴミエリン合成酵素
スフィンゴミエリン合成酵素活性は1970年代より、マウス肝臓の膜画分に検出されていたが[2][22]、2004年に二つのグループからスフィンゴミエリン合成酵素遺伝子のクローニングが報告された[5][23]。Huitemaらはlipid phosphate phosphatase (LPP)の特徴的モチーフなど、配列情報を基にin silicoスクリーニングを用い[5]、Yamaokaらはスフィンゴミエリン合成欠損マウスリンパ細胞を用いた発現クローニングの手法により[23]、スフィンゴミエリン合成酵素遺伝子を同定した。
ヒトでは、スフィンゴミエリン合成酵素1 (sphingomyelin synthase 1; SMS1) 、2 (SMS2)の二つの酵素がSGMS1とSGMS2の二つの遺伝子にコードされている。これらSGMS1、SGMS2は哺乳動物間で非常に高く保存されている(ヒト対マウス: >90%)他、スフィンゴミエリンを持つ生物、線虫C. elegansなどでも遺伝子とその産物の酵素活性が確認されている[5]。両者の転写産物は、ヒト脳、心臓、腎臓、肝臓、筋肉、および胃で検出されており、さまざまな臓器に広く発現していることが明らかになっている[5]。
SMS1はトランスゴルジ膜に局在し、新規スフィンゴミエリン合成に関わっているのに対し、SMS2はゴルジ体膜にも局在するが、主に細胞膜に局在し、細胞膜のスフィンゴ脂質の異化により生じたセラミドを基質としていると考えられている[5][24]。SMS1、SMS2は6回膜貫通タンパク質であり、その触媒中心はSMS1ではゴルジ体内腔側を、SMS2では細胞外側を向いていると考えられている。
上記、SMS1、SMS2の他に、配列類似性を基にスフィンゴミエリン合成酵素関連タンパク質(sphingomyelin synthase-related protein; SMSr)もまた同定された[5]。試験管内のアッセイでは、SMSrはスフィンゴミエリン合成活性は示さず、哺乳類ではごく微量存在するスフィンゴ脂質、セラミドホスホエタノールアミン(CPE)合成活性を示す[25][5]。SMSrは小胞体に局在し、セラミドホスホエタノールアミンを合成することで小胞体のセラミドレベルを調節すると考えられている[26]。スフィンゴミエリン生合成に伴う、セラミド消費とジアシルグリセロール産生は、単に生合成のみならず、二つの生理活性脂質を介したシグナル伝達により細胞増殖に関与するという仮説“スフィンゴミエリンサイクル”が立てられている[27][28]。
代謝
スフィンゴミエリンの分解に関しては、5つの異なるスフィンゴミエリナーゼ(スフィンゴミエリナーゼホスホジエステラーぜ、sphingomyelin phosphodiesterase; SMPD1-4, SMPDL3A)が、細胞膜、小胞体、ゴルジ体、核、リソソーム、ミトコンドリア、細胞外スペースに局在することが知られている[29]。これらの酵素は至適pHが異なっており、それぞれの細胞内機能部位におけるpHを反映していると考えられる。中性スフィンゴミエリナーゼ(nSMase2:SMPD3)は、酸性リン脂質によってアロステリックに活性化され、二カ所のパルミトイル化により細胞膜内層に局在する[30]。酸性スフィンゴミエリナーゼ(aSMase:SMPD1)は、分泌経路を通り、リソソームへ局在し、酵素活性に必要なZnと結合する。腫瘍壊死因子 (tumor necrosis factor; TNFやインターロイキン1(interleukin-1; IL-1)などのサイトカイン刺激により細胞外へ分泌される[31]が、分泌された分子が至適pH、Zn不在の環境下、酵素活性を発揮するかは不明である。
細胞内局在
スフィンゴミエリンは細胞膜にその大部分(90%[32])が存在する一方で、トランスゴルジ体膜[33][34][35]や後期エンドソーム・リソソーム[35]、リサイクリングエンドソーム[36]の他、核[37]にも存在する。
この細胞内局在は、スフィンゴミエリン合成酵素やスフィンゴミエリナーゼの局在を反映していると考えられる。上述のように、SMS1はゴルジ体膜に局在し、小胞体から輸送されたセラミドを基質にスフィンゴミエリンを合成する。スフィンゴミエリンは他のリン脂質と比べ、コレステロールとの親和性が高く[38][39][40][41]、細胞膜上では両者からなる微小な膜ドメイン(5-50 nm)(脂質ラフト)を形成すると考えられている[42][43][44][45][46]。生合成されたコレステロールは、小胞体から輸送タンパク質オキシステロール結合タンパク質1 (oxysterol-binding protein 1; OSBP)によりトランスゴルジ体膜に供給され[47]、ここで初めてスフィンゴミエリン/コレステロールの膜ドメインが形成されると推測されている[48][49][50]。トランスゴルジ体膜で合成されたスフィンゴミエリンは、細胞膜へ向けた小胞輸送経路によって細胞膜に供給され[34][51] 、また、GPI-アンカー型タンパク質のトランスゴルジネットワーク(TGN)におけるソーティング/輸送に関わっていると考えられている。
細胞膜ではスフィンゴミエリンは、外層(outer/ extracellular leaflet)に約90%が分布しているが[12][52]、内層(inner/cytoplasmic leaflet)にも存在し、クラスターを形成している[52]。この細胞質側のスフィンゴミエリンプールは、細胞膜外層のスフィンゴミエリンが細胞質の可溶性のPI(4,5)P2結合タンパク質末梢髄鞘タンパク質2 (peripheral myelin protein 2; PMP2) 依存的なフリップにより生じる[53]。細胞膜のスフィンゴミエリンは、エンドサイトーシスによって細胞内に取り込まれ、後期エンドソーム・リソソームにおいて酸性スフィンゴミエリナーゼ(acid sphingomyelinase, aSMase)によって加水分解され、さらなる異化反応が進行する。中性スフィンゴミエリナーゼnSMase2の働きにより生じたセラミドが多胞体(mutivesicular body; MVB)からのエクソソーム(exosome、細胞間コミュニケーションに働くとされる)の放出のトリガーとなっていることが報告されている[54]。nSMase2の阻害により、それぞれ神経発達と神経変性に重要なマイクロRNA(miRNA)やクロイツフェルト・ヤコブ病を引き起こすプリオンタンパク質等を含むエクソソーム分泌が減少する[55][56]。また、バクテリア感染細胞において、バクテリアを内包するダメージを受けたリソソームから細胞質側に露出したスフィンゴミエリンがシグナルとなり、オートファジーによる損傷リソソームの処理が開始することが明らかになってきている[57][58][59]。
種類と作用、細胞機能
スフィンゴイド塩基の分子種は、スフィンゴシン(d18:1) が最も一般的であるが、ジヒドロスフィンゴシン/スフィンガニン(d18:0)もみられる。N-アシル基の脂肪酸としては、パルミチン酸(palmitic acid, C16:0)が哺乳動物末梢細胞では最も多く、極長鎖脂肪酸のリグノセリン酸(lignoceric acid, C24:0)や、一価不飽和のネルボン酸(nervonic acid, C24:1∆15c)も一般的である[60][61][62][63][12][64][65][13][66][67][68]。神経・脳組織では、ステアリン酸(C18:0)がより一般的である[69][13]。ブタ脳では、C18:0が45.5%、C24:0が23.3%を占める他、C16:0, C20:0, C22:0, C24:1は各々10%未満の少量である[70]。牛乳では、C23:0が32.8%、C24:0が20%、C22:0が19.1%、C16:0が18.5%の他、C14:0、C18:0、C20:0、C24:1は各々10%未満の少量を構成する[70]。鶏卵では、C16:0が83.9%を占める他、C18:0、C20:0、C22:0、C24:0は各々10%未満の少量である[70]。
スフィンゴミエリンの主要な分子種は、上述のように、長鎖塩基部分ではトランスの二重結合、また飽和N-アシル基を有しており、他のリン脂質と比べ(例えば代表的なリン脂質C16:0/C18:1 PC (POPC)の相転移温度は約-4°C)、比較的高い相転移温度(C16:0 スフィンゴミエリン, 41°C)を示す[71][72]。また、コレステロールは、他のリン脂質と比べ、スフィンゴミエリンと高い親和性を示す[38][39][40][41]。スフィンゴミエリン、不飽和ホスファチジルコリン、コレステロールから構成されるモデル膜は、生理的温度で、スフィンゴミエリンとコレステロールに富んだ秩序液体ドメイン(liquid-ordered domain, Lo domain)と不飽和PCに富んだ無秩序液体ドメイン(liquid-disordered domain, Ld domain)とに相分離する。Loドメインでは、脂質は緊密に充填されつつも流動性を保持した、アシル鎖部分の伸展した厚みのある膜ドメインを形成する一方、Ldドメインでは、脂質は不飽和脂肪酸鎖の配向がランダムな流動性の高い膜ドメインを形成する。このようなコレステロールとの相互作用に起因した膜側方面での相分離は、脂質ラフト仮説の論拠となっており、こうした微小Lo膜ドメインが、タンパク質の輸送、ソーティングやシグナル伝達などの足場として機能すると考えられている[73][48][74][49][75]。
ゴルジ体層間の輸送やゴルジ体から小胞体への逆行輸送(retrograde traffic)に働くコートマーCOPI complexのコンポーネントであるp24の膜貫通領域の特異的な配列(VXXTLXXIY)がC18:0スフィンゴミエリンのアシル鎖と相互作用する[76]。ゴルジ体膜に比べCOPI小胞は、スフィンゴミエリンとコレステロールが有意に少ない[77]が、この特異的相互作用によりC18:0スフィンゴミエリンがCOPI小胞でp24のオリゴマー状態を制御すると考えられている[76]。
遊走細胞では、細胞質物質を内包したmigrasomeと呼ばれる膜小胞が遊走方向とは逆向きに進展したretraction fibersに沿って形成し[78]、器官形態形成[79]、胎生血管新生[80]、細胞内mRNA輸送[81]やミトンコンドリア品質管理[82]に役割を果たしていると考えられている。このmigrasomeは、初め遊走細胞の進行方向側端にSMS2が蓄積した不動な部位として生成するが、細胞の遊走に伴い、細胞後方からretraction fibersへと成長しながら移動することが報告されている[83]。Migrasomeはスフィンゴミエリンに富んでおり、SMS2がその合成を担っていると考えられ、併せてセラミド合成酵素5 (ceramide synthase 5; CerS5)とCERTもmigrasome生成に必要な分子として同定された[83]。
最近になって、細胞質側に提示されたスフィンゴミエリンの生理的機能が報告されている。通常、細胞外側(オルガネラ内腔側)の膜層に存在するスフィンゴミエリンが、細胞質側に露出することにより、シグナルとして機能する。非典型オートファジーであるconjugation of ATG8 to single membranes (CASM)、ではE3リガーゼ複合体が、ダメージを受けた細胞内オルガネラをユビキチン様ATG8/LC3ファミリータンパク質で標識する。このCASMのうち、スフィンゴミエリン特異的な経路sphingomyelin-TECPR1-induced LC3 lipidation (STIL) [84]の存在が報告されている。病原体の侵入[58]や様々な薬剤(ナノ粒子、トランスフェクション試薬、抗ヒスタミン薬、LLOMe等のリソソーム膜透過化薬、界面活性剤)でダメージを受けたリソソーム膜において、tectonin b-propeller repeat containing 1 (TECPR1)が、細胞質側に露出したスフィンゴミエリンに結合することで、TECPR1-ATG5-ATG12複合体をリソソーム膜にリクルートし、E3リガーゼ活性によりATG8/LC3標識することが報告されている[57][85][59]。この相互作用において、TECPR1 N末のdysferlin (DysF) domainが最小のスフィンゴミエリン結合ドメインである[57]。
リソソームに生じた膜ダメージは、Ca2+により活性化されたスクランブラーゼTMEM16Fによる脂質のscramblingを引き起こし、スフィンゴミエリンが細胞質側膜に提示される。さらにスフィンゴミエリンの中性スフィンゴミエリナーゼによるセラミド生成が、ESCRT非依存のリソソーム膜修復機構を誘導する[86]。
疾患との関連
神経疾患
シャルコー・マリー・トゥース病
哺乳動物ミエリン膜では、脂質の含量が約70%と非常に高く[87][88][89][90][91]、特徴的な脂質組成を示す。コレステロールとガラクトシルセラミドが、髄鞘において、27-28%、20-24%の割合で存在するのに対し[92][90][93]、スフィンゴミエリンは、中枢、末梢神経系のミエリンにおいて、それぞれ6%、13%を占める[94]。SGMS1あるいはSGMS2のノックアウトマウスでは、ミエリンに障害は観察されないが、酸性スフィンゴミエリナーゼの遺伝・薬理的阻害は、cuprizoneによる脱髄マウスモデルにおいて、有意なミエリンの回復が見られ、スフィンゴミエリンのミエリン鞘における役割が示唆されている[95]。
細胞膜外層のスフィンゴミエリンをフリップし、内層のスフィンゴミエリンプールを生じるPMP2をコードする遺伝子は、遺伝性の運動・感覚性神経障害、シャルコー・マリー・トゥース病(Charcot-Marie-Tooth disease; CMT)のうち、脱髄が顕著なCMT1の原因遺伝子の一つとして知られている。PMP2の点変異I43NはCMT1家系で常染色体顕性の病因性変異であることが示唆されている[96][97]。PMP2 I43Nは野生型タンパク質に比べ、PI(4,5)P2へ高い親和性を示し、スフィンゴミエリンのフリップを亢進する、機能獲得型変異であることが示唆された[53]。
アルツハイマー病
アルツハイマー病において、スフィンゴミエリンとコレステロールレベルが、γ―セクレターゼの活性制御を通して、アミロイドβ前駆体タンパク質(APP)のアミロイドβ(Aβ)への切断をコントロールすること、また異なる切断産物が代謝酵素の制御を通じて、スフィンゴミエリンとコレステロールレベルを変化させることが報告されている[98]。
ニーマン・ピック病
aSMase(遺伝子SMPD1)はリソソームにおいて、スフィンゴミエリンの異化を担うスフィンゴミエリンホスホジエステラーゼ(sphingomyelin phosphodiesterase, E.C. 3.1.4.12)であるが、常染色体劣性リソソーム病であるニーマン・ピック病A型およびB型(Niemann-Pick disease type A/B, NPA/B)の原因遺伝子でもある[99]。A型患者細胞では、酵素活性欠損により[100]、基質であるスフィンゴミエリンがエンドソーム/リソソームに蓄積する[35][101][102]。A型の患者は、生後1年以内に肝脾腫や発育不良を示し、急速に進行する神経変性を伴い、発達遅延が著しく、3年以内に死亡する。B型の患者では、中枢神経系の異常は見られないが、重度の肝脾腫や肝不全が現れ、血中の中性脂肪や低密度リポタンパク質(LDL) コレステロールレベルが高くなる[99]。当該疾患では、後期エンドソーム・リソソームに局在するコレステロールトランスポーターNPC1、NPC2欠損によるニーマンピック病C型と同様、コレステロールの蓄積が観察されるが、これはaSMase欠損により蓄積したスフィンゴミエリンがコレステロールと相互作用することにより、NPC2によるコレステロール輸送を阻害していると考えられる[103]。
パーキンソン病
パーキンソン病において、ニーマンピック病のようなリソソームの脂質蓄積病との関連が示唆されており、リソソームの機能不全がα-シヌクレイン(α-Syn)の蓄積を引き起こすことが示唆されているが、発症機序は現段階では不明である[104]。
骨疾患
SMS2は骨組織で高い発現レベルを示し、そのヘテロ接合変異が、常染色体顕性遺伝疾患、骨脆弱性を伴う頭蓋骨のドーナツ状病変(calvarial doughnut lesions with bone fragility; CDL: OMIM #126550)の原因変異として同定されている[105]。シビアな変異I62SやM64Rをもつ病原性SMS2は小胞体から出ることができず、小胞体でスフィンゴミエリンを合成/蓄積することで、細胞内の脂質プロファイルに変化を生じる[24]。
ウイルス感染症
ヒト免疫不全症候群ウイルス1型
ヒト免疫不全症候群ウイルス1型 (HIV-1, human immunodeficiency virus type-I)は、エンベロープウイルスであり、複製されたウイルスは、感染細胞の細胞膜で形成、出芽し、細胞外へ放出される。ウイルスエンベロープのリピドミクス解析では[106][107][108][109][110]、スフィンゴミエリンが感染細胞の細胞膜に比べ濃縮されていることが報告されている[108][109][110]。これらの結果は、スフィンゴミエリン、コレステロールに特異的に結合するタンパク質(脂質プローブ)と先端顕微鏡技術の使用によって確認され、スフィンゴミエリンやコレステロールが細胞膜上のウイルス形成部位に濃縮されることが観察されている[111][112][113]。セラミド合成酵素阻害剤fumonisin B1処理は、産生されたウイルスの感染性を減少する[107]。宿主由来の中性スフィンゴミエリナーゼ(nSMase2)がウイルスに取り込まれ、その活性がウイルス成熟に重要であることが報告された[114][115]。nSMase2の薬理的、遺伝的阻害は、ウイルスプロテアーゼ活性低下によるウイルス成熟を阻害し、ウイルスの感染性を低下させる[114][115]。
C型肝炎ウイルス
C型肝炎ウイルス(hepatitis C virus)のエンベロープのリピドミクス解析によって、スフィンゴミエリン、コレステロールエステルが濃縮されている一方で、ホスファチジルコリン、ホスファチジルエタノールアミン(PE)、ホスファチジルセリン(PS)、ホスファチジルイノシトール(PI)などが減少していることが明らかになっている[116]。ウイルス粒子のスフィンゴミエリナーゼ処理は、ウイルスの取り込みを阻害し、ウイルスの感染性を低下する[117]。また、細胞のスフィンゴ脂質生合成の阻害剤処理は、ウイルス産生を阻害する[117]。
ウエストナイルウイルス
ウエストナイルウイルス(WNV)のエンベロープには、スフィンゴミエリンが濃縮されている[118]。感染細胞のnSMase阻害剤処理は、ウエストナイルウイルスの産生を減少する。ウエストナイルウイルスの感染はaSMase欠損マウスや、ニーマン・ピックA患者由来の細胞など、スフィンゴミエリンが蓄積していると考えられる細胞で増加する[119]。培養細胞へのスフィンゴミエリンの添加は、WNV感染を増加する一方で、スフィンゴミエリン合成阻害剤処理は、ウエストナイルウイルス感染を減少する。共焦点顕微鏡観察では、ウエストナイルウイルス感染細胞においてスフィンゴミエリンとWNV double-strand RNAが共局在する。このようにスフィンゴミエリンは、ウエストナイルウイルスの異なる二つのステップに重要な役割を果たしている。
インフルエンザA型ウイルス
インフルエンザA型ウイルス(IAV)もまた、感染細胞の細胞膜上の脂質マイクロドメイン“脂質ラフト”の感染と出芽への関与が報告されている[120][121]。スフィンゴミエリン特異的な関与については、遺伝的あるいは薬理的にSMS1を阻害した細胞では、新しいウイルス粒子の成熟と産生が遅れることが報告されている [122]。ウイルス粒子のスフィンゴミエリナーゼ処理は、感染性を低下し、ウイルスの膜への付着と細胞内への取り込みを阻害した。また、細胞のスフィンゴミエリナーゼ処理は、ウイルス感染、取り込みを減少し、細胞への外来性のスフィンゴミエリン添加は感染を亢進した[123]。またスフィンゴミエリンとコレステロールの複合体に特異的に結合するタンパク質、NakanoriによりMDCK細胞からのウイルスの出芽が抑えられた[43]
その他
aSMaseと酸性セラミダーゼ(aCDase)が、炎症性サイトカインTNF-αやIL-1β刺激に応じたIL-6やCC-chemokine ligand 5 (CCL5)の産生を正に調節する一方で、スフィンゴシンキナーゼ(SphK2)は負に調節していることが示されている[124]。すなわち、スフィンゴシンがCCL5の産生に重要であることが示唆されている。CCL5の過剰産生は、動脈硬化、喘息やがんを含む疾患に関連付けられている[124]。臨床では、血清中のaSMaseレベルにより全身性の炎症進展のリスクがある患者の死亡率を予見しうることが報告されている[125]。
Sgms2-ノックアウトマウスでは、スフィンゴミエリンレベルが減少するが、インスリン感受性が亢進し、高脂質食誘導の肥満に耐性を示した[126]。Sgms1-ノックアウトマウスでは、インスリン分泌の減少、白色脂肪組織での酸化ストレス誘導が観察され、白色脂肪細胞の破壊と機能不全を生じた[127]。
特異的標的毒素とその可視化技術への利用
スフィンゴミエリンをターゲットとし、多量体形成による細胞膜に孔を形成する毒素が知られている。これらの毒素は、変異導入や全長タンパク質の脂質結合ドメインへの短縮化により単量体・無毒化が図られ、細胞におけるスフィンゴミエリンの分布・動態可視化に用いられている[128][129]。また、蛍光スフィンゴミエリン 類似体による可視化例についても総説を紹介する[130][131][132][133]。
スフィンゴミエリン特異的毒素
ライセニン
ライセニン(lysenin)は、33 KDaのミミズ由来[134]の孔形成毒素で特異的にスフィンゴミエリンに結合する(KD = 5.3 x 10-9 M)[102]。部分的に共通した他の脂質との結合比較により、ライセニンはセラミドに付加したホスホコリン構造を認識していると推測される[128]。孔形成毒素としてのライセニンへの耐性を指標として、スフィンゴミエリン合成に関わる遺伝子のスクリーニングに利用され、セラミド輸送タンパク質CERTを含む、スフィンゴミエリン合成関連遺伝子の同定に成功している[135][136][137][138][139]。ライセニンのC末のβ-trefoilモチーフがスフィンゴミエリン への結合に関わっており、N末のオリゴマー形成に必要なドメインを欠損した変異体NT-Lys(15.9 KDa)は、スフィンゴミエリン への特異的結合を維持するが(KD = 1.9 x 10-7 M)[35]、毒性を欠失しており、蛍光色素や蛍光タンパク質による標識体を用いて、細胞におけるスフィンゴミエリンの局在やダイナミクスが可視化されている。ライセニンは5-6分子のスフィンゴミエリンからなるクラスターに結合し[140][141][142]、スフィンゴミエリンとクラスターを形成する糖脂質や、飽和脂肪酸をもつホスファチジルコリンの共存によって、その結合が阻害される[141][142]。
エキナトキシン
エキナトキシン(equinatoxin II, EqtII)は、イソギンチャク由来のアクチノポリンファミリーに属する20 KDaの孔形成毒素であり[143][144]、スフィンゴミエリンに特異的に結合する(KD = 7.5 x 10-9 M)[145]。EqtII(8-69)は、V8C/K69Cの二重変異を持ち、分子内ジスルフィド架橋形成により立体構造変換を阻害することで無毒化された変異体であり[145]、細胞内スフィンゴミエリン可視化に利用された[33]。Eqt-SMは、V22W/Y108Iの二重変異を持つ無毒化変異体でトランスゴルジネットワークから細胞表層へ輸送される、GPI-アンカー型タンパク質を積荷した小胞へのスフィンゴミエリン濃縮を可視化するのに用いられた[34]。最近では、別の無毒化NT-EqtIIがL26A/P81Aの二重変異の導入により作製され、細胞膜内層のスフィンゴミエリン動態の可視化に使用された[146]。
人工膜を用いて、NT-LysがLoドメインの、EqtIIはLdドメインのスフィンゴミエリンに結合するという差異が観察されている[142]。これはNT-Lysがクラスター化したスフィンゴミエリン を好むのに対し、EqtIIは密度の低いスフィンゴミエリン に結合することを反映していると推測されている[128][142]。
スフィンゴミエリン /コレステロール複合体特異的毒素・結合タンパク質
Aegerolysins
キノコ由来のAegerolysinsは、二つのサブユニットから構成される孔形成毒素の約15 KDaの膜結合サブユニットである。類似したタンパクであるOstreolysin A (OlyA)[147]、pleurotolysin A2 (PlyA2)[148]の脂質結合性が解析され、スフィンゴミエリン/コレステロールの複合体に結合することが報告された。OlyAは、コレステロールとの複合体形成時の極性頭部が膜面へ傾いたコンフォメーションのスフィンゴミエリンを認識することが推測されている[149]。これらのタンパク質のスフィンゴミエリン/コレステロール複合体に対する結合定数は非常に弱く、求められていないが、CPE/コレステロール複合体には高い親和性で結合する(OlyA, KD = 1.2 x 10-9 M; PlyA2, KD = 1.2 x 10-8 M)[150]。類似タンパクであるErylysin A (EryA) はCPE/コレステロールには結合するがスフィンゴミエリン/コレステロールには結合しない[150]
Nakanori
Nakanoriもまたキノコ由来のスフィンゴミエリン/コレステロール複合体結合タンパク質であるが、他のスフィンゴミエリンやスフィンゴミエリン/コレステロール結合タンパク質とは配列類似性を持たず、毒性を示さない。一方Nakanoriの立体構造はスチコライシン、エキナトキシン等のアクチノポリンと類似しているがN末に30残基のアミノ酸を余分に持っている点が異なっている。Nakanoriはスフィンゴミエリン/コレステロールへの高い親和性を示す(KD = 1.2 x 10-9 M)[43]。
参考文献
- ↑ Thudicum, J.C.W. (1884).
A Treatise on the Chemical Constitution of Brain. ファイル:Thudicum Sphingomyelin.pdf - ↑ 2.0 2.1
Ullman, M.D., & Radin, N.S. (1974).
The enzymatic formation of sphingomyelin from ceramide and lecithin in mouse liver. The Journal of biological chemistry, 249(5), 1506-12. [PubMed:4817756] [WorldCat] - ↑
Satouchi, K., Hirano, K., Sakaguchi, M., Takehara, H., & Matsuura, F. (1993).
Phospholipids from the free-living nematode Caenorhabditis elegans. Lipids, 28(9), 837-40. [PubMed:8231660] [WorldCat] [DOI] - ↑
Elmendorf, H.G., & Haldar, K. (1994).
Plasmodium falciparum exports the Golgi marker sphingomyelin synthase into a tubovesicular network in the cytoplasm of mature erythrocytes. The Journal of cell biology, 124(4), 449-62. [PubMed:8106545] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3 5.4 5.5 5.6 5.7
Huitema, K., van den Dikkenberg, J., Brouwers, J.F., & Holthuis, J.C. (2004).
Identification of a family of animal sphingomyelin synthases. The EMBO journal, 23(1), 33-44. [PubMed:14685263] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Koval, M., & Pagano, R.E. (1991).
Intracellular transport and metabolism of sphingomyelin. Biochimica et biophysica acta, 1082(2), 113-25. [PubMed:2007175] [WorldCat] [DOI] - ↑
Talbott, C.M., Vorobyov, I., Borchman, D., Taylor, K.G., DuPré, D.B., & Yappert, M.C. (2000).
Conformational studies of sphingolipids by NMR spectroscopy. II. Sphingomyelin. Biochimica et biophysica acta, 1467(2), 326-37. [PubMed:11030591] [WorldCat] [DOI] - ↑
Choi, B.J., Park, M.H., Jin, H.K., & Bae, J.S. (2024).
Acid sphingomyelinase as a pathological and therapeutic target in neurological disorders: focus on Alzheimer's disease. Experimental & molecular medicine, 56(2), 301-310. [PubMed:38337058] [PMC] [WorldCat] [DOI] - ↑
Zhuo, C., Zhao, F., Tian, H., Chen, J., Li, Q., Yang, L., ..., & Song, X. (2022).
Acid sphingomyelinase/ceramide system in schizophrenia: implications for therapeutic intervention as a potential novel target. Translational psychiatry, 12(1), 260. [PubMed:35739089] [PMC] [WorldCat] [DOI] - ↑ Pick, L., and Bielschowsky, M. (1927).
über lipoidzellige Splenomegalie (Typus Niemann-Pick) und amaurotische Idiotie. Klin. Wschr. 6: 1631-1632. - ↑ Shapiro, D., Flowers, H.M. (1962).
Studies on Sphingolipids. VII. Synthesis and Configuration of Natural Sphingomyelins. J. Am. Chem. Soc., 84(6), 1047–50. [DOI]</pubmed> - ↑ 12.0 12.1 12.2
Lorent, J.H., Levental, K.R., Ganesan, L., Rivera-Longsworth, G., Sezgin, E., Doktorova, M., ..., & Levental, I. (2020).
Plasma membranes are asymmetric in lipid unsaturation, packing and protein shape. Nature chemical biology, 16(6), 644-652. [PubMed:32367017] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Valsecchi, M., Mauri, L., Casellato, R., Prioni, S., Loberto, N., Prinetti, A., ..., & Sonnino, S. (2007).
Ceramide and sphingomyelin species of fibroblasts and neurons in culture. Journal of lipid research, 48(2), 417-24. [PubMed:17093290] [WorldCat] [DOI] - ↑
Sandhoff, R. (2010).
Very long chain sphingolipids: tissue expression, function and synthesis. FEBS letters, 584(9), 1907-13. [PubMed:20035755] [WorldCat] [DOI] - ↑ 15.0 15.1
Murata, M., Matsumori, N., Kinoshita, M., & London, E. (2022).
Molecular substructure of the liquid-ordered phase formed by sphingomyelin and cholesterol: sphingomyelin clusters forming nano-subdomains are a characteristic feature. Biophysical reviews, 14(3), 655-678. [PubMed:35791389] [PMC] [WorldCat] [DOI] - ↑
Slotte, J.P. (2016).
The importance of hydrogen bonding in sphingomyelin's membrane interactions with co-lipids. Biochimica et biophysica acta, 1858(2), 304-10. [PubMed:26656158] [WorldCat] [DOI] - ↑ 17.0 17.1
Hanada, K., Kumagai, K., Tomishige, N., & Yamaji, T. (2009).
CERT-mediated trafficking of ceramide. Biochimica et biophysica acta, 1791(7), 684-91. [PubMed:19416656] [WorldCat] [DOI] - ↑
Kumagai, K., Yasuda, S., Okemoto, K., Nishijima, M., Kobayashi, S., & Hanada, K. (2005).
CERT mediates intermembrane transfer of various molecular species of ceramides. The Journal of biological chemistry, 280(8), 6488-95. [PubMed:15596449] [WorldCat] [DOI] - ↑
Fougère, L., Grison, M., Laquel, P., Montrazi, M., Cordelières, F., Fernández-Monreal, M., ..., & Boutté, Y. (2025).
ER-to-Golgi trafficking through a dynamic intermediate cis-Golgi tubular network in Arabidopsis. Nature cell biology, 27(3), 424-437. [PubMed:40000850] [WorldCat] [DOI] - ↑
Kim, Y., Mavodza, G., Senkal, C.E., & Burd, C.G. (2023).
Cholesterol-dependent homeostatic regulation of very long chain sphingolipid synthesis. The Journal of cell biology, 222(12). [PubMed:37787764] [PMC] [WorldCat] [DOI] - ↑
Kim, Y., Parolek, J., & Burd, C.G. (2025).
Cholesterol depletion activates trafficking-coupled sphingolipid synthesis. bioRxiv : the preprint server for biology. [PubMed:39990424] [PMC] [WorldCat] [DOI] - ↑
Voelker, D.R., & Kennedy, E.P. (1982).
Cellular and enzymic synthesis of sphingomyelin. Biochemistry, 21(11), 2753-9. [PubMed:7093220] [WorldCat] [DOI] - ↑ 23.0 23.1
Yamaoka, S., Miyaji, M., Kitano, T., Umehara, H., & Okazaki, T. (2004).
Expression cloning of a human cDNA restoring sphingomyelin synthesis and cell growth in sphingomyelin synthase-defective lymphoid cells. The Journal of biological chemistry, 279(18), 18688-93. [PubMed:14976195] [WorldCat] [DOI] - ↑ 24.0 24.1
Sokoya, T., Parolek, J., Foged, M.M., Danylchuk, D.I., Bozan, M., Sarkar, B., ..., & Holthuis, J.C.M. (2022).
Pathogenic variants of sphingomyelin synthase SMS2 disrupt lipid landscapes in the secretory pathway. eLife, 11. [PubMed:36102623] [PMC] [WorldCat] [DOI] - ↑
Hu, K., Zhang, Q., Chen, Y., Yang, J., Xia, Y., Rao, B., ..., & Cao, Y. (2024).
Cryo-EM structure of human sphingomyelin synthase and its mechanistic implications for sphingomyelin synthesis. Nature structural & molecular biology, 31(6), 884-895. [PubMed:38388831] [WorldCat] [DOI] - ↑
Vacaru, A.M., Tafesse, F.G., Ternes, P., Kondylis, V., Hermansson, M., Brouwers, J.F., ..., & Holthuis, J.C. (2009).
Sphingomyelin synthase-related protein SMSr controls ceramide homeostasis in the ER. The Journal of cell biology, 185(6), 1013-27. [PubMed:19506037] [PMC] [WorldCat] [DOI] - ↑
Hannun, Y.A. (1994).
The sphingomyelin cycle and the second messenger function of ceramide. The Journal of biological chemistry, 269(5), 3125-8. [PubMed:8106344] [WorldCat] - ↑
Pagano, R.E. (1988).
What is the fate of diacylglycerol produced at the Golgi apparatus? Trends in biochemical sciences, 13(6), 202-5. [PubMed:3255201] [WorldCat] [DOI] - ↑
Hannun, Y.A., & Obeid, L.M. (2018).
Sphingolipids and their metabolism in physiology and disease. Nature reviews. Molecular cell biology, 19(3), 175-191. [PubMed:29165427] [PMC] [WorldCat] [DOI] - ↑
Airola, M.V., Shanbhogue, P., Shamseddine, A.A., Guja, K.E., Senkal, C.E., Maini, R., ..., & Hannun, Y.A. (2017).
Structure of human nSMase2 reveals an interdomain allosteric activation mechanism for ceramide generation. Proceedings of the National Academy of Sciences of the United States of America, 114(28), E5549-E5558. [PubMed:28652336] [PMC] [WorldCat] [DOI] - ↑
Jenkins, R.W., Idkowiak-Baldys, J., Simbari, F., Canals, D., Roddy, P., Riner, C.D., ..., & Hannun, Y.A. (2011).
A novel mechanism of lysosomal acid sphingomyelinase maturation: requirement for carboxyl-terminal proteolytic processing. The Journal of biological chemistry, 286(5), 3777-88. [PubMed:21098024] [PMC] [WorldCat] [DOI] - ↑
Lange, Y., Swaisgood, M.H., Ramos, B.V., & Steck, T.L. (1989).
Plasma membranes contain half the phospholipid and 90% of the cholesterol and sphingomyelin in cultured human fibroblasts. The Journal of biological chemistry, 264(7), 3786-93. [PubMed:2917977] [WorldCat] - ↑ 33.0 33.1
Bakrac, B., Gutiérrez-Aguirre, I., Podlesek, Z., Sonnen, A.F., Gilbert, R.J., Macek, P., ..., & Anderluh, G. (2008).
Molecular determinants of sphingomyelin specificity of a eukaryotic pore-forming toxin. The Journal of biological chemistry, 283(27), 18665-77. [PubMed:18442982] [WorldCat] [DOI] - ↑ 34.0 34.1 34.2
Deng, Y., Rivera-Molina, F.E., Toomre, D.K., & Burd, C.G. (2016).
Sphingomyelin is sorted at the trans Golgi network into a distinct class of secretory vesicle. Proceedings of the National Academy of Sciences of the United States of America, 113(24), 6677-82. [PubMed:27247384] [PMC] [WorldCat] [DOI] - ↑ 35.0 35.1 35.2 35.3
Kiyokawa, E., Baba, T., Otsuka, N., Makino, A., Ohno, S., & Kobayashi, T. (2005).
Spatial and functional heterogeneity of sphingolipid-rich membrane domains. The Journal of biological chemistry, 280(25), 24072-84. [PubMed:15840575] [WorldCat] [DOI] - ↑
Yachi, R., Uchida, Y., Balakrishna, B.H., Anderluh, G., Kobayashi, T., Taguchi, T., & Arai, H. (2012).
Subcellular localization of sphingomyelin revealed by two toxin-based probes in mammalian cells. Genes to cells : devoted to molecular & cellular mechanisms, 17(8), 720-7. [PubMed:22747662] [WorldCat] [DOI] - ↑
Lazzarini, A., Macchiarulo, A., Floridi, A., Coletti, A., Cataldi, S., Codini, M., ..., & Albi, E. (2015).
Very-long-chain fatty acid sphingomyelin in nuclear lipid microdomains of hepatocytes and hepatoma cells: can the exchange from C24:0 to C16:0 affect signal proteins and vitamin D receptor? Molecular biology of the cell, 26(13), 2418-25. [PubMed:26124436] [PMC] [WorldCat] [DOI] - ↑ 38.0 38.1
Engberg, O., Hautala, V., Yasuda, T., Dehio, H., Murata, M., Slotte, J.P., & Nyholm, T.K.M. (2016).
The Affinity of Cholesterol for Different Phospholipids Affects Lateral Segregation in Bilayers. Biophysical journal, 111(3), 546-556. [PubMed:27508438] [PMC] [WorldCat] [DOI] - ↑ 39.0 39.1
Engberg, O., Lin, K.L., Hautala, V., Slotte, J.P., & Nyholm, T.K.M. (2020).
Sphingomyelin Acyl Chains Influence the Formation of Sphingomyelin- and Cholesterol-Enriched Domains. Biophysical journal, 119(5), 913-923. [PubMed:32755561] [PMC] [WorldCat] [DOI] - ↑ 40.0 40.1
Engberg, O., Yasuda, T., Hautala, V., Matsumori, N., Nyholm, T.K.M., Murata, M., & Slotte, J.P. (2016).
Lipid Interactions and Organization in Complex Bilayer Membranes. Biophysical journal, 110(7), 1563-1573. [PubMed:27074681] [PMC] [WorldCat] [DOI] - ↑ 41.0 41.1
Jaikishan, S., & Slotte, J.P. (2011).
Effect of hydrophobic mismatch and interdigitation on sterol/sphingomyelin interaction in ternary bilayer membranes. Biochimica et biophysica acta, 1808(7), 1940-5. [PubMed:21515240] [WorldCat] [DOI] - ↑
Eggeling, C., Ringemann, C., Medda, R., Schwarzmann, G., Sandhoff, K., Polyakova, S., ..., & Hell, S.W. (2009).
Direct observation of the nanoscale dynamics of membrane lipids in a living cell. Nature, 457(7233), 1159-62. [PubMed:19098897] [WorldCat] [DOI] - ↑ 43.0 43.1 43.2
Makino, A., Abe, M., Ishitsuka, R., Murate, M., Kishimoto, T., Sakai, S., ..., & Kobayashi, T. (2017).
A novel sphingomyelin/cholesterol domain-specific probe reveals the dynamics of the membrane domains during virus release and in Niemann-Pick type C. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 31(4), 1301-1322. [PubMed:27492925] [WorldCat] [DOI] - ↑
Pralle, A., Keller, P., Florin, E.L., Simons, K., & Hörber, J.K. (2000).
Sphingolipid-cholesterol rafts diffuse as small entities in the plasma membrane of mammalian cells. The Journal of cell biology, 148(5), 997-1008. [PubMed:10704449] [PMC] [WorldCat] [DOI] - ↑
Prior, I.A., Harding, A., Yan, J., Sluimer, J., Parton, R.G., & Hancock, J.F. (2001).
GTP-dependent segregation of H-ras from lipid rafts is required for biological activity. Nature cell biology, 3(4), 368-75. [PubMed:11283610] [WorldCat] [DOI] - ↑
Sharma, P., Varma, R., Sarasij, R.C., Ira, Gousset, K., Krishnamoorthy, G., ..., & Mayor, S. (2004).
Nanoscale organization of multiple GPI-anchored proteins in living cell membranes. Cell, 116(4), 577-89. [PubMed:14980224] [WorldCat] [DOI] - ↑
Mesmin, B., Antonny, B., & Drin, G. (2013).
Insights into the mechanisms of sterol transport between organelles. Cellular and molecular life sciences : CMLS, 70(18), 3405-21. [PubMed:23283302] [PMC] [WorldCat] [DOI] - ↑ 48.0 48.1
Lingwood, D., & Simons, K. (2010).
Lipid rafts as a membrane-organizing principle. Science (New York, N.Y.), 327(5961), 46-50. [PubMed:20044567] [WorldCat] [DOI] - ↑ 49.0 49.1
Simons, K., & Ikonen, E. (1997).
Functional rafts in cell membranes. Nature, 387(6633), 569-72. [PubMed:9177342] [WorldCat] [DOI] - ↑
Surma, M.A., Klose, C., & Simons, K. (2012).
Lipid-dependent protein sorting at the trans-Golgi network. Biochimica et biophysica acta, 1821(8), 1059-67. [PubMed:22230596] [WorldCat] [DOI] - ↑
Wakana, Y., Hayashi, K., Nemoto, T., Watanabe, C., Taoka, M., Angulo-Capel, J., ..., & Tagaya, M. (2021).
The ER cholesterol sensor SCAP promotes CARTS biogenesis at ER-Golgi membrane contact sites. The Journal of cell biology, 220(1). [PubMed:33156328] [PMC] [WorldCat] [DOI] - ↑ 52.0 52.1
Murate, M., Abe, M., Kasahara, K., Iwabuchi, K., Umeda, M., & Kobayashi, T. (2015).
Transbilayer distribution of lipids at nano scale. Journal of cell science, 128(8), 1627-38. [PubMed:25673880] [WorldCat] [DOI] - ↑ 53.0 53.1
Abe, M., Makino, A., Murate, M., Hullin-Matsuda, F., Yanagawa, M., Sako, Y., & Kobayashi, T. (2021).
PMP2/FABP8 induces PI(4,5)P2-dependent transbilayer reorganization of sphingomyelin in the plasma membrane. Cell reports, 37(6), 109935. [PubMed:34758297] [WorldCat] [DOI] - ↑
Trajkovic, K., Hsu, C., Chiantia, S., Rajendran, L., Wenzel, D., Wieland, F., ..., & Simons, M. (2008).
Ceramide triggers budding of exosome vesicles into multivesicular endosomes. Science (New York, N.Y.), 319(5867), 1244-7. [PubMed:18309083] [WorldCat] [DOI] - ↑
Guo, B.B., Bellingham, S.A., & Hill, A.F. (2015).
The neutral sphingomyelinase pathway regulates packaging of the prion protein into exosomes. The Journal of biological chemistry, 290(6), 3455-67. [PubMed:25505180] [PMC] [WorldCat] [DOI] - ↑
Kosaka, N., Iguchi, H., Yoshioka, Y., Takeshita, F., Matsuki, Y., & Ochiya, T. (2010).
Secretory mechanisms and intercellular transfer of microRNAs in living cells. The Journal of biological chemistry, 285(23), 17442-52. [PubMed:20353945] [PMC] [WorldCat] [DOI] - ↑ 57.0 57.1 57.2
Boyle, K.B., Ellison, C.J., Elliott, P.R., Schuschnig, M., Grimes, K., Dionne, M.S., ..., & Randow, F. (2023).
TECPR1 conjugates LC3 to damaged endomembranes upon detection of sphingomyelin exposure. The EMBO journal, 42(17), e113012. [PubMed:37409490] [PMC] [WorldCat] [DOI] - ↑ 58.0 58.1
Ellison, C.J., Kukulski, W., Boyle, K.B., Munro, S., & Randow, F. (2020).
Transbilayer Movement of Sphingomyelin Precedes Catastrophic Breakage of Enterobacteria-Containing Vacuoles. Current biology : CB, 30(15), 2974-2983.e6. [PubMed:32649908] [PMC] [WorldCat] [DOI] - ↑ 59.0 59.1
Kaur, N., de la Ballina, L.R., Haukaas, H.S., Torgersen, M.L., Radulovic, M., Munson, M.J., ..., & Lystad, A.H. (2023).
TECPR1 is activated by damage-induced sphingomyelin exposure to mediate noncanonical autophagy. The EMBO journal, 42(17), e113105. [PubMed:37409525] [PMC] [WorldCat] [DOI] - ↑
Colbeau, A., Nachbaur, J., & Vignais, P.M. (1971).
Enzymic characterization and lipid composition of rat liver subcellular membranes. Biochimica et biophysica acta, 249(2), 462-92. [PubMed:5134192] [WorldCat] [DOI] - ↑
Dodge, J.T., & Phillips, G.B. (1967).
Composition of phospholipids and of phospholipid fatty acids and aldehydes in human red cells. Journal of lipid research, 8(6), 667-75. [PubMed:6057495] [WorldCat] - ↑
Gerl, M.J., Sampaio, J.L., Urban, S., Kalvodova, L., Verbavatz, J.M., Binnington, B., ..., & Simons, K. (2012).
Quantitative analysis of the lipidomes of the influenza virus envelope and MDCK cell apical membrane. The Journal of cell biology, 196(2), 213-21. [PubMed:22249292] [PMC] [WorldCat] [DOI] - ↑
Keenan, T.W., & Morré, D.J. (1970).
Phospholipid class and fatty acid composition of golgi apparatus isolated from rat liver and comparison with other cell fractions. Biochemistry, 9(1), 19-25. [PubMed:4312390] [WorldCat] [DOI] - ↑
Pfleger, R.C., Anderson, N.G., & Snyder, F. (1968).
Lipid class and fatty acid composition of rat liver plasma membranes isolated by zonal centrifugation. Biochemistry, 7(8), 2826-33. [PubMed:4299085] [WorldCat] [DOI] - ↑
Skotland, T., & Sandvig, K. (2019).
The role of PS 18:0/18:1 in membrane function. Nature communications, 10(1), 2752. [PubMed:31227693] [PMC] [WorldCat] [DOI] - ↑
Van Hoeven, R.P., Emmelot, P., Krol, J.H., & Oomen-Meulemans, E.P. (1975).
Studies on plasma membranes. XXII. Fatty acid profiles of lipid classes in plasma membranes of rat and mouse livers and hepatomas. Biochimica et biophysica acta, 380(1), 1-11. [PubMed:164234] [WorldCat] - ↑
Ways, P., & Hanahan, D.J. (1964).
Characterization and quantification of red cell lipids in normal man. Journal of lipid research, 5(3), 318-28. [PubMed:5873368] [WorldCat] - ↑
Wood, R., & Falch, J. (1973).
Lipids of cultured hepatoma cells. II. Effect of media lipids on cellular phospholipids. Lipids, 8(12), 702-10. [PubMed:4359202] [WorldCat] [DOI] - ↑
O'Brien, J.S., & Sampson, E.L. (1965).
Fatty acid and fatty aldehyde composition of the major brain lipids in normal human gray matter, white matter, and myelin. Journal of lipid research, 6(4), 545-51. [PubMed:5865383] [WorldCat] - ↑ 70.0 70.1 70.2
Jendrasiak, G.L., & Smith, R.L. (2001).
The effect of the choline head group on phospholipid hydration. Chemistry and physics of lipids, 113(1-2), 55-66. [PubMed:11687227] [WorldCat] [DOI] - ↑
Björkqvist, Y.J., Brewer, J., Bagatolli, L.A., Slotte, J.P., & Westerlund, B. (2009).
Thermotropic behavior and lateral distribution of very long chain sphingolipids. Biochimica et biophysica acta, 1788(6), 1310-20. [PubMed:19272355] [WorldCat] [DOI] - ↑ Marsh, D. 2013.
Handbook of Lipid Bilayers. CRC Press. - ↑
Levental, I., Levental, K.R., & Heberle, F.A. (2020).
Lipid Rafts: Controversies Resolved, Mysteries Remain. Trends in cell biology, 30(5), 341-353. [PubMed:32302547] [PMC] [WorldCat] [DOI] - ↑
Pabst, G., & Keller, S. (2024).
Exploring membrane asymmetry and its effects on membrane proteins. Trends in biochemical sciences, 49(4), 333-345. [PubMed:38355393] [WorldCat] [DOI] - ↑
Simons, K., & Toomre, D. (2000).
Lipid rafts and signal transduction. Nature reviews. Molecular cell biology, 1(1), 31-9. [PubMed:11413487] [WorldCat] [DOI] - ↑ 76.0 76.1
Contreras, F.X., Ernst, A.M., Haberkant, P., Björkholm, P., Lindahl, E., Gönen, B., ..., & Brügger, B. (2012).
Molecular recognition of a single sphingolipid species by a protein's transmembrane domain. Nature, 481(7382), 525-9. [PubMed:22230960] [WorldCat] [DOI] - ↑
Brügger, B., Sandhoff, R., Wegehingel, S., Gorgas, K., Malsam, J., Helms, J.B., ..., & Wieland, F.T. (2000).
Evidence for segregation of sphingomyelin and cholesterol during formation of COPI-coated vesicles. The Journal of cell biology, 151(3), 507-18. [PubMed:11062253] [PMC] [WorldCat] [DOI] - ↑
Ma, L., Li, Y., Peng, J., Wu, D., Zhao, X., Cui, Y., ..., & Yu, L. (2015).
Discovery of the migrasome, an organelle mediating release of cytoplasmic contents during cell migration. Cell research, 25(1), 24-38. [PubMed:25342562] [PMC] [WorldCat] [DOI] - ↑
Jiang, D., Jiang, Z., Lu, D., Wang, X., Liang, H., Zhang, J., ..., & Yu, L. (2019).
Migrasomes provide regional cues for organ morphogenesis during zebrafish gastrulation. Nature cell biology, 21(8), 966-977. [PubMed:31371827] [WorldCat] [DOI] - ↑
Zhang, C., Li, T., Yin, S., Gao, M., He, H., Li, Y., ..., & Yu, L. (2022).
Monocytes deposit migrasomes to promote embryonic angiogenesis. Nature cell biology, 24(12), 1726-1738. [PubMed:36443426] [WorldCat] [DOI] - ↑
Zhu, M., Zou, Q., Huang, R., Li, Y., Xing, X., Fang, J., ..., & Yu, L. (2021).
Lateral transfer of mRNA and protein by migrasomes modifies the recipient cells. Cell research, 31(2), 237-240. [PubMed:32994478] [PMC] [WorldCat] [DOI] - ↑
Jiao, H., Jiang, D., Hu, X., Du, W., Ji, L., Yang, Y., ..., & Yu, L. (2021).
Mitocytosis, a migrasome-mediated mitochondrial quality-control process. Cell, 184(11), 2896-2910.e13. [PubMed:34048705] [WorldCat] [DOI] - ↑ 83.0 83.1
Liang, H., Ma, X., Zhang, Y., Liu, Y., Liu, N., Zhang, W., ..., & Yu, L. (2023).
The formation of migrasomes is initiated by the assembly of sphingomyelin synthase 2 foci at the leading edge of migrating cells. Nature cell biology, 25(8), 1173-1184. [PubMed:37488437] [WorldCat] [DOI] - ↑
Figueras-Novoa, C., Timimi, L., Marcassa, E., Ulferts, R., & Beale, R. (2024).
Conjugation of ATG8s to single membranes at a glance. Journal of cell science, 137(15). [PubMed:39145464] [PMC] [WorldCat] [DOI] - ↑
Corkery, D.P., Castro-Gonzalez, S., Knyazeva, A., Herzog, L.K., & Wu, Y.W. (2023).
An ATG12-ATG5-TECPR1 E3-like complex regulates unconventional LC3 lipidation at damaged lysosomes. EMBO reports, 24(9), e56841. [PubMed:37381828] [PMC] [WorldCat] [DOI] - ↑
Niekamp, P., Scharte, F., Sokoya, T., Vittadello, L., Kim, Y., Deng, Y., ..., & Holthuis, J.C.M. (2022).
Ca2+-activated sphingomyelin scrambling and turnover mediate ESCRT-independent lysosomal repair. Nature communications, 13(1), 1875. [PubMed:35388011] [PMC] [WorldCat] [DOI] - ↑
DeVries, G.H., Zetusky, W.J., Zmachinski, C., & Calabrese, V.P. (1981).
Lipid composition of axolemma-enriched fractions from human brains. Journal of lipid research, 22(2), 208-16. [PubMed:7240954] [WorldCat] - ↑
GENT, W.L., GREGSON, N.A., GAMMACK, D.B., & RAPER, J.H. (1964).
THE LIPID-PROTEIN UNIT IN MYELIN. Nature, 204, 553-5. [PubMed:14238160] [WorldCat] [DOI] - ↑
NORTON, W.T., & AUTILIO, L.A. (1965).
THE CHEMICAL COMPOSITION OF BOVINE CNS MYELIN. Annals of the New York Academy of Sciences, 122, 77-85. [PubMed:14313516] [WorldCat] [DOI] - ↑ 90.0 90.1
Norton, W.T., & Poduslo, S.E. (1973).
Myelination in rat brain: changes in myelin composition during brain maturation. Journal of neurochemistry, 21(4), 759-73. [PubMed:4754856] [WorldCat] [DOI] - ↑
Svennerholm, L., Boström, K., Fredman, P., Jungbjer, B., Månsson, J.E., & Rynmark, B.M. (1992).
Membrane lipids of human peripheral nerve and spinal cord. Biochimica et biophysica acta, 1128(1), 1-7. [PubMed:1390872] [WorldCat] [DOI] - ↑
Garbay, B., Heape, A.M., Sargueil, F., & Cassagne, C. (2000).
Myelin synthesis in the peripheral nervous system. Progress in neurobiology, 61(3), 267-304. [PubMed:10727776] [WorldCat] [DOI] - ↑
Ozgen, H., Baron, W., Hoekstra, D., & Kahya, N. (2016).
Oligodendroglial membrane dynamics in relation to myelin biogenesis. Cellular and molecular life sciences : CMLS, 73(17), 3291-310. [PubMed:27141942] [PMC] [WorldCat] [DOI] - ↑
Poitelon, Y., Kopec, A.M., & Belin, S. (2020).
Myelin Fat Facts: An Overview of Lipids and Fatty Acid Metabolism. Cells, 9(4). [PubMed:32230947] [PMC] [WorldCat] [DOI] - ↑
Chami, M., Halmer, R., Schnoeder, L., Anne Becker, K., Meier, C., Fassbender, K., ..., & Walter, S. (2017).
Acid sphingomyelinase deficiency enhances myelin repair after acute and chronic demyelination. PloS one, 12(6), e0178622. [PubMed:28582448] [PMC] [WorldCat] [DOI] - ↑
Gonzaga-Jauregui, C., Harel, T., Gambin, T., Kousi, M., Griffin, L.B., Francescatto, L., ..., & Lupski, J.R. (2015).
Exome Sequence Analysis Suggests that Genetic Burden Contributes to Phenotypic Variability and Complex Neuropathy. Cell reports, 12(7), 1169-83. [PubMed:26257172] [PMC] [WorldCat] [DOI] - ↑
Hong, Y.B., Joo, J., Hyun, Y.S., Kwak, G., Choi, Y.R., Yeo, H.K., ..., & Choi, B.O. (2016).
A Mutation in PMP2 Causes Dominant Demyelinating Charcot-Marie-Tooth Neuropathy. PLoS genetics, 12(2), e1005829. [PubMed:26828946] [PMC] [WorldCat] [DOI] - ↑
Grimm, M.O., Grimm, H.S., Pätzold, A.J., Zinser, E.G., Halonen, R., Duering, M., ..., & Hartmann, T. (2005).
Regulation of cholesterol and sphingomyelin metabolism by amyloid-beta and presenilin. Nature cell biology, 7(11), 1118-23. [PubMed:16227967] [WorldCat] [DOI] - ↑ 99.0 99.1
Schuchman, E.H., & Desnick, R.J. (2017).
Types A and B Niemann-Pick disease. Molecular genetics and metabolism, 120(1-2), 27-33. [PubMed:28164782] [PMC] [WorldCat] [DOI] - ↑
Brady, R.O., Kanfer, J.N., Mock, M.B., & Fredrickson, D.S. (1966).
The metabolism of sphingomyelin. II. Evidence of an enzymatic deficiency in Niemann-Pick diseae. Proceedings of the National Academy of Sciences of the United States of America, 55(2), 366-9. [PubMed:5220952] [PMC] [WorldCat] [DOI] - ↑
Kiyokawa, E., Makino, A., Ishii, K., Otsuka, N., Yamaji-Hasegawa, A., & Kobayashi, T. (2004).
Recognition of sphingomyelin by lysenin and lysenin-related proteins. Biochemistry, 43(30), 9766-73. [PubMed:15274631] [WorldCat] [DOI] - ↑ 102.0 102.1
Yamaji, A., Sekizawa, Y., Emoto, K., Sakuraba, H., Inoue, K., Kobayashi, H., & Umeda, M. (1998).
Lysenin, a novel sphingomyelin-specific binding protein. The Journal of biological chemistry, 273(9), 5300-6. [PubMed:9478988] [WorldCat] [DOI] - ↑
Oninla, V.O., Breiden, B., Babalola, J.O., & Sandhoff, K. (2014).
Acid sphingomyelinase activity is regulated by membrane lipids and facilitates cholesterol transfer by NPC2. Journal of lipid research, 55(12), 2606-19. [PubMed:25339683] [PMC] [WorldCat] [DOI] - ↑
Signorelli, P., Conte, C., & Albi, E. (2021).
The Multiple Roles of Sphingomyelin in Parkinson's Disease. Biomolecules, 11(9). [PubMed:34572524] [PMC] [WorldCat] [DOI] - ↑
Pekkinen, M., Terhal, P.A., Botto, L.D., Henning, P., Mäkitie, R.E., Roschger, P., ..., & Mäkitie, O. (2019).
Osteoporosis and skeletal dysplasia caused by pathogenic variants in SGMS2. JCI insight, 4(7). [PubMed:30779713] [PMC] [WorldCat] [DOI] - ↑
Aloia, R.C., Tian, H., & Jensen, F.C. (1993).
Lipid composition and fluidity of the human immunodeficiency virus envelope and host cell plasma membranes. Proceedings of the National Academy of Sciences of the United States of America, 90(11), 5181-5. [PubMed:8389472] [PMC] [WorldCat] [DOI] - ↑ 107.0 107.1
Brügger, B., Glass, B., Haberkant, P., Leibrecht, I., Wieland, F.T., & Kräusslich, H.G. (2006).
The HIV lipidome: a raft with an unusual composition. Proceedings of the National Academy of Sciences of the United States of America, 103(8), 2641-6. [PubMed:16481622] [PMC] [WorldCat] [DOI] - ↑ 108.0 108.1
Chan, R., Uchil, P.D., Jin, J., Shui, G., Ott, D.E., Mothes, W., & Wenk, M.R. (2008).
Retroviruses human immunodeficiency virus and murine leukemia virus are enriched in phosphoinositides. Journal of virology, 82(22), 11228-38. [PubMed:18799574] [PMC] [WorldCat] [DOI] - ↑ 109.0 109.1
Lorizate, M., Sachsenheimer, T., Glass, B., Habermann, A., Gerl, M.J., Kräusslich, H.G., & Brügger, B. (2013).
Comparative lipidomics analysis of HIV-1 particles and their producer cell membrane in different cell lines. Cellular microbiology, 15(2), 292-304. [PubMed:23279151] [WorldCat] [DOI] - ↑ 110.0 110.1
Mücksch, F., Citir, M., Lüchtenborg, C., Glass, B., Traynor-Kaplan, A., Schultz, C., ..., & Kräusslich, H.G. (2019).
Quantification of phosphoinositides reveals strong enrichment of PIP2 in HIV-1 compared to producer cell membranes. Scientific reports, 9(1), 17661. [PubMed:31776383] [PMC] [WorldCat] [DOI] - ↑
Favard, C., Chojnacki, J., Merida, P., Yandrapalli, N., Mak, J., Eggeling, C., & Muriaux, D. (2019).
HIV-1 Gag specifically restricts PI(4,5)P2 and cholesterol mobility in living cells creating a nanodomain platform for virus assembly. Science advances, 5(10), eaaw8651. [PubMed:31616784] [PMC] [WorldCat] [DOI] - ↑
Sengupta, P., Seo, A.Y., Pasolli, H.A., Song, Y.E., Johnson, M.C., & Lippincott-Schwartz, J. (2019).
A lipid-based partitioning mechanism for selective incorporation of proteins into membranes of HIV particles. Nature cell biology, 21(4), 452-461. [PubMed:30936472] [WorldCat] [DOI] - ↑
Tomishige, N., Bin Nasim, M., Murate, M., Pollet, B., Didier, P., Godet, J., ..., & Kobayashi, T. (2023).
HIV-1 Gag targeting to the plasma membrane reorganizes sphingomyelin-rich and cholesterol-rich lipid domains. Nature communications, 14(1), 7353. [PubMed:37990014] [PMC] [WorldCat] [DOI] - ↑ 114.0 114.1
Waheed, A.A., Zhu, Y., Agostino, E., Naing, L., Hikichi, Y., Soheilian, F., ..., & Freed, E.O. (2023).
Neutral sphingomyelinase 2 is required for HIV-1 maturation. Proceedings of the National Academy of Sciences of the United States of America, 120(28), e2219475120. [PubMed:37406093] [PMC] [WorldCat] [DOI] - ↑ 115.0 115.1
Yoo, S.W., Waheed, A.A., Deme, P., Tohumeken, S., Rais, R., Smith, M.D., ..., & Haughey, N.J. (2023).
Inhibition of neutral sphingomyelinase 2 impairs HIV-1 envelope formation and substantially delays or eliminates viral rebound. Proceedings of the National Academy of Sciences of the United States of America, 120(28), e2219543120. [PubMed:37406092] [PMC] [WorldCat] [DOI] - ↑
Merz, A., Long, G., Hiet, M.S., Brügger, B., Chlanda, P., Andre, P., ..., & Bartenschlager, R. (2011).
Biochemical and morphological properties of hepatitis C virus particles and determination of their lipidome. The Journal of biological chemistry, 286(4), 3018-32. [PubMed:21056986] [PMC] [WorldCat] [DOI] - ↑ 117.0 117.1
Aizaki, H., Morikawa, K., Fukasawa, M., Hara, H., Inoue, Y., Tani, H., ..., & Suzuki, T. (2008).
Critical role of virion-associated cholesterol and sphingolipid in hepatitis C virus infection. Journal of virology, 82(12), 5715-24. [PubMed:18367533] [PMC] [WorldCat] [DOI] - ↑
Martín-Acebes, M.A., Merino-Ramos, T., Blázquez, A.B., Casas, J., Escribano-Romero, E., Sobrino, F., & Saiz, J.C. (2014).
The composition of West Nile virus lipid envelope unveils a role of sphingolipid metabolism in flavivirus biogenesis. Journal of virology, 88(20), 12041-54. [PubMed:25122799] [PMC] [WorldCat] [DOI] - ↑
Martín-Acebes, M.A., Gabandé-Rodríguez, E., García-Cabrero, A.M., Sánchez, M.P., Ledesma, M.D., Sobrino, F., & Saiz, J.C. (2016).
Host sphingomyelin increases West Nile virus infection in vivo. Journal of lipid research, 57(3), 422-32. [PubMed:26764042] [PMC] [WorldCat] [DOI] - ↑
Eierhoff, T., Hrincius, E.R., Rescher, U., Ludwig, S., & Ehrhardt, C. (2010).
The epidermal growth factor receptor (EGFR) promotes uptake of influenza A viruses (IAV) into host cells. PLoS pathogens, 6(9), e1001099. [PubMed:20844577] [PMC] [WorldCat] [DOI] - ↑
Verma, D.K., Gupta, D., & Lal, S.K. (2018).
Host Lipid Rafts Play a Major Role in Binding and Endocytosis of Influenza A Virus. Viruses, 10(11). [PubMed:30453689] [PMC] [WorldCat] [DOI] - ↑
Tafesse, F.G., Sanyal, S., Ashour, J., Guimaraes, C.P., Hermansson, M., Somerharju, P., & Ploegh, H.L. (2013).
Intact sphingomyelin biosynthetic pathway is essential for intracellular transport of influenza virus glycoproteins. Proceedings of the National Academy of Sciences of the United States of America, 110(16), 6406-11. [PubMed:23576732] [PMC] [WorldCat] [DOI] - ↑
Audi, A., Soudani, N., Dbaibo, G., & Zaraket, H. (2020).
Depletion of Host and Viral Sphingomyelin Impairs Influenza Virus Infection. Frontiers in microbiology, 11, 612. [PubMed:32425895] [PMC] [WorldCat] [DOI] - ↑ 124.0 124.1
Jenkins, R.W., Clarke, C.J., Canals, D., Snider, A.J., Gault, C.R., Heffernan-Stroud, L., ..., & Hannun, Y.A. (2011).
Regulation of CC ligand 5/RANTES by acid sphingomyelinase and acid ceramidase. The Journal of biological chemistry, 286(15), 13292-303. [PubMed:21335555] [PMC] [WorldCat] [DOI] - ↑
Kott, M., Elke, G., Reinicke, M., Winoto-Morbach, S., Schädler, D., Zick, G., ..., & Schütze, S. (2014).
Acid sphingomyelinase serum activity predicts mortality in intensive care unit patients after systemic inflammation: a prospective cohort study. PloS one, 9(11), e112323. [PubMed:25384060] [PMC] [WorldCat] [DOI] - ↑
Li, Z., Zhang, H., Liu, J., Liang, C.P., Li, Y., Li, Y., ..., & Jiang, X.C. (2011).
Reducing plasma membrane sphingomyelin increases insulin sensitivity. Molecular and cellular biology, 31(20), 4205-18. [PubMed:21844222] [PMC] [WorldCat] [DOI] - ↑
Yano, M., Yamamoto, T., Nishimura, N., Gotoh, T., Watanabe, K., Ikeda, K., ..., & Oike, Y. (2013).
Increased oxidative stress impairs adipose tissue function in sphingomyelin synthase 1 null mice. PloS one, 8(4), e61380. [PubMed:23593476] [PMC] [WorldCat] [DOI] - ↑ 128.0 128.1 128.2
Kobayashi, T., Tomishige, N., Inaba, T., Makino, A., Murata, M., Yamaji-Hasegawa, A., & Murate, M. (2021).
Impact of Intrinsic and Extrinsic Factors on Cellular Sphingomyelin Imaging with Specific Reporter Proteins. Contact (Thousand Oaks (Ventura County, Calif.)), 4, 25152564211042456. [PubMed:37366372] [PMC] [WorldCat] [DOI] - ↑
Tomishige, N., Murate, M., Didier, P., Richert, L., Mély, Y., & Kobayashi, T. (2021).
The use of pore-forming toxins to image lipids and lipid domains. Methods in enzymology, 649, 503-542. [PubMed:33712198] [WorldCat] [DOI] - ↑
Jamecna, D., & Höglinger, D. (2024).
The use of click chemistry in sphingolipid research. Journal of cell science, 137(6). [PubMed:38488070] [WorldCat] [DOI] - ↑
Kishimoto, T., Ishitsuka, R., & Kobayashi, T. (2016).
Detectors for evaluating the cellular landscape of sphingomyelin- and cholesterol-rich membrane domains. Biochimica et biophysica acta, 1861(8 Pt B), 812-829. [PubMed:26993577] [WorldCat] [DOI] - ↑
Kol, M., Novak, A.J.E., Morstein, J., Schröer, C., Sokoya, T., Mensing, S., ..., & Holthuis, J.C.M. (2025).
Optical control of sphingolipid biosynthesis using photoswitchable sphingosines. Journal of lipid research, 66(1), 100724. [PubMed:39672331] [PMC] [WorldCat] [DOI] - ↑
Yamaji-Hasegawa, A., Hullin-Matsuda, F., Greimel, P., & Kobayashi, T. (2016).
Pore-forming toxins: Properties, diversity, and uses as tools to image sphingomyelin and ceramide phosphoethanolamine. Biochimica et biophysica acta, 1858(3), 576-92. [PubMed:26498396] [WorldCat] [DOI] - ↑
Sekizawa, Y., Kubo, T., Kobayashi, H., Nakajima, T., & Natori, S. (1997).
Molecular cloning of cDNA for lysenin, a novel protein in the earthworm Eisenia foetida that causes contraction of rat vascular smooth muscle. Gene, 191(1), 97-102. [PubMed:9210594] [WorldCat] [DOI] - ↑
Goto, A., Sakai, S., Mizuike, A., Yamaji, T., & Hanada, K. (2022).
Compartmentalization of casein kinase 1 γ CSNK1G controls the intracellular trafficking of ceramide. iScience, 25(7), 104624. [PubMed:35800758] [PMC] [WorldCat] [DOI] - ↑
Hanada, K., Hara, T., Fukasawa, M., Yamaji, A., Umeda, M., & Nishijima, M. (1998).
Mammalian cell mutants resistant to a sphingomyelin-directed cytolysin. Genetic and biochemical evidence for complex formation of the LCB1 protein with the LCB2 protein for serine palmitoyltransferase. The Journal of biological chemistry, 273(50), 33787-94. [PubMed:9837968] [WorldCat] [DOI] - ↑
Hanada, K., Kumagai, K., Yasuda, S., Miura, Y., Kawano, M., Fukasawa, M., & Nishijima, M. (2003).
Molecular machinery for non-vesicular trafficking of ceramide. Nature, 426(6968), 803-9. [PubMed:14685229] [WorldCat] [DOI] - ↑
Mizuike, A., Sakai, S., Katoh, K., Yamaji, T., & Hanada, K. (2023).
The C10orf76-PI4KB axis orchestrates CERT-mediated ceramide trafficking to the distal Golgi. The Journal of cell biology, 222(7). [PubMed:37195633] [PMC] [WorldCat] [DOI] - ↑
Tomishige, N., Kumagai, K., Kusuda, J., Nishijima, M., & Hanada, K. (2009).
Casein kinase I{gamma}2 down-regulates trafficking of ceramide in the synthesis of sphingomyelin. Molecular biology of the cell, 20(1), 348-57. [PubMed:19005213] [PMC] [WorldCat] [DOI] - ↑
Ishitsuka, R., & Kobayashi, T. (2007).
Cholesterol and lipid/protein ratio control the oligomerization of a sphingomyelin-specific toxin, lysenin. Biochemistry, 46(6), 1495-502. [PubMed:17243772] [WorldCat] [DOI] - ↑ 141.0 141.1
Ishitsuka, R., Yamaji-Hasegawa, A., Makino, A., Hirabayashi, Y., & Kobayashi, T. (2004).
A lipid-specific toxin reveals heterogeneity of sphingomyelin-containing membranes. Biophysical journal, 86(1 Pt 1), 296-307. [PubMed:14695271] [PMC] [WorldCat] [DOI] - ↑ 142.0 142.1 142.2 142.3
Makino, A., Abe, M., Murate, M., Inaba, T., Yilmaz, N., Hullin-Matsuda, F., ..., & Kobayashi, T. (2015).
Visualization of the heterogeneous membrane distribution of sphingomyelin associated with cytokinesis, cell polarity, and sphingolipidosis. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 29(2), 477-93. [PubMed:25389132] [WorldCat] [DOI] - ↑
Anderluh, G., Pungercar, J., Strukelj, B., Macek, P., & Gubensek, F. (1996).
Cloning, sequencing, and expression of equinatoxin II. Biochemical and biophysical research communications, 220(2), 437-42. [PubMed:8645323] [WorldCat] [DOI] - ↑
Rojko, N., Dalla Serra, M., Maček, P., & Anderluh, G. (2016).
Pore formation by actinoporins, cytolysins from sea anemones. Biochimica et biophysica acta, 1858(3), 446-56. [PubMed:26351738] [WorldCat] [DOI] - ↑ 145.0 145.1
Hong, Q., Gutierrez-Aguirre, I., Barlic, A., Malovrh, P., Kristan, K., Podlesek, Z., ..., & Anderluh, G. (2002).
Two-step membrane binding by Equinatoxin II, a pore-forming toxin from the sea anemone, involves an exposed aromatic cluster and a flexible helix. The Journal of biological chemistry, 277(44), 41916-24. [PubMed:12198118] [WorldCat] [DOI] - ↑
Mori, T., Niki, T., Uchida, Y., Mukai, K., Kuchitsu, Y., Kishimoto, T., ..., & Suzuki, K.G.N. (2024).
A non-toxic equinatoxin-II reveals the dynamics and distribution of sphingomyelin in the cytosolic leaflet of the plasma membrane. Scientific reports, 14(1), 16872. [PubMed:39043900] [PMC] [WorldCat] [DOI] - ↑
Skočaj, M., Resnik, N., Grundner, M., Ota, K., Rojko, N., Hodnik, V., ..., & Sepčić, K. (2014).
Tracking cholesterol/sphingomyelin-rich membrane domains with the ostreolysin A-mCherry protein. PloS one, 9(3), e92783. [PubMed:24664106] [PMC] [WorldCat] [DOI] - ↑
Bhat, H.B., Kishimoto, T., Abe, M., Makino, A., Inaba, T., Murate, M., ..., & Kobayashi, T. (2013).
Binding of a pleurotolysin ortholog from Pleurotus eryngii to sphingomyelin and cholesterol-rich membrane domains. Journal of lipid research, 54(10), 2933-43. [PubMed:23918047] [PMC] [WorldCat] [DOI] - ↑
Endapally, S., Frias, D., Grzemska, M., Gay, A., Tomchick, D.R., & Radhakrishnan, A. (2019).
Molecular Discrimination between Two Conformations of Sphingomyelin in Plasma Membranes. Cell, 176(5), 1040-1053.e17. [PubMed:30712872] [PMC] [WorldCat] [DOI] - ↑ 150.0 150.1
Bhat, H.B., Ishitsuka, R., Inaba, T., Murate, M., Abe, M., Makino, A., ..., & Kobayashi, T. (2015).
Evaluation of aegerolysins as novel tools to detect and visualize ceramide phosphoethanolamine, a major sphingolipid in invertebrates. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 29(9), 3920-34. [PubMed:26060215] [WorldCat] [DOI]