「LIMドメイン含有キナーゼ」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の4版が非表示) | |||
| 3行目: | 3行目: | ||
''東北大学 大学院生命科学研究科 分子化学生物学専攻''<br> | ''東北大学 大学院生命科学研究科 分子化学生物学専攻''<br> | ||
DOI:<selfdoi /> 原稿受付日:2025年6月15日 原稿完成日:2025年6月24日<br> | DOI:<selfdoi /> 原稿受付日:2025年6月15日 原稿完成日:2025年6月24日<br> | ||
担当編集委員:[http://researchmap.jp/read0192882 古屋敷 智之] | 担当編集委員:[http://researchmap.jp/read0192882 古屋敷 智之](神戸大学大学院医学研究科・医学部 薬理学分野)<br> | ||
</div> | </div> | ||
| 17行目: | 17行目: | ||
さらに、LIMK1のキナーゼドメインのcDNA断片を用いたスクリーニングによって、ドメイン構造が同じで高い相同性をもつ[[LIMK2]]が発見された<ref name=Okano1995><pubmed>8537403</pubmed></ref>。また、全体の構造は異なるが、他のキナーゼと比べてキナーゼドメインの相同性が高く[[精巣]]に高発現している[[Testicular protein kinase]] ([[TESK1]]と[[TESK2]])がクローニングされた<ref name=Toshima1995><pubmed>8537404</pubmed></ref><ref name=Toshima2001><pubmed>11418599</pubmed></ref>。 | さらに、LIMK1のキナーゼドメインのcDNA断片を用いたスクリーニングによって、ドメイン構造が同じで高い相同性をもつ[[LIMK2]]が発見された<ref name=Okano1995><pubmed>8537403</pubmed></ref>。また、全体の構造は異なるが、他のキナーゼと比べてキナーゼドメインの相同性が高く[[精巣]]に高発現している[[Testicular protein kinase]] ([[TESK1]]と[[TESK2]])がクローニングされた<ref name=Toshima1995><pubmed>8537404</pubmed></ref><ref name=Toshima2001><pubmed>11418599</pubmed></ref>。 | ||
[[ファイル:Ohashi LIMK Fig1.png|サムネイル|''' | [[ファイル:Ohashi LIMK Fig1.png|サムネイル|'''図1. コフィリンのリン酸化・脱リン酸化によるアクチン骨格のダイナミクス制御]] | ||
=== 基質の同定とその機能 === | === 基質の同定とその機能 === | ||
LIMK1が同定された後、LIMK1がリン酸化する標的基質の探索と機能解析が進められた。[[免疫沈降]]したLIMK1を<sup>32</sup>P-[[ATP]]を用いた[[リン酸化]]アッセイにかけると共沈物の中の20 kDaのタンパク質がリン酸化されること、LIMK1を培養細胞に過剰発現させると[[アクチン]]が過[[重合]]することが見出された。アクチン線維の切断・脱重合因子である[[コフィリン]]は、分子量が約20 kDaで3番目の[[セリン]]残基がリン酸化されることで不活性化することが知られていたため<ref name=Agnew1995><pubmed>7615564</pubmed></ref>、LIMK1の基質候補としてコフィリンが検討され、基質であることが明らかにされた<ref name=Arber1998><pubmed>9655397</pubmed></ref><ref name=Yang1998><pubmed>9655398</pubmed></ref>。 | LIMK1が同定された後、LIMK1がリン酸化する標的基質の探索と機能解析が進められた。[[免疫沈降]]したLIMK1を<sup>32</sup>P-[[ATP]]を用いた[[リン酸化]]アッセイにかけると共沈物の中の20 kDaのタンパク質がリン酸化されること、LIMK1を培養細胞に過剰発現させると[[アクチン]]が過[[重合]]することが見出された。アクチン線維の切断・脱重合因子である[[コフィリン]]は、分子量が約20 kDaで3番目の[[セリン]]残基がリン酸化されることで不活性化することが知られていたため<ref name=Agnew1995><pubmed>7615564</pubmed></ref>、LIMK1の基質候補としてコフィリンが検討され、基質であることが明らかにされた<ref name=Arber1998><pubmed>9655397</pubmed></ref><ref name=Yang1998><pubmed>9655398</pubmed></ref>。 | ||
| 39行目: | 39行目: | ||
| [[膜型マトリックスメタロプロテアーゼ]] ([[MT-MMP]]) (LIMK1) || [[癌]]細胞の浸潤の促進([[細胞外マトリックス]]の分解の促進) | | [[膜型マトリックスメタロプロテアーゼ]] ([[MT-MMP]]) (LIMK1) || [[癌]]細胞の浸潤の促進([[細胞外マトリックス]]の分解の促進) | ||
|- | |- | ||
| | | Orb2A (LIMK1) || 長期記憶形成(Orb2Aのオリゴマー化) | ||
|- | |- | ||
| | | NKX-3.1 (LIMK2) || がん悪性化(リン酸化によるユビキチン化の阻害) | ||
|- | |- | ||
| | | PTEN (LIMK2) || がん悪性化(リン酸化によるユビキチン化の阻害) | ||
|- | |- | ||
| | | SPOP (LIMK2) || がん悪性化(リン酸化によるがん抑制因子のユビキチン化の阻害) | ||
|- | |- | ||
| | | SRPK1 (LIMK2) || がん悪性化(リン酸化によるユビキチン化の阻害) | ||
|- | |- | ||
| | | TWIST1 (LIMK2) || がん悪性化(リン酸化によるユビキチン化の阻害) | ||
|} | |} | ||
[[ファイル:Ohashi LIMK Fig2.png|サムネイル|'''図2. LIMキナーゼファミリーの構造と上流キナーゼによるリン酸化部位とカスパーゼ3による切断部位'''<br>LIM: LIMドメイン、PDZ: PDZドメイン、S/T: セリン/スレオニンリッチドメイン、PK: キナーゼドメイン]] | [[ファイル:Ohashi LIMK Fig2.png|サムネイル|'''図2. LIMキナーゼファミリーの構造と上流キナーゼによるリン酸化部位とカスパーゼ3による切断部位'''<br>LIM: LIMドメイン、PDZ: PDZドメイン、S/T: セリン/スレオニンリッチドメイン、PK: キナーゼドメイン]] | ||
| 73行目: | 73行目: | ||
主な働きは、コフィリンの3番目のセリン残基をリン酸化することで不活性化し、アクチン線維の切断・脱重合を抑制してアクチン骨格構造を安定化し、アクチン重合を促進することである('''図1''')<ref name=Arber1998><pubmed>9655397</pubmed></ref><ref name=Yang1998><pubmed>9655398</pubmed></ref>。アクチン骨格構造の動態制御は多くの細胞活動の基盤であり、LIMKは様々な細胞機能において重要な制御機能を担っている。 | 主な働きは、コフィリンの3番目のセリン残基をリン酸化することで不活性化し、アクチン線維の切断・脱重合を抑制してアクチン骨格構造を安定化し、アクチン重合を促進することである('''図1''')<ref name=Arber1998><pubmed>9655397</pubmed></ref><ref name=Yang1998><pubmed>9655398</pubmed></ref>。アクチン骨格構造の動態制御は多くの細胞活動の基盤であり、LIMKは様々な細胞機能において重要な制御機能を担っている。 | ||
LIMKは複数のシグナル経路で活性が制御されることが明らかにされている<ref name=Mizuno2013><pubmed>23153585</pubmed></ref><ref name=Ohashi2015><pubmed>25864508</pubmed></ref><ref name=Villalonga2023><pubmed>36899941</pubmed></ref>。最も主要な経路として、LIMKは低分子量Gタンパク質Rhoファミリーの下流で活性化される。LIMKは[[RhoA]]の下流因子である | LIMKは複数のシグナル経路で活性が制御されることが明らかにされている<ref name=Mizuno2013><pubmed>23153585</pubmed></ref><ref name=Ohashi2015><pubmed>25864508</pubmed></ref><ref name=Villalonga2023><pubmed>36899941</pubmed></ref>。最も主要な経路として、LIMKは低分子量Gタンパク質Rhoファミリーの下流で活性化される。LIMKは[[RhoA]]の下流因子である[[ROCK]]、[[Rac]]と[[Cdc42]]の下流因子である[[PAK]]、Cdc42の下流因子である[[myotonic dystrophy kinase-related Cdc42-binding kinase α]] ([[MRCKα]])によってキナーゼドメイン内の活性化ループの508番目のスレオニン(LIMK2では505番目)がリン酸化され活性化される<ref name=Edwards1999><pubmed>10559936</pubmed></ref><ref name=Maekawa1999><pubmed>10436159</pubmed></ref><ref name=Ohashi2000><pubmed>10652353</pubmed></ref><ref name=Sumi2001><pubmed>11340065</pubmed></ref>。RhoA-ROCK経路によるLIMKの活性化は収縮性の[[アクトミオシン]]であるストレスファイバーの形成を促進し、Rac1やCdc42の下流でPAKによって活性化される場合には、細胞の辺縁で突出するひだ状のアクチン構造であるラメリポディア(葉状仮足)の形成に寄与する。このように、LIMKはRhoファミリーの下流で他のシグナルの分子群と共役して、様々なアクチン骨格構造の形成に関与する<ref name=Mizuno2013><pubmed>23153585</pubmed></ref><ref name=Ohashi2015><pubmed>25864508</pubmed></ref><ref name=Villalonga2023><pubmed>36899941</pubmed></ref>。一方、Rho経路を介さずにLIMKの活性を制御するタンパク質や、LIMKの発現や分解を制御する多くの因子が見出されている(表2)<ref name=Mizuno2013><pubmed>23153585</pubmed></ref><ref name=Ohashi2015><pubmed>25864508</pubmed></ref><ref name=Villalonga2023><pubmed>36899941</pubmed></ref><ref name=BenZablah2021><pubmed>34440848</pubmed></ref>。 | ||
{| class="wikitable" | {| class="wikitable" | ||
|+表2. LIMKの制御因子 | |+表2. LIMKの制御因子 | ||
! 活性化因子 !! 作用 !! 機能 | ! 活性化因子 !! 作用 !! 機能 | ||
|- | |- | ||
| rowspan="2"| | | rowspan="2"|Aurora A || リン酸化 (LIMK1: Ser-307, Thr-508) || 紡錘体形成 | ||
|- | |- | ||
| リン酸化 (LIMK2: Ser-283, Thr-494, Thr-505)|| | | リン酸化 (LIMK2: Ser-283, Thr-494, Thr-505)|| 乳癌細胞の悪性化(キナーゼ活性の活性化、ユビキチン化の阻害による分解の抑制) | ||
|- | |- | ||
| | | CaMKII || リン酸化 (LIMK1: Thr-508) || 皮質神経細胞の神経突起伸展 | ||
|- | |- | ||
| | | CaMKIV || リン酸化 (LIMK1: Thr-508) || Ca2+シグナルによる神経突起形成 | ||
|- | |- | ||
| | | MAPKAPK2(MK2) || リン酸化 (LIMK1: Ser-323) || 血管内皮細胞の移動、管腔形成 | ||
|- | |- | ||
| PAK || リン酸化 (LIMK1: Thr-508) || アクチン重合の促進、葉状仮足形成促進 | | PAK || リン酸化 (LIMK1: Thr-508) || アクチン重合の促進、葉状仮足形成促進 | ||
| 94行目: | 92行目: | ||
| MRCKα || リン酸化 (LIMK1: Thr-508) <br>リン酸化 (LIMK2: Thr-505)|| 未解析 | | MRCKα || リン酸化 (LIMK1: Thr-508) <br>リン酸化 (LIMK2: Thr-505)|| 未解析 | ||
|- | |- | ||
| | | Protein kinase A (PKA) || リン酸化 (LIMK1: Ser-323, Ser-596) || 線維芽細胞の移動 | ||
|- | |- | ||
| ROCK || リン酸化 (LIMK1: Thr-508)<br>リン酸化 (LIMK2: Thr-505) || アクチン重合の促進、ストレスファイバー形成促進 | | ROCK || リン酸化 (LIMK1: Thr-508)<br>リン酸化 (LIMK2: Thr-505) || アクチン重合の促進、ストレスファイバー形成促進 | ||
|- | |- | ||
| | | BMPRII || 結合 (LIMK1) || 神経細胞の樹状突起形成 | ||
|- | |- | ||
| | | p57<sup>Kip2</sup> || 結合 (LIMK1) || ストレスファイバー形成促進、細胞移動の抑制 | ||
|- | |- | ||
| | | Caspase 3 || 限定分解 (LIMK1: Asp-240) || アポトーシスの進行 | ||
|- | |- | ||
! 不活性化因子 !! 作用 !! 機能 | ! 不活性化因子 !! 作用 !! 機能 | ||
|- | |- | ||
| | | Slingshot1 || 脱リン酸化 (LIMK1: Thr-508) || アクチン重合促進に対するフィードバック阻害 | ||
|- | |- | ||
| | | β-Arrestin || 結合による活性抑制 (LIMK1) || ラメリポディア形成の促進 | ||
|- | |- | ||
| BMPRII || 結合による活性抑制 (LIMK1) || アクチン重合の抑制 | | BMPRII || 結合による活性抑制 (LIMK1) || アクチン重合の抑制 | ||
|- | |- | ||
| | | LATS1 || 結合による活性抑制 (LIMK1) || 収縮環の収縮の抑制 | ||
|- | |- | ||
| | | Nischarin || 結合による活性抑制 (LIMK1) || 細胞運動の抑制 | ||
|- | |- | ||
| | | Par3 || 結合による活性抑制 (LIMK2) || タイトジャンクション形成の促進 | ||
|- | |- | ||
| p57Kip2 || 結合による核内移行 (LIMK1) || アクチン重合の抑制 | | p57Kip2 || 結合による核内移行 (LIMK1) || アクチン重合の抑制 | ||
|- | |- | ||
| | | Parkin || ユビキチン化(分解の促進) (LIMK1) || アクチン重合の抑制 | ||
|- | |- | ||
| | | RNF6 || ユビキチン化(分解の促進) (LIMK1) || 海馬神経細胞の軸索伸展の調節 | ||
|- | |- | ||
| miR-134 || 翻訳の抑制 (LIMK1) || 神経樹状突起スパインの発達 | | miR-134 || 翻訳の抑制 (LIMK1) || 神経樹状突起スパインの発達 | ||
| 129行目: | 127行目: | ||
=== 神経細胞における機能 === | === 神経細胞における機能 === | ||
LIMK1は神経突起の伸展・退縮、シナプス形成に関与することが示されている。まず、セマフォリン3Aによるトリ後根神経節(DRG)細胞の軸索先端の成長円錐の退縮において、LIMK1によるコフィリンのリン酸化が必要であることが示された<ref name=Aizawa2001><pubmed>11276226</pubmed></ref>。また、PC12細胞とDRG細胞の神経成長因子(NGF)による神経突起の伸長において、LIMKとSlingshotの両方の活性が必要であることが示され、これらによるコフィリンのリン酸化・脱リン酸化の適切な制御が神経突起の伸展に必要であることが示された<ref name=Endo2003><pubmed>12684437</pubmed></ref><ref name=Endo2007><pubmed>17360713</pubmed></ref>。これまでに、神経細胞の様々な機能においてLIMKの関与が数多く報告されているが、その多くはRho経路の下流でアクチン骨格の再構築を制御することによってなされているものと考えられる。 | |||
一方、Ca<sup>2+</sup>シグナルによる神経突起伸展にもLIMK1は関与しており、Ca<sup>2+</sup> | 一方、Ca<sup>2+</sup>シグナルによる神経突起伸展にもLIMK1は関与しており、Ca<sup>2+</sup>シグナルによるNeuro2A細胞の神経突起伸展において、カルシウムカルモジュリン依存性タンパク質キナーゼ(CaMK)IVによるLIMK1のThr-508のリン酸化と活性化が必要であることや<ref name=Takemura2009><pubmed>19696021</pubmed></ref>、大脳皮質神経細胞の神経突起の伸展においてCaMKIIによるLIMK1のリン酸化と活性化が必要であることが示されている<ref name=Saito2013><pubmed>23600483</pubmed></ref>。大脳皮質神経細胞の樹状突起形成においてII型骨形成因子(BMP)受容体(BMPRII)がLIMK1を活性化することが必要であることが示された<ref name=Lee-Hoeflich2004><pubmed>15538389</pubmed></ref>。 | ||
海馬神経細胞においてユビキチンリガーゼであるRNF6はLIMK1をユビキチン化してプロテアソーム依存的な分解を誘導し、軸索伸長の抑制に働く<ref name=Tursun2005><pubmed>16204183</pubmed></ref>。また、塩基性線維芽細胞成長因子(bFGF)による海馬神経細胞の分化において、LIMK1による転写因子CREBのリン酸化が必要であることが示されている<ref name=Yang2004b><pubmed>14684741</pubmed></ref>。また、ラット海馬スライスを用いた高頻度刺激による後期長期増強(L-LTP)の誘導において、神経細胞の樹状突起スパインにおけるコフィリンのリン酸化と(それに続く)アクチンの重合が必要であることが示され、LIMKの関与が示唆された<ref name=Fukazawa2003><pubmed>12741991</pubmed></ref>。 | |||
=== 神経細胞以外における機能 === | === 神経細胞以外における機能 === | ||
| 142行目: | 140行目: | ||
細胞分裂の前中期・中期にLIMK1の活性は上昇し、コフィリンのリン酸化レベルは上昇するが、後期・終期にかけてLIMK1の活性は低下し、コフィリンのリン酸化レベルは低下する<ref name=Amano2002><pubmed>11925442</pubmed></ref><ref name=Kaji2003><pubmed>12807904</pubmed></ref>。中期におけるLIMKによるコフィリンのリン酸化は紡錘体の正常な配向に必要であり、終期におけるコフィリンの脱リン酸化は正常な細胞質分裂に必要であることが示された<ref name=Kaji2003><pubmed>12807904</pubmed></ref><ref name=Kaji2008><pubmed>18079118</pubmed></ref>。Aurora AとLIMK1は中心体に共局在し、Aurora Aは、LIMK1の307番目のセリン、508番目のスレオニンをリン酸化して活性化する。同時に、LIMK1もAurora Aをリン酸化して活性化し、これらは紡錘体形成に関与する<ref name=Ritchey2012><pubmed>22214762</pubmed></ref>。また、LIMK1は収縮環のアクトミオシンリングの収縮に寄与している<ref name=Yang2004><pubmed>15220930</pubmed></ref>。 | 細胞分裂の前中期・中期にLIMK1の活性は上昇し、コフィリンのリン酸化レベルは上昇するが、後期・終期にかけてLIMK1の活性は低下し、コフィリンのリン酸化レベルは低下する<ref name=Amano2002><pubmed>11925442</pubmed></ref><ref name=Kaji2003><pubmed>12807904</pubmed></ref>。中期におけるLIMKによるコフィリンのリン酸化は紡錘体の正常な配向に必要であり、終期におけるコフィリンの脱リン酸化は正常な細胞質分裂に必要であることが示された<ref name=Kaji2003><pubmed>12807904</pubmed></ref><ref name=Kaji2008><pubmed>18079118</pubmed></ref>。Aurora AとLIMK1は中心体に共局在し、Aurora Aは、LIMK1の307番目のセリン、508番目のスレオニンをリン酸化して活性化する。同時に、LIMK1もAurora Aをリン酸化して活性化し、これらは紡錘体形成に関与する<ref name=Ritchey2012><pubmed>22214762</pubmed></ref>。また、LIMK1は収縮環のアクトミオシンリングの収縮に寄与している<ref name=Yang2004><pubmed>15220930</pubmed></ref>。 | ||
==== 細胞移動(走化性) ==== | ==== 細胞移動(走化性) ==== | ||
アクチン骨格の再構築は細胞移動、細胞遊走に必須であることから、LIMKによるコフィリンのリン酸化は癌細胞、免疫細胞、神経細胞など多くの細胞の移動、遊走に関与している<ref name=Nishita2002><pubmed>11784854</pubmed></ref><ref name=Nishita2005><pubmed>16230460</pubmed></ref>。 | |||
==== 血管新生 ==== | ==== 血管新生 ==== | ||
血管内皮細胞増殖因子(VEGF)による血管内皮細胞の細胞遊走や3次元ゲル内での管腔形成において、LIMK1は、p38MAPキナーゼの下流のキナーゼであるMAPKAPK2 (MK2)によってLIMK1の323番目のセリンがリン酸化され、活性化されることが必要であることが示された<ref name=Kobayashi2006><pubmed>16456544</pubmed></ref>。 | |||
==== 癌細胞の浸潤、転移 ==== | ==== 癌細胞の浸潤、転移 ==== | ||
癌細胞におけるLIMK1とLIMK2の発現の上昇は、増殖能、運動能や浸潤性を亢進し癌の悪性化に寄与することが報告されている<ref name=Villalonga2023><pubmed>36899941</pubmed></ref> | 癌細胞におけるLIMK1とLIMK2の発現の上昇は、増殖能、運動能や浸潤性を亢進し癌の悪性化に寄与することが報告されている<ref name=Villalonga2023><pubmed>36899941</pubmed></ref>。高浸潤性の肝癌細胞が中皮細胞層を透過する癌細胞の浸潤モデルや、乳癌細胞のコラーゲンゲル内を移動するモデルにおいてLIMK1の関与が示された<ref name=Horita2008><pubmed>18171679</pubmed></ref><ref name=Mishima2010><pubmed>20100465</pubmed></ref>。LIMK2については、乳癌などいくつかのモデルでの関与が示されている。LIMK2は、Aurora-Aによるリン酸化によって活性化し乳癌の悪性化に働く。また、LIMK2は癌転移促進因子であるTWIST1をリン酸化してユビキチン化を阻害し、プロテアソームによる分解を抑制することや、逆に、癌の抑制因子であるPTEN, NKX-3.1, SPOPをリン酸化してユビキチン化を促進してプロテアソームによる分解を促進することで、癌の悪性化に関与する<ref name=Villalonga2023><pubmed>36899941</pubmed></ref>。 | ||
== 個体での機能 == | == 個体での機能 == | ||
limk1遺伝子欠損マウスでは海馬における長期増強(LTP)が増強されること、恐怖文脈条件づけによる恐怖反応において、条件刺激の再提示の繰り返しで恐怖反応時間の短縮が起こらないことや、モリス水迷路テストによる空間学習において再学習に障害があることが示されており、少なくとも一部の学習能に障害が起きていることが示唆されている<ref name=Meng2002><pubmed>12123613</pubmed></ref>。また、海馬や皮質の錐体神経細胞では樹状突起スパインの形状が細長く未熟であることが示されている<ref name=Meng2002><pubmed>12123613</pubmed></ref>。limk2遺伝子欠損マウスでは、精子形成に欠損があるが、神経形態に大きな異常は認められない。limk1とlimk2遺伝子の両方を欠損したマウスでは、神経細胞の形態や神経機能の異常は重篤化し、神経細胞においてこれらが相補的に働いていることが示唆されている<ref name=Meng2004><pubmed>15458846</pubmed></ref>。一方、limk1遺伝子の欠損は、後期長期増強(L-LTP)の大きな障害を生じるという結果も報告されている<ref name=Todorovski2015><pubmed>25645926</pubmed></ref>。また、代謝型グルタミン酸受容体依存性の長期抑圧(mGluR-LTD)に対して、LIMK1が不活性化されることが必要であることが示されている<ref name=Zhou2011><pubmed>21248105</pubmed></ref>。これらの知見は、記憶の形成におけるシナプスの形態制御にLIMK1-コフィリン経路を介したアクチン骨格の重合制御が関与することを示唆している。 | |||
神経細胞における影響の他に、limk1遺伝子欠損マウスは骨の形成に影響し、骨芽細胞の減少と骨量の減少が見られる<ref name=Kawano2013><pubmed>23017662</pubmed></ref>。 | |||
== 疾患との関わり == | == 疾患との関わり == | ||
=== 精神・神経疾患 === | === 精神・神経疾患 === | ||
アルツハイマー病、パーキンソン病、統合失調症、自閉症スペクトラムといった精神・神経疾患、発達異常に関連があることが示唆されている<ref name=Villalonga2023><pubmed>36899941</pubmed></ref><ref name=BenZablah2021><pubmed>34440848</pubmed></ref>。これらの疾患の症状は、LIMK1の単独の機能欠損に依存するというよりも、Rho経路等のLIMK1の上流因子の異常とともにLIMK1を介したコフィリンのリン酸化レベルの調節が不全となり、アクチン動態と細胞形態・機能の異常を引き起こすことが神経機能の低下の一因として働いていると考えられる。パーキンソン病については、LIMK1とユビキチンリガーゼであるパーキンが相互作用し、お互いに働きを抑制することが示されている<ref name=Lim2007><pubmed>17512523</pubmed></ref>。しかし、LIMK1の欠損によるスパイン形成異常とパーキンソン病との関係は不明である。先天的な染色体欠失による発達障害であるウィリアムズ・ボーレン症候群では、limk1遺伝子単独の半接合体欠損の家系の解析から、LIMK1が空間認知機能に関与することが報告された<ref name=Frangiskakis1996><pubmed>8689688</pubmed></ref>。その後の解析では、空間認知機能におけるLIMK1の関与を示唆する報告と否定的な報告がある<ref name=Smith2009><pubmed>19662944</pubmed></ref><ref name=Gregory2019><pubmed>31687737</pubmed></ref>。 | |||
=== 癌 === | === 癌 === | ||
| 166行目: | 160行目: | ||
== 阻害剤 == | == 阻害剤 == | ||
LIMK1は精神・神経疾患との関連が示唆されていることや、LIMKは癌細胞で高発現して癌細胞の運動性や浸潤能に関与することから、それらの治療の標的分子としてLIMK阻害薬の探索とその効能が検討されている。また、Rho-ROCK経路の下流で働くことから、細胞の収縮力の制御の異常に起因する疾患の緩和を目的としてLIMK阻害剤の効果が検討されている<ref name=Berabez2022><pubmed>35805176</pubmed></ref>。Ellipticine誘導体のPyr1をもとにしたLIMK阻害剤は、統合失調症、癌発症のモデルマウスに対する効果が検討され、白血病、乳癌、統合失調症様の行動異常を改善する効果が確認されている<ref name=Prudent2012><pubmed>22761334</pubmed></ref><ref name=Prunier2016><pubmed>27216191</pubmed></ref><ref name=Gory-Faure2021><pubmed>33790791</pubmed></ref>。また、pyrrolopyrimidine化合物をもとにしたLIMK阻害剤は、マウスへのデキサメサゾン投与による眼圧の上昇を抑制する<ref name=Harrison2009><pubmed>19831390</pubmed></ref>。SrcファミリーのLckの阻害剤として同定されていた天然物のDamnacantholは、LIMK1に対してLckよりも強い阻害効果をもち、マウス耳の皮膚へのハプテン刺激によるランゲルハンス細胞の遊走を阻害する<ref name=Ohashi2014><pubmed>24478456</pubmed></ref>。その他にも培養癌細胞や病理組織由来の培養細胞に対するLIMK阻害剤の効果が検討されている<ref name=Berabez2022><pubmed>35805176</pubmed></ref>。LIMKの阻害剤はLIMKの上流キナーゼであるROCKの阻害剤に比べて細胞毒性が低い傾向があり、有効な薬剤となることが期待されている。 | |||
== 関連語 == | == 関連語 == | ||
* [[コフィリン]] | * [[コフィリン]] | ||
* [[Rho]] | * [[Rho]] | ||
* [[ | * [[Slingshot]] | ||
* [[リン酸化]] | * [[リン酸化]] | ||
* [[アクチン細胞骨格]] | * [[アクチン細胞骨格]] | ||
2025年6月30日 (月) 12:22時点における版
大橋 一正、水野 健作
東北大学 大学院生命科学研究科 分子化学生物学専攻
DOI:10.14931/bsd.11092 原稿受付日:2025年6月15日 原稿完成日:2025年6月24日
担当編集委員:古屋敷 智之(神戸大学大学院医学研究科・医学部 薬理学分野)
英:LIM domain-containing kinase
略称:LIMキナーゼ、LIMK
LIMドメイン含有キナーゼ (LIMK)は、N末端にジンクフィンガーモチーフであるLIMドメインを2つ持ち、C末端側にキナーゼドメインを持つ細胞内のリン酸化酵素である。アクチン切断・脱重合因子であるコフィリンをリン酸化して不活性化し、アクチン骨格の再構築を制御する。コフィリンによるアクチン線維の切断・脱重合はアクチン骨格のターンオーバーに必須であり、LIMKはその働きを阻害する。一方、コフィリンの脱リン酸化酵素であるSlingshotは再活性化を担う。LIMKとSlingshotによるコフィリンのリン酸化の制御によってアクチン骨格の形成と崩壊の動的な制御が行われる。アクチン骨格の動的な制御は多くの細胞活動の基盤であり、LIMKによるコフィリンのリン酸化は、神経機能を含む様々な細胞機能・生理機能に重要な役割を果たしている。LIMKの活性は、アクチン骨格の再構築の主要な制御因子である低分子量Gタンパク質Rhoファミリーを介するシグナル経路によって主に制御されている。その他にも翻訳後修飾、分解、タンパク質相互作用、発現調節によって活性や発現量が制御されている。limk遺伝子は、脊椎動物ではlimk1とlimk2の2種類が存在し、ともに組織に広く発現しており、LIMK1は発生過程や脳に比較的発現量が高い。LIMKは、神経細胞の突起形成やスパイン形成の制御に関与しており、記憶の形成や神経疾患に関与することが報告されている。また、癌の悪性化にも関与することが報告されている。
LIMドメイン含有キナーゼとは
発見
LIMKは、1994年、プロテインキナーゼのキナーゼドメインの配列類似性に基づいた遺伝子クローニングによって発見された。まず、受容体型チロシンキナーゼである肝細胞増殖因子(HGF)受容体 (c-met)と類似したプロトオンコジーンc-seaのcDNA断片を用いたcDNAスクリーニングによって、ヒトHepG2細胞のcDNAライブラリーより新たなプロテインキナーゼが同定され、分子内にZnフィンガーモチーフの一つであるLIMドメインを持つことから、LIMドメイン含有キナーゼ-1(LIMK1)と命名された[1]。また、キナーゼドメインに保存された配列をプライマーに用いたPCRによって、同年、マウス嗅上皮のcDNAより新たなキナーゼが同定され、Kiz-1と名付けられたが、これはLIMK1と同一であることがわかった[2]。
さらに、LIMK1のキナーゼドメインのcDNA断片を用いたスクリーニングによって、ドメイン構造が同じで高い相同性をもつLIMK2が発見された[3]。また、全体の構造は異なるが、他のキナーゼと比べてキナーゼドメインの相同性が高く精巣に高発現しているTesticular protein kinase (TESK1とTESK2)がクローニングされた[4][5]。
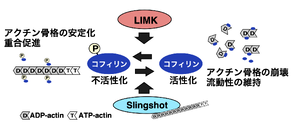
基質の同定とその機能
LIMK1が同定された後、LIMK1がリン酸化する標的基質の探索と機能解析が進められた。免疫沈降したLIMK1を32P-ATPを用いたリン酸化アッセイにかけると共沈物の中の20 kDaのタンパク質がリン酸化されること、LIMK1を培養細胞に過剰発現させるとアクチンが過重合することが見出された。アクチン線維の切断・脱重合因子であるコフィリンは、分子量が約20 kDaで3番目のセリン残基がリン酸化されることで不活性化することが知られていたため[6]、LIMK1の基質候補としてコフィリンが検討され、基質であることが明らかにされた[7][8]。
コフィリンは、哺乳類で非筋肉型コフィリン(別名n-cofilin、cofilin-1)、筋肉型コフィリン(別名m-cofilin、cofilin-2)、actin depolymerizing factor(ADF)(別名デストリンdestrin)の3種類が存在する。これらの働きは共通しており、全てLIMKにリン酸化され不活性化される[9][10]。以後、これらを総称してコフィリンと記す。コフィリンは、アクチン骨格の動的な状態を生み出すタンパク質である。系統学的には酵母にも存在し、細胞の生存に必須である。また、ヒトと酵母で機能互換できるほどその働きは重要で保存されている[9][11][12]。一方で、コフィリンのリン酸化による活性制御は細胞の生存に必須ではなく、後生生物になってから獲得した翻訳後修飾であると考えられる。
LIMKの基本的な働きは、コフィリンを不活性化して、アクチン線維の脱重合を抑制し、重合を促進し、アクチン線維を安定化することである(図1)。その後の解析により、LIMKのコフィリン以外の基質も複数報告され、それらのリン酸化の役割が報告されている(表1)[10][13][14]。
LIMKの発見後、細胞応答におけるその働きとシグナル伝達機構が探索され、アクチン骨格の再構築制御の鍵となる低分子量Gタンパク質Rhoファミリー分子の下流で機能することが示された[15][16][17]。さらに、様々な刺激に対する細胞応答において、Rho経路以外にもLIMKの活性を制御する制御因子やシグナル経路が同定され(表2)、アクチン骨格再構築の制御という共通の働きによって、神経機能を含む様々な細胞応答に寄与していることが明らかになっている[10][13][14][18]。
| 基質 (LIMKのタイプ) | 機能 |
|---|---|
| コフィリン (LINK1/LIMK2) | アクチン線維の重合・安定化の促進 |
| アネキシン1 (LIMK1) | 内皮細胞の管腔形成の促進 |
| サイクリックAMP応答配列結合タンパク質 (CREB) (LIMK1) | 神経細胞の分化促進 |
| 膜型マトリックスメタロプロテアーゼ (MT-MMP) (LIMK1) | 癌細胞の浸潤の促進(細胞外マトリックスの分解の促進) |
| Orb2A (LIMK1) | 長期記憶形成(Orb2Aのオリゴマー化) |
| NKX-3.1 (LIMK2) | がん悪性化(リン酸化によるユビキチン化の阻害) |
| PTEN (LIMK2) | がん悪性化(リン酸化によるユビキチン化の阻害) |
| SPOP (LIMK2) | がん悪性化(リン酸化によるがん抑制因子のユビキチン化の阻害) |
| SRPK1 (LIMK2) | がん悪性化(リン酸化によるユビキチン化の阻害) |
| TWIST1 (LIMK2) | がん悪性化(リン酸化によるユビキチン化の阻害) |
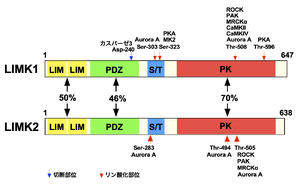
LIM: LIMドメイン、PDZ: PDZドメイン、S/T: セリン/スレオニンリッチドメイン、PK: キナーゼドメイン
構造
LIMKは、哺乳類ではドメイン構成が同じLIMK1とLIMK2の2種類が存在する。また、LIMドメインをもたないが、キナーゼドメインが、他のキナーゼに比べて高い相同性を示し、LIMKと同様にコフィリンを基質とするTESK1とTESK2が存在しており、広義のLIMKファミリーはこれらも含む[10][13]。本項では主にLIMK1とLIMK2について記述する。
LIMK1とLIMK2は、N末端側にジンクフィンガーモチーフの一つであるLIMドメインを2つもち、続いて、PDZドメイン、セリン/スレオニン(S/T)リッチ領域、C末端側にキナーゼドメインを有する(図2)[3][10]。キナーゼドメインの配列はチロシンキナーゼ様の配列を示すが、キナーゼドメインの12の保存されたサブドメインのうち基質認識に関与するサブドメインVIb(HRDモチーフ)の配列がLIMKでは特徴的であり、実際にはセリン/スレオニンとチロシンの両方の残基をリン酸化することができる[3]。LIMドメインは、LIMK1のキナーゼドメインを含むC末端領域と結合し、キナーゼ活性を負に制御することが示されている[19]。
また、キナーゼドメイン内にシャペロンの一つであるHsp90の結合部位が存在し、LIMKはHsp90と結合することで2量体化が促進されること、2量体化によって自己リン酸化が促進され、LIMKの安定化と細胞内のコフィリンのリン酸化レベルの維持に寄与する[20]。また、LIMK1は、PDZドメイン内に2箇所の核外移行シグナル配列を持ち、キナーゼドメイン内に核移行シグナルを持つ[21]。LIMK2はキナーゼドメイン内のLIMK1と相同の位置に核移行シグナルを持つが、その直前にLIMK1には無い核小体への局在化配列を持つ[22]。
X線結晶構造解析によって、LIMK1のキナーゼドメインは、通常のキナーゼ-基質間の結合領域とは別の領域でもコフィリンと特異的に結合することが示されており[23]、この結果はコフィリンがLIMKの主要な基質であることを裏付けている。
limk1, limk2遺伝子は、後生生物以降で出現する。limk1とlimk2遺伝子は、各々ヒト染色体の7q11.23と22q12.2に存在する[3]。limkのオーソログは、ホヤ、ウニ、ショウジョウバエには存在するが、酵母、粘菌、植物、線虫には存在しない。基質であるコフィリンは酵母を含むこれらの種に存在するが、LIMKファミリーの存在しない生物種でのコフィリンのリン酸化制御の有無は不明である。
組織発現分布
LIMK1の組織発現分布は、発生過程の脳に高発現していることが特徴であるが、体全体にもユビキタスに発現している[24]。LIMK2は、体全体にユビキタスに発現しており、広くLIMK1と重なった発現分布である。また、精巣など一部の組織で細胞種特異的なスプライシング変異体の発現があることが示されている[24][25]。limk1遺伝子欠損マウスでは脳神経系に異常がみられることや、limk1とlimk2遺伝子の両方を欠損したマウスでは症状が重篤化することなど、ある程度発現分布と一致した結果が報告されている[14]。
細胞内局在
LIMK1とLIMK2は共に、培養細胞に発現させた場合、間期の細胞では細胞質に拡散して存在し、特徴的な局在は見られない[8]。しかし、接着斑、紡錘体、中心体、ゴルジ体に局在するとの報告もある[26][27][28]。また、核移行シグナルと核外移行シグナル配列をもち、核内外をシャトルしている[21]。アクチンやコフィリンも核内に存在し、コフィリンは核内のアクチン線維のターンオーバーや凝集に関与することが知られているが[9]、LIMKの核内における役割は不明である。分裂期では、LIMK1はlarge tumor suppressor kinase 1 (LATS1)と相互作用し収縮環に局在する[29]。海馬神経細胞では、LIMK1はN末端付近のシステイン残基がパルミトイル化され樹状突起のスパインに局在することが示されている[30]。
細胞機能
アクチン骨格再構築における機能とRho経路による活性制御
主な働きは、コフィリンの3番目のセリン残基をリン酸化することで不活性化し、アクチン線維の切断・脱重合を抑制してアクチン骨格構造を安定化し、アクチン重合を促進することである(図1)[7][8]。アクチン骨格構造の動態制御は多くの細胞活動の基盤であり、LIMKは様々な細胞機能において重要な制御機能を担っている。
LIMKは複数のシグナル経路で活性が制御されることが明らかにされている[10][13][14]。最も主要な経路として、LIMKは低分子量Gタンパク質Rhoファミリーの下流で活性化される。LIMKはRhoAの下流因子であるROCK、RacとCdc42の下流因子であるPAK、Cdc42の下流因子であるmyotonic dystrophy kinase-related Cdc42-binding kinase α (MRCKα)によってキナーゼドメイン内の活性化ループの508番目のスレオニン(LIMK2では505番目)がリン酸化され活性化される[15][16][17][31]。RhoA-ROCK経路によるLIMKの活性化は収縮性のアクトミオシンであるストレスファイバーの形成を促進し、Rac1やCdc42の下流でPAKによって活性化される場合には、細胞の辺縁で突出するひだ状のアクチン構造であるラメリポディア(葉状仮足)の形成に寄与する。このように、LIMKはRhoファミリーの下流で他のシグナルの分子群と共役して、様々なアクチン骨格構造の形成に関与する[10][13][14]。一方、Rho経路を介さずにLIMKの活性を制御するタンパク質や、LIMKの発現や分解を制御する多くの因子が見出されている(表2)[10][13][14][18]。
| 活性化因子 | 作用 | 機能 |
|---|---|---|
| Aurora A | リン酸化 (LIMK1: Ser-307, Thr-508) | 紡錘体形成 |
| リン酸化 (LIMK2: Ser-283, Thr-494, Thr-505) | 乳癌細胞の悪性化(キナーゼ活性の活性化、ユビキチン化の阻害による分解の抑制) | |
| CaMKII | リン酸化 (LIMK1: Thr-508) | 皮質神経細胞の神経突起伸展 |
| CaMKIV | リン酸化 (LIMK1: Thr-508) | Ca2+シグナルによる神経突起形成 |
| MAPKAPK2(MK2) | リン酸化 (LIMK1: Ser-323) | 血管内皮細胞の移動、管腔形成 |
| PAK | リン酸化 (LIMK1: Thr-508) | アクチン重合の促進、葉状仮足形成促進 |
| MRCKα | リン酸化 (LIMK1: Thr-508) リン酸化 (LIMK2: Thr-505) |
未解析 |
| Protein kinase A (PKA) | リン酸化 (LIMK1: Ser-323, Ser-596) | 線維芽細胞の移動 |
| ROCK | リン酸化 (LIMK1: Thr-508) リン酸化 (LIMK2: Thr-505) |
アクチン重合の促進、ストレスファイバー形成促進 |
| BMPRII | 結合 (LIMK1) | 神経細胞の樹状突起形成 |
| p57Kip2 | 結合 (LIMK1) | ストレスファイバー形成促進、細胞移動の抑制 |
| Caspase 3 | 限定分解 (LIMK1: Asp-240) | アポトーシスの進行 |
| 不活性化因子 | 作用 | 機能 |
| Slingshot1 | 脱リン酸化 (LIMK1: Thr-508) | アクチン重合促進に対するフィードバック阻害 |
| β-Arrestin | 結合による活性抑制 (LIMK1) | ラメリポディア形成の促進 |
| BMPRII | 結合による活性抑制 (LIMK1) | アクチン重合の抑制 |
| LATS1 | 結合による活性抑制 (LIMK1) | 収縮環の収縮の抑制 |
| Nischarin | 結合による活性抑制 (LIMK1) | 細胞運動の抑制 |
| Par3 | 結合による活性抑制 (LIMK2) | タイトジャンクション形成の促進 |
| p57Kip2 | 結合による核内移行 (LIMK1) | アクチン重合の抑制 |
| Parkin | ユビキチン化(分解の促進) (LIMK1) | アクチン重合の抑制 |
| RNF6 | ユビキチン化(分解の促進) (LIMK1) | 海馬神経細胞の軸索伸展の調節 |
| miR-134 | 翻訳の抑制 (LIMK1) | 神経樹状突起スパインの発達 |
注)LIMK2に対して解析されていないものを含む。
神経細胞における機能
LIMK1は神経突起の伸展・退縮、シナプス形成に関与することが示されている。まず、セマフォリン3Aによるトリ後根神経節(DRG)細胞の軸索先端の成長円錐の退縮において、LIMK1によるコフィリンのリン酸化が必要であることが示された[32]。また、PC12細胞とDRG細胞の神経成長因子(NGF)による神経突起の伸長において、LIMKとSlingshotの両方の活性が必要であることが示され、これらによるコフィリンのリン酸化・脱リン酸化の適切な制御が神経突起の伸展に必要であることが示された[33][34]。これまでに、神経細胞の様々な機能においてLIMKの関与が数多く報告されているが、その多くはRho経路の下流でアクチン骨格の再構築を制御することによってなされているものと考えられる。
一方、Ca2+シグナルによる神経突起伸展にもLIMK1は関与しており、Ca2+シグナルによるNeuro2A細胞の神経突起伸展において、カルシウムカルモジュリン依存性タンパク質キナーゼ(CaMK)IVによるLIMK1のThr-508のリン酸化と活性化が必要であることや[35]、大脳皮質神経細胞の神経突起の伸展においてCaMKIIによるLIMK1のリン酸化と活性化が必要であることが示されている[36]。大脳皮質神経細胞の樹状突起形成においてII型骨形成因子(BMP)受容体(BMPRII)がLIMK1を活性化することが必要であることが示された[37]。
海馬神経細胞においてユビキチンリガーゼであるRNF6はLIMK1をユビキチン化してプロテアソーム依存的な分解を誘導し、軸索伸長の抑制に働く[38]。また、塩基性線維芽細胞成長因子(bFGF)による海馬神経細胞の分化において、LIMK1による転写因子CREBのリン酸化が必要であることが示されている[39]。また、ラット海馬スライスを用いた高頻度刺激による後期長期増強(L-LTP)の誘導において、神経細胞の樹状突起スパインにおけるコフィリンのリン酸化と(それに続く)アクチンの重合が必要であることが示され、LIMKの関与が示唆された[40]。
神経細胞以外における機能
アクチン骨格の再構築、細胞形態
LIMKは、細胞質でコフィリンをリン酸化して不活性化し、アクチン線維の脱重合を抑制し、重合の促進、アクチン線維の安定化を促進する。これによりストレスファイバー形成、ラメリポディア形成などアクチン骨格の再構築を制御し、細胞の形態制御や運動など多くの機能に寄与している[10][13][14]。
細胞分裂
細胞分裂の前中期・中期にLIMK1の活性は上昇し、コフィリンのリン酸化レベルは上昇するが、後期・終期にかけてLIMK1の活性は低下し、コフィリンのリン酸化レベルは低下する[41][42]。中期におけるLIMKによるコフィリンのリン酸化は紡錘体の正常な配向に必要であり、終期におけるコフィリンの脱リン酸化は正常な細胞質分裂に必要であることが示された[42][43]。Aurora AとLIMK1は中心体に共局在し、Aurora Aは、LIMK1の307番目のセリン、508番目のスレオニンをリン酸化して活性化する。同時に、LIMK1もAurora Aをリン酸化して活性化し、これらは紡錘体形成に関与する[44]。また、LIMK1は収縮環のアクトミオシンリングの収縮に寄与している[29]。
細胞移動(走化性)
アクチン骨格の再構築は細胞移動、細胞遊走に必須であることから、LIMKによるコフィリンのリン酸化は癌細胞、免疫細胞、神経細胞など多くの細胞の移動、遊走に関与している[45][46]。
血管新生
血管内皮細胞増殖因子(VEGF)による血管内皮細胞の細胞遊走や3次元ゲル内での管腔形成において、LIMK1は、p38MAPキナーゼの下流のキナーゼであるMAPKAPK2 (MK2)によってLIMK1の323番目のセリンがリン酸化され、活性化されることが必要であることが示された[47]。
癌細胞の浸潤、転移
癌細胞におけるLIMK1とLIMK2の発現の上昇は、増殖能、運動能や浸潤性を亢進し癌の悪性化に寄与することが報告されている[14]。高浸潤性の肝癌細胞が中皮細胞層を透過する癌細胞の浸潤モデルや、乳癌細胞のコラーゲンゲル内を移動するモデルにおいてLIMK1の関与が示された[48][49]。LIMK2については、乳癌などいくつかのモデルでの関与が示されている。LIMK2は、Aurora-Aによるリン酸化によって活性化し乳癌の悪性化に働く。また、LIMK2は癌転移促進因子であるTWIST1をリン酸化してユビキチン化を阻害し、プロテアソームによる分解を抑制することや、逆に、癌の抑制因子であるPTEN, NKX-3.1, SPOPをリン酸化してユビキチン化を促進してプロテアソームによる分解を促進することで、癌の悪性化に関与する[14]。
個体での機能
limk1遺伝子欠損マウスでは海馬における長期増強(LTP)が増強されること、恐怖文脈条件づけによる恐怖反応において、条件刺激の再提示の繰り返しで恐怖反応時間の短縮が起こらないことや、モリス水迷路テストによる空間学習において再学習に障害があることが示されており、少なくとも一部の学習能に障害が起きていることが示唆されている[50]。また、海馬や皮質の錐体神経細胞では樹状突起スパインの形状が細長く未熟であることが示されている[50]。limk2遺伝子欠損マウスでは、精子形成に欠損があるが、神経形態に大きな異常は認められない。limk1とlimk2遺伝子の両方を欠損したマウスでは、神経細胞の形態や神経機能の異常は重篤化し、神経細胞においてこれらが相補的に働いていることが示唆されている[51]。一方、limk1遺伝子の欠損は、後期長期増強(L-LTP)の大きな障害を生じるという結果も報告されている[52]。また、代謝型グルタミン酸受容体依存性の長期抑圧(mGluR-LTD)に対して、LIMK1が不活性化されることが必要であることが示されている[53]。これらの知見は、記憶の形成におけるシナプスの形態制御にLIMK1-コフィリン経路を介したアクチン骨格の重合制御が関与することを示唆している。
神経細胞における影響の他に、limk1遺伝子欠損マウスは骨の形成に影響し、骨芽細胞の減少と骨量の減少が見られる[54]。
疾患との関わり
精神・神経疾患
アルツハイマー病、パーキンソン病、統合失調症、自閉症スペクトラムといった精神・神経疾患、発達異常に関連があることが示唆されている[14][18]。これらの疾患の症状は、LIMK1の単独の機能欠損に依存するというよりも、Rho経路等のLIMK1の上流因子の異常とともにLIMK1を介したコフィリンのリン酸化レベルの調節が不全となり、アクチン動態と細胞形態・機能の異常を引き起こすことが神経機能の低下の一因として働いていると考えられる。パーキンソン病については、LIMK1とユビキチンリガーゼであるパーキンが相互作用し、お互いに働きを抑制することが示されている[55]。しかし、LIMK1の欠損によるスパイン形成異常とパーキンソン病との関係は不明である。先天的な染色体欠失による発達障害であるウィリアムズ・ボーレン症候群では、limk1遺伝子単独の半接合体欠損の家系の解析から、LIMK1が空間認知機能に関与することが報告された[56]。その後の解析では、空間認知機能におけるLIMK1の関与を示唆する報告と否定的な報告がある[57][58]。
癌
癌細胞におけるLIMK1とLIMK2の発現の上昇は、増殖、運動能や浸潤性を亢進し、癌の悪性化に寄与することが報告されている[14]。培養細胞では、LIMK1の過剰発現によってコフィリンが過剰にリン酸化されると細胞の運動性は極端に低下し増殖できなくなることから、癌細胞ではLIMKの適度な発現量の増加が運動能、増殖能の亢進に寄与しているものと考えられる。LIMK2については、乳癌などいくつかのモデルにおいて関与が示されている。LIMK2は、前述のようにAurora-Aによるリン酸化によって活性化し乳癌の悪性化に働く。また、LIMK2はTWIST1, PTEN, NKX-3.1, SPOPをリン酸化し、癌転移促進因子であるTWIST1ではプロテアソームによる分解の抑制、癌抑制因子であるPTEN, NKX-3.1, SPOPでは分解を促進して癌の悪性化に関与する[14]。
阻害剤
LIMK1は精神・神経疾患との関連が示唆されていることや、LIMKは癌細胞で高発現して癌細胞の運動性や浸潤能に関与することから、それらの治療の標的分子としてLIMK阻害薬の探索とその効能が検討されている。また、Rho-ROCK経路の下流で働くことから、細胞の収縮力の制御の異常に起因する疾患の緩和を目的としてLIMK阻害剤の効果が検討されている[59]。Ellipticine誘導体のPyr1をもとにしたLIMK阻害剤は、統合失調症、癌発症のモデルマウスに対する効果が検討され、白血病、乳癌、統合失調症様の行動異常を改善する効果が確認されている[60][61][62]。また、pyrrolopyrimidine化合物をもとにしたLIMK阻害剤は、マウスへのデキサメサゾン投与による眼圧の上昇を抑制する[63]。SrcファミリーのLckの阻害剤として同定されていた天然物のDamnacantholは、LIMK1に対してLckよりも強い阻害効果をもち、マウス耳の皮膚へのハプテン刺激によるランゲルハンス細胞の遊走を阻害する[64]。その他にも培養癌細胞や病理組織由来の培養細胞に対するLIMK阻害剤の効果が検討されている[59]。LIMKの阻害剤はLIMKの上流キナーゼであるROCKの阻害剤に比べて細胞毒性が低い傾向があり、有効な薬剤となることが期待されている。
関連語
参考論文
- ↑
Mizuno, K., Okano, I., Ohashi, K., Nunoue, K., Kuma, K., Miyata, T., & Nakamura, T. (1994).
Identification of a human cDNA encoding a novel protein kinase with two repeats of the LIM/double zinc finger motif. Oncogene, 9(6), 1605-12. [PubMed:8183554] [WorldCat] - ↑
Bernard, O., Ganiatsas, S., Kannourakis, G., & Dringen, R. (1994).
Kiz-1, a protein with LIM zinc finger and kinase domains, is expressed mainly in neurons. Cell growth & differentiation : the molecular biology journal of the American Association for Cancer Research, 5(11), 1159-71. [PubMed:7848918] [WorldCat] - ↑ 3.0 3.1 3.2 3.3
Okano, I., Hiraoka, J., Otera, H., Nunoue, K., Ohashi, K., Iwashita, S., ..., & Mizuno, K. (1995).
Identification and characterization of a novel family of serine/threonine kinases containing two N-terminal LIM motifs. The Journal of biological chemistry, 270(52), 31321-30. [PubMed:8537403] [WorldCat] [DOI] - ↑
Toshima, J., Ohashi, K., Okano, I., Nunoue, K., Kishioka, M., Kuma, K., ..., & Mizuno, K. (1995).
Identification and characterization of a novel protein kinase, TESK1, specifically expressed in testicular germ cells. The Journal of biological chemistry, 270(52), 31331-7. [PubMed:8537404] [WorldCat] [DOI] - ↑
Toshima, J., Toshima, J.Y., Takeuchi, K., Mori, R., & Mizuno, K. (2001).
Cofilin phosphorylation and actin reorganization activities of testicular protein kinase 2 and its predominant expression in testicular Sertoli cells. The Journal of biological chemistry, 276(33), 31449-58. [PubMed:11418599] [WorldCat] [DOI] - ↑
Agnew, B.J., Minamide, L.S., & Bamburg, J.R. (1995).
Reactivation of phosphorylated actin depolymerizing factor and identification of the regulatory site. The Journal of biological chemistry, 270(29), 17582-7. [PubMed:7615564] [WorldCat] [DOI] - ↑ 7.0 7.1
Arber, S., Barbayannis, F.A., Hanser, H., Schneider, C., Stanyon, C.A., Bernard, O., & Caroni, P. (1998).
Regulation of actin dynamics through phosphorylation of cofilin by LIM-kinase. Nature, 393(6687), 805-9. [PubMed:9655397] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2
Yang, N., Higuchi, O., Ohashi, K., Nagata, K., Wada, A., Kangawa, K., ..., & Mizuno, K. (1998).
Cofilin phosphorylation by LIM-kinase 1 and its role in Rac-mediated actin reorganization. Nature, 393(6687), 809-12. [PubMed:9655398] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2
Ono, S. (2007).
Mechanism of depolymerization and severing of actin filaments and its significance in cytoskeletal dynamics. International review of cytology, 258, 1-82. [PubMed:17338919] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2 10.3 10.4 10.5 10.6 10.7 10.8
Mizuno, K. (2013).
Signaling mechanisms and functional roles of cofilin phosphorylation and dephosphorylation. Cellular signalling, 25(2), 457-69. [PubMed:23153585] [WorldCat] [DOI] - ↑
Bamburg, J.R., McGough, A., & Ono, S. (1999).
Putting a new twist on actin: ADF/cofilins modulate actin dynamics. Trends in cell biology, 9(9), 364-70. [PubMed:10461190] [WorldCat] [DOI] - ↑
Pollard, T.D., & Borisy, G.G. (2003).
Cellular motility driven by assembly and disassembly of actin filaments. Cell, 112(4), 453-65. [PubMed:12600310] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2 13.3 13.4 13.5 13.6
Ohashi, K. (2015).
Roles of cofilin in development and its mechanisms of regulation. Development, growth & differentiation, 57(4), 275-90. [PubMed:25864508] [WorldCat] [DOI] - ↑ 14.00 14.01 14.02 14.03 14.04 14.05 14.06 14.07 14.08 14.09 14.10 14.11
Villalonga, E., Mosrin, C., Normand, T., Girardin, C., Serrano, A., Žunar, B., ..., & Vallée, B. (2023).
LIM Kinases, LIMK1 and LIMK2, Are Crucial Node Actors of the Cell Fate: Molecular to Pathological Features. Cells, 12(5). [PubMed:36899941] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1
Edwards, D.C., Sanders, L.C., Bokoch, G.M., & Gill, G.N. (1999).
Activation of LIM-kinase by Pak1 couples Rac/Cdc42 GTPase signalling to actin cytoskeletal dynamics. Nature cell biology, 1(5), 253-9. [PubMed:10559936] [WorldCat] [DOI] - ↑ 16.0 16.1
Maekawa, M., Ishizaki, T., Boku, S., Watanabe, N., Fujita, A., Iwamatsu, A., ..., & Narumiya, S. (1999).
Signaling from Rho to the actin cytoskeleton through protein kinases ROCK and LIM-kinase. Science (New York, N.Y.), 285(5429), 895-8. [PubMed:10436159] [WorldCat] [DOI] - ↑ 17.0 17.1
Ohashi, K., Nagata, K., Maekawa, M., Ishizaki, T., Narumiya, S., & Mizuno, K. (2000).
Rho-associated kinase ROCK activates LIM-kinase 1 by phosphorylation at threonine 508 within the activation loop. The Journal of biological chemistry, 275(5), 3577-82. [PubMed:10652353] [WorldCat] [DOI] - ↑ 18.0 18.1 18.2
Ben Zablah, Y., Zhang, H., Gugustea, R., & Jia, Z. (2021).
LIM-Kinases in Synaptic Plasticity, Memory, and Brain Diseases. Cells, 10(8). [PubMed:34440848] [PMC] [WorldCat] [DOI] - ↑
Nagata, K., Ohashi, K., Yang, N., & Mizuno, K. (1999).
The N-terminal LIM domain negatively regulates the kinase activity of LIM-kinase 1. The Biochemical journal, 343 Pt 1(Pt 1), 99-105. [PubMed:10493917] [PMC] [WorldCat] - ↑
Li, R., Soosairajah, J., Harari, D., Citri, A., Price, J., Ng, H.L., ..., & Bernard, O. (2006).
Hsp90 increases LIM kinase activity by promoting its homo-dimerization. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 20(8), 1218-20. [PubMed:16641196] [WorldCat] [DOI] - ↑ 21.0 21.1
Yang, N., & Mizuno, K. (1999).
Nuclear export of LIM-kinase 1, mediated by two leucine-rich nuclear-export signals within the PDZ domain. The Biochemical journal, 338 ( Pt 3)(Pt 3), 793-8. [PubMed:10051454] [PMC] [WorldCat] - ↑
Goyal, P., Pandey, D., & Siess, W. (2006).
Phosphorylation-dependent regulation of unique nuclear and nucleolar localization signals of LIM kinase 2 in endothelial cells. The Journal of biological chemistry, 281(35), 25223-30. [PubMed:16820362] [WorldCat] [DOI] - ↑
Hamill, S., Lou, H.J., Turk, B.E., & Boggon, T.J. (2016).
Structural Basis for Noncanonical Substrate Recognition of Cofilin/ADF Proteins by LIM Kinases. Molecular cell, 62(3), 397-408. [PubMed:27153537] [PMC] [WorldCat] [DOI] - ↑ 24.0 24.1
Mori, T., Okano, I., Mizuno, K., Tohyama, M., & Wanaka, A. (1997).
Comparison of tissue distribution of two novel serine/threonine kinase genes containing the LIM motif (LIMK-1 and LIMK-2) in the developing rat. Brain research. Molecular brain research, 45(2), 247-54. [PubMed:9149099] [WorldCat] [DOI] - ↑
Acevedo, K., Moussi, N., Li, R., Soo, P., & Bernard, O. (2006).
LIM kinase 2 is widely expressed in all tissues. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society, 54(5), 487-501. [PubMed:16399995] [WorldCat] [DOI] - ↑
Foletta, V.C., Moussi, N., Sarmiere, P.D., Bamburg, J.R., & Bernard, O. (2004).
LIM kinase 1, a key regulator of actin dynamics, is widely expressed in embryonic and adult tissues. Experimental cell research, 294(2), 392-405. [PubMed:15023529] [WorldCat] [DOI] - ↑
Sumi, T., Hashigasako, A., Matsumoto, K., & Nakamura, T. (2006).
Different activity regulation and subcellular localization of LIMK1 and LIMK2 during cell cycle transition. Experimental cell research, 312(7), 1021-30. [PubMed:16455074] [WorldCat] [DOI] - ↑
Salvarezza, S.B., Deborde, S., Schreiner, R., Campagne, F., Kessels, M.M., Qualmann, B., ..., & Rodriguez-Boulan, E. (2009).
LIM kinase 1 and cofilin regulate actin filament population required for dynamin-dependent apical carrier fission from the trans-Golgi network. Molecular biology of the cell, 20(1), 438-51. [PubMed:18987335] [PMC] [WorldCat] [DOI] - ↑ 29.0 29.1
Yang, X., Yu, K., Hao, Y., Li, D.M., Stewart, R., Insogna, K.L., & Xu, T. (2004).
LATS1 tumour suppressor affects cytokinesis by inhibiting LIMK1. Nature cell biology, 6(7), 609-17. [PubMed:15220930] [WorldCat] [DOI] - ↑
George, J., Soares, C., Montersino, A., Beique, J.C., & Thomas, G.M. (2015).
Palmitoylation of LIM Kinase-1 ensures spine-specific actin polymerization and morphological plasticity. eLife, 4, e06327. [PubMed:25884247] [PMC] [WorldCat] [DOI] - ↑
Sumi, T., Matsumoto, K., Shibuya, A., & Nakamura, T. (2001).
Activation of LIM kinases by myotonic dystrophy kinase-related Cdc42-binding kinase alpha. The Journal of biological chemistry, 276(25), 23092-6. [PubMed:11340065] [WorldCat] [DOI] - ↑
Aizawa, H., Wakatsuki, S., Ishii, A., Moriyama, K., Sasaki, Y., Ohashi, K., ..., & Yahara, I. (2001).
Phosphorylation of cofilin by LIM-kinase is necessary for semaphorin 3A-induced growth cone collapse. Nature neuroscience, 4(4), 367-73. [PubMed:11276226] [WorldCat] [DOI] - ↑
Endo, M., Ohashi, K., Sasaki, Y., Goshima, Y., Niwa, R., Uemura, T., & Mizuno, K. (2003).
Control of growth cone motility and morphology by LIM kinase and Slingshot via phosphorylation and dephosphorylation of cofilin. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(7), 2527-37. [PubMed:12684437] [PMC] [WorldCat] [DOI] - ↑
Endo, M., Ohashi, K., & Mizuno, K. (2007).
LIM kinase and slingshot are critical for neurite extension. The Journal of biological chemistry, 282(18), 13692-702. [PubMed:17360713] [WorldCat] [DOI] - ↑
Takemura, M., Mishima, T., Wang, Y., Kasahara, J., Fukunaga, K., Ohashi, K., & Mizuno, K. (2009).
Ca2+/calmodulin-dependent protein kinase IV-mediated LIM kinase activation is critical for calcium signal-induced neurite outgrowth. The Journal of biological chemistry, 284(42), 28554-62. [PubMed:19696021] [PMC] [WorldCat] [DOI] - ↑
Saito, A., Miyajima, K., Akatsuka, J., Kondo, H., Mashiko, T., Kiuchi, T., ..., & Mizuno, K. (2013).
CaMKIIβ-mediated LIM-kinase activation plays a crucial role in BDNF-induced neuritogenesis. Genes to cells : devoted to molecular & cellular mechanisms, 18(7), 533-43. [PubMed:23600483] [WorldCat] [DOI] - ↑
Lee-Hoeflich, S.T., Causing, C.G., Podkowa, M., Zhao, X., Wrana, J.L., & Attisano, L. (2004).
Activation of LIMK1 by binding to the BMP receptor, BMPRII, regulates BMP-dependent dendritogenesis. The EMBO journal, 23(24), 4792-801. [PubMed:15538389] [PMC] [WorldCat] [DOI] - ↑
Tursun, B., Schlüter, A., Peters, M.A., Viehweger, B., Ostendorff, H.P., Soosairajah, J., ..., & Bach, I. (2005).
The ubiquitin ligase Rnf6 regulates local LIM kinase 1 levels in axonal growth cones. Genes & development, 19(19), 2307-19. [PubMed:16204183] [PMC] [WorldCat] [DOI] - ↑
Yang, E.J., Yoon, J.H., Min, D.S., & Chung, K.C. (2004).
LIM kinase 1 activates cAMP-responsive element-binding protein during the neuronal differentiation of immortalized hippocampal progenitor cells. The Journal of biological chemistry, 279(10), 8903-10. [PubMed:14684741] [WorldCat] [DOI] - ↑
Fukazawa, Y., Saitoh, Y., Ozawa, F., Ohta, Y., Mizuno, K., & Inokuchi, K. (2003).
Hippocampal LTP is accompanied by enhanced F-actin content within the dendritic spine that is essential for late LTP maintenance in vivo. Neuron, 38(3), 447-60. [PubMed:12741991] [WorldCat] [DOI] - ↑
Amano, T., Kaji, N., Ohashi, K., & Mizuno, K. (2002).
Mitosis-specific activation of LIM motif-containing protein kinase and roles of cofilin phosphorylation and dephosphorylation in mitosis. The Journal of biological chemistry, 277(24), 22093-102. [PubMed:11925442] [WorldCat] [DOI] - ↑ 42.0 42.1
Kaji, N., Ohashi, K., Shuin, M., Niwa, R., Uemura, T., & Mizuno, K. (2003).
Cell cycle-associated changes in Slingshot phosphatase activity and roles in cytokinesis in animal cells. The Journal of biological chemistry, 278(35), 33450-5. [PubMed:12807904] [WorldCat] [DOI] - ↑
Kaji, N., Muramoto, A., & Mizuno, K. (2008).
LIM kinase-mediated cofilin phosphorylation during mitosis is required for precise spindle positioning. The Journal of biological chemistry, 283(8), 4983-92. [PubMed:18079118] [WorldCat] [DOI] - ↑
Ritchey, L., Ottman, R., Roumanos, M., & Chakrabarti, R. (2012).
A functional cooperativity between Aurora A kinase and LIM kinase1: implication in the mitotic process. Cell cycle (Georgetown, Tex.), 11(2), 296-309. [PubMed:22214762] [PMC] [WorldCat] [DOI] - ↑
Nishita, M., Aizawa, H., & Mizuno, K. (2002).
Stromal cell-derived factor 1alpha activates LIM kinase 1 and induces cofilin phosphorylation for T-cell chemotaxis. Molecular and cellular biology, 22(3), 774-83. [PubMed:11784854] [PMC] [WorldCat] [DOI] - ↑
Nishita, M., Tomizawa, C., Yamamoto, M., Horita, Y., Ohashi, K., & Mizuno, K. (2005).
Spatial and temporal regulation of cofilin activity by LIM kinase and Slingshot is critical for directional cell migration. The Journal of cell biology, 171(2), 349-59. [PubMed:16230460] [PMC] [WorldCat] [DOI] - ↑
Kobayashi, M., Nishita, M., Mishima, T., Ohashi, K., & Mizuno, K. (2006).
MAPKAPK-2-mediated LIM-kinase activation is critical for VEGF-induced actin remodeling and cell migration. The EMBO journal, 25(4), 713-26. [PubMed:16456544] [PMC] [WorldCat] [DOI] - ↑
Horita, Y., Ohashi, K., Mukai, M., Inoue, M., & Mizuno, K. (2008).
Suppression of the invasive capacity of rat ascites hepatoma cells by knockdown of Slingshot or LIM kinase. The Journal of biological chemistry, 283(10), 6013-21. [PubMed:18171679] [WorldCat] [DOI] - ↑
Mishima, T., Naotsuka, M., Horita, Y., Sato, M., Ohashi, K., & Mizuno, K. (2010).
LIM-kinase is critical for the mesenchymal-to-amoeboid cell morphological transition in 3D matrices. Biochemical and biophysical research communications, 392(4), 577-81. [PubMed:20100465] [WorldCat] [DOI] - ↑ 50.0 50.1
Meng, Y., Zhang, Y., Tregoubov, V., Janus, C., Cruz, L., Jackson, M., ..., & Jia, Z. (2002).
Abnormal spine morphology and enhanced LTP in LIMK-1 knockout mice. Neuron, 35(1), 121-33. [PubMed:12123613] [WorldCat] [DOI] - ↑
Meng, Y., Takahashi, H., Meng, J., Zhang, Y., Lu, G., Asrar, S., ..., & Jia, Z. (2004).
Regulation of ADF/cofilin phosphorylation and synaptic function by LIM-kinase. Neuropharmacology, 47(5), 746-54. [PubMed:15458846] [WorldCat] [DOI] - ↑
Todorovski, Z., Asrar, S., Liu, J., Saw, N.M., Joshi, K., Cortez, M.A., ..., & Jia, Z. (2015).
LIMK1 regulates long-term memory and synaptic plasticity via the transcriptional factor CREB. Molecular and cellular biology, 35(8), 1316-28. [PubMed:25645926] [PMC] [WorldCat] [DOI] - ↑
Zhou, Z., Hu, J., Passafaro, M., Xie, W., & Jia, Z. (2011).
GluA2 (GluR2) regulates metabotropic glutamate receptor-dependent long-term depression through N-cadherin-dependent and cofilin-mediated actin reorganization. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(3), 819-33. [PubMed:21248105] [PMC] [WorldCat] [DOI] - ↑
Kawano, T., Zhu, M., Troiano, N., Horowitz, M., Bian, J., Gundberg, C., ..., & Insogna, K. (2013).
LIM kinase 1 deficient mice have reduced bone mass. Bone, 52(1), 70-82. [PubMed:23017662] [PMC] [WorldCat] [DOI] - ↑
Lim, M.K., Kawamura, T., Ohsawa, Y., Ohtsubo, M., Asakawa, S., Takayanagi, A., & Shimizu, N. (2007).
Parkin interacts with LIM Kinase 1 and reduces its cofilin-phosphorylation activity via ubiquitination. Experimental cell research, 313(13), 2858-74. [PubMed:17512523] [WorldCat] [DOI] - ↑
Frangiskakis, J.M., Ewart, A.K., Morris, C.A., Mervis, C.B., Bertrand, J., Robinson, B.F., ..., & Keating, M.T. (1996).
LIM-kinase1 hemizygosity implicated in impaired visuospatial constructive cognition. Cell, 86(1), 59-69. [PubMed:8689688] [WorldCat] [DOI] - ↑
Smith, A.D., Gilchrist, I.D., Hood, B., Tassabehji, M., & Karmiloff-Smith, A. (2009).
Inefficient search of large-scale space in Williams syndrome: further insights on the role of LIMK1 deletion in deficits of spatial cognition. Perception, 38(5), 694-701. [PubMed:19662944] [WorldCat] [DOI] - ↑
Gregory, M.D., Mervis, C.B., Elliott, M.L., Kippenhan, J.S., Nash, T., B Czarapata, J., ..., & Berman, K.F. (2019).
Williams syndrome hemideletion and LIMK1 variation both affect dorsal stream functional connectivity. Brain : a journal of neurology, 142(12), 3963-3974. [PubMed:31687737] [PMC] [WorldCat] [DOI] - ↑ 59.0 59.1
Berabez, R., Routier, S., Bénédetti, H., Plé, K., & Vallée, B. (2022).
LIM Kinases, Promising but Reluctant Therapeutic Targets: Chemistry and Preclinical Validation In Vivo. Cells, 11(13). [PubMed:35805176] [PMC] [WorldCat] [DOI] - ↑
Prudent, R., Vassal-Stermann, E., Nguyen, C.H., Pillet, C., Martinez, A., Prunier, C., ..., & Lafanechère, L. (2012).
Pharmacological inhibition of LIM kinase stabilizes microtubules and inhibits neoplastic growth. Cancer research, 72(17), 4429-39. [PubMed:22761334] [WorldCat] [DOI] - ↑
Prunier, C., Josserand, V., Vollaire, J., Beerling, E., Petropoulos, C., Destaing, O., ..., & Lafanechère, L. (2016).
LIM Kinase Inhibitor Pyr1 Reduces the Growth and Metastatic Load of Breast Cancers. Cancer research, 76(12), 3541-52. [PubMed:27216191] [WorldCat] [DOI] - ↑
Gory-Fauré, S., Powell, R., Jonckheere, J., Lanté, F., Denarier, E., Peris, L., ..., & Andrieux, A. (2021).
Pyr1-Mediated Pharmacological Inhibition of LIM Kinase Restores Synaptic Plasticity and Normal Behavior in a Mouse Model of Schizophrenia. Frontiers in pharmacology, 12, 627995. [PubMed:33790791] [PMC] [WorldCat] [DOI] - ↑
Harrison, B.A., Whitlock, N.A., Voronkov, M.V., Almstead, Z.Y., Gu, K.J., Mabon, R., ..., & Rawlins, D.B. (2009).
Novel class of LIM-kinase 2 inhibitors for the treatment of ocular hypertension and associated glaucoma. Journal of medicinal chemistry, 52(21), 6515-8. [PubMed:19831390] [WorldCat] [DOI] - ↑
Ohashi, K., Sampei, K., Nakagawa, M., Uchiumi, N., Amanuma, T., Aiba, S., ..., & Mizuno, K. (2014).
Damnacanthal, an effective inhibitor of LIM-kinase, inhibits cell migration and invasion. Molecular biology of the cell, 25(6), 828-40. [PubMed:24478456] [PMC] [WorldCat] [DOI]