「オートファジー」の版間の差分
| 34行目: | 34行目: | ||
隔離膜の伸長には, 2つの[[ユビキチン]]様結合システムが必要である。1つは、[[wikipedia:Atg12|Atg12]]とAtg5が共有結合するAtg12-Atg5システムである。もう1つは、[[wikipedia:Atg8|Atg8]] (哺乳類ではLC3) と[[wikipedia:JA:リン脂質|リン脂質]]である[[wikipedia:JA:ホスファチジルエタノールアミン|ホスファチジルエタノールアミン]] (PE) が共有結合するLC3-PEシステムである。 | 隔離膜の伸長には, 2つの[[ユビキチン]]様結合システムが必要である。1つは、[[wikipedia:Atg12|Atg12]]とAtg5が共有結合するAtg12-Atg5システムである。もう1つは、[[wikipedia:Atg8|Atg8]] (哺乳類ではLC3) と[[wikipedia:JA:リン脂質|リン脂質]]である[[wikipedia:JA:ホスファチジルエタノールアミン|ホスファチジルエタノールアミン]] (PE) が共有結合するLC3-PEシステムである。 | ||
Atg12は[[wikipedia:JA: | Atg12は[[wikipedia:JA:ユビキチン#.E3.83.A6.E3.83.93.E3.82.AD.E3.83.81.E3.83.B3.E3.82.B7.E3.82.B9.E3.83.86.E3.83.A0|E1酵素]][[wikipedia:Atg7|Atg7]]、[[wikipedia:JA:ユビキチン#.E3.83.A6.E3.83.93.E3.82.AD.E3.83.81.E3.83.B3.E3.82.B7.E3.82.B9.E3.83.86.E3.83.A0|E2酵素]][[wikipedia:Atg10|Atg10]]を介して、Atg5と共有結合しAtg12-Atg5を形成する。その後、Atg12-Atg5結合体は[[wikipedia:JA:Atg16L1|Atg16L1]]と大きな複合体を形成し、隔離膜の外側に局在する。隔離膜が閉じてオートファゴソームになるとき、Atg12-Atg5-Atg16L1は膜から離脱する。 | ||
一方、LC3はホスファチジルエタノールアミン化されることにより、膜に局在化するようになる。前駆体LC3は合成後、まず、[[wikipedia:JA:システインプロテアーゼ|システインプロテアーゼ]]である[[wikipedia | 一方、LC3はホスファチジルエタノールアミン化されることにより、膜に局在化するようになる。前駆体LC3は合成後、まず、[[wikipedia:JA:システインプロテアーゼ|システインプロテアーゼ]]である[[wikipedia:Atg4|Atg4]](A-Dの4種類存在する)によりC末端が切断され、[[wikipedia:JA:グリシン|グリシン]]残基を露出したLC3-I formになる。LC3-IはE1酵素Atg7、E2酵素[[wikipedia:Atg3|Atg3]]を介して、最終的にはPEと共有結合し、LC3-PE(LC3-II form)になる。このとき、Atg12-Atg5はE3様の働きをして、LC3-PE形成に必須な役割を果たしている。 | ||
LC3-PE は、隔離膜の伸長および閉じる過程に必須の役割を果たしており、隔離膜だけでなく、オートファゴソーム膜にも局在する。そのため、オートファゴソームマーカーとして頻用されている。オートファジーが誘導される条件下では細胞質中におけるLC3を含む小構造体の増加が観察される。しかし、オートファゴソームの蓄積はリソソームの阻害によっても引き起こされるため、オートファジー誘導とリソソーム阻害のどちらに起因するのかを区別する必要がある。 | LC3-PE は、隔離膜の伸長および閉じる過程に必須の役割を果たしており、隔離膜だけでなく、オートファゴソーム膜にも局在する。そのため、オートファゴソームマーカーとして頻用されている。オートファジーが誘導される条件下では細胞質中におけるLC3を含む小構造体の増加が観察される。しかし、オートファゴソームの蓄積はリソソームの阻害によっても引き起こされるため、オートファジー誘導とリソソーム阻害のどちらに起因するのかを区別する必要がある。 | ||
2012年4月25日 (水) 00:34時点における版
オートファジーは主要な細胞内分解機構の一つであり、細胞質成分をリソソームに輸送し分解する現象である[1][2]。これまでに、マクロオートファジー、シャペロン介在性オートファジー、マイクロオートファジーの3タイプが報告されている。単に「オートファジー」という場合は、主にマクロオートファジーのことを指す。(以下、オートファジーと表記する。)(全体の内容の要約を御願い致します)
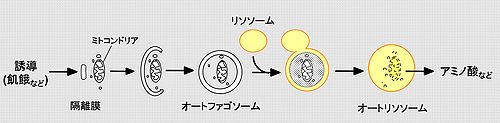
飢餓などによりオートファジーが誘導されると、細胞質に出現した隔離膜が伸張し、細胞質のタンパク質やミトコンドリアを含みながら閉鎖することでオートファゴソームが形成される。オートファゴソームの外膜とリソソームが融合し、オートファゴソームの内膜と取り囲まれた細胞質成分が分解される。オートファジーが生じると、主要な産物として、細胞内タンパク質由来のアミノ酸が供給される。
オートファジーの過程
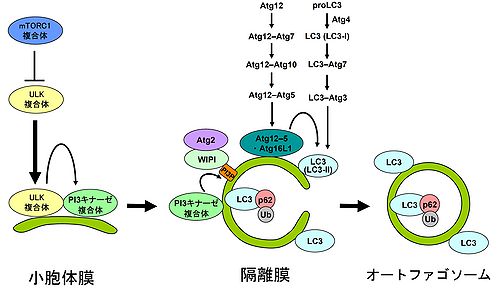
栄養条件下において, オートファジーはmTORC1による負の制御を受けている。飢餓条件下では、このmTORC1による抑制が解除されることにより、ULK複合体が活性化して、小胞体膜上に局在化する。その次に、クラスIII PI3キナーゼ(phosphatidylinositol 3-kinase)複合体が小胞体膜上へ局在化し、ホスファチジルイノシトール-3-一リン酸 (phosphatidylinositol 3-phosphate, PI(3)P)を産生することで、下流で機能するPI(3)P結合タンパク質のオートファゴソーム形成起点への局在化を促す。その後、Atg12–Atg5-Atg16L1、LC3–ホスファチジルエタノールアミン (PE)が隔離膜上に局在化して隔離膜の伸長が促進され、最終的にオートファゴソームが形成される。p62 (sequestosome 1 (SQSTM1))などの選択的基質はLC3 結合ドメイン(LIR motif)とユビキチン結合(UBA)ドメインを有するため、ユビキチン(Ub)化された凝集体やミトコンドリアなどと結合し、オートファゴソームによる分解を促すユビキチン受容体として機能する。(図の中にいくつか定義されていない略号がございますので、説明文の中に入れて頂ければ幸いです。
オートファジーは主要な細胞内分解機構の一つであり、細胞質成分をリソソームに輸送し分解する現象である。マクロオートファジー、シャペロン介在性オートファジー、マイクロオートファジーの3タイプが報告されている。単に「オートファジー」という場合は、主にマクロオートファジーのことを指す。
マクロオートファジー
まず細胞質中に隔離膜(isolation membrane/phagophore)が出現する。この隔離膜が細胞質成分を取り囲み、二重膜のオートファゴソーム(autophagosome)を形成する。その後、オートファゴソームはリソソームと融合し、オートファゴソームの内膜と隔離した細胞質成分はリソソーム由来の酵素により分解され、一重膜のオートリソソームとなる(図1)。この一連の過程により産生されたアミノ酸などの分解産物は、タンパク質合成などに再利用される[1][2]。元来、オートファジーは非選択的な分解機構だと考えられていたが、近年、ミトコンドリア(マイトファジー)やペルオキシソーム(ペキソファジー)などのオルガネラ、細胞内細菌(ゼノファジー)、可溶性タンパク質p62 (sequestosome 1 (SQSTM1))などを、選択的に分解していることが明らかになってきている[3]。
シャペロン介在性オートファジー
細胞質中のタンパク質がHsc70シャペロンタンパク質により認識されて、高次構造がほどかれた状態でリソソーム膜を通過し、リソソーム内で分解される。Hsc70の基質認識配列として、KFERQ様モチーフが知られている[4]。
マイクロオートファジー
リソソーム膜が内側に陥入して細胞質成分を直接飲み込み、リソソーム内に取り込む。最近では、マイクロートファジーとMultivesicular body 形成との類似点が指摘されている[5]。
分子機構
これまでに、酵母遺伝学を用いた解析から、35のオートファジー関連分子(Atg分子)が同定されている[2][6][7] 。これらのうち、Atg1-10, 12-14, 16-18, 29, 31がオートファゴソームの形成に必須であり、哺乳類では、そのほとんどの相同分子が保存されている。Atg分子は機能的な役割から、Atg1/ULK複合体、クラスIII PI3キナーゼ (phosphatidylinositol 3-kinase)複合体、Atg9、Atg2-18複合体、Atg12-Atg5結合体, Atg8/LC3-PE結合体に分けられる(図2)。
誘導
オートファジーは、主に栄養飢餓により誘導される。細胞内の栄養シグナルはmammalian target of rapamycin(mTOR)を介したリン酸化シグナルにより厳密に制御されており、豊栄養条件下ではインスリンやアミノ酸によりmTORが活性化され、タンパク合成や細胞成長が促進されている。一方で、mTORによりオートファジー活性は低い状態に抑制されている。栄養飢餓時には、このmTORシグナルが減弱することによりオートファジーが活性化される。mTOR阻害剤であるラパマイシンは、オートファジーを誘導する薬剤としてよく用いられる。
隔離膜の形成
オートファジーの最も初期のステップでは、タンパク質リン酸化酵素であるAtg1/ULK複合体(哺乳類ではULK-Atg13-FIP200-Atg101で構成される)が重要な役割を果たす。このULK複合体は栄養依存的にmTORに結合し、リン酸化を受け、負に制御されている。栄養飢餓条件下では、ULK複合体がmTORから外れることにより活性化し、小胞体膜上に局在化する。
クラスIII PI3キナーゼ複合体(哺乳類ではBeclin1-Atg14-Vps15-Vps34で構成される)は、ULK複合体依存的に小胞体膜上へ局在化する。クラスIII PI3キナーゼ複合体は、ホスファチジルイノシトール3-リン酸(phosphatidylinositol 3-phosphate; PI(3)P)を産生することで、下流で機能するPI(3)P結合タンパク質Atg18(哺乳類ではWIPI)などのオートファゴソーム形成起点への局在化を促す。このクラスIII PI3キナーゼ複合体によるPI(3)Pの産生は、オートファゴソームの前駆体である隔離膜の形成に必須である。 オートファジーを阻害することで知られているワルトマニンや3-メチルアデニンは、このPI3キナーゼ活性を阻害することにより、オートファジーを抑制する。
隔離膜の伸長、およびオートファゴソームの形成
隔離膜の伸長には, 2つのユビキチン様結合システムが必要である。1つは、Atg12とAtg5が共有結合するAtg12-Atg5システムである。もう1つは、Atg8 (哺乳類ではLC3) とリン脂質であるホスファチジルエタノールアミン (PE) が共有結合するLC3-PEシステムである。
Atg12はE1酵素Atg7、E2酵素Atg10を介して、Atg5と共有結合しAtg12-Atg5を形成する。その後、Atg12-Atg5結合体はAtg16L1と大きな複合体を形成し、隔離膜の外側に局在する。隔離膜が閉じてオートファゴソームになるとき、Atg12-Atg5-Atg16L1は膜から離脱する。
一方、LC3はホスファチジルエタノールアミン化されることにより、膜に局在化するようになる。前駆体LC3は合成後、まず、システインプロテアーゼであるAtg4(A-Dの4種類存在する)によりC末端が切断され、グリシン残基を露出したLC3-I formになる。LC3-IはE1酵素Atg7、E2酵素Atg3を介して、最終的にはPEと共有結合し、LC3-PE(LC3-II form)になる。このとき、Atg12-Atg5はE3様の働きをして、LC3-PE形成に必須な役割を果たしている。
LC3-PE は、隔離膜の伸長および閉じる過程に必須の役割を果たしており、隔離膜だけでなく、オートファゴソーム膜にも局在する。そのため、オートファゴソームマーカーとして頻用されている。オートファジーが誘導される条件下では細胞質中におけるLC3を含む小構造体の増加が観察される。しかし、オートファゴソームの蓄積はリソソームの阻害によっても引き起こされるため、オートファジー誘導とリソソーム阻害のどちらに起因するのかを区別する必要がある。
選択的基質認識
一部のタンパク質は、オートファゴソームにより選択的に認識される[3]。選択的基質のうち、p62(sequestosome 1 (SQSTM1))は最も解析が進んでいるものの一つである。p62はLC3 結合ドメイン(LIR motif)とユビキチン結合(UBA)ドメインを有するため、ユビキチン化された凝集体やミトコンドリアなどと結合し、オートファゴソームによる分解を促すユビキチン受容体としての役割が明らかになりつつある。p62はオートファジー阻害により、細胞内に蓄積することから、オートファジー活性の指標としても用いられる。p62と同様にアダプター分子としての役割を果たしているものとして、NBR1、NDP52、optineurinなども報告されている。
タンパク質の分解とオートファジーの収束
以上の一連の反応により、形成されたオートファゴソームは、速やかにリソソームと融合し、オートファゴソームの内膜とともに隔離した細胞質成分が分解される。バフィロマイシンやクロロキンは、リソソームの機能阻害により、オートファジー依存的なタンパク質の分解を阻害する。オートファジーが生じると、主要な産物として、細胞内タンパク質由来のアミノ酸が供給される。細胞質中に十分量のアミノ酸が供給されると、mTORが活性化され、オートファジーは不活化する。このように、オートファジーはアミノ酸シグナルを介して、負のフィードバック制御を受けている。
オートファジーの生理学的意義と病理学的意義
栄養飢餓におけるアミノ酸供給[1]
Atg遺伝子欠損マウス(Atg3-/-、Atg5-/-、Atg7-/-、Atg9-/-、Atg16L1-/-)は、生後まもなく死亡する。Atg5遺伝子欠損マウスを用いた解析では、組織、および血漿中のアミノ酸レベルが減少しており、出生直後の飢餓状態では、オートファジーによるアミノ酸供給が生存に必須であることが示唆されている。飢餓応答としての役割は、これまで調べられたモデル生物(酵母、線虫、ショウジョウバエ、マウス)において共通に報告されており、オートファジーの最も基本的な生理的役割と考えられる。
細胞内タンパク質の品質管理[1][8]
栄養が豊富な条件下においても、基底状態レベルのオートファジーが生じており、不要なタンパク質を分解している。実際、組織特異的オートファジー不全マウスを用いた解析では、ほとんどの組織でp62やユビキチン陽性の凝集体が観察される。特に、あまり細胞分裂しない神経細胞や肝細胞では、オートファジーを介したタンパク質分解の役割が大きく、神経特異的オートファジー不全マウスでは神経変性が生じ、肝特異的オートファジー不全マウスでは肝肥大や肝炎、腫瘍(良性)が観察されるようになる。興味深いことに、ヒト神経疾患(アルツハイマー病、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症など)の多くで、構造的に類似した凝集体が観察されている。そのため、ラパマイシン誘導体などのオートファジー活性化剤による凝集体蓄積の抑制、神経変性疾患の発症抑制に期待が集まっている。しかしながら、オートファジーの異常がこれらの疾患の直接の原因であるかどうか、直接的な証拠は得られていない。
不良ミトコンドリアの分解 (細胞内オルガネラの品質管理)[9]
不良ミトコンドリアは、選択的に認識されオートファジーにより分解される(マイトファジー)。最近、家族性パーキンソン病の原因因子であるParkinが、膜電位の低下したミトコンドリアに局在し、マイトファジーを引き起こすことが明らかになった。不良ミトコンドリアの蓄積は、酸化ストレスや神経脱落を引き起こすため、マイトファジー不全がパーキンソン病の病態形成の一因として考えられている。しかしながら、Parkinはオートファジーに依存しないミトコンドリアへの作用も有しており、Parkinがどのようにパーキンソン病の病態形成に関与しているかについては、まだ不明な点が多い。
細胞内侵入細菌の分解 (ゼノファジー)[10]
マクロファージなどの食細胞は、細菌を貧食してリソソーム系で分解するが、一部の細菌はそのような宿主の防御機構を回避してしまう。オートファジーは、このような細胞内侵入細菌の分解においても重要な役割を果たしている。ファゴソームから細胞質中に脱出したレンサ球菌などは、オートファゴソームにより選択的に認識されリソソーム系に輸送される。ファゴソームに取り込まれたサルモネラ菌は、ファゴソームごとオートファゴソームに囲まれて、リソソーム系に輸送される。ファゴソームの成熟を阻害する結核菌も、オートファジー依存的にファゴソームごと分解される。これらの細菌のオートファゴソームによる選択的認識には、ユビキチンが深く関与していることが指摘されている。一方で、リステリア菌、赤痢菌などの細菌は、オートファジーによる分解も回避する能力を獲得していることが報告されている。
発生・分化における細胞内再構築[1]
マウス受精卵では、受精直後に過剰なオートファジーが誘導される。卵特異的オートファジー不全マウスでは、胚発生が正常におこなわれず、4-8細胞期で致死となることから、着床に至るまでの栄養が限られた条件では、オートファジーによるアミノ酸供給が必要であると考えられている。父方由来のミトコンドリアが選択的に分解され、母方由来のミトコンドリアだけが残るミトコンドリア母性遺伝の現象にも、オートファジーが関与している。最近、線虫を用いた解析から、受精後に父方由来のミトコンドリアがオートファジーにより分解されることが示された。組織特異的ノックアウトマウスを用いた解析では、脂肪細胞や赤血球、T細胞、B細胞(骨髄Pre-B細胞、末梢B-1a細胞)などの細胞分化に異常が見られることが報告されている。このように、発生・分化に伴う急激な細胞内変化に、オートファジーが重要な役割を果たしていることが明らかになりつつある。
抗原提示[11]
抗原提示細胞は、抗原をペプチド断片にまで分解し、主要組織適合遺伝子複合体(MHC)分子によって細胞表面に提示する役割をもつ。このとき、外来性抗原は、細胞外からエンドサイトーシス経路で取り込まれ、MHCクラスIIコンパートメントに運ばれる。一方で、一部の内在性抗原もMHCクラスII分子により細胞表面に提示されることが知られていたが、どのようにMHCクラスIIコンパートメントに輸送されているのか、その分子機構は不明であった。最近、細胞質中の内在性抗原はオートファゴソームに取り込まれ、そのオートファゴソームがMHCクラスIIコンパートメントと融合することが報告され、オートファジーが抗原提示に関与していることが示された。また同様に、胸腺での自己反応性T細胞除去に必要な自己抗原の提示にも、オートファジー経路が重要であることが明らかになっている。
がんにおけるオートファジーの二面性[12]
オートファジーの細胞内品質管理における役割と、栄養(アミノ酸)供給システムとしての役割が、がんにおいては相反する作用を発揮する。一部のオートファジー不全マウスでは、がんの発症率や腫瘍形成能が増加することから、がん初期段階では、オートファジーはがん抑制的に機能している。オートファジーを介した異常タンパク質や異常ミトコンドリアの分解により、酸化ストレスの減少、慢性炎症の抑制、および二次的ながん発症を抑制していると考えられている。一方で、抗がん剤投与時にオートファジー阻害剤を同時投与すると、がん抑制効果が増強される。がん細胞が増殖する段階においては、栄養が枯渇した条件下における生存をオートファジーが促していると考えられている。
クローン病とAtg16L1[11]
炎症性腸疾患クローン病に関連する遺伝子変異として、Atg16L1 T300Aの一塩基多型(SNPs)が報告されている。遺伝子欠損マウスを用いた解析から、Atg16L1が腸管における炎症反応や腸管上皮細胞の成熟に重要な役割を果たしていることが明らかになっている。しかしながら、T300AがAtg16L1の機能にどのような影響を及ぼすのか、オートファジー不全がクローン病の病態形成の一因なのか、まだ不明な点が多い。
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4
Mizushima, N., & Komatsu, M. (2011).
Autophagy: renovation of cells and tissues. Cell, 147(4), 728-41. [PubMed:22078875] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Mizushima, N., Yoshimori, T., & Ohsumi, Y. (2011).
The role of Atg proteins in autophagosome formation. Annual review of cell and developmental biology, 27, 107-32. [PubMed:21801009] [WorldCat] [DOI] - ↑ 3.0 3.1
Kraft, C., Peter, M., & Hofmann, K. (2010).
Selective autophagy: ubiquitin-mediated recognition and beyond. Nature cell biology, 12(9), 836-41. [PubMed:20811356] [WorldCat] [DOI] - ↑
Orenstein, S.J., & Cuervo, A.M. (2010).
Chaperone-mediated autophagy: molecular mechanisms and physiological relevance. Seminars in cell & developmental biology, 21(7), 719-26. [PubMed:20176123] [PMC] [WorldCat] [DOI] - ↑
Sahu, R., Kaushik, S., Clement, C.C., Cannizzo, E.S., Scharf, B., Follenzi, A., ..., & Santambrogio, L. (2011).
Microautophagy of cytosolic proteins by late endosomes. Developmental cell, 20(1), 131-9. [PubMed:21238931] [PMC] [WorldCat] [DOI] - ↑
Klionsky, D.J., Cregg, J.M., Dunn, W.A., Emr, S.D., Sakai, Y., Sandoval, I.V., ..., & Ohsumi, Y. (2003).
A unified nomenclature for yeast autophagy-related genes. Developmental cell, 5(4), 539-45. [PubMed:14536056] [WorldCat] - ↑
Nakatogawa, H., Suzuki, K., Kamada, Y., & Ohsumi, Y. (2009).
Dynamics and diversity in autophagy mechanisms: lessons from yeast. Nature reviews. Molecular cell biology, 10(7), 458-67. [PubMed:19491929] [WorldCat] [DOI] - ↑
Menzies, F.M., Moreau, K., & Rubinsztein, D.C. (2011).
Protein misfolding disorders and macroautophagy. Current opinion in cell biology, 23(2), 190-7. [PubMed:21087849] [PMC] [WorldCat] [DOI] - ↑
Youle, R.J., & Narendra, D.P. (2011).
Mechanisms of mitophagy. Nature reviews. Molecular cell biology, 12(1), 9-14. [PubMed:21179058] [PMC] [WorldCat] [DOI] - ↑
Knodler, L.A., & Celli, J. (2011).
Eating the strangers within: host control of intracellular bacteria via xenophagy. Cellular microbiology, 13(9), 1319-27. [PubMed:21740500] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1
Virgin, H.W., & Levine, B. (2009).
Autophagy genes in immunity. Nature immunology, 10(5), 461-70. [PubMed:19381141] [PMC] [WorldCat] [DOI] - ↑
White, E., Karp, C., Strohecker, A.M., Guo, Y., & Mathew, R. (2010).
Role of autophagy in suppression of inflammation and cancer. Current opinion in cell biology, 22(2), 212-7. [PubMed:20056400] [PMC] [WorldCat] [DOI]
(執筆者:西村多喜、水島昇 担当編集者:尾藤晴彦)