「Engrailed」の版間の差分
細編集の要約なし |
|||
| (同じ利用者による、間の3版が非表示) | |||
| 8行目: | 8行目: | ||
英略称:En | 英略称:En | ||
{{box|text= ''Engrailed''(''En'')遺伝子は、動物界で広く見られるホメオドメインタンパク質Enをコードする。Enは、転写因子としての機能を持つほか、古典的なシグナルペプチドを持たないにも拘わらずその一部は細胞外に分泌され、更に細胞外から他の細胞内へ移行できるという細胞間シグナル分子としての性質も有する。加えて、eIF4Eに結合し翻訳を促進するという翻訳調節因子としての側面も持つ。脊椎動物は、''Engrailed-1''(''En1'')および''Engrailed-2''(''En2'')の2つのパラログを有しており、これらは中脳—後脳境界の形成、小脳および中脳の発生、神経回路の構築、神経細胞の分化や生存維持において重要な役割を果たす。'' | {{box|text= ''Engrailed''(''En'')遺伝子は、動物界で広く見られるホメオドメインタンパク質Enをコードする。Enは、転写因子としての機能を持つほか、古典的なシグナルペプチドを持たないにも拘わらずその一部は細胞外に分泌され、更に細胞外から他の細胞内へ移行できるという細胞間シグナル分子としての性質も有する。加えて、eIF4Eに結合し翻訳を促進するという翻訳調節因子としての側面も持つ。脊椎動物は、''Engrailed-1''(''En1'')および''Engrailed-2''(''En2'')の2つのパラログを有しており、これらは中脳—後脳境界の形成、小脳および中脳の発生、神経回路の構築、神経細胞の分化や生存維持において重要な役割を果たす。''EN2''は自閉スペクトラム症との関連が示されている一方、''En1''ヘテロ接合性マウスはパーキンソン病に特徴的なドーパミンニューロン減少と運動制御異常を示す。}} | ||
== 研究の歴史 == | == 研究の歴史 == | ||
| 15行目: | 15行目: | ||
== サブファミリー == | == サブファミリー == | ||
=== 無脊椎動物 === | === 無脊椎動物 === | ||
多くは単一の''en''を有する一方、ショウジョウバエには、''en''と隣接してその[[パラログ]]遺伝子である''[[invected]]''(''[[inv]]'')が存在する<ref name=Gustavson1996><pubmed>8849895</pubmed></ref> | 多くは単一の''en''を有する一方、ショウジョウバエには、''en''と隣接してその[[パラログ]]遺伝子である''[[invected]]''(''[[inv]]'')が存在する<ref name=Gustavson1996><pubmed>8849895</pubmed></ref>。''inv''を欠く個体は生存可能であり、表現型にも顕著な異常は見られないが、''en''と''inv''の二重変異体では''en''単独変異の[[表現型]]が増強されることから、両者は機能的に冗長であると考えられる<ref name=Gustavson1996><pubmed>8849895</pubmed></ref>。 | ||
=== 脊椎動物 === | === 脊椎動物 === | ||
多くは2つの''en''相同遺伝子''En1''および''En2''を有する<ref name=Holland1990><pubmed>1980115</pubmed></ref>。[[ゼブラフィッシュ]]では、それぞれの遺伝子がさらに重複し、''En1''および''En2''が各2コピーずつ存在する<ref name=Force1999><pubmed>10101175</pubmed></ref>。 | 多くは2つの''en''相同遺伝子''En1''および''En2''を有する<ref name=Holland1990><pubmed>1980115</pubmed></ref>。[[ゼブラフィッシュ]]では、それぞれの遺伝子がさらに重複し、''En1''および''En2''が各2コピーずつ存在する<ref name=Force1999><pubmed>10101175</pubmed></ref>。 | ||
| 37行目: | 37行目: | ||
EH4は[[ホメオドメイン]]であり、DNAへの結合に関わる<ref name=Kissinger1990><pubmed>1977522</pubmed></ref>。ホメオドメインを構成する3本の[[αヘリックス]]のうち第3ヘリックスと、ホメオドメインのN末端のヘリックスを構成しない数アミノ酸がDNAに結合する<ref name=Kissinger1990><pubmed>1977522</pubmed></ref>。[[SAAB法]]によるとEngrailed単独で最も高い親和性を示すDNA配列はTAATTAである<ref name=Ades1994><pubmed>8049221</pubmed></ref>。また、Exdとのヘテロ二量体化により、EnのDNA結合特異性が変化する<ref name=vanDijk1994><pubmed>7915200</pubmed></ref>。ショウジョウバエ胚における[[ChIP解析]]によるとEnのコンセンサス結合配列はYAATYANBである<ref name=Solano2003><pubmed>12588842</pubmed></ref>。Enの結合親和性は、認識部位に隣接する、認識配列に類似した繰り返し配列を伴うDNA領域により増強される<ref name=Castellanos2020><pubmed>31992709</pubmed></ref>。 | EH4は[[ホメオドメイン]]であり、DNAへの結合に関わる<ref name=Kissinger1990><pubmed>1977522</pubmed></ref>。ホメオドメインを構成する3本の[[αヘリックス]]のうち第3ヘリックスと、ホメオドメインのN末端のヘリックスを構成しない数アミノ酸がDNAに結合する<ref name=Kissinger1990><pubmed>1977522</pubmed></ref>。[[SAAB法]]によるとEngrailed単独で最も高い親和性を示すDNA配列はTAATTAである<ref name=Ades1994><pubmed>8049221</pubmed></ref>。また、Exdとのヘテロ二量体化により、EnのDNA結合特異性が変化する<ref name=vanDijk1994><pubmed>7915200</pubmed></ref>。ショウジョウバエ胚における[[ChIP解析]]によるとEnのコンセンサス結合配列はYAATYANBである<ref name=Solano2003><pubmed>12588842</pubmed></ref>。Enの結合親和性は、認識部位に隣接する、認識配列に類似した繰り返し配列を伴うDNA領域により増強される<ref name=Castellanos2020><pubmed>31992709</pubmed></ref>。 | ||
EH3の大部分とホメオドメインのN末端の一部を含む領域は、細胞表面の[[グリコサミノグリカン]]([[GAG]])との相互作用を通じて、Enの細胞外から細胞内への移行を制御する<ref name=Cardon2023><pubmed>37032404</pubmed></ref>。ホメオドメインのC末端側には、[[核外移行シグナル配列]]([[NES]])/細胞外への分泌シグナルと、細胞外から細胞内への移行シグナル([[膜透過ペプチド]]配列[[penetratin]])が存在する<ref name=Joliot1998><pubmed>9705930</pubmed></ref><ref name=Maizel1999><pubmed>10375508</pubmed></ref> | EH3の大部分とホメオドメインのN末端の一部を含む領域は、細胞表面の[[グリコサミノグリカン]]([[GAG]])との相互作用を通じて、Enの細胞外から細胞内への移行を制御する<ref name=Cardon2023><pubmed>37032404</pubmed></ref>。ホメオドメインのC末端側には、[[核外移行シグナル配列]]([[NES]])/細胞外への分泌シグナルと、細胞外から細胞内への移行シグナル([[膜透過ペプチド]]配列[[penetratin]])が存在する<ref name=Joliot1998><pubmed>9705930</pubmed></ref><ref name=Maizel1999><pubmed>10375508</pubmed></ref><ref name=Dupont2007><pubmed>17242404</pubmed></ref>。細胞外から細胞内への移行は[[エンドサイトーシス]]と、エンドサイトーシスを介さない直接的移行の2つの様式により起こる<ref name=Dupont2007><pubmed>17242404</pubmed></ref><ref name=Jiao2009><pubmed>19833724</pubmed></ref>。Enの細胞内外への出入りには、[[ホスファチジルイノシトール4,5-ビスリン酸]]([[PIP2]])と[[コレステロール]]が必要である<ref name=Amblard2020b><pubmed>32434869</pubmed></ref>。EnのEH2ドメインのN末端側には高[[セリン]]領域が存在する。[[カゼインキナーゼ2]] ([[CK2]])によるこの領域の[[リン酸化]]は、EnホメオドメインのDNAへの結合を増強する一方<ref name=Bourbon1995><pubmed>7744743</pubmed></ref>、Enの細胞外分泌を阻害する<ref name=Maizel2002><pubmed>12117805</pubmed></ref>。また、Enは他のいくつかのホメオドメインタンパク質([[Bicoid]], [[Emx2]], [[HoxA9]], [[Prh]]など)と同様に、[[真核生物翻訳開始因子4E]] ([[eIF4E]])と結合するが<ref name=Nedelec2004><pubmed>15247416</pubmed></ref>、それらのホメオドメインタンパク質とは異なり<ref name=Topisirovic2005><pubmed>16136508</pubmed></ref>、EH1ドメインがeIF4E結合部位を兼ねることが推定されている(<ref name=Rhoads2009><pubmed>19237539</pubmed></ref>、Alain Prochiantz、私信)。これとは別に、マウスのEn1のホメオドメインN末端に位置するリジンに点突然変異K313Eを導入すると、eIF4Eに結合しなくなる<ref name=Stettler2012><pubmed>22147955</pubmed></ref>。[[Foxa2]]との相互作用には高セリン領域からホメオドメインにかけての領域が関与する<ref name=Foucher2003><pubmed>12642491</pubmed></ref>。 | ||
== 発現 == | == 発現 == | ||
| 71行目: | 71行目: | ||
=== 転写の標的遺伝子 === | === 転写の標的遺伝子 === | ||
脊椎動物では、神経系におけるEnの標的遺伝子として、[[微小管結合タンパク質1b]]、および[[長鎖散在反復配列]][[LINE-1]]がin vivoで同定されている<ref name=Foucher2003><pubmed>12642491</pubmed></ref><ref name=deThe2018><pubmed>29941661</pubmed></ref> | 脊椎動物では、神経系におけるEnの標的遺伝子として、[[微小管結合タンパク質1b]]、および[[長鎖散在反復配列]][[LINE-1]]がin vivoで同定されている<ref name=Foucher2003><pubmed>12642491</pubmed></ref><ref name=deThe2018><pubmed>29941661</pubmed></ref>。また、ニワトリ初期胚の脳において、''Pax6''が標的遺伝子の候補として同定されている<ref name=Araki1999></ref>。 | ||
脊椎動物の初期胚の脳における、''En''による''Wnt1''、''Pax2''、''Fgf8''の誘導は直接的なものではないことを先に述べたが、同様に、''En''による[[軸索ガイダンス]]や細胞のソーティングに関わる細胞表面タンパク質をコードする[[EphrinA2]]や[[EphrinA5]]の発現誘導も<ref name=Logan1996><pubmed>8805331</pubmed></ref><ref name=Shigetani1996><pubmed>9129179</pubmed></ref><ref name=Lee1997><pubmed>9056772</pubmed></ref>、間接的な制御であると推定される<ref name= | 脊椎動物の初期胚の脳における、''En''による''Wnt1''、''Pax2''、''Fgf8''の誘導は直接的なものではないことを先に述べたが、同様に、''En''による[[軸索ガイダンス]]や細胞のソーティングに関わる細胞表面タンパク質をコードする[[EphrinA2]]や[[EphrinA5]]の発現誘導も<ref name=Logan1996><pubmed>8805331</pubmed></ref><ref name=Shigetani1996><pubmed>9129179</pubmed></ref><ref name=Lee1997><pubmed>9056772</pubmed></ref>、間接的な制御であると推定される<ref name=Araki1999></ref>。 | ||
=== 中脳および後脳の初期発生 === | === 中脳および後脳の初期発生 === | ||
初期胚において、''En1''と''En2''は、中脳後脳境界オーガナイザーの維持や、[[中脳間脳境界]]([[diencephalic–mesencephalic boundary]],[[DMB]])の確立と維持を通じて、発生中の脳の領域化に寄与する<ref name=Joyner1991><pubmed>1672471</pubmed></ref><ref name=Araki1999><pubmed>10529429</pubmed></ref><ref name=Wurst1994><pubmed>7925010</pubmed></ref><ref name=Joyner1996><pubmed>8741855</pubmed></ref><ref name=Matsunaga2000><pubmed>10804178</pubmed></ref><ref name=Scholpp2003><pubmed>12917294</pubmed></ref>。脳の領域化においてEnは専ら転写因子として機能し、細胞間シグナル分子としての役割は小さい、とする報告がある一方<ref name=Lesaffre2007><pubmed>17229313</pubmed></ref>、中脳間脳境界の確立にはEnが分泌されることが必要であることも示されている<ref name=Rampon2015><pubmed>25926358</pubmed></ref>。また、中脳間脳境界と中脳後脳境界の確立にはPbxとの協調も必要である<ref name=Erickson2007><pubmed>16959235</pubmed></ref>。前述の通り、''En1''と''En2''は機能的に冗長ではあるが<ref name= | 初期胚において、''En1''と''En2''は、中脳後脳境界オーガナイザーの維持や、[[中脳間脳境界]]([[diencephalic–mesencephalic boundary]],[[DMB]])の確立と維持を通じて、発生中の脳の領域化に寄与する<ref name=Joyner1991><pubmed>1672471</pubmed></ref><ref name=Araki1999><pubmed>10529429</pubmed></ref><ref name=Wurst1994><pubmed>7925010</pubmed></ref><ref name=Joyner1996><pubmed>8741855</pubmed></ref><ref name=Matsunaga2000><pubmed>10804178</pubmed></ref><ref name=Scholpp2003><pubmed>12917294</pubmed></ref>。脳の領域化においてEnは専ら転写因子として機能し、細胞間シグナル分子としての役割は小さい、とする報告がある一方<ref name=Lesaffre2007><pubmed>17229313</pubmed></ref>、中脳間脳境界の確立にはEnが分泌されることが必要であることも示されている<ref name=Rampon2015><pubmed>25926358</pubmed></ref>。また、中脳間脳境界と中脳後脳境界の確立にはPbxとの協調も必要である<ref name=Erickson2007><pubmed>16959235</pubmed></ref>。前述の通り、''En1''と''En2''は機能的に冗長ではあるが<ref name=Hanks1995></ref>、''En1''は小脳と上丘の発生にE9より前のみ必要であり<ref name=Sgaier2007><pubmed>17537797</pubmed></ref>、''En1''の欠失によりE9.5までに中脳後脳境界近傍で[[細胞死]]が増加する<ref name=Chi2003><pubmed>12736208</pubmed></ref>。一方で、''En1''は[[下丘]]の、''En2''は小脳の発生において、より長期にわたり機能が要求される<ref name=Sgaier2007><pubmed>17537797</pubmed></ref>。さらに、[[脳の領域化]]後においても、''En''は中脳後脳領域内での勾配的または局所的な発現を通じて、領域内のパターン形成に寄与する。この機能は、神経回路形成、特定のニューロンの発生、および中脳後脳内における微細構造の形成に関与する<ref name=Sgaier2005></ref><ref name=Itasaki1991><pubmed>1811932</pubmed></ref><ref name=Millen1995><pubmed>8575294</pubmed></ref><ref name=Omi2014><pubmed>24803658</pubmed></ref>。 | ||
=== 神経回路形成 === | === 神経回路形成 === | ||
| 83行目: | 83行目: | ||
[[脊髄]]では、''En1''はV1介在ニューロンの特定化には必要ないが、その軸索ガイダンスと軸索束形成に必要である<ref name=Saueressig1999><pubmed>10477289</pubmed></ref>。また、V1ニューロンの一部に由来する[[レンショー細胞]]と[[運動ニューロン]]の抑制性シナプス形成を調節する<ref name=Sapir2004><pubmed>14762144</pubmed></ref>。 | [[脊髄]]では、''En1''はV1介在ニューロンの特定化には必要ないが、その軸索ガイダンスと軸索束形成に必要である<ref name=Saueressig1999><pubmed>10477289</pubmed></ref>。また、V1ニューロンの一部に由来する[[レンショー細胞]]と[[運動ニューロン]]の抑制性シナプス形成を調節する<ref name=Sapir2004><pubmed>14762144</pubmed></ref>。 | ||
発生中の体幹部において、軸上筋神経は体節中の''En1''陽性領域に誘引される一方、軸下筋神経は''En''陽性領域を忌避する<ref name=Ahmed2017><pubmed>28807781</pubmed></ref> | 発生中の体幹部において、軸上筋神経は体節中の''En1''陽性領域に誘引される一方、軸下筋神経は''En''陽性領域を忌避する<ref name=Ahmed2017><pubmed>28807781</pubmed></ref>。また、四肢背側の筋肉に投射する脊髄運動ニューロン軸索に対し、肢芽腹側のEn1は細胞間シグナル分子として直接的に反発効果を呈すると共に、転写因子として制御下のEphrinA5を介して間接的にも反発効果を示す<ref name=Huettl2015><pubmed>25710467</pubmed></ref>。但し、中脳視蓋とは異なりEn1とEphrinA5との相乗効果は見られず、またEn2はこの軸索に対して反発効果を示さない。 | ||
=== ニューロンの分化と維持 === | === ニューロンの分化と維持 === | ||
''En1''、''En2''は中脳ドーパミンニューロンの維持に、細胞自律的に必要であり<ref name=Simon2001><pubmed>11312297</pubmed></ref><ref name=Alberi2004><pubmed>15175251</pubmed></ref>、LINE-1の発現抑制を通じて、[[酸化ストレス]]から中脳ドーパミンニューロンを保護する<ref name=deThe2018><pubmed>29941661</pubmed></ref><ref name=Alvarez2011><pubmed>21892157</pubmed></ref>。また、''En1''は上オリーブ核ニューロンの、''En1''、''En2''は共に[[小脳核]]内側の一部の[[興奮性ニューロン]]および縫線核[[5-HT]]ニューロンの分化と維持に必要である<ref name= | ''En1''、''En2''は中脳ドーパミンニューロンの維持に、細胞自律的に必要であり<ref name=Simon2001><pubmed>11312297</pubmed></ref><ref name=Alberi2004><pubmed>15175251</pubmed></ref>、LINE-1の発現抑制を通じて、[[酸化ストレス]]から中脳ドーパミンニューロンを保護する<ref name=deThe2018><pubmed>29941661</pubmed></ref><ref name=Alvarez2011><pubmed>21892157</pubmed></ref>。また、''En1''は上オリーブ核ニューロンの、''En1''、''En2''は共に[[小脳核]]内側の一部の[[興奮性ニューロン]]および縫線核[[5-HT]]ニューロンの分化と維持に必要である<ref name=Altieri2015><pubmed>26542008</pubmed></ref><ref name=Fox2012><pubmed>22674259</pubmed></ref><ref name=Krishnamurthy2024><pubmed>38912572</pubmed></ref>。更に、''En2''は[[大脳基底核]]由来[[神経幹細胞]]からのGABA作動性ニューロンの分化に必要である<ref name=Boschian2018><pubmed>29964155</pubmed></ref>。加えて、En1およびEn2は[[培養海馬細胞]]の樹状突起の複雑度やシナプスに差次的に影響する<ref name=Soltani2017><pubmed>28809922</pubmed></ref>。 | ||
マウス成体の脊髄のV1介在ニューロンで発現するEn1は、[[α運動ニューロン]]に対し[[傍分泌性]]の[[神経栄養活性]]を有する<ref name=Leboeuf2023><pubmed>37534581</pubmed></ref>。 | マウス成体の脊髄のV1介在ニューロンで発現するEn1は、[[α運動ニューロン]]に対し[[傍分泌性]]の[[神経栄養活性]]を有する<ref name=Leboeuf2023><pubmed>37534581</pubmed></ref>。 | ||
| 95行目: | 95行目: | ||
=== 自閉スペクトラム症 === | === 自閉スペクトラム症 === | ||
'' | ''EN2''の多型と[[自閉スペクトラム症]]との関連は1995年に最初に示された<ref name=Petit1995><pubmed>7643354</pubmed></ref>。''EN2''は患者で過剰発現する<ref name=James2014><pubmed>25290267</pubmed></ref>。また、自閉スペクトラム症に関連する''EN2''のイントロン中の2つのSNPは、発現上昇に繋がる<ref name=Benayed2009><pubmed>19615670</pubmed></ref>。''En2''欠損マウスは患者と類似した行動、および学習の障害や、小脳の形態異常を示す<ref name=Cheh2006><pubmed>16935268</pubmed></ref>。また、患者において[[味覚]]異常が報告されているが、''En2''欠損マウスでも[[塩化ナトリウム]]への嗜好性が強まる<ref name=Gupta2018><pubmed>29953887</pubmed></ref>。成人患者に対する慢性ストレスが、行動上の、あるいは神経解剖学的な表現型を増悪するかどうかは明らかで無いが、慢性的な[[環境ストレス]]に曝露した''En2''欠損マウスでは、行動上の、あるいは神経解剖学的な表現型が増悪することが報告されている<ref name=Phan2021><pubmed>34271036</pubmed></ref>。 | ||
=== 統合失調症 === | === 統合失調症 === | ||
'' | ''EN1''のいくつかの[[単一塩基多型]]は[[統合失調症]]の症状および[[抗精神病薬]]の効果と関連する<ref name=Webb2008><pubmed>18698228</pubmed></ref>。 | ||
== 参考文献 == | == 参考文献 == | ||
2025年10月6日 (月) 16:08時点における最新版
荒木 功人
岩手大学 農学部
DOI:10.14931/bsd.11378 原稿受付日:2025年6月23日 原稿完成日:2025年9月26日
担当編集委員:山形 方人(ハーバード大学・脳科学センター)
英略称:En
Engrailed(En)遺伝子は、動物界で広く見られるホメオドメインタンパク質Enをコードする。Enは、転写因子としての機能を持つほか、古典的なシグナルペプチドを持たないにも拘わらずその一部は細胞外に分泌され、更に細胞外から他の細胞内へ移行できるという細胞間シグナル分子としての性質も有する。加えて、eIF4Eに結合し翻訳を促進するという翻訳調節因子としての側面も持つ。脊椎動物は、Engrailed-1(En1)およびEngrailed-2(En2)の2つのパラログを有しており、これらは中脳—後脳境界の形成、小脳および中脳の発生、神経回路の構築、神経細胞の分化や生存維持において重要な役割を果たす。EN2は自閉スペクトラム症との関連が示されている一方、En1ヘテロ接合性マウスはパーキンソン病に特徴的なドーパミンニューロン減少と運動制御異常を示す。
研究の歴史
1920年代後半の研究により、ショウジョウバエの最初のengrailed(en)変異体が樹立された[1]。その後の研究により、enは翅原基の後部コンパートメント形成や[2]、セグメントポラリティー遺伝子の一つとして胚の体節化[3]に関与することなどが明らかになった。1985年には、ショウジョウバエのen遺伝子のcDNA配列が決定され、それがホメオボックス遺伝子であることが判明した[4][5]。更に、脊椎動物を含む他の動物分類群においてen相同遺伝子の単離と解析が進んだ[6][7][8][9]。
サブファミリー
無脊椎動物
多くは単一のenを有する一方、ショウジョウバエには、enと隣接してそのパラログ遺伝子であるinvected(inv)が存在する[10]。invを欠く個体は生存可能であり、表現型にも顕著な異常は見られないが、enとinvの二重変異体ではen単独変異の表現型が増強されることから、両者は機能的に冗長であると考えられる[10]。
脊椎動物
多くは2つのen相同遺伝子En1およびEn2を有する[7]。ゼブラフィッシュでは、それぞれの遺伝子がさらに重複し、En1およびEn2が各2コピーずつ存在する[11]。
En1遺伝子座にEn2をノックインしたマウスの解析によると、En1とEn2は機能的に冗長である[12]。一方、En1遺伝子座にショウジョウバエのenをノックインしたマウスでは、四肢の表現型のみが見られる[13]。このノックインマウスからさらに内在性En2を除去すると中脳と小脳の発生に異常が生ずる[14]。これは、En2のみを欠くマウスが小脳に小さな欠損を呈するものの生存可能かつ生殖可能であるのと対照的である[15]。
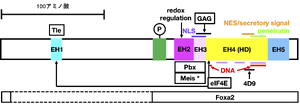
ニワトリEn2をモデルとして示す。緑は高セリン領域を示す。薄紫のバーはホメオドメイン(HD)中のαヘリックスを示す[16]。4D9はEnに関する研究でしばしば用いられるモノクローナル抗体であり、本図ではそのエピトープが含まれる領域を示す[17]。ショウジョウバエEnではCATアッセイによりEH1とEH2の間の一部の領域(アミノ酸228〜282)が転写抑制活性を有することが示されているが[18]、この領域は脊椎動物のEnとの相同性は見られない。(*) MeisはEnに直接結合するが、Enのどの部分に結合するかは不明である。
構造
遺伝子およびmRNA
代表的な脊椎動物種のEn1およびEn2の多くは、2つのエキソンと1つのイントロンから成る[19]。
En1 mRNAの3'UTRには細胞質ポリアデニル化配列(CPE)が存在することから、その樹状突起への局在はCPE結合タンパク質により調節される可能性がある[20]。in vitroにおけるEn1 mRNAの翻訳は、ポリアデニル化に依存して脱分極により増加し、この翻訳はラパマイシンにより阻害される。またEn2はmiR-212の標的である[21]。
タンパク質
Loganら[19]は、ショウジョウバエのEngrailed(En)、マウス、ヒト、ニワトリのEn1, En2およびアフリカツメガエルのEn2のアミノ酸配列を比較することにより、Enタンパク質において進化的に保存されている5つの領域を同定し、それぞれをEH1〜EH5と名付けた(図1)。CATアッセイによると、このうちEH1とEH5はEngrailedの転写抑制活性に関わる[22]。
EH1は、Enを初めとするホメオドメインタンパク質やフォークヘッドタンパク質、Tボックスタンパク質、Znフィンガータンパク質などにおいても見られるアミノ酸モチーフであり[23]、転写抑制補助因子であるGroucho(Gro)/Tleが結合する[22][24]。in vivoで、EH1のみに変異を入れるだけでEnの転写抑制活性が失われる[23][25]。ショウジョウバエのEnには、EH1とEH2の間(アミノ酸201〜205)に昆虫特有のGro結合部位(ehIFRPFモチーフ)が、EH1とは別に存在する[26]。
EH2およびEH3にはTALEホメオドメインタンパク質に属する転写補助因子Extradenticle(Exd)/Pbxが結合する[27]。特にEH2内の2つのトリプトファンの何れかをリジンに置換するとPbxと結合できなくなる[28]。また、この置換によりEnは、細胞外に移行できなくなる[29]。他のホメオドメインタンパク質と同様、EnはExd/Pbxの他、Homothorax (Hth)/Meisとヘテロ三量体を形成する。結合部位の詳細は不明であるが、Hth/MeisはEnに直接結合するとされる[30]。EH2のC末端の2つのアミノ酸とEH3全体は核移行シグナル (NLS)であると推定されている[22][31]。また、EH2中のシステイン残基は、酸化還元調節に応じたEn2の細胞間シグナル伝達の調節に関与する[32]。
EH4はホメオドメインであり、DNAへの結合に関わる[16]。ホメオドメインを構成する3本のαヘリックスのうち第3ヘリックスと、ホメオドメインのN末端のヘリックスを構成しない数アミノ酸がDNAに結合する[16]。SAAB法によるとEngrailed単独で最も高い親和性を示すDNA配列はTAATTAである[33]。また、Exdとのヘテロ二量体化により、EnのDNA結合特異性が変化する[34]。ショウジョウバエ胚におけるChIP解析によるとEnのコンセンサス結合配列はYAATYANBである[35]。Enの結合親和性は、認識部位に隣接する、認識配列に類似した繰り返し配列を伴うDNA領域により増強される[36]。
EH3の大部分とホメオドメインのN末端の一部を含む領域は、細胞表面のグリコサミノグリカン(GAG)との相互作用を通じて、Enの細胞外から細胞内への移行を制御する[31]。ホメオドメインのC末端側には、核外移行シグナル配列(NES)/細胞外への分泌シグナルと、細胞外から細胞内への移行シグナル(膜透過ペプチド配列penetratin)が存在する[37][38][39]。細胞外から細胞内への移行はエンドサイトーシスと、エンドサイトーシスを介さない直接的移行の2つの様式により起こる[39][40]。Enの細胞内外への出入りには、ホスファチジルイノシトール4,5-ビスリン酸(PIP2)とコレステロールが必要である[41]。EnのEH2ドメインのN末端側には高セリン領域が存在する。カゼインキナーゼ2 (CK2)によるこの領域のリン酸化は、EnホメオドメインのDNAへの結合を増強する一方[42]、Enの細胞外分泌を阻害する[43]。また、Enは他のいくつかのホメオドメインタンパク質(Bicoid, Emx2, HoxA9, Prhなど)と同様に、真核生物翻訳開始因子4E (eIF4E)と結合するが[44]、それらのホメオドメインタンパク質とは異なり[45]、EH1ドメインがeIF4E結合部位を兼ねることが推定されている([46]、Alain Prochiantz、私信)。これとは別に、マウスのEn1のホメオドメインN末端に位置するリジンに点突然変異K313Eを導入すると、eIF4Eに結合しなくなる[47]。Foxa2との相互作用には高セリン領域からホメオドメインにかけての領域が関与する[48]。
発現
細胞内分布
Enを発現させたCOS細胞において、細胞内のEnのうち、細胞外へ出るのは5%未満であると見積もられており、その大部分は核に局在する[37]。Enはいくつかのニューロンにおいて樹状突起など核外に局在することが報告されている[20][44]。ゼブラフィッシュ胚中脳視蓋において、H2O2レベルが増加するとEn2の核への移行が促進される[32]。
初期胚の神経系における主な発現
脊椎動物の初期胚では、En1、En2のmRNAおよびそれらのタンパク質の発現が中脳から第1菱脳胞(ロンボメア1)にかけて見られる[11][12][17][49][50][51][52][53][54]。En1 mRNAおよびEn1タンパク質陽性領域は発現初期には中脳前端まで至り、のちに発現領域は中脳後脳境界(midbrain–hindbrain boundary, MHB)付近に限られるようになる[49][50][51][52][55]。発現の時期には種差があり、マウスやニワトリではEn1の発現が先行する一方、ゼブラフィッシュではEn2の発現が先行する[56][57][58]。発生が進むとEn2タンパク質は中脳視蓋で前方から後方に向かって発現レベルが上昇する勾配を呈するようになる[59]。ゼブラフィッシュ胚において、H2O2レベルを上昇させると中脳視蓋におけるEn2タンパク質の発現勾配がより急になること、En2はH2O2が高レベルの細胞から分泌され、低レベルの細胞に取り込まれること、En2が細胞に取り込まれるとH2O2レベルが上昇することが報告されている[32]。
また、脊髄から後脳後部にかけての腹側介在ニューロンでもEn1 mRNAおよびEn1タンパク質が発現する[11][12][49][51][53][54]。マウスでは、このEn1陽性介在ニューロンは、脊髄のPax2陽性介在ニューロンの一部であり、その発生はPax6に依存する[60][61]。
中脳後脳関連遺伝子間の初期胚における発現相互依存性
脊椎動物初期胚の中脳後脳領域においてEn1と相前後して発現を開始し、協調して中脳、後脳の発生に関わる遺伝子として、Wnt1、Pax2、Fgf8が存在する。初期胚の脳において、Wnt1、Pax2、Fgf8の異所的発現あるいは機能喪失は、En1の発現の変化を引き起こす[55][56][57][62][63][64][65][66][67][68]。同様にEn1の異所的発現あるいは機能喪失は、Wnt1、Pax2、Fgf8の発現の変化を引き起こす[25][55][65][69][70]。したがって、初期胚の中脳・後脳領域において、En1、Wnt1、Pax2、Fgf8は互いの発現維持に相互依存している。一方で、それぞれの発現開始には関与しないことが示されている[62][65][69][71]。ニワトリでは脊索で発現するFgf4が中脳後脳領域におけるEn1の発現を誘導することが提唱されているが、マウスやゼブラフィッシュの脊索におけるFgf4の発現は報告されていない[55][58]。
Wnt1、Pax2、Fgf8はEn2 mRNAおよびEn2タンパク質の発現維持にも関与する[55][56][67][72][73][74][75][76]。また、Wnt1およびPax2ノックアウトマウスではEn2が発現しないことが、Pax2変異ゼブラフィッシュではEn1が発現しないことが報告されており、これはEn2(ゼブラフィッシュの場合はEn1)の発現開始がそれらの遺伝子に依存することを示唆する[57][62][77]。
なお、EnによるWnt1、Pax2、Fgf8の誘導や、Fgf8によるEnの誘導は間接的であると考えられている[25][68]。
中期発生以降の神経系における発現
発生初期の脳の領域化以降も、主として中脳や小脳においてEnの発現が見られる。マウスにおいて、En1およびEn2が中脳ドーパミンニューロンにおいて、またEn1が上オリーブ核のグリシン作動性、コリン作動性およびGABA作動性ニューロンにおいて、胚発生期から成体まで発現する[78][79]。また、縫線核ではEn1およびEn2が5-HTニューロンで胚発生期に発現し、En1の発現は出生後も継続する[80]。胚発生15.5日目(E15.5)〜出生後0日目(P0)のマウス胚小脳では、苔状線維と登上線維の神経支配と合致したEn2の縞状の発現が見られる[81]。
マウス海馬ではE16以降、En1およびEn2が低レベルで発現し、シナプス形成が盛んに起こる出生時および生後1週間の間に、En2の発現は激減する[82]。
ニワトリでは、孵卵開始10日目の中脳視蓋において浅灰白線維層(SGFS)のg〜j層と脳室帯でEn2の発現が見られ、特にSGFSのi層で発現が高い[83]。また、この時期でも中脳視蓋後方から前方にかけての発現勾配が見られる。
機能
分子としての機能
Enは、転写抑制因子としても転写活性化因子としても機能する[22][23][25][84]。また直接的に転写活性化因子として機能する他、別の転写抑制因子を抑制することにより間接的に転写活性化を引き起こす可能性がある[25]。Enによる転写抑制には転写抑制補助因子Groが必要である[85]。更に、Enの転写抑制活性は、Ext/PbxおよびHth/Meisとヘテロ三量体を形成することにより増強される[30]。
また、Enは、非典型的分泌経路を介して細胞間シグナル分子としても機能する[37][38][39]。
更に、EnはeIF4Eに結合し、タンパク質合成を刺激することが、E17のマウス胚背側上丘において示されている[47]。この刺激によりミトコンドリア呼吸鎖複合体Iを構成するNdufs3の翻訳が促進され、ATP合成が増加し、それに引き続くATPの分泌とアデノシンへの加水分解を経てアデノシンA1受容体が活性化される。
転写の標的遺伝子
脊椎動物では、神経系におけるEnの標的遺伝子として、微小管結合タンパク質1b、および長鎖散在反復配列LINE-1がin vivoで同定されている[48][86]。また、ニワトリ初期胚の脳において、Pax6が標的遺伝子の候補として同定されている[25]。
脊椎動物の初期胚の脳における、EnによるWnt1、Pax2、Fgf8の誘導は直接的なものではないことを先に述べたが、同様に、Enによる軸索ガイダンスや細胞のソーティングに関わる細胞表面タンパク質をコードするEphrinA2やEphrinA5の発現誘導も[52][87][88]、間接的な制御であると推定される[25]。
中脳および後脳の初期発生
初期胚において、En1とEn2は、中脳後脳境界オーガナイザーの維持や、中脳間脳境界(diencephalic–mesencephalic boundary,DMB)の確立と維持を通じて、発生中の脳の領域化に寄与する[15][25][89][90][91][92]。脳の領域化においてEnは専ら転写因子として機能し、細胞間シグナル分子としての役割は小さい、とする報告がある一方[93]、中脳間脳境界の確立にはEnが分泌されることが必要であることも示されている[29]。また、中脳間脳境界と中脳後脳境界の確立にはPbxとの協調も必要である[28]。前述の通り、En1とEn2は機能的に冗長ではあるが[12]、En1は小脳と上丘の発生にE9より前のみ必要であり[14]、En1の欠失によりE9.5までに中脳後脳境界近傍で細胞死が増加する[71]。一方で、En1は下丘の、En2は小脳の発生において、より長期にわたり機能が要求される[14]。さらに、脳の領域化後においても、Enは中脳後脳領域内での勾配的または局所的な発現を通じて、領域内のパターン形成に寄与する。この機能は、神経回路形成、特定のニューロンの発生、および中脳後脳内における微細構造の形成に関与する[50][59][81][83]。
神経回路形成
Enは、中脳視蓋の後方でより高いという前後軸方向の発現勾配を呈することにより、投射地図(トポグラフィックマップ)の前後軸の確立に寄与する[94][95][96]。これは、転写因子としてEnがEphrinA2やEphrinA5の前後軸方向の勾配を伴った発現を誘導することと[52][87]、En自身が分泌性因子として耳側網膜神経節細胞(retinal ganglion cells, RGC)軸索を反発する一方、鼻側軸索を誘引することにより達成される[97]。成長円錐内部に移行したEnは、eIF4Eとの相互作用を介して、この軸索ガイダンス作用に必要な局所的翻訳を刺激する。この刺激によるラミンB2の翻訳促進が、ミトコンドリアの機能と軸索輸送に必要である[98]。En2はまた、EphrinA5による軸索成長円錐の崩壊に関し、アデノシンA1受容体シグナル伝達依存的に、耳側網膜神経節細胞を感作する[47][99]。この感作により、投射地図はより精密になる。
脊髄では、En1はV1介在ニューロンの特定化には必要ないが、その軸索ガイダンスと軸索束形成に必要である[100]。また、V1ニューロンの一部に由来するレンショー細胞と運動ニューロンの抑制性シナプス形成を調節する[101]。
発生中の体幹部において、軸上筋神経は体節中のEn1陽性領域に誘引される一方、軸下筋神経はEn陽性領域を忌避する[102]。また、四肢背側の筋肉に投射する脊髄運動ニューロン軸索に対し、肢芽腹側のEn1は細胞間シグナル分子として直接的に反発効果を呈すると共に、転写因子として制御下のEphrinA5を介して間接的にも反発効果を示す[103]。但し、中脳視蓋とは異なりEn1とEphrinA5との相乗効果は見られず、またEn2はこの軸索に対して反発効果を示さない。
ニューロンの分化と維持
En1、En2は中脳ドーパミンニューロンの維持に、細胞自律的に必要であり[78][104]、LINE-1の発現抑制を通じて、酸化ストレスから中脳ドーパミンニューロンを保護する[86][105]。また、En1は上オリーブ核ニューロンの、En1、En2は共に小脳核内側の一部の興奮性ニューロンおよび縫線核5-HTニューロンの分化と維持に必要である[79][80][106]。更に、En2は大脳基底核由来神経幹細胞からのGABA作動性ニューロンの分化に必要である[107]。加えて、En1およびEn2は培養海馬細胞の樹状突起の複雑度やシナプスに差次的に影響する[82]。
マウス成体の脊髄のV1介在ニューロンで発現するEn1は、α運動ニューロンに対し傍分泌性の神経栄養活性を有する[108]。
疾患との関連
パーキンソン病
En1+/-マウスあるいはEn1+/-; En2-/-マウスは、ヒトのパーキンソン病に類似したドーパミン作動性ニューロンの進行性喪失や運動障害を示す[105][109]。カニクイザルのパーキンソン病モデルの黒質緻密部へのEN1タンパク質の注入による治療効果が報告されている[110]。
自閉スペクトラム症
EN2の多型と自閉スペクトラム症との関連は1995年に最初に示された[111]。EN2は患者で過剰発現する[112]。また、自閉スペクトラム症に関連するEN2のイントロン中の2つのSNPは、発現上昇に繋がる[113]。En2欠損マウスは患者と類似した行動、および学習の障害や、小脳の形態異常を示す[114]。また、患者において味覚異常が報告されているが、En2欠損マウスでも塩化ナトリウムへの嗜好性が強まる[115]。成人患者に対する慢性ストレスが、行動上の、あるいは神経解剖学的な表現型を増悪するかどうかは明らかで無いが、慢性的な環境ストレスに曝露したEn2欠損マウスでは、行動上の、あるいは神経解剖学的な表現型が増悪することが報告されている[116]。
統合失調症
EN1のいくつかの単一塩基多型は統合失調症の症状および抗精神病薬の効果と関連する[117]。
参考文献
- ↑ Eker, R. (1929).
The recessive mutant engrailed in Drosophila melanogaster. Hereditas 12, 217-222. [PDF] - ↑
Morata, G., & Lawrence, P.A. (1975).
Control of compartment development by the engrailed gene in Drosophila. Nature, 255(5510), 614-7. [PubMed:1134551] [WorldCat] [DOI] - ↑
Nüsslein-Volhard, C., & Wieschaus, E. (1980).
Mutations affecting segment number and polarity in Drosophila. Nature, 287(5785), 795-801. [PubMed:6776413] [WorldCat] [DOI] - ↑
Fjose, A., McGinnis, W.J., & Gehring, W.J. (1985).
Isolation of a homoeo box-containing gene from the engrailed region of Drosophila and the spatial distribution of its transcripts. Nature, 313(6000), 284-9. [PubMed:2481829] [WorldCat] [DOI] - ↑
Poole, S.J., Kauvar, L.M., Drees, B., & Kornberg, T. (1985).
The engrailed locus of Drosophila: structural analysis of an embryonic transcript. Cell, 40(1), 37-43. [PubMed:3917855] [WorldCat] [DOI] - ↑
Joyner, A.L., Kornberg, T., Coleman, K.G., Cox, D.R., & Martin, G.R. (1985).
Expression during embryogenesis of a mouse gene with sequence homology to the Drosophila engrailed gene. Cell, 43(1), 29-37. [PubMed:2416459] [WorldCat] [DOI] - ↑ 7.0 7.1
Holland, P.W., & Williams, N.A. (1990).
Conservation of engrailed-like homeobox sequences during vertebrate evolution. FEBS letters, 277(1-2), 250-2. [PubMed:1980115] [WorldCat] [DOI] - ↑
Holland, L.Z., Kene, M., Williams, N.A., & Holland, N.D. (1997).
Sequence and embryonic expression of the amphioxus engrailed gene (AmphiEn): the metameric pattern of transcription resembles that of its segment-polarity homolog in Drosophila. Development (Cambridge, England), 124(9), 1723-32. [PubMed:9165120] [WorldCat] [DOI] - ↑
Imai, K.S., Satoh, N., & Satou, Y. (2002).
Region specific gene expressions in the central nervous system of the ascidian embryo. Mechanisms of development, 119 Suppl 1, S275-7. [PubMed:14516697] [WorldCat] [DOI] - ↑ 10.0 10.1
Gustavson, E., Goldsborough, A.S., Ali, Z., & Kornberg, T.B. (1996).
The Drosophila engrailed and invected genes: partners in regulation, expression and function. Genetics, 142(3), 893-906. [PubMed:8849895] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2
Force, A., Lynch, M., Pickett, F.B., Amores, A., Yan, Y.L., & Postlethwait, J. (1999).
Preservation of duplicate genes by complementary, degenerative mutations. Genetics, 151(4), 1531-45. [PubMed:10101175] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2 12.3
Hanks, M., Wurst, W., Anson-Cartwright, L., Auerbach, A.B., & Joyner, A.L. (1995).
Rescue of the En-1 mutant phenotype by replacement of En-1 with En-2. Science (New York, N.Y.), 269(5224), 679-82. [PubMed:7624797] [WorldCat] [DOI] - ↑
Hanks, M.C., Loomis, C.A., Harris, E., Tong, C.X., Anson-Cartwright, L., Auerbach, A., & Joyner, A. (1998).
Drosophila engrailed can substitute for mouse Engrailed1 function in mid-hindbrain, but not limb development. Development (Cambridge, England), 125(22), 4521-30. [PubMed:9778510] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2
Sgaier, S.K., Lao, Z., Villanueva, M.P., Berenshteyn, F., Stephen, D., Turnbull, R.K., & Joyner, A.L. (2007).
Genetic subdivision of the tectum and cerebellum into functionally related regions based on differential sensitivity to engrailed proteins. Development (Cambridge, England), 134(12), 2325-35. [PubMed:17537797] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1
Joyner, A.L., Herrup, K., Auerbach, B.A., Davis, C.A., & Rossant, J. (1991).
Subtle cerebellar phenotype in mice homozygous for a targeted deletion of the En-2 homeobox. Science (New York, N.Y.), 251(4998), 1239-43. [PubMed:1672471] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2
Kissinger, C.R., Liu, B.S., Martin-Blanco, E., Kornberg, T.B., & Pabo, C.O. (1990).
Crystal structure of an engrailed homeodomain-DNA complex at 2.8 A resolution: a framework for understanding homeodomain-DNA interactions. Cell, 63(3), 579-90. [PubMed:1977522] [WorldCat] [DOI] - ↑ 17.0 17.1
Patel, N.H., Martin-Blanco, E., Coleman, K.G., Poole, S.J., Ellis, M.C., Kornberg, T.B., & Goodman, C.S. (1989).
Expression of engrailed proteins in arthropods, annelids, and chordates. Cell, 58(5), 955-68. [PubMed:2570637] [WorldCat] [DOI] - ↑
Han, K., & Manley, J.L. (1993).
Functional domains of the Drosophila Engrailed protein. The EMBO journal, 12(7), 2723-33. [PubMed:8334991] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Logan, C., Hanks, M.C., Noble-Topham, S., Nallainathan, D., Provart, N.J., & Joyner, A.L. (1992).
Cloning and sequence comparison of the mouse, human, and chicken engrailed genes reveal potential functional domains and regulatory regions. Developmental genetics, 13(5), 345-58. [PubMed:1363401] [WorldCat] [DOI] - ↑ 20.0 20.1
Di Nardo, A.A., Nedelec, S., Trembleau, A., Volovitch, M., Prochiantz, A., & Montesinos, M.L. (2007).
Dendritic localization and activity-dependent translation of Engrailed1 transcription factor. Molecular and cellular neurosciences, 35(2), 230-6. [PubMed:17399993] [WorldCat] [DOI] - ↑
Zhou, Y., Ji, Z., Yan, W., Zhou, Z., & Li, H. (2017).
The biological functions and mechanism of miR‑212 in prostate cancer proliferation, migration and invasion via targeting Engrailed-2. Oncology reports, 38(3), 1411-1419. [PubMed:28713997] [PMC] [WorldCat] [DOI] - ↑ 22.0 22.1 22.2 22.3
Tolkunova, E.N., Fujioka, M., Kobayashi, M., Deka, D., & Jaynes, J.B. (1998).
Two distinct types of repression domain in engrailed: one interacts with the groucho corepressor and is preferentially active on integrated target genes. Molecular and cellular biology, 18(5), 2804-14. [PubMed:9566899] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1 23.2
Smith, S.T., & Jaynes, J.B. (1996).
A conserved region of engrailed, shared among all en-, gsc-, Nk1-, Nk2- and msh-class homeoproteins, mediates active transcriptional repression in vivo. Development (Cambridge, England), 122(10), 3141-50. [PubMed:8898227] [PMC] [WorldCat] [DOI] - ↑
Dasen, J.S., Martinez Barbera, J.P., Herman, T.S., Connell, S.O., Olson, L., Ju, B., ..., & Rosenfeld, M.G. (2001).
Temporal regulation of a paired-like homeodomain repressor/TLE corepressor complex and a related activator is required for pituitary organogenesis. Genes & development, 15(23), 3193-207. [PubMed:11731482] [PMC] [WorldCat] [DOI] - ↑ 25.0 25.1 25.2 25.3 25.4 25.5 25.6 25.7
Araki, I., & Nakamura, H. (1999).
Engrailed defines the position of dorsal di-mesencephalic boundary by repressing diencephalic fate. Development (Cambridge, England), 126(22), 5127-35. [PubMed:10529429] [WorldCat] [DOI] - ↑
Hittinger, C.T., & Carroll, S.B. (2008).
Evolution of an insect-specific GROUCHO-interaction motif in the ENGRAILED selector protein. Evolution & development, 10(5), 537-45. [PubMed:18803772] [PMC] [WorldCat] [DOI] - ↑
Peltenburg, L.T., & Murre, C. (1996).
Engrailed and Hox homeodomain proteins contain a related Pbx interaction motif that recognizes a common structure present in Pbx. The EMBO journal, 15(13), 3385-93. [PubMed:8698039] [PMC] [WorldCat] - ↑ 28.0 28.1
Erickson, T., Scholpp, S., Brand, M., Moens, C.B., & Waskiewicz, A.J. (2007).
Pbx proteins cooperate with Engrailed to pattern the midbrain-hindbrain and diencephalic-mesencephalic boundaries. Developmental biology, 301(2), 504-17. [PubMed:16959235] [PMC] [WorldCat] [DOI] - ↑ 29.0 29.1
Rampon, C., Gauron, C., Lin, T., Meda, F., Dupont, E., Cosson, A., ..., & Joliot, A. (2015).
Control of brain patterning by Engrailed paracrine transfer: a new function of the Pbx interaction domain. Development (Cambridge, England), 142(10), 1840-9. [PubMed:25926358] [PMC] [WorldCat] [DOI] - ↑ 30.0 30.1
Kobayashi, M., Fujioka, M., Tolkunova, E.N., Deka, D., Abu-Shaar, M., Mann, R.S., & Jaynes, J.B. (2003).
Engrailed cooperates with extradenticle and homothorax to repress target genes in Drosophila. Development (Cambridge, England), 130(4), 741-51. [PubMed:12506004] [PMC] [WorldCat] [DOI] - ↑ 31.0 31.1
Cardon, S., Hervis, Y.P., Bolbach, G., Lopin-Bon, C., Jacquinet, J.C., Illien, F., ..., & Sagan, S. (2023).
A cationic motif upstream Engrailed2 homeodomain controls cell internalization through selective interaction with heparan sulfates. Nature communications, 14(1), 1998. [PubMed:37032404] [PMC] [WorldCat] [DOI] - ↑ 32.0 32.1 32.2
Amblard, I., Thauvin, M., Rampon, C., Queguiner, I., Pak, V.V., Belousov, V., ..., & Vriz, S. (2020).
H2O2 and Engrailed 2 paracrine activity synergize to shape the zebrafish optic tectum. Communications biology, 3(1), 536. [PubMed:32994473] [PMC] [WorldCat] [DOI] - ↑
Ades, S.E., & Sauer, R.T. (1994).
Differential DNA-binding specificity of the engrailed homeodomain: the role of residue 50. Biochemistry, 33(31), 9187-94. [PubMed:8049221] [WorldCat] [DOI] - ↑
van Dijk, M.A., & Murre, C. (1994).
extradenticle raises the DNA binding specificity of homeotic selector gene products. Cell, 78(4), 617-24. [PubMed:7915200] [WorldCat] [DOI] - ↑
Solano, P.J., Mugat, B., Martin, D., Girard, F., Huibant, J.M., Ferraz, C., ..., & Maschat, F. (2003).
Genome-wide identification of in vivo Drosophila Engrailed-binding DNA fragments and related target genes. Development (Cambridge, England), 130(7), 1243-54. [PubMed:12588842] [WorldCat] [DOI] - ↑
Castellanos, M., Mothi, N., & Muñoz, V. (2020).
Eukaryotic transcription factors can track and control their target genes using DNA antennas. Nature communications, 11(1), 540. [PubMed:31992709] [PMC] [WorldCat] [DOI] - ↑ 37.0 37.1 37.2
Joliot, A., Maizel, A., Rosenberg, D., Trembleau, A., Dupas, S., Volovitch, M., & Prochiantz, A. (1998).
Identification of a signal sequence necessary for the unconventional secretion of Engrailed homeoprotein. Current biology : CB, 8(15), 856-63. [PubMed:9705930] [WorldCat] [DOI] - ↑ 38.0 38.1
Maizel, A., Bensaude, O., Prochiantz, A., & Joliot, A. (1999).
A short region of its homeodomain is necessary for engrailed nuclear export and secretion. Development (Cambridge, England), 126(14), 3183-90. [PubMed:10375508] [WorldCat] [DOI] - ↑ 39.0 39.1 39.2
Dupont, E., Prochiantz, A., & Joliot, A. (2007).
Identification of a signal peptide for unconventional secretion. The Journal of biological chemistry, 282(12), 8994-9000. [PubMed:17242404] [WorldCat] [DOI] - ↑
Jiao, C.Y., Delaroche, D., Burlina, F., Alves, I.D., Chassaing, G., & Sagan, S. (2009).
Translocation and endocytosis for cell-penetrating peptide internalization. The Journal of biological chemistry, 284(49), 33957-65. [PubMed:19833724] [PMC] [WorldCat] [DOI] - ↑
Amblard, I., Dupont, E., Alves, I., Miralvès, J., Queguiner, I., & Joliot, A. (2020).
Bidirectional transfer of homeoprotein EN2 across the plasma membrane requires PIP2. Journal of cell science, 133(13). [PubMed:32434869] [WorldCat] [DOI] - ↑
Bourbon, H.M., Martin-Blanco, E., Rosen, D., & Kornberg, T.B. (1995).
Phosphorylation of the Drosophila engrailed protein at a site outside its homeodomain enhances DNA binding. The Journal of biological chemistry, 270(19), 11130-9. [PubMed:7744743] [WorldCat] [DOI] - ↑
Maizel, A., Tassetto, M., Filhol, O., Cochet, C., Prochiantz, A., & Joliot, A. (2002).
Engrailed homeoprotein secretion is a regulated process. Development (Cambridge, England), 129(15), 3545-53. [PubMed:12117805] [WorldCat] [DOI] - ↑ 44.0 44.1
Nédélec, S., Foucher, I., Brunet, I., Bouillot, C., Prochiantz, A., & Trembleau, A. (2004).
Emx2 homeodomain transcription factor interacts with eukaryotic translation initiation factor 4E (eIF4E) in the axons of olfactory sensory neurons. Proceedings of the National Academy of Sciences of the United States of America, 101(29), 10815-20. [PubMed:15247416] [PMC] [WorldCat] [DOI] - ↑
Topisirovic, I., & Borden, K.L. (2005).
Homeodomain proteins and eukaryotic translation initiation factor 4E (eIF4E): an unexpected relationship. Histology and histopathology, 20(4), 1275-84. [PubMed:16136508] [WorldCat] [DOI] - ↑
Rhoads, R.E. (2009).
eIF4E: new family members, new binding partners, new roles. The Journal of biological chemistry, 284(25), 16711-16715. [PubMed:19237539] [PMC] [WorldCat] [DOI] - ↑ 47.0 47.1 47.2
Stettler, O., Joshi, R.L., Wizenmann, A., Reingruber, J., Holcman, D., Bouillot, C., ..., & Moya, K.L. (2012).
Engrailed homeoprotein recruits the adenosine A1 receptor to potentiate ephrin A5 function in retinal growth cones. Development (Cambridge, England), 139(1), 215-24. [PubMed:22147955] [WorldCat] [DOI] - ↑ 48.0 48.1
Foucher, I., Montesinos, M.L., Volovitch, M., Prochiantz, A., & Trembleau, A. (2003).
Joint regulation of the MAP1B promoter by HNF3beta/Foxa2 and Engrailed is the result of a highly conserved mechanism for direct interaction of homeoproteins and Fox transcription factors. Development (Cambridge, England), 130(9), 1867-76. [PubMed:12642491] [WorldCat] [DOI] - ↑ 49.0 49.1 49.2
Davis, C.A., Holmyard, D.P., Millen, K.J., & Joyner, A.L. (1991).
Examining pattern formation in mouse, chicken and frog embryos with an En-specific antiserum. Development (Cambridge, England), 111(2), 287-98. [PubMed:1680044] [WorldCat] [DOI] - ↑ 50.0 50.1 50.2
Sgaier, S.K., Millet, S., Villanueva, M.P., Berenshteyn, F., Song, C., & Joyner, A.L. (2005).
Morphogenetic and cellular movements that shape the mouse cerebellum; insights from genetic fate mapping. Neuron, 45(1), 27-40. [PubMed:15629700] [WorldCat] [DOI] - ↑ 51.0 51.1 51.2
Gardner, C.A., & Barald, K.F. (1992).
Expression patterns of engrailed-like proteins in the chick embryo. Developmental dynamics : an official publication of the American Association of Anatomists, 193(4), 370-88. [PubMed:1354990] [WorldCat] [DOI] - ↑ 52.0 52.1 52.2 52.3
Logan, C., Wizenmann, A., Drescher, U., Monschau, B., Bonhoeffer, F., & Lumsden, A. (1996).
Rostral optic tectum acquires caudal characteristics following ectopic engrailed expression. Current biology : CB, 6(8), 1006-14. [PubMed:8805331] [WorldCat] [DOI] - ↑ 53.0 53.1
Hatta, K., Bremiller, R., Westerfield, M., & Kimmel, C.B. (1991).
Diversity of expression of engrailed-like antigens in zebrafish. Development (Cambridge, England), 112(3), 821-32. [PubMed:1682127] [WorldCat] [DOI] - ↑ 54.0 54.1
Ekker, M., Wegner, J., Akimenko, M.A., & Westerfield, M. (1992).
Coordinate embryonic expression of three zebrafish engrailed genes. Development (Cambridge, England), 116(4), 1001-10. [PubMed:1363539] [WorldCat] [DOI] - ↑ 55.0 55.1 55.2 55.3 55.4
Shamim, H., Mahmood, R., Logan, C., Doherty, P., Lumsden, A., & Mason, I. (1999).
Sequential roles for Fgf4, En1 and Fgf8 in specification and regionalisation of the midbrain. Development (Cambridge, England), 126(5), 945-59. [PubMed:9927596] [WorldCat] [DOI] - ↑ 56.0 56.1 56.2
Reifers, F., Böhli, H., Walsh, E.C., Crossley, P.H., Stainier, D.Y., & Brand, M. (1998).
Fgf8 is mutated in zebrafish acerebellar (ace) mutants and is required for maintenance of midbrain-hindbrain boundary development and somitogenesis. Development (Cambridge, England), 125(13), 2381-95. [PubMed:9609821] [WorldCat] [DOI] - ↑ 57.0 57.1 57.2
Lun, K., & Brand, M. (1998).
A series of no isthmus (noi) alleles of the zebrafish pax2.1 gene reveals multiple signaling events in development of the midbrain-hindbrain boundary. Development (Cambridge, England), 125(16), 3049-62. [PubMed:9671579] [WorldCat] [DOI] - ↑ 58.0 58.1
Rhinn, M., & Brand, M. (2001).
The midbrain--hindbrain boundary organizer. Current opinion in neurobiology, 11(1), 34-42. [PubMed:11179870] [WorldCat] [DOI] - ↑ 59.0 59.1
Itasaki, N., Ichijo, H., Hama, C., Matsuno, T., & Nakamura, H. (1991).
Establishment of rostrocaudal polarity in tectal primordium: engrailed expression and subsequent tectal polarity. Development (Cambridge, England), 113(4), 1133-44. [PubMed:1811932] [WorldCat] [DOI] - ↑
Burrill, J.D., Moran, L., Goulding, M.D., & Saueressig, H. (1997).
PAX2 is expressed in multiple spinal cord interneurons, including a population of EN1+ interneurons that require PAX6 for their development. Development (Cambridge, England), 124(22), 4493-503. [PubMed:9409667] [WorldCat] - ↑
Matise, M.P., & Joyner, A.L. (1997).
Expression patterns of developmental control genes in normal and Engrailed-1 mutant mouse spinal cord reveal early diversity in developing interneurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(20), 7805-16. [PubMed:9315901] [PMC] [WorldCat] [DOI] - ↑ 62.0 62.1 62.2
McMahon, A.P., Joyner, A.L., Bradley, A., & McMahon, J.A. (1992).
The midbrain-hindbrain phenotype of Wnt-1-/Wnt-1- mice results from stepwise deletion of engrailed-expressing cells by 9.5 days postcoitum. Cell, 69(4), 581-95. [PubMed:1534034] [WorldCat] [DOI] - ↑
Danielian, P.S., & McMahon, A.P. (1996).
Engrailed-1 as a target of the Wnt-1 signalling pathway in vertebrate midbrain development. Nature, 383(6598), 332-4. [PubMed:8848044] [WorldCat] [DOI] - ↑
Lekven, A.C., Buckles, G.R., Kostakis, N., & Moon, R.T. (2003).
Wnt1 and wnt10b function redundantly at the zebrafish midbrain-hindbrain boundary. Developmental biology, 254(2), 172-87. [PubMed:12591239] [WorldCat] [DOI] - ↑ 65.0 65.1 65.2
Ye, W., Bouchard, M., Stone, D., Liu, X., Vella, F., Lee, J., ..., & Rosenthal, A. (2001).
Distinct regulators control the expression of the mid-hindbrain organizer signal FGF8. Nature neuroscience, 4(12), 1175-81. [PubMed:11704761] [WorldCat] [DOI] - ↑
Ye, W., Shimamura, K., Rubenstein, J.L., Hynes, M.A., & Rosenthal, A. (1998).
FGF and Shh signals control dopaminergic and serotonergic cell fate in the anterior neural plate. Cell, 93(5), 755-66. [PubMed:9630220] [WorldCat] [DOI] - ↑ 67.0 67.1
Liu, A., Losos, K., & Joyner, A.L. (1999).
FGF8 can activate Gbx2 and transform regions of the rostral mouse brain into a hindbrain fate. Development (Cambridge, England), 126(21), 4827-38. [PubMed:10518499] [WorldCat] - ↑ 68.0 68.1
Liu, A., Li, J.Y., Bromleigh, C., Lao, Z., Niswander, L.A., & Joyner, A.L. (2003).
FGF17b and FGF18 have different midbrain regulatory properties from FGF8b or activated FGF receptors. Development (Cambridge, England), 130(25), 6175-85. [PubMed:14602678] [WorldCat] [DOI] - ↑ 69.0 69.1
Liu, A., & Joyner, A.L. (2001).
EN and GBX2 play essential roles downstream of FGF8 in patterning the mouse mid/hindbrain region. Development (Cambridge, England), 128(2), 181-91. [PubMed:11124114] [WorldCat] [DOI] - ↑
Picker, A., Scholpp, S., Böhli, H., Takeda, H., & Brand, M. (2002).
A novel positive transcriptional feedback loop in midbrain-hindbrain boundary development is revealed through analysis of the zebrafish pax2.1 promoter in transgenic lines. Development (Cambridge, England), 129(13), 3227-39. [PubMed:12070097] [WorldCat] [DOI] - ↑ 71.0 71.1
Chi, C.L., Martinez, S., Wurst, W., & Martin, G.R. (2003).
The isthmic organizer signal FGF8 is required for cell survival in the prospective midbrain and cerebellum. Development (Cambridge, England), 130(12), 2633-44. [PubMed:12736208] [WorldCat] [DOI] - ↑
Sugiyama, S., Funahashi, J., Kitajewski, J., & Nakamura, H. (1998).
Crossregulation between En-2 and Wnt-1 in chick tectal development. Development, growth & differentiation, 40(2), 157-66. [PubMed:9572358] [WorldCat] [DOI] - ↑
Okafuji, T., Funahashi, J., & Nakamura, H. (1999).
Roles of Pax-2 in initiation of the chick tectal development. Brain research. Developmental brain research, 116(1), 41-9. [PubMed:10446345] [WorldCat] [DOI] - ↑
Crossley, P.H., Martinez, S., & Martin, G.R. (1996).
Midbrain development induced by FGF8 in the chick embryo. Nature, 380(6569), 66-8. [PubMed:8598907] [WorldCat] [DOI] - ↑
Shimamura, K., & Rubenstein, J.L. (1997).
Inductive interactions direct early regionalization of the mouse forebrain. Development (Cambridge, England), 124(14), 2709-18. [PubMed:9226442] [WorldCat] - ↑
Sato, T., Araki, I., & Nakamura, H. (2001).
Inductive signal and tissue responsiveness defining the tectum and the cerebellum. Development (Cambridge, England), 128(13), 2461-9. [PubMed:11493563] [WorldCat] [DOI] - ↑
Schwarz, M., Alvarez-Bolado, G., Dressler, G., Urbánek, P., Busslinger, M., & Gruss, P. (1999).
Pax2/5 and Pax6 subdivide the early neural tube into three domains. Mechanisms of development, 82(1-2), 29-39. [PubMed:10354469] [WorldCat] [DOI] - ↑ 78.0 78.1
Simon, H.H., Saueressig, H., Wurst, W., Goulding, M.D., & O'Leary, D.D. (2001).
Fate of midbrain dopaminergic neurons controlled by the engrailed genes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(9), 3126-34. [PubMed:11312297] [PMC] [WorldCat] [DOI] - ↑ 79.0 79.1
Altieri, S.C., Jalabi, W., Zhao, T., Romito-DiGiacomo, R.R., & Maricich, S.M. (2015).
En1 directs superior olivary complex neuron positioning, survival, and expression of FoxP1. Developmental biology, 408(1), 99-108. [PubMed:26542008] [PMC] [WorldCat] [DOI] - ↑ 80.0 80.1
Fox, S.R., & Deneris, E.S. (2012).
Engrailed is required in maturing serotonin neurons to regulate the cytoarchitecture and survival of the dorsal raphe nucleus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(23), 7832-42. [PubMed:22674259] [PMC] [WorldCat] [DOI] - ↑ 81.0 81.1
Millen, K.J., Hui, C.C., & Joyner, A.L. (1995).
A role for En-2 and other murine homologues of Drosophila segment polarity genes in regulating positional information in the developing cerebellum. Development (Cambridge, England), 121(12), 3935-45. [PubMed:8575294] [WorldCat] [DOI] - ↑ 82.0 82.1
Soltani, A., Lebrun, S., Carpentier, G., Zunino, G., Chantepie, S., Maïza, A., ..., & Stettler, O. (2017).
Increased signaling by the autism-related Engrailed-2 protein enhances dendritic branching and spine density, alters synaptic structural matching, and exaggerates protein synthesis. PloS one, 12(8), e0181350. [PubMed:28809922] [PMC] [WorldCat] [DOI] - ↑ 83.0 83.1
Omi, M., Harada, H., Watanabe, Y., Funahashi, J., & Nakamura, H. (2014).
Role of En2 in the tectal laminar formation of chick embryos. Development (Cambridge, England), 141(10), 2131-8. [PubMed:24803658] [WorldCat] [DOI] - ↑
Serrano, N., & Maschat, F. (1998).
Molecular mechanism of polyhomeotic activation by Engrailed. The EMBO journal, 17(13), 3704-13. [PubMed:9649440] [PMC] [WorldCat] [DOI] - ↑
Jiménez, G., Paroush, Z., & Ish-Horowicz, D. (1997).
Groucho acts as a corepressor for a subset of negative regulators, including Hairy and Engrailed. Genes & development, 11(22), 3072-82. [PubMed:9367988] [PMC] [WorldCat] [DOI] - ↑ 86.0 86.1
Blaudin de Thé, F.X., Rekaik, H., Peze-Heidsieck, E., Massiani-Beaudoin, O., Joshi, R.L., Fuchs, J., & Prochiantz, A. (2018).
Engrailed homeoprotein blocks degeneration in adult dopaminergic neurons through LINE-1 repression. The EMBO journal, 37(15). [PubMed:29941661] [PMC] [WorldCat] [DOI] - ↑ 87.0 87.1
Shigetani, Y., Funahashi, J.I., & Nakamura, H. (1997).
En-2 regulates the expression of the ligands for Eph type tyrosine kinases in chick embryonic tectum. Neuroscience research, 27(3), 211-7. [PubMed:9129179] [WorldCat] [DOI] - ↑
Lee, S.M., Danielian, P.S., Fritzsch, B., & McMahon, A.P. (1997).
Evidence that FGF8 signalling from the midbrain-hindbrain junction regulates growth and polarity in the developing midbrain. Development (Cambridge, England), 124(5), 959-69. [PubMed:9056772] [WorldCat] [DOI] - ↑
Wurst, W., Auerbach, A.B., & Joyner, A.L. (1994).
Multiple developmental defects in Engrailed-1 mutant mice: an early mid-hindbrain deletion and patterning defects in forelimbs and sternum. Development (Cambridge, England), 120(7), 2065-75. [PubMed:7925010] [WorldCat] - ↑
Joyner, A.L. (1996).
Engrailed, Wnt and Pax genes regulate midbrain--hindbrain development. Trends in genetics : TIG, 12(1), 15-20. [PubMed:8741855] [WorldCat] [DOI] - ↑
Matsunaga, E., Araki, I., & Nakamura, H. (2000).
Pax6 defines the di-mesencephalic boundary by repressing En1 and Pax2. Development (Cambridge, England), 127(11), 2357-65. [PubMed:10804178] [WorldCat] - ↑
Scholpp, S., Lohs, C., & Brand, M. (2003).
Engrailed and Fgf8 act synergistically to maintain the boundary between diencephalon and mesencephalon. Development (Cambridge, England), 130(20), 4881-93. [PubMed:12917294] [WorldCat] [DOI] - ↑
Lesaffre, B., Joliot, A., Prochiantz, A., & Volovitch, M. (2007).
Direct non-cell autonomous Pax6 activity regulates eye development in the zebrafish. Neural development, 2, 2. [PubMed:17229313] [PMC] [WorldCat] [DOI] - ↑
Itasaki, N., & Nakamura, H. (1996).
A role for gradient en expression in positional specification on the optic tectum. Neuron, 16(1), 55-62. [PubMed:8562091] [WorldCat] [DOI] - ↑
Rétaux, S., McNeill, L., & Harris, W.A. (1996).
Engrailed, retinotectal targeting, and axonal patterning in the midbrain during Xenopus development: an antisense study. Neuron, 16(1), 63-75. [PubMed:8562092] [WorldCat] [DOI] - ↑
Friedman, G.C., & O'Leary, D.D. (1996).
Retroviral misexpression of engrailed genes in the chick optic tectum perturbs the topographic targeting of retinal axons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(17), 5498-509. [PubMed:8757262] [PMC] [WorldCat] [DOI] - ↑
Brunet, I., Weinl, C., Piper, M., Trembleau, A., Volovitch, M., Harris, W., ..., & Holt, C. (2005).
The transcription factor Engrailed-2 guides retinal axons. Nature, 438(7064), 94-8. [PubMed:16267555] [PMC] [WorldCat] [DOI] - ↑
Yoon, B.C., Jung, H., Dwivedy, A., O'Hare, C.M., Zivraj, K.H., & Holt, C.E. (2012).
Local translation of extranuclear lamin B promotes axon maintenance. Cell, 148(4), 752-64. [PubMed:22341447] [PMC] [WorldCat] [DOI] - ↑
Wizenmann, A., Brunet, I., Lam, J., Sonnier, L., Beurdeley, M., Zarbalis, K., ..., & Prochiantz, A. (2009).
Extracellular Engrailed participates in the topographic guidance of retinal axons in vivo. Neuron, 64(3), 355-366. [PubMed:19914184] [PMC] [WorldCat] [DOI] - ↑
Saueressig, H., Burrill, J., & Goulding, M. (1999).
Engrailed-1 and netrin-1 regulate axon pathfinding by association interneurons that project to motor neurons. Development (Cambridge, England), 126(19), 4201-12. [PubMed:10477289] [WorldCat] [DOI] - ↑
Sapir, T., Geiman, E.J., Wang, Z., Velasquez, T., Mitsui, S., Yoshihara, Y., ..., & Goulding, M. (2004).
Pax6 and engrailed 1 regulate two distinct aspects of renshaw cell development. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(5), 1255-64. [PubMed:14762144] [PMC] [WorldCat] [DOI] - ↑
Ahmed, M.U., Maurya, A.K., Cheng, L., Jorge, E.C., Schubert, F.R., Maire, P., ..., & Dietrich, S. (2017).
Engrailed controls epaxial-hypaxial muscle innervation and the establishment of vertebrate three-dimensional mobility. Developmental biology, 430(1), 90-104. [PubMed:28807781] [WorldCat] [DOI] - ↑
Huettl, R.E., Luxenhofer, G., Bianchi, E., Haupt, C., Joshi, R., Prochiantz, A., & Huber, A.B. (2015).
Engrailed 1 mediates correct formation of limb innervation through two distinct mechanisms. PloS one, 10(2), e0118505. [PubMed:25710467] [PMC] [WorldCat] [DOI] - ↑
Albéri, L., Sgadò, P., & Simon, H.H. (2004).
Engrailed genes are cell-autonomously required to prevent apoptosis in mesencephalic dopaminergic neurons. Development (Cambridge, England), 131(13), 3229-36. [PubMed:15175251] [WorldCat] [DOI] - ↑ 105.0 105.1
Alvarez-Fischer, D., Fuchs, J., Castagner, F., Stettler, O., Massiani-Beaudoin, O., Moya, K.L., ..., & Prochiantz, A. (2011).
Engrailed protects mouse midbrain dopaminergic neurons against mitochondrial complex I insults. Nature neuroscience, 14(10), 1260-6. [PubMed:21892157] [WorldCat] [DOI] - ↑
Krishnamurthy, A., Lee, A.S., Bayin, N.S., Stephen, D.N., Nasef, O., Lao, Z., & Joyner, A.L. (2024).
Engrailed transcription factors direct excitatory cerebellar neuron diversity and survival. Development (Cambridge, England), 151(14). [PubMed:38912572] [PMC] [WorldCat] [DOI] - ↑
Boschian, C., Messina, A., Bozza, A., Castellini, M.E., Provenzano, G., Bozzi, Y., & Casarosa, S. (2018).
Impaired Neuronal Differentiation of Neural Stem Cells Lacking the Engrailed-2 Gene. Neuroscience, 386, 137-149. [PubMed:29964155] [WorldCat] [DOI] - ↑
Lebœuf, M., Vargas-Abonce, S.E., Pezé-Hedsieck, E., Dupont, E., Jimenez-Alonso, L., Moya, K.L., & Prochiantz, A. (2023).
ENGRAILED-1 transcription factor has a paracrine neurotrophic activity on adult spinal α-motoneurons. EMBO reports, 24(8), e56525. [PubMed:37534581] [PMC] [WorldCat] [DOI] - ↑
Sgadò, P., Albéri, L., Gherbassi, D., Galasso, S.L., Ramakers, G.M., Alavian, K.N., ..., & Simon, H.H. (2006).
Slow progressive degeneration of nigral dopaminergic neurons in postnatal Engrailed mutant mice. Proceedings of the National Academy of Sciences of the United States of America, 103(41), 15242-7. [PubMed:17015829] [PMC] [WorldCat] [DOI] - ↑
Thomasson, N., Pioli, E., Friedel, C., Monseur, A., Lavaur, J., Moya, K.L., ..., & Prochiantz, A. (2019).
Engrailed-1 induces long-lasting behavior benefit in an experimental Parkinson primate model. Movement disorders : official journal of the Movement Disorder Society, 34(7), 1082-1084. [PubMed:31077447] [WorldCat] [DOI] - ↑
Petit, E., Hérault, J., Martineau, J., Perrot, A., Barthélémy, C., Hameury, L., ..., & Müh, J.P. (1995).
Association study with two markers of a human homeogene in infantile autism. Journal of medical genetics, 32(4), 269-74. [PubMed:7643354] [PMC] [WorldCat] [DOI] - ↑
James, S.J., Shpyleva, S., Melnyk, S., Pavliv, O., & Pogribny, I.P. (2014).
Elevated 5-hydroxymethylcytosine in the Engrailed-2 (EN-2) promoter is associated with increased gene expression and decreased MeCP2 binding in autism cerebellum. Translational psychiatry, 4(10), e460. [PubMed:25290267] [PMC] [WorldCat] [DOI] - ↑
Benayed, R., Choi, J., Matteson, P.G., Gharani, N., Kamdar, S., Brzustowicz, L.M., & Millonig, J.H. (2009).
Autism-associated haplotype affects the regulation of the homeobox gene, ENGRAILED 2. Biological psychiatry, 66(10), 911-7. [PubMed:19615670] [PMC] [WorldCat] [DOI] - ↑
Cheh, M.A., Millonig, J.H., Roselli, L.M., Ming, X., Jacobsen, E., Kamdar, S., & Wagner, G.C. (2006).
En2 knockout mice display neurobehavioral and neurochemical alterations relevant to autism spectrum disorder. Brain research, 1116(1), 166-76. [PubMed:16935268] [WorldCat] [DOI] - ↑
Gupta, A., Li, X., DiCicco-Bloom, E., & Bello, N.T. (2018).
Altered salt taste response and increased tongue epithelium Scnna1 expression in adult Engrailed-2 null mice. Physiology & behavior, 194, 410-419. [PubMed:29953887] [PMC] [WorldCat] [DOI] - ↑
Phan, M.L., Liu, T.T., Vollbrecht, M.S., Mansour, M.H., Nikodijevic, I., Jadav, N., ..., & Samuels, B.A. (2021).
Engrailed 2 deficiency and chronic stress alter avoidance and motivation behaviors. Behavioural brain research, 413, 113466. [PubMed:34271036] [WorldCat] [DOI] - ↑
Webb, B.T., Sullivan, P.F., Skelly, T., & van den Oord, E.J. (2008).
Model-based gene selection shows engrailed 1 is associated with antipsychotic response. Pharmacogenetics and genomics, 18(9), 751-9. [PubMed:18698228] [WorldCat] [DOI]