「麻薬」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 18行目: | 18行目: | ||
[[wj:中国|中国]]では、[[大麻]]が成分とされる「[[wj:麻沸散|麻沸散]]」と呼ばれる[[麻酔薬]]を使って腹部切開手術を行った記載が[[wj:三国志|三国志]]にある。さらに「[[wj:本草綱目|本草綱目]]」(1892種の本草([[wj:生薬|生薬]])について薬効などを詳しく記述されている文献)では阿片を主薬とする「[[wj:一粒金丹|一粒金丹]]」という製剤の記載があり、万能薬として用いられた。日本では、1804 年に[[wj:華岡青洲|華岡青洲]]が[[wj:麻沸散|麻沸散]](別名:[[wj:通仙散|通仙散]])による[[全身麻酔]]下で[[wj:乳癌|乳癌]]摘出手術に成功したといわれている。1803 年にドイツの薬剤師である[[wj:フリードリヒ・ゼルチュルナー|Sertürner]] があへんからモルヒネの単離にはじめて成功した。 | [[wj:中国|中国]]では、[[大麻]]が成分とされる「[[wj:麻沸散|麻沸散]]」と呼ばれる[[麻酔薬]]を使って腹部切開手術を行った記載が[[wj:三国志|三国志]]にある。さらに「[[wj:本草綱目|本草綱目]]」(1892種の本草([[wj:生薬|生薬]])について薬効などを詳しく記述されている文献)では阿片を主薬とする「[[wj:一粒金丹|一粒金丹]]」という製剤の記載があり、万能薬として用いられた。日本では、1804 年に[[wj:華岡青洲|華岡青洲]]が[[wj:麻沸散|麻沸散]](別名:[[wj:通仙散|通仙散]])による[[全身麻酔]]下で[[wj:乳癌|乳癌]]摘出手術に成功したといわれている。1803 年にドイツの薬剤師である[[wj:フリードリヒ・ゼルチュルナー|Sertürner]] があへんからモルヒネの単離にはじめて成功した。 | ||
このように、人類は紀元前よりオピオイドの鎮痛作用や陶酔作用といった効果を知っていたが、その薬理作用の仕組みが理解されるようになったのは20世紀後半からである。研究者達はなぜ植物由来の成分が動物や人間の生体内でこれほど強い効果を引き出すことができるのかという素朴な疑問を持ち続け、それは次第に “モルヒネ感受性受容体の存在” という概念にたどり着いた。1971 年、[[w:Avram Goldstein|Goldstein]] はオピオイド受容体の発見の基になる報告をし<ref name=ref1><pubmed>5288759</pubmed></ref>、1973 年にそれぞれ、[[w:Solomon H. Snyder|Snyder]]と[[w:Candace Pert|Pert]]<ref name="ref2"><pubmed>4687585</pubmed></ref> | このように、人類は紀元前よりオピオイドの鎮痛作用や陶酔作用といった効果を知っていたが、その薬理作用の仕組みが理解されるようになったのは20世紀後半からである。研究者達はなぜ植物由来の成分が動物や人間の生体内でこれほど強い効果を引き出すことができるのかという素朴な疑問を持ち続け、それは次第に “モルヒネ感受性受容体の存在” という概念にたどり着いた。1971 年、[[w:Avram Goldstein|Goldstein]] はオピオイド受容体の発見の基になる報告をし<ref name=ref1><pubmed>5288759</pubmed></ref>、1973 年にそれぞれ、[[w:Solomon H. Snyder|Snyder]]と[[w:Candace Pert|Pert]]<ref name="ref2"><pubmed>4687585</pubmed></ref>、[[w:Eric J. Simon|Simon]]<ref name="ref3"><pubmed>4583407</pubmed></ref>、[[wd:Lars Terenius|Terenius]]<ref name="ref4"><pubmed>4801083</pubmed></ref>の3つのグループから[[オピオイド受容体]]の存在が提唱され、広く研究者の間で受け入れられるようになった。1975 年には[[w:John Hughes (neuroscientist)|Hughes]]と[[w:Hans Kosterlitz|Kosterlitz]]ら<ref name="ref5"><pubmed>1207728</pubmed></ref>が[[エンケファリン]]を発見し、さらに、1979 年にGoldsteinとTachibanaら<ref name="ref6"><pubmed>230519</pubmed></ref>が[[ダイノルフィン]]を抽出し、生体内に存在するモルヒネ様物質、いわゆる“[[内因性オピオイド]]”が発見された。 | ||
[[オピオイド受容体]]は[[Μ受容体|μ]]、[[Δ受容体|δ]]および[[Κ受容体|κ]]に大別され、これら3種のオピオイド受容体の研究がもっとも盛んに行われてきた。オピオイド受容体遺伝子のクロ−ニングは他の受容体と比べて遅く、1992 年になってEvansらと[[w:Brigitte Kieffer|Kieffer]]らのグループがそれぞれ、δ受容体のクロ−ニングに成功した<ref name="ref7"><pubmed>1335167</pubmed></ref> <ref name="ref8"><pubmed>1334555</pubmed></ref> | [[オピオイド受容体]]は[[Μ受容体|μ]]、[[Δ受容体|δ]]および[[Κ受容体|κ]]に大別され、これら3種のオピオイド受容体の研究がもっとも盛んに行われてきた。オピオイド受容体遺伝子のクロ−ニングは他の受容体と比べて遅く、1992 年になってEvansらと[[w:Brigitte Kieffer|Kieffer]]らのグループがそれぞれ、δ受容体のクロ−ニングに成功した<ref name="ref7"><pubmed>1335167</pubmed></ref> <ref name="ref8"><pubmed>1334555</pubmed></ref>。δ受容体のクロ−ニング後、[[PCR]]法によるホモロジーを利用した研究によってμおよびκ受容体のクロ−ニングの成功が相次いで報告された。 | ||
== 不正薬物 == | == 不正薬物 == | ||
「[[wj:覚醒剤取締法|覚醒剤取締法]]」、「[[wj:大麻取締法|大麻取締法]]」、「[[wj:麻薬及び向精神薬取締法|麻薬及び向精神薬取締法]]」、「[[wj:あへん法|あへん法]]」等により法律で厳しく規制されている薬物である('''図1''')<ref>[http://www.mhlw.go.jp/bunya/iyakuhin/yakubuturanyou/gyousei-gaikyo/torishimari.html 厚生労働省 不正麻薬の取締り]</ref> | 「[[wj:覚醒剤取締法|覚醒剤取締法]]」、「[[wj:大麻取締法|大麻取締法]]」、「[[wj:麻薬及び向精神薬取締法|麻薬及び向精神薬取締法]]」、「[[wj:あへん法|あへん法]]」等により法律で厳しく規制されている薬物である('''図1''')<ref>[http://www.mhlw.go.jp/bunya/iyakuhin/yakubuturanyou/gyousei-gaikyo/torishimari.html 厚生労働省 不正麻薬の取締り]</ref>。 | ||
[[Image:麻薬1.png|thumb|350px|'''図1.代表的な不正麻薬の化学構造式''']] | [[Image:麻薬1.png|thumb|350px|'''図1.代表的な不正麻薬の化学構造式''']] | ||
=== 覚醒剤 === | === 覚醒剤 === | ||
| 47行目: | 47行目: | ||
=== LSD === | === LSD === | ||
LSD(化学名:リゼルギン酸ジエチルアミド; lysergic acid diethylamide) は、合成麻薬の一種で、「麻薬及び向精神薬取締法」の規制の対象とされ、水溶液をしみこませた紙片、錠剤、カプセル、ゼラチン等があり、経口又は飲み物とともに飲むなどして乱用されている。LSD を乱用すると、幻視、幻聴、時間の感覚の欠如などの強烈な幻覚作用が現れる。特に幻視作用が強く、ほんのわずかな量だけで物の形が変形、巨大化して見えたり、色とりどりの光が見えたりする状態が 8~12 時間続く。また、乱用を続けると、長期にわたって神経障害を来す。 | |||
== 医療用麻薬-オピオイド == | == 医療用麻薬-オピオイド == | ||
| 63行目: | 63行目: | ||
|+'''表.オピオイド受容体に対するpotency''' | |+'''表.オピオイド受容体に対するpotency''' | ||
|- | |- | ||
! style="background-color:#d3d3d3" rowspan="2" |種類 | |||
! style="background-color:#d3d3d3" rowspan="2" |薬物名 | ! style="background-color:#d3d3d3" rowspan="2" |薬物名 | ||
! style="background-color:#d3d3d3; text-align:center" colspan="3" | オピオイド受容体 | ! style="background-color:#d3d3d3; text-align:center" colspan="3" | オピオイド受容体 | ||
| 71行目: | 72行目: | ||
! style="background-color:#d3d3d3; text-align:center" | κ | ! style="background-color:#d3d3d3; text-align:center" | κ | ||
|- | |- | ||
| style="background-color:#fed0e0; text-align:center" rowspan="6" | 強オピオイド鎮痛薬 | |||
| style="background-color:#fed0e0; text-align:center" | モルヒネ | | style="background-color:#fed0e0; text-align:center" | モルヒネ | ||
| style="background-color:#fed0e0; text-align:center" | +++ | | style="background-color:#fed0e0; text-align:center" | +++ | ||
| 92行目: | 94行目: | ||
| style="background-color:#fed0e0; text-align:center" | +++ | | style="background-color:#fed0e0; text-align:center" | +++ | ||
| style="background-color:#fed0e0; text-align:center" | | | style="background-color:#fed0e0; text-align:center" | | ||
| style="background-color:#fed0e0; text-align:center" | | | style="background-color:#fed0e0; text-align:center" | | ||
| style="background-color:#fed0e0; text-align:center" | 半合成麻薬 | | style="background-color:#fed0e0; text-align:center" | 半合成麻薬 | ||
|- | |- | ||
| 146行目: | 148行目: | ||
==== オキシコドン ==== | ==== オキシコドン ==== | ||
オキシコドンは、あへんに含まれるアルカロイドの[[テバイン]]から合成される半合成テバイン誘導体であり、強オピオイドに分類される。体内に入ると代謝酵素である[[wj:CYP2D6|CYP2D6]]により[[オキシモルフォン]]へ、[[wj:CYP3A4|CYP3A4]]により[[ノルオキシコドン]] | オキシコドンは、あへんに含まれるアルカロイドの[[テバイン]]から合成される半合成テバイン誘導体であり、強オピオイドに分類される。体内に入ると代謝酵素である[[wj:CYP2D6|CYP2D6]]により[[オキシモルフォン]]へ、[[wj:CYP3A4|CYP3A4]]により[[ノルオキシコドン]](非活性)へとそれぞれ代謝される。オキシモルフォンは活性代謝産物であり、その鎮痛効果はオキシコドンより強力であるが、AUC(Area Under the Curve; 時間曲線下面積、血漿中の薬物濃度の変化を時間の関数として表す曲線の定積分)はオキシコドンの約1%程度と低いため、臨床上問題とはならない。また、ノルオキシコドンは薬理活性がほとんどない。したがってオキシコドンの代謝物の影響はほとんどないと考えられる。薬理学的評価における臨床所見はオキシコドンの血中濃度と相関し、鎮痛作用はオキシコドンそのものによってもたらされる<ref name="ref10"><pubmed>1982347</pubmed></ref>。 | ||
==== フェンタニル ==== | ==== フェンタニル ==== | ||
| 205行目: | 207行目: | ||
=== がん疼痛におけるオピオイド投与の有効性 === | === がん疼痛におけるオピオイド投与の有効性 === | ||
近年、「がんの患者に早期から疼痛緩和ケアを導入すると、生存期間が延長する」という注目すべき研究結果が発表された<ref name="ref11"><pubmed>20818875</pubmed></ref> | 近年、「がんの患者に早期から疼痛緩和ケアを導入すると、生存期間が延長する」という注目すべき研究結果が発表された<ref name="ref11"><pubmed>20818875</pubmed></ref>。がん疼痛は、がんによる知覚神経終末の刺激を伴う侵害受容性疼痛とがんによる神経の圧迫や浸潤に伴って引き起こされる神経障害性疼痛に大別され、それらが複合的に生じる。がん性疼痛治療のなかでオピオイドはもっとも重要な薬剤であり、他の鎮痛薬と同じように「痛み」に対して使用を躊躇することがあってはならない。がん疼痛の治療にあたっては、基本的にWHOの[[三段階がん疼痛治療指針]]に従って行うべきである。WHOの三段階がん疼痛治療指針は、痛みの強さによって選択するという原則があることを忘れてはならない。がん疼痛の治療にあたっては、痛みの強さや治療による痛みの消長について患者が感じていることに積極的に耳を傾けることが重要である。患者の訴えと医療側の考えに大きな差があるときは、処方内容をどう改訂したかを患者に知らせ、その結果の除痛状態を必ず患者に聞くことを心がける。 | ||
一方、このがん疼痛の約30%に認められる神経障害性疼痛は、モルヒネをはじめとするオピオイド鎮痛薬が効きにくいことが多く、臨床上問題となる。一方、モルヒネは神経障害性疼痛下においても、脊髄腔内投与では十分な鎮痛効果をもたらす可能性が高い。 | 一方、このがん疼痛の約30%に認められる神経障害性疼痛は、モルヒネをはじめとするオピオイド鎮痛薬が効きにくいことが多く、臨床上問題となる。一方、モルヒネは神経障害性疼痛下においても、脊髄腔内投与では十分な鎮痛効果をもたらす可能性が高い。 | ||
| 216行目: | 218行目: | ||
モルヒネは中脳辺縁系の細胞体が存在する腹側被蓋野に高密度に分布するµオピオイド受容体を介し、[[介在ニューロン]]である抑制性の γ-アミノ酪酸 (GABA) 神経系を抑制して、中脳辺縁ドパミン神経系の活性化を引き起こす。活性化された中脳辺縁ドパミン神経系は、その投射先である側坐核からドパミンの著明な遊離を引き起こし、これがオピオイドによる多幸感発現や精神依存形成の引き金になっていると考えられている。中脳辺縁ドパミン神経系の起始核である腹側被蓋野には、抑制性 GABA 神経が投射しており、ドパミン神経系を抑制的に調節している。オピオイドはこの GABA神経上に存在するµオピオイド受容体に作用して、抑制性GABA神経を抑制し、GABAの遊離を抑制する([[脱抑制]])。その結果、ドパミン神経系が活性化され、中脳辺縁系の投射先である側坐核においてドパミンが過剰に遊離し、精神依存が引き起こされると考えられている。 | モルヒネは中脳辺縁系の細胞体が存在する腹側被蓋野に高密度に分布するµオピオイド受容体を介し、[[介在ニューロン]]である抑制性の γ-アミノ酪酸 (GABA) 神経系を抑制して、中脳辺縁ドパミン神経系の活性化を引き起こす。活性化された中脳辺縁ドパミン神経系は、その投射先である側坐核からドパミンの著明な遊離を引き起こし、これがオピオイドによる多幸感発現や精神依存形成の引き金になっていると考えられている。中脳辺縁ドパミン神経系の起始核である腹側被蓋野には、抑制性 GABA 神経が投射しており、ドパミン神経系を抑制的に調節している。オピオイドはこの GABA神経上に存在するµオピオイド受容体に作用して、抑制性GABA神経を抑制し、GABAの遊離を抑制する([[脱抑制]])。その結果、ドパミン神経系が活性化され、中脳辺縁系の投射先である側坐核においてドパミンが過剰に遊離し、精神依存が引き起こされると考えられている。 | ||
また、側坐核ではダイノルフィン神経系がκオピオイド受容体を介してドパミンの遊離を抑制的に制御している。炎症性疼痛下では側坐核においてκオピオイド受容体の機能亢進が引き起こされることにより、オピオイドによるドパミン遊離量増加が抑制される。また、神経障害性疼痛下では、脊髄からの持続的な疼痛刺激により、腹側被蓋野においてβ-エンドルフィンが持続的に遊離され、GABA 神経上におけるμオピオイド受容体の機能低下が誘導される。その結果、ドパミン神経系の活性化が引き起こされにくくなり、オピオイドによるドパミン遊離量増加が抑制される。このような一連の変化により、炎症性疼痛および神経障害性疼痛下では、モルヒネの精神依存が形成されにくいと考えられる<ref name="ref14"><pubmed>20471111</pubmed></ref> | また、側坐核ではダイノルフィン神経系がκオピオイド受容体を介してドパミンの遊離を抑制的に制御している。炎症性疼痛下では側坐核においてκオピオイド受容体の機能亢進が引き起こされることにより、オピオイドによるドパミン遊離量増加が抑制される。また、神経障害性疼痛下では、脊髄からの持続的な疼痛刺激により、腹側被蓋野においてβ-エンドルフィンが持続的に遊離され、GABA 神経上におけるμオピオイド受容体の機能低下が誘導される。その結果、ドパミン神経系の活性化が引き起こされにくくなり、オピオイドによるドパミン遊離量増加が抑制される。このような一連の変化により、炎症性疼痛および神経障害性疼痛下では、モルヒネの精神依存が形成されにくいと考えられる<ref name="ref14"><pubmed>20471111</pubmed></ref>。一方、オピオイドの過量投与や痛みがないときにオピオイドを投与すると精神依存が誘発されるので、適量のオピオイドの適切な使用が強く求められている。 | ||
==== 身体的依存 ==== | ==== 身体的依存 ==== | ||
| 229行目: | 231行目: | ||
==== 便秘 ==== | ==== 便秘 ==== | ||
便秘は、オピオイドの副作用の中でもっとも頻度の高い症状である<ref name="ref15"><pubmed>21269005</pubmed></ref> | 便秘は、オピオイドの副作用の中でもっとも頻度の高い症状である<ref name="ref15"><pubmed>21269005</pubmed></ref>。便秘は主にμオピオイド受容体を介した、腸管神経叢での[[アセチルコリン]]遊離抑制と腸管でのセロトニン遊離作用による。オピオイドによる便秘はほとんど耐性を生じず、継続使用によりほぼ100%が便秘となる。したがって、オピオイドを投与後、便秘が生じてから[[wj:緩下薬|緩下薬]]を投与するのではなく、オピオイド投与と同時に予防的に定期投与する必要がある。末梢µオピオイド受容体拮抗薬は、腸管のµオピオイド受容体に直接に結合し、鎮痛作用を減弱させることなく便秘症状を緩和する。 | ||
==== 眠気・傾眠 ==== | ==== 眠気・傾眠 ==== | ||
| 238行目: | 240行目: | ||
==== せん妄 ==== | ==== せん妄 ==== | ||
オピオイド投与により[[せん妄]] | オピオイド投与により[[せん妄]]が引き起こされることが知られている。しかし、オピオイドの投与期間や投与量とは必ずしも直結するわけではなく、その発現機序は不明である。せん妄対策の原則としては減量であるが、疼痛出現のために減量が困難である場合があることが多い。 | ||
==関連項目== | ==関連項目== | ||
2021年6月18日 (金) 15:43時点における版
酒井 寛泰、成田 年
星薬科大学 薬学部 薬学科
DOI:10.14931/bsd.3553 原稿受付日:2013年3月26日 原稿完成日:2013年4月30日 全面改訂:2021年6月18日
担当編集委員:加藤 忠史(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:narcotics 独:Suchtstoff 仏:narcotique
麻薬とは、法律で規制された薬物を指す定義と薬理学な定義がある。さらに麻薬は、使用目的によって2つに分類される。1つは有効性/安全性が確認され国が承認した合成あるいは天然の薬物であり、医師が必要に応じて処方できる医療用麻薬である。代表的な医薬品として鎮痛薬であるモルヒネ等がある。もう1つは違法に取引されている化学物質や薬物である。一時的な快楽のため不正に使用されることがあり、乱用や依存の危険性が高いために、医療用としての使用も許可されていない。代表的な不正麻薬としてコカイン、ヘロイン、3,4-メチレンジオキシメタンフェタミン (MDMA)、リゼルギン酸ジエチルアミド (LSD) 等がある。
歴史
歴史上、麻薬という言葉は、あへん剤のことを指していた。あへん剤とは、モルヒネ、ヘロイン、コデインなど、けしの実から抽出されるアルカロイドを合成した薬剤のことである。昏迷状態を引き起こす中枢抑制薬であり、酩酊・多幸感などをもたらす一方、強力な依存性があり、身体は急速に耐性を形成する。その依存性の強さから、麻薬の製造や流通は法律で厳しく規制されている。
歴史をたどると紀元前に遡り、メソポタミア文明から、けしの栽培、あへんの精製が行われていた。ギリシャ神話においてもけしの記載があり、ローマ時代には頭痛、難聴、痙攣、喘息、咳、疝痛、発熱、メランコリーの治療ならびに贅沢品としてあへんが使用され、中世には、手術の際の鎮痛薬として使用された記載がイタリアの文献にある。
中国では、大麻が成分とされる「麻沸散」と呼ばれる麻酔薬を使って腹部切開手術を行った記載が三国志にある。さらに「本草綱目」(1892種の本草(生薬)について薬効などを詳しく記述されている文献)では阿片を主薬とする「一粒金丹」という製剤の記載があり、万能薬として用いられた。日本では、1804 年に華岡青洲が麻沸散(別名:通仙散)による全身麻酔下で乳癌摘出手術に成功したといわれている。1803 年にドイツの薬剤師であるSertürner があへんからモルヒネの単離にはじめて成功した。
このように、人類は紀元前よりオピオイドの鎮痛作用や陶酔作用といった効果を知っていたが、その薬理作用の仕組みが理解されるようになったのは20世紀後半からである。研究者達はなぜ植物由来の成分が動物や人間の生体内でこれほど強い効果を引き出すことができるのかという素朴な疑問を持ち続け、それは次第に “モルヒネ感受性受容体の存在” という概念にたどり着いた。1971 年、Goldstein はオピオイド受容体の発見の基になる報告をし[1]、1973 年にそれぞれ、SnyderとPert[2]、Simon[3]、Terenius[4]の3つのグループからオピオイド受容体の存在が提唱され、広く研究者の間で受け入れられるようになった。1975 年にはHughesとKosterlitzら[5]がエンケファリンを発見し、さらに、1979 年にGoldsteinとTachibanaら[6]がダイノルフィンを抽出し、生体内に存在するモルヒネ様物質、いわゆる“内因性オピオイド”が発見された。
オピオイド受容体はμ、δおよびκに大別され、これら3種のオピオイド受容体の研究がもっとも盛んに行われてきた。オピオイド受容体遺伝子のクロ−ニングは他の受容体と比べて遅く、1992 年になってEvansらとKiefferらのグループがそれぞれ、δ受容体のクロ−ニングに成功した[7] [8]。δ受容体のクロ−ニング後、PCR法によるホモロジーを利用した研究によってμおよびκ受容体のクロ−ニングの成功が相次いで報告された。
不正薬物
「覚醒剤取締法」、「大麻取締法」、「麻薬及び向精神薬取締法」、「あへん法」等により法律で厳しく規制されている薬物である(図1)[9]。
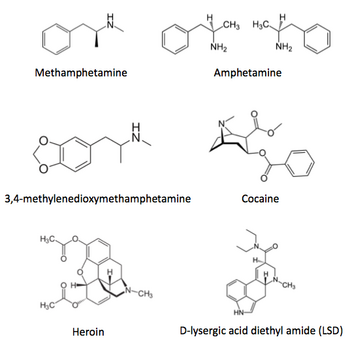
覚醒剤
「覚醒剤取締法」では、一般名メタンフェタミン、アンフェタミン及びその塩類並びにこれらを含有する物を「覚醒剤」として規制の対象としている。覚醒剤は、主に麻黄(マオウ)という植物から抽出されたエフェドリン等を原料として、化学的に合成して製造され、形状は主に白色の粉末や無色透明の結晶で、無臭でやや苦みがある。覚醒剤には、中枢神経を興奮させる作用があり、乱用すると眠気や疲労感がなくなり、頭が冴えたような感じになる。しかし、そのような効果は数時間で切れ、その後は激しい脱力感、疲労感、倦怠感に襲われる。
覚醒剤は、特に依存性が強く、乱用を続けると、「覚醒剤精神病」の状態になり、幻覚や妄想が現れるほか、時には錯乱状態になって、発作的に他人に暴行を加えたり、殺害したりすることがある。このような症状は、乱用を止めても長期間にわたって残る危険性がある。また、大量の覚醒剤を摂取すると、急性中毒により、全身けいれんを起こし、意識を失い、最後には脳出血で死亡することもある。
大麻
大麻とは、アサ科の1年草である大麻草とその製品をいい、「大麻取締法」で規制されている。大麻を乱用すると一般的には、心拍数の増加、結膜の充血、口の渇き、吐き気、めまい、筋力の低下、平衡感覚の障害などの身体症状が現れる。精神症状としては、気分が快活、陽気になり、よくしゃべるようになると言われているが、その一方で視覚、聴覚、味覚、触覚等の感覚が過敏になり、変調をきたしたり、現在、過去、未来の観念が混乱して思考が分裂し、感情が不安定になる。このため、興奮状態に陥って暴力や挑発的な行為を行うことがあり、さらには幻覚や[[妄想等に襲われるようになる。これらの症状は、「大麻精神病」といわれる。また、無気力になり何もやる気のない状態となる「無動機症候」に陥ることもある。初めての乱用で大量の大麻を摂取すると、意識障害を伴う中毒性精神病の状態になることがある。大麻の常用は、生殖機能に支障を来し、不妊、流産、胎児の死亡、染色体異常の原因となる可能性も知られている。
MDMA/MDA
MDMA (3,4-メチレンジオキシメタンフェタミン, 3,4-methylene-dioxymethamphetamine)、MDA (3,4-メチレンジオキシアンフェタミン, 3,4-Methylene-dioxyamphetamine) は、覚醒剤と似た化学構造を有する薬物で、けしやコカ等の植物からではなく、他の化学薬品から合成された麻薬の一種で、「麻薬及び向精神薬取締法」で麻薬として規制されている。MDMAとMDAの薬理作用は類似しており、視覚、聴覚を変化させる作用があるが、その反面、不安や不眠などに悩まされる場合もある。また、強い精神的依存性があり、乱用を続けると錯乱状態に陥ることがあるほか、腎・肝機能障害や記憶障害等の症状も現れることがある。
コカイン
コカインは、南米産のコカの木の葉を原料とした薬物で、無色の結晶又は白色の結晶性粉末で、無臭で苦みがあり、「麻薬及び向精神薬取締法」で麻薬として規制されている。コカインは、鼻粘膜からの吸引のほか、経口による方法で乱用されている。コカインには、覚醒剤と同様に中枢神経を興奮させる作用があるため、気分が高揚し、眠気や疲労感の脱却から体が軽く感じられ、腕力、知力がついたという錯覚が起こる。しかし、覚醒剤に比べて、その効果の持続時間が 30 分程度と短いため、精神的依存が形成されると、一日に何度も乱用するようになる。乱用を続けると、幻覚等の症状が現れ、“誰かに狙われている”、“警察に尾行されている”という強烈な不安に襲われる。これらの症状は、「コカイン精神病」と呼ばれている。
ヘロイン
ヘロインは、けしを原料とした薬物で、けしの実からあへんを採取し、複数の工程を経て精製され、「麻薬及び向精神薬取締法」で麻薬として取り扱いを厳しく規制されている。 ヘロインは、静脈注射のほか、火であぶって煙を吸う方法、吸引具により吸引する方法、経口による方法で乱用されている。ヘロインには神経を抑制する作用があり、乱用すると強い陶酔感を覚えることから、このような快感が忘れられず、乱用を繰り返すようになり、強い精神的依存が形成される。さらに、強い身体的依存も形成され、2~3時間ごとに摂取しないと、体中の筋肉や関節に激痛が走り、骨がバラバラになって飛散するかと思うほどの痛み、悪寒、嘔吐、失神などの激しい禁断症状に苦しむことになる。ショック状態に陥ると、昏睡状態から呼吸停止、死に至る場合もある。
あへん
あへんは、けしから採取した液汁を自然に凝固させたもの及びこれに加工を施したもの(医薬品としての加工を施したものを除く。) で、黒褐色で特殊な臭気(アンモニア臭)と苦味がある。原料である、けしの栽培やあへんの採取、あへん及びけしがら(けしの麻薬を抽出することができる部分)の輸出入、所持等は「あへん法」により規制されている。あへんは、調整したあへん煙膏として特殊なキセルに塗って炎にかざし、出てきた煙を吸引する方法や、経口による方法で乱用される。あへんには中枢神経を抑制する作用があり、乱用すると強い陶酔感を覚え、精神的、身体的依存性を生じやすく、急性中毒では、呼吸抑制、縮瞳、チアノーゼ状態となり、昏睡から呼吸麻痺の結果、死に至る。常用により慢性中毒症状を起こし、脱力感、倦怠感を感じるようになり、やがては精神錯乱を伴う衰弱状態に至る。
LSD
LSD(化学名:リゼルギン酸ジエチルアミド; lysergic acid diethylamide) は、合成麻薬の一種で、「麻薬及び向精神薬取締法」の規制の対象とされ、水溶液をしみこませた紙片、錠剤、カプセル、ゼラチン等があり、経口又は飲み物とともに飲むなどして乱用されている。LSD を乱用すると、幻視、幻聴、時間の感覚の欠如などの強烈な幻覚作用が現れる。特に幻視作用が強く、ほんのわずかな量だけで物の形が変形、巨大化して見えたり、色とりどりの光が見えたりする状態が 8~12 時間続く。また、乱用を続けると、長期にわたって神経障害を来す。
医療用麻薬-オピオイド
オピウム (opium)は日本語であへんのことであり、けしの果実から抽出される。元来、鎮痛薬として使用されてきたが19世紀に入るとその嗜好性、習慣性から医薬用外で大流行したため、鎮痛作用や鎮咳作用よりも「麻薬」という悪いイメージだけが残ってしまっていた。しかし、あへんからのモルヒネの単離精製に成功したことで、モルヒネ様作用をもつ薬剤の研究開発が進み、モルヒネやコデインといったあへんからの精製物をオピウム、半合成誘導体をオピエート (opiate)、あへん様合成薬剤をオピオイド (opioid)と呼び分けた。
現在では、「オピオイド」 と言う呼び名は、中枢神経や末梢神経に存在する特異的受容体(オピオイド受容体)への結合を介して作用を発現するモルヒネに類似する作用を持つ物質の総称として使われ、植物由来の天然のオピオイド、合成・半合成のオピオイド、体内で産生される内因性オピオイド(エンケファリン、ダイノルフィン、β-エンドルフィン)などの分類が一般的となっている。医療用麻薬はオピオイドと位置づけられるが、オピオイドではない医療用麻薬もある。
ケタミンはオピオイドではない医療用麻薬である(2007年1月1日から麻薬指定)。従って、ケタミンは麻薬性非オピオイド鎮痛薬に分類される。
種類
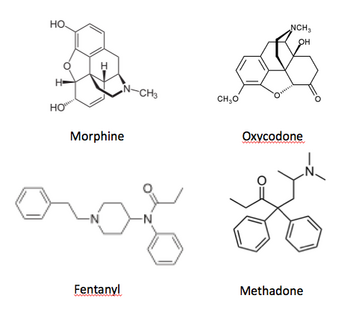
本邦にて臨床で汎用されるオピオイドにはモルヒネ、オキシコドン、フェンタニル、レミフェンタニル、ヒドロモルフォン、メサドン、トラマドール(非麻薬)、タペンタドール、コデイン、ペンタゾシン (非麻薬)、ブプレノルフィン (非麻薬)などがある (図2)。μ、δおよびκの3つのタイプのオピオイド受容体に対する親和性および鎮痛効果 (potency) は個々の薬物によって異なる (表)。
| 種類 | 薬物名 | オピオイド受容体 | 備考 | ||
|---|---|---|---|---|---|
| μ | δ | κ | |||
| 強オピオイド鎮痛薬 | モルヒネ | +++ | + | + | アヘンアルカロイド |
| フェンタニル | +++ | 合成麻薬 | |||
| レミフェンタニル | +++ | 合成麻薬 | |||
| オキシコドン | +++ | 半合成麻薬 | |||
| メサドン | +++ | 合成麻薬 | |||
| タペンタドール | ++ | SSRI様作用を併せ持つ | |||
| メペリジン | ++ | 合成麻薬 | |||
| コデイン | ++ | アヘン アルカロイド | |||
| トラマドール | ++ | (+) | SNRI様作用を併せ持つ | ||
| ブプレノルフィン | + (++) |
+ (++) |
麻薬拮抗性 鎮痛薬 | ||
| ペンタゾシン | + (++) |
++ (+) |
麻薬拮抗性 鎮痛薬 | ||
+++: 強 agonist、 ++: 弱 agonist、 +: 部分 agonist ( ) 可能性
SSRI: 選択的セロトニン再取り込み阻害薬、SNRI: セロトニン・ノルアドレナリン再取り込み阻害薬
モルヒネ
モルヒネは数ある強オピオイドのなかでもっとも歴史が古く、もっとも研究されている薬物で、すべてのオピオイドの原点であり基本となる。剤形も多く、内服薬、坐剤、注射薬があり投与経路の変更なども同一薬剤で行いやすい。このモルヒネがあへんに代わって広く使われるようになったのは20世紀に入ってからであるが、依存性の問題などから長い間「危険な薬」として考えられてきた。
しかし、1986年に世界保健機関 (WHO)ががん疼痛治療の成績向上を目指して作成されたモルヒネを主軸とした「WHO方式がん疼痛治療法」を普及するために、「がんの痛みからの解放」の第1版を発表した。そのため、モルヒネはがんの痛みに積極的に使用すべき有効でかつ、安全な医薬品であると提唱された。臨床において広く使われるようになった一方で、眠気や便秘、悪心・嘔吐などの副作用が臨床上問題となっている。
オキシコドン
オキシコドンは、あへんに含まれるアルカロイドのテバインから合成される半合成テバイン誘導体であり、強オピオイドに分類される。体内に入ると代謝酵素であるCYP2D6によりオキシモルフォンへ、CYP3A4によりノルオキシコドン(非活性)へとそれぞれ代謝される。オキシモルフォンは活性代謝産物であり、その鎮痛効果はオキシコドンより強力であるが、AUC(Area Under the Curve; 時間曲線下面積、血漿中の薬物濃度の変化を時間の関数として表す曲線の定積分)はオキシコドンの約1%程度と低いため、臨床上問題とはならない。また、ノルオキシコドンは薬理活性がほとんどない。したがってオキシコドンの代謝物の影響はほとんどないと考えられる。薬理学的評価における臨床所見はオキシコドンの血中濃度と相関し、鎮痛作用はオキシコドンそのものによってもたらされる[10]。
フェンタニル
フェンタニルは1959年にモルヒネ系薬物とは化学構造の異なる4-アニリドピペリジン (4-anilidopiperidine)系鎮痛薬として合成された合成麻薬であり、強オピオイドである。フェンタニルの効果は、モルヒネまたはペチジンと比較すると極めて強力な鎮痛作用を有する。また、フェンタニルの安全域はモルヒネやペチジンに比べて大きいのも特徴である。静脈内投与した場合、フェンタニルの鎮痛作用はモルヒネの約50~100 倍である。
また、フェンタニルは、経皮、皮下、口腔粘膜、静脈内、硬膜外、くも膜下腔内と多くの投与経路を持つ。 静脈内投与したフェンタニルが最大鎮痛効果に達する時間は約5分とモルヒネや他のオピオイドと比較して速効性がある。脂溶性が高く比較的分子量が小さいため、皮膚吸収が良好であり、貼付剤としても頻用されている。フェンタニルは肝臓でCYP3A4によってN-脱アルキル化と水酸化によって代謝を受け、ほとんど薬理学的活性のない代謝産物ノルフェンタニルとなり、大部分が尿中に排泄される。活性代謝産物がほとんどないため、腎機能の悪化した患者でも蓄積作用による悪影響を及ぼしにくいとされている。
レミフェンタニル
レミフェンタニルは、超短時間作用型の合成オピオイドであり、フェンタニルと同様、μ-オピオイド受容体に対する選択性が非常に高い。作用発現時間が数分と非常に速くかつ非特異的エステラーゼにより速やかに代謝されるため血中半減期も 3〜10 分と非常に短い。長時間投与後の蓄積性がなく、持続静注が可能なため、術中および術後鎮痛の目的で使用される。
ヒドロモルフォン
ヒドロモルフォンは、日本では、2017 年に経口の徐放製剤および即放製剤が、2018 年に注射製剤が承認されたが、海外においては昔から販売されている麻薬性鎮痛剤であり、WHO のがん疼痛治療のためのガイドライン等において疼痛管理の標準薬に位置付けられている。化学構造的にはモルヒネとわずかに異なる構造を持つが、モルヒネよりも強力な効果を示し、従来のオピオイドとは異なる。また、ヒドロモルフォンは主にグルクロン酸抱合によりヒドロモルフォン-3-グルクロニドに代謝されるが、この代謝物は活性が非常に低いため腎臓への影響が少なく、腎機能が低下した患者でも使用できる。
メサドン
メサドンは、合成ジフェニルヘプタン誘導体の強オピオイドであり、モルヒネ、オキシコドン、フェンタニル等の強オピオイドでは治療困難な疼痛を伴う各種がん疼痛患者に対して使用が可能となっている。また、NMDA型グルタミン酸受容体拮抗作用、セロトニン・ノルアドレナリン再取り込み作用により神経障害性疼痛にも有用である可能性も示唆されている。一方、他のオピオイドに比べ、呼吸抑制および 心電図上QT延長の副作用が多いと考えられている。本邦においてその処方開始にあたっては、「がん疼痛の治療に精通し、メサドンのリスク等について十分な知識をもつ医師のもとで、適切と判断された症例にのみ投与されること」などのいくつかの制限が設定されている。
トラマドール
トラマドール (非麻薬性オピオイド)自体はμ-オピオイド受容体に対する親和性は低いが、代謝物のモノ-O-脱メチル化体 (O-デスメチルトラマゾール, M1) が高い親和性を有し、トラマドールの鎮痛作用に寄与している。こうした背景から、トラマドールは、非麻薬性のオピオイドに分類される。また、セロトニンおよびノルアドレナリン再取り込み阻害作用を併せ持つため、その相乗効果により鎮痛作用を発揮すると考えられている。トラマドール自体は精神依存ならびに鎮痛耐性を形成しにくく、セロトニンおよびノルアドレナリン再取り込み阻害作用も有することから、非がん性の慢性疼痛やオピオイド抵抗性を示すような神経障害性疼痛への有効性も期待されている。
タペンタドール
タペンタドールは、トラマドールのμ-オピオイド受容体活性とノルアドレナリン再取り込み阻害作用を持ち合わせ、セロトニン再取り込み阻害作用はほとんど有さない強オピオイド鎮痛薬である。μオピオイド受容体作動活性は他の強オピオイドに比べやや弱いものの、ノルアドレナリン再取り込み阻害作用を併せ持つため、侵害受容性疼痛だけでなく、神経障害性疼痛への効果も期待されている。
さらに、モルヒネやオキシコドンに比べて便秘、悪心・嘔吐などの消化器症状の副作用が少ないことが報告されている。また、タペンタドールは、主に肝臓でグルクロン酸抱合により非活性代謝物に代謝された後にほとんどが排泄されることから、腎障害時においてもモルヒネ、オキシコドン、トラマドールと比べて安全に使用できる上に、シトクロムP450 (CYP)による代謝をほとんど受けないため薬物相互作用が少ない。
コデイン
コデイン自体のμ-オピオイド受容体に対する親和性はモルヒネに比べて低く、約10%が肝臓でCYP2D6により O-脱メチル化されてモルヒネとなることで鎮痛作用を発揮する。一方、コデインは強力な鎮咳作用を有するため中枢性鎮咳薬としてもよく用いられる。
ペンタゾシン
ペンタゾシン (麻薬拮抗性鎮痛薬; µオピオイド受容体部分作動薬、非麻薬であり第2種向精神薬)は κオピオイド受容体に対しては作動薬として作用すると考えられているが、µオピオイド受容体に対しては部分作動薬として作用するため、麻薬拮抗性鎮痛薬とも呼ばれる。その鎮痛作用は、主に µオピオイド受容体を介して発現するが、一部は κオピオイド受容体も介している可能性がある。µオピオイド受容体に対しての部分作動薬としての性質から、鎮痛作用においては有効限界 (天井効果) を有し、また、モルヒネなどの完全作動薬からの切り替え時に退薬症候を誘発する可能性がある。
ブプレノルフィン
ププレノルフィン(麻薬拮抗性鎮痛薬; µオピオイド受容体部分作動薬、非麻薬であり第2種向精神薬)は、μオピオイド受容体に対してほぼ不可逆的に結合性を有する部分作動薬であり、κオピオイド受容体に対しても部分作動薬として作用するため、麻薬拮抗性鎮痛薬とも呼ばれる。低用量から強い鎮痛効力を持つが、天井効果を有する。両オピオイド受容体に対して高親和性を有し、受容体からの解離が遅いため、長時間の作用を示す。注射剤および坐剤、テープ剤が用いられる。
対象疾患
手術中の痛み、術後痛、外傷痛、がん疼痛、神経障害性疼痛などに見られる、長期間続く慢性痛に対して鎮痛薬として用いられている。
鎮痛効果発現機序

μオピオイド受容体、δオピオイド受容体およびκオピオイド受容体は、すべてGTP結合タンパク質(Gタンパク質)と共役する7回膜貫通型受容体(GPCR)である。これらオピオイド受容体タイプ間の相同性は高く(全体で約60%)、特に細胞膜貫通領域では非常に高い。いずれの受容体も基本的にGi/oタンパク質と共役しており、オピオイド受容体の活性化後、さまざまな細胞内情報伝達系が影響を受け、神経伝達物質の遊離や神経細胞体の興奮性が低下するために神経細胞の活動が抑制される。
これらの中で鎮痛作用に関して最も重要な役割を果たすのが µオピオイド受容体である。μオピオイド受容体を介する鎮痛効果発現機序には下記の3つの経路が知られている(図3)。
一次知覚神経からの痛覚伝達の抑制
µオピオイド受容体作動薬は、脊髄後角に存在するµオピオイド受容体を介して一次知覚神経末端からの痛覚伝達物質の遊離を抑制する(前膜抑制)。また、µオピオイド受容体の活性化によって脊髄後角神経が直接抑制され(後膜抑制)、痛覚伝達が遮断される。
下行性抑制系の賦活
μオピオイド受容体作動薬は、中脳や延髄領域に存在するµオピオイド受容体を介して下行性抑制系であるセロトニンおよびノルアドレナリン神経系などを賦活し、脊髄での痛覚伝導を遮断して鎮痛効果を発現する。µオピオイド受容体作動薬は、中脳水道周囲灰白質 (PAG) 、縫線核 (背側縫線核 (DR) や大縫線核 (NRM) など) 、吻側延髄内腹側部 (RVM)、青斑核 (LC) において、主として GABA神経上に存在するµオピオイド受容体を活性化することで、GABA神経を抑制し、GABAの遊離を抑制 (脱抑制) することによって、これらの領域を起始核とした下行性の神経系を活性化する(下行性痛覚抑制系の賦活化)。脊髄後角に投射しているこれらの下行性の神経系は、一次知覚神経から痛覚伝達物質の遊離を抑制する。また、これらの神経系は、脊髄後角の後膜を直接抑制して痛覚伝達を遮断すると考えられている。
視床中継核/視床下部/大脳知覚領における痛覚伝達や痛覚発現の抑制
視床中継核/視床下部/大脳知覚領に存在するµオピオイド受容体作動薬は、二次/三次知覚神経を介する痛覚の伝導路 (主に視床脊髄路) において、脳内 (主に視床) のµオピオイド受容体を活性化することで、大脳皮質の体性感覚野や帯状回領域への痛覚伝達を遮断する。
麻薬拮抗薬 (µ受容体拮抗薬)
ナロキソン
µオピオイド受容体に対して結合するが、鎮痛効果などの内活性を全く示さない拮抗薬である。高用量においてδおよびκオピオイド受容体に対しても拮抗作用を示すことが知られている。臨床においては、ナロキソンは、モルヒネやフェンタニルなどのμオピオイド受容体作動薬による呼吸抑制などの急性中毒を解除する目的で使用される。
ナルデメジン
ナルデメジンは、オピオイド誘発性便秘症 (opioid-induced constipation: OIC) の治療薬として、2017年に承認された末梢性µオピオイド受容体拮抗薬である。多くのオピオイド鎮痛薬は、脊髄や脳内に存在する中枢のµオピオイド受容体に作用し、強い鎮痛効果を示すが、腸管に存在する末梢のμオピオイド受容体にも作用することで強い便秘症状を引き起こす。ナルデメジンは、血液脳関門を通過しにくいので、主に末梢のμオピオイド受容体に結合し、強オピオイドの鎮痛作用を減弱させることなく便秘症状を緩和する。
がん疼痛におけるオピオイド投与の有効性
近年、「がんの患者に早期から疼痛緩和ケアを導入すると、生存期間が延長する」という注目すべき研究結果が発表された[11]。がん疼痛は、がんによる知覚神経終末の刺激を伴う侵害受容性疼痛とがんによる神経の圧迫や浸潤に伴って引き起こされる神経障害性疼痛に大別され、それらが複合的に生じる。がん性疼痛治療のなかでオピオイドはもっとも重要な薬剤であり、他の鎮痛薬と同じように「痛み」に対して使用を躊躇することがあってはならない。がん疼痛の治療にあたっては、基本的にWHOの三段階がん疼痛治療指針に従って行うべきである。WHOの三段階がん疼痛治療指針は、痛みの強さによって選択するという原則があることを忘れてはならない。がん疼痛の治療にあたっては、痛みの強さや治療による痛みの消長について患者が感じていることに積極的に耳を傾けることが重要である。患者の訴えと医療側の考えに大きな差があるときは、処方内容をどう改訂したかを患者に知らせ、その結果の除痛状態を必ず患者に聞くことを心がける。
一方、このがん疼痛の約30%に認められる神経障害性疼痛は、モルヒネをはじめとするオピオイド鎮痛薬が効きにくいことが多く、臨床上問題となる。一方、モルヒネは神経障害性疼痛下においても、脊髄腔内投与では十分な鎮痛効果をもたらす可能性が高い。
依存性
オピオイドには慢性投与により精神・身体依存ならびに耐性が生じるが、痛みが生じている時には形成されにくい。
精神依存
脳内のドパミン神経系には、黒質-線条体系と腹側被蓋野から側坐核に投射している中脳辺縁系などがある。このうち、情動や陶酔感の発現には中脳辺縁系のドパミン神経が関与していることが明らかにされている。
モルヒネは中脳辺縁系の細胞体が存在する腹側被蓋野に高密度に分布するµオピオイド受容体を介し、介在ニューロンである抑制性の γ-アミノ酪酸 (GABA) 神経系を抑制して、中脳辺縁ドパミン神経系の活性化を引き起こす。活性化された中脳辺縁ドパミン神経系は、その投射先である側坐核からドパミンの著明な遊離を引き起こし、これがオピオイドによる多幸感発現や精神依存形成の引き金になっていると考えられている。中脳辺縁ドパミン神経系の起始核である腹側被蓋野には、抑制性 GABA 神経が投射しており、ドパミン神経系を抑制的に調節している。オピオイドはこの GABA神経上に存在するµオピオイド受容体に作用して、抑制性GABA神経を抑制し、GABAの遊離を抑制する(脱抑制)。その結果、ドパミン神経系が活性化され、中脳辺縁系の投射先である側坐核においてドパミンが過剰に遊離し、精神依存が引き起こされると考えられている。
また、側坐核ではダイノルフィン神経系がκオピオイド受容体を介してドパミンの遊離を抑制的に制御している。炎症性疼痛下では側坐核においてκオピオイド受容体の機能亢進が引き起こされることにより、オピオイドによるドパミン遊離量増加が抑制される。また、神経障害性疼痛下では、脊髄からの持続的な疼痛刺激により、腹側被蓋野においてβ-エンドルフィンが持続的に遊離され、GABA 神経上におけるμオピオイド受容体の機能低下が誘導される。その結果、ドパミン神経系の活性化が引き起こされにくくなり、オピオイドによるドパミン遊離量増加が抑制される。このような一連の変化により、炎症性疼痛および神経障害性疼痛下では、モルヒネの精神依存が形成されにくいと考えられる[12]。一方、オピオイドの過量投与や痛みがないときにオピオイドを投与すると精神依存が誘発されるので、適量のオピオイドの適切な使用が強く求められている。
身体的依存
投与中止によって退薬症候(発熱、下痢、散瞳、不安等)を誘発することがある。海外においては、オピオイド依存症患者に対してメサドン代替療法を行う。麻薬拮抗薬は禁断症状を誘発してしまう。オピオイドを急激に減量すると、青斑核から大脳皮質に投射しているノルアドナリン神経の抑制が解除され、興奮して大脳皮質領域でノルアドレナリンの遊離が引き起こされる。これが受容体を過剰に刺激して、退薬症候が起こると考えられている。
耐性
薬物の慢性適用によって、単回投与と同程度の効果を得るために、大量の薬物を必要とする現象をさす。オピオイドは慢性投与によって鎮痛効果の減弱(鎮痛耐性)が引き起こされるが、痛みがあるときは、オピオイドの鎮痛耐性は生じにくいとされている。一般に、耐性を生じやすいオピオイドの薬理作用と、そうでない作用がある。
副作用
嘔気・嘔吐
延髄第四脳室底にある化学受容器引き金帯(CTZ)にはドパミン受容体が存在する。オピオイドはこの受容体を活性化させ(おそらくドパミン遊離作用による間接的修飾)、化学受容器引き金帯を直接刺激し、その刺激が延髄にある嘔吐中枢(VC)に伝わり、嘔気・嘔吐を起こす。また、前庭器を刺激して過敏にさせ、これが 化学受容器引き金帯を間接的に刺激し、嘔吐中枢 に伝達されて嘔気・嘔吐を起こす。さらに、オピオイドが胃前庭部を緊張させるため、その運動性が低下して胃内容物の停留が起こる。この停留による胃内圧増大が求心性神経を介して 化学受容器引き金帯、嘔吐中枢を刺激し、嘔気・嘔吐を起こす。
便秘
便秘は、オピオイドの副作用の中でもっとも頻度の高い症状である[13]。便秘は主にμオピオイド受容体を介した、腸管神経叢でのアセチルコリン遊離抑制と腸管でのセロトニン遊離作用による。オピオイドによる便秘はほとんど耐性を生じず、継続使用によりほぼ100%が便秘となる。したがって、オピオイドを投与後、便秘が生じてから緩下薬を投与するのではなく、オピオイド投与と同時に予防的に定期投与する必要がある。末梢µオピオイド受容体拮抗薬は、腸管のµオピオイド受容体に直接に結合し、鎮痛作用を減弱させることなく便秘症状を緩和する。
眠気・傾眠
眠気はオピオイド投与初期や増量時に発現するが、耐性がつきやすい。通常軽い刺激ですぐに覚醒し、平常通り会話が可能である。見当識障害や意識混濁は伴わない。減量により軽減することが多い。
呼吸抑制作用
主として脳幹の延髄呼吸中枢に作用し、二酸化炭素の蓄積に対する呼吸反応を直接抑制する。CO2に対する感受性の低下、ならびにチェーン・ストークス呼吸を起こす。また、延髄・橋の全般的な抑制により、包括的に呼吸リズムや呼吸中枢の応答性を低下させる。呼吸抑制はオピオイドによる急性毒性の死因となり µオピオイド受容体拮抗薬であるナロキソンが解毒薬となる。
せん妄
オピオイド投与によりせん妄が引き起こされることが知られている。しかし、オピオイドの投与期間や投与量とは必ずしも直結するわけではなく、その発現機序は不明である。せん妄対策の原則としては減量であるが、疼痛出現のために減量が困難である場合があることが多い。
関連項目
参考文献
- ↑
Goldstein, A., Lowney, L.I., & Pal, B.K. (1971).
Stereospecific and nonspecific interactions of the morphine congener levorphanol in subcellular fractions of mouse brain. Proceedings of the National Academy of Sciences of the United States of America, 68(8), 1742-7. [PubMed:5288759] [PMC] [WorldCat] [DOI] - ↑
Pert, C.B., & Snyder, S.H. (1973).
Opiate receptor: demonstration in nervous tissue. Science (New York, N.Y.), 179(4077), 1011-4. [PubMed:4687585] [WorldCat] [DOI] - ↑
Simon, E.J. (1973).
In search of the opiate receptor. The American journal of the medical sciences, 266(3), 160-8. [PubMed:4583407] [WorldCat] [DOI] - ↑
Terenius, L. (1973).
Characteristics of the "receptor" for narcotic analgesics in synaptic plasma membrane fraction from rat brain. Acta pharmacologica et toxicologica, 33(5), 377-84. [PubMed:4801083] [WorldCat] [DOI] - ↑
Hughes, J., Smith, T.W., Kosterlitz, H.W., Fothergill, L.A., Morgan, B.A., & Morris, H.R. (1975).
Identification of two related pentapeptides from the brain with potent opiate agonist activity. Nature, 258(5536), 577-80. [PubMed:1207728] [WorldCat] [DOI] - ↑
Goldstein, A., Tachibana, S., Lowney, L.I., Hunkapiller, M., & Hood, L. (1979).
Dynorphin-(1-13), an extraordinarily potent opioid peptide. Proceedings of the National Academy of Sciences of the United States of America, 76(12), 6666-70. [PubMed:230519] [PMC] [WorldCat] [DOI] - ↑
Evans, C.J., Keith, D.E., Morrison, H., Magendzo, K., & Edwards, R.H. (1992).
Cloning of a delta opioid receptor by functional expression. Science (New York, N.Y.), 258(5090), 1952-5. [PubMed:1335167] [WorldCat] [DOI] - ↑
Kieffer, B.L., Befort, K., Gaveriaux-Ruff, C., & Hirth, C.G. (1992).
The delta-opioid receptor: isolation of a cDNA by expression cloning and pharmacological characterization. Proceedings of the National Academy of Sciences of the United States of America, 89(24), 12048-52. [PubMed:1334555] [PMC] [WorldCat] [DOI] - ↑ 厚生労働省 不正麻薬の取締り
- ↑
Seltzer, Z., Dubner, R., & Shir, Y. (1990).
A novel behavioral model of neuropathic pain disorders produced in rats by partial sciatic nerve injury. Pain, 43(2), 205-18. [PubMed:1982347] [WorldCat] [DOI] - ↑
Temel, J.S., Greer, J.A., Muzikansky, A., Gallagher, E.R., Admane, S., Jackson, V.A., ..., & Lynch, T.J. (2010).
Early palliative care for patients with metastatic non-small-cell lung cancer. The New England journal of medicine, 363(8), 733-42. [PubMed:20818875] [WorldCat] [DOI] - ↑
Niikura, K., Narita, M., Butelman, E.R., Kreek, M.J., & Suzuki, T. (2010).
Neuropathic and chronic pain stimuli downregulate central mu-opioid and dopaminergic transmission. Trends in pharmacological sciences, 31(7), 299-305. [PubMed:20471111] [WorldCat] [DOI] - ↑
Walters, J.B., & Montagnini, M. (2011).
Current concepts in the management of opioid-induced constipation. Journal of opioid management, 6(6), 435-44. [PubMed:21269005] [WorldCat]