「抗不安薬」の版間の差分
細 →常用量依存 |
細編集の要約なし |
||
| 7行目: | 7行目: | ||
英語名:anxiolytics | 英語名:anxiolytics | ||
{{box|text= | {{box|text= | ||
ベンゾジアゼピン(BZD)系薬と[[セロトニン]]系薬が治療の中心となっている。 | |||
ベンゾジアゼピン系薬は、GABA<sub>A</sub>受容体と複合体を形成するベンゾジアゼピン受容体に[[アゴニスト]]として作用する。種々の[[不安]]・[[焦燥]]・[[緊張]]を認める病態に効果をもたらす。ただ[[依存性]]が問題となるため、漫然と使用しないことが望ましく、日中の[[wikipedia:ja:|眠気]]・[[wikipedia:ja:|ふらつき]]、[[頭痛]]、[[wikipedia:ja:|脱力]]・[[wikipedia:ja:|倦怠感]]などの[[wikipedia:ja:|副作用]]が出現することもある。また服用後の[[健忘]]が認められ、過量摂取では呼吸抑制に働くこともあり、注射剤、特に[[wikipedia:ja:|静注]]の際は緩徐に投与する必要がある。使用によりかえって不安、緊張が高まり、興奮や攻撃性が増すこともごくまれにある。 | |||
セロトニン<sub>1A</sub>受容体部分作動薬は、ベンゾジアゼピン系薬のように全身に作用せず、不安に関与する大脳辺縁系の同受容体を刺激することで作用する。ベンゾジアゼピン系薬にみられる有害事象が少なく、長期投与や高齢者に相応しい。また重症筋無力症などベンゾジアゼピン系薬が禁忌とされる疾患にも好ましい。しかし効果が弱く、また発現に2週間近くかかることが欠点となる。 | |||
選択的セロトニン再取り込み阻害薬(SSRI)もセロトニンを活性化し、5- | 選択的セロトニン再取り込み阻害薬(SSRI)もセロトニンを活性化し、5-HT<sub>1A</sub>受容体を刺激することで抗不安効果をもたらす。強迫性障害や社交不安障害などに適応を持つが、効果発現に時間がかかるため、頓用使用には適しておらず、治療初期にベンゾジアゼピン系薬と併用し、落ち着いてからSSRIを中心にという治療がなされる。 | ||
}} | }} | ||
| 26行目: | 24行目: | ||
[[image:抗不安薬3.jpg|thumb|300px|'''表1. 抗不安薬の半減期と作用強度'''<br><ref name=ref9 />]] | [[image:抗不安薬3.jpg|thumb|300px|'''表1. 抗不安薬の半減期と作用強度'''<br><ref name=ref9 />]] | ||
[[不安障害]]など不安を持つ患者に対して、1940年代まではアルコールやバルビツール酸製剤(barbiturate)が、その鎮静効果を活かして用いられてきた。しかしこれらは不安そのものを解消する薬物ではなかった。1951年に臨床に登場したメプロバメート(meprobamate)は、不安を特異的に軽減する作用にちなんでトランキライザー(tranquilizer、 精神安定剤)と名付けられ一時代を築いたが、依存性・乱用などの問題のため短期間で臨床から姿を消した<ref name=ref1>'''越野 好文'''<br>不安障害の薬理学的理解と臨床への活用<br>''臨床精神薬理'' : 2012、 15(8);1317-1324</ref>。 1955年Sternbachにより最初のベンゾジアゼピン(BZD)(benzodiazepine)系薬物クロルジアゼポキシド(chlordiazepoxide)が合成され、1957年、これが強い鎮静作用、抗けいれん作用、筋弛緩作用を持つことが確認された。この薬物はメプロバメートより抗不安作用、安全性において遙かに優れており、その後1960年に海外で上市された。続いて合成されたのが、1963年に上市されたジアゼパム(diazepam)である。この2剤は世界的に広く汎用され、ジアゼパムは本邦でもいまだに広く使用されている<ref name=ref2><pubmed>21714826</pubmed></ref> <ref name=ref3>'''寺尾 岳'''<br>中止しにくい向精神病薬と多剤併用<br>''精神科治療学'' :2012、 27(1); 81-86</ref> | [[不安障害]]など不安を持つ患者に対して、1940年代まではアルコールやバルビツール酸製剤(barbiturate)が、その鎮静効果を活かして用いられてきた。しかしこれらは不安そのものを解消する薬物ではなかった。1951年に臨床に登場したメプロバメート(meprobamate)は、不安を特異的に軽減する作用にちなんでトランキライザー(tranquilizer、 精神安定剤)と名付けられ一時代を築いたが、依存性・乱用などの問題のため短期間で臨床から姿を消した<ref name=ref1>'''越野 好文'''<br>不安障害の薬理学的理解と臨床への活用<br>''臨床精神薬理'' : 2012、 15(8);1317-1324</ref>。 1955年Sternbachにより最初のベンゾジアゼピン(BZD)(benzodiazepine)系薬物クロルジアゼポキシド(chlordiazepoxide)が合成され、1957年、これが強い鎮静作用、抗けいれん作用、筋弛緩作用を持つことが確認された。この薬物はメプロバメートより抗不安作用、安全性において遙かに優れており、その後1960年に海外で上市された。続いて合成されたのが、1963年に上市されたジアゼパム(diazepam)である。この2剤は世界的に広く汎用され、ジアゼパムは本邦でもいまだに広く使用されている<ref name=ref2><pubmed>21714826</pubmed></ref> <ref name=ref3>'''寺尾 岳'''<br>中止しにくい向精神病薬と多剤併用<br>''精神科治療学'' :2012、 27(1); 81-86</ref>。以後、多数のベンゾジアゼピン系薬物が開発され全盛を誇った。しかし、ベンゾジアゼピン系抗不安薬をもってしても過鎮静効果(oversedation)や精神運動機能低下などの有害作用、あるいはアルコールとの併用により生じる問題などに加え、長期服用に伴う弊害が指摘されるようになった。 | ||
米国のブリストル・マイヤーズ社は1968年にアザピロン(azapirone)誘導体のブスピロン(buspirone) | 米国のブリストル・マイヤーズ社は1968年にアザピロン(azapirone)誘導体のブスピロン(buspirone)を合成したが、その後の研究でジアゼパムと同等の抗不安効果があることが明らかになり、最初のベンゾジアゼピン受容体に作用しない抗不安薬として1985年に西ドイツ、1986年に米国で承認された<ref name=ref4><pubmed>7838922</pubmed></ref> <ref name=ref1 />。住友製薬(現、大日本住友製薬)は、このブスピロン(buspirone)を改良し抗コンフリクト作用を強めた同じアザピロン(azapirone)系のセロトニン5-HT<sub>1A</sub>受容体部分[[作動薬]]であるタンドスピロン(tandospirone)を開発し<ref name=ref5>'''中村 三孝'''<br>セロトニン(5-HT)<sub>1A</sub>作動薬の薬効薬理作用<br>''臨床精神薬理'' : 1998、1(5);497-505</ref>、本邦では1996年に上市した<ref name=ref1 />。 | ||
1990年頃からは、最初は抗うつ薬と認知された[[選択的セロトニン再取り込み阻害薬]](SSRI)が、[[パニック障害]](panic disorder)や[[強迫性障害]](obsessive compulsive | 1990年頃からは、最初は抗うつ薬と認知された[[選択的セロトニン再取り込み阻害薬]](SSRI)が、[[パニック障害]](panic disorder)や[[強迫性障害]](obsessive compulsive disorder)をはじめとする多くの不安障害にも有効なことが証明された。こうして現在は、ベンゾジアゼピン系抗不安薬とセロトニン系の薬物が不安障害や種々の不安症状に対する治療薬の中心となっている。 | ||
== | == ベンゾジアゼピン系薬物 == | ||
===作用機序=== | ===作用機序=== | ||
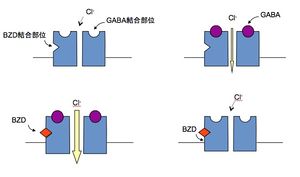
ベンゾジアゼピン系薬は、神経細胞の細胞体と樹上突起に分布するγ-アミノ酪酸A(GABA<sub>A</sub>)受容体(GABA<sub>A</sub> receptor)に存在するベンゾジアゼピン受容体(benzodiazepine receptor)にアゴニストとして作用する<ref name=ref6><pubmed>11752090</pubmed></ref> <ref name=ref7>'''辻 敬一郎、田島 治'''<br>抗不安薬<br>''日本臨牀'' : 2012、 70(1);42-46</ref>。ベンゾジアゼピン受容体は[[GABA<sub>A</sub>受容体|GABAA受容体]]と塩素イオン(Cl-)チャンネル(Cl- channel)と複合体を形成する。薬物が受容体に結合するとアロステリック(allosteric)にGABA<sub>A</sub>受容体が活性化され、Cl-チャンネルが開口し、Cl-が細胞内に流入し、過分極となることで鎮静に働くとされる(図1)。こうして大脳辺縁系の神経活動を抑制し、効果をもたらす<ref name=ref8>'''Stahl SM 訳 仙波純一'''<br>精神薬理学エセンシャルズ -神経科学的基礎と応用- 第3版<br>''メディカル・サイエンス・インターナショナル'':2010</ref> <ref name=ref9 />。 | |||
GABA<sub>A</sub>受容体にはベンゾジアゼピン系薬以外にも、バルビツール酸(barbituric acid)、エタノール(ethanol)、[[ニューロステロイド]](neurosteroid)、ピクロトキシン(picrotoxinin)などの結合部位が存在し、これらの薬物も[[GABA]]の作用をアロステリックに調節しているが、同時に直接的にもCl-の通過性を高める作用がある。そのためバルビツールやアルコールなどの過量摂取時には生理的限界を超えて作用し、呼吸抑制をもたらし、ときに致死的となりえ危険が大きい。他方、ベンゾジアゼピン系薬は直接にはCl-の通過性に影響せず、内在性のGABAの効果を増強するものの、これは生理的刺激を最大にするだけである。したがって、過量服用しても身体的な影響は限定されており、比較的安全性が高い<ref name=ref10><pubmed>11337025</pubmed></ref> <ref name=ref1 />。 | |||
GABA<sub>A</sub>受容体の脳内分布としては、[[縫線核]]や[[扁桃体]]、[[海馬]]、[[視床下部]]などが知られている<ref name=ref11><pubmed>10073896</pubmed></ref> <ref name=ref7 />。Maliziaらは1998年にフルマゼニル(flumazenil)を用いたPET研究で、パニック障害の患者ではベンゾジアゼピン結合が正常人に比べて全体的に低下し、特に眼窩・前頭皮質と島において著明なことを報告している<ref name=ref12><pubmed>9707382</pubmed></ref>。 | |||
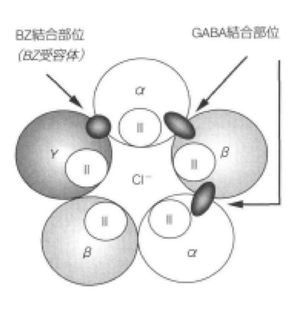
GABA<sub>A</sub>受容体は2個のαサブユニットと2個のβサブユニット、1個のγサブユニットからなり、ベンゾジアゼピン結合部位はαサブユニットとγサブユニットにまたがって存在すると考えられている。αサブユニットはα1~α6の6種類が存在することが知られており、既存のベンゾジアゼピン系薬はα1~α3、α5を持つGABA<sub>A</sub>受容体にアゴニストとして作用し、高い親和性を有している。それぞれのサブユニットに対するベンゾジアゼピン系薬の作用も解明されてきており、α1サブユニットは鎮静作用と抗けいれん作用に、α2サブユニットは抗不安作用と筋弛緩作用に、α3とα5サブユニットは筋弛緩作用に関与することがわかってきている<ref name=ref6 /> <ref name=ref13 /> <ref name=ref7 />。(図2) | |||
===作用=== | ===作用=== | ||
基本的に精神科疾患のみならず、種々の不安・焦燥・緊張を認める病態に効果をもたらす。身体的な疾患でその発症や経過に心理的因子が密接に関係している場合、ベンゾジアゼピン系薬を用いて不安、緊張などを緩和し、精神療法への導入を図ることを考える。他の向精神薬と比して効果発現が速いのも特徴である。またアルコール離脱症状の予防などにも用いられる<ref name=ref9 />。 | |||
作用の強弱と半減期の長短に応じた分類は表1のようになる。臨床ではその強弱よりも半減期の長短に注目するとわかりやすい。半減期と特徴との関係を表2に示す<ref name=ref9 />。 | 作用の強弱と半減期の長短に応じた分類は表1のようになる。臨床ではその強弱よりも半減期の長短に注目するとわかりやすい。半減期と特徴との関係を表2に示す<ref name=ref9 />。 | ||
| 76行目: | 74行目: | ||
hang over / carry over | hang over / carry over | ||
長時間作用型のベンゾジアゼピン系薬の効果が翌朝以降も持続するために、日中の眠気・ふらつき、頭痛、脱力・倦怠感などの症状が出現することがある。高齢者ほどこの効果が出やすい。肝機能低下時やベンゾジアゼピン系薬の肝代謝を阻害する薬物を服用している際には代謝が遅延する点、腎機能低下時では排泄が遅延する点にも注意する必要がある<ref name=ref15>'''菅原 裕子、 石郷岡 純'''<br>Benzodiazepineの有効性・安全性の予測因子<br>''臨床精神薬理'' : 2009、 12; 61-68</ref>。 | |||
====常用量依存==== | ====常用量依存==== | ||
| 83行目: | 81行目: | ||
漫然と投与すると、以前と同量では効果が期待できず、同等の効果発現のためには増量が必要となる。これを免れるためには有効最少量を投与し、短時間作用型の漫然投与を避ける。また効果がないからといって、最高用量まで安易に増やす<ref name=ref16>'''村崎 光邦'''<br>抗不安薬の臨床用量依存<br>''精神経誌'' :1996、 98;612-621</ref>ことや同効薬(例えば短時間型同士など)の併用はより耐性(tolerance)形成に働くため、避けなければならない。 | 漫然と投与すると、以前と同量では効果が期待できず、同等の効果発現のためには増量が必要となる。これを免れるためには有効最少量を投与し、短時間作用型の漫然投与を避ける。また効果がないからといって、最高用量まで安易に増やす<ref name=ref16>'''村崎 光邦'''<br>抗不安薬の臨床用量依存<br>''精神経誌'' :1996、 98;612-621</ref>ことや同効薬(例えば短時間型同士など)の併用はより耐性(tolerance)形成に働くため、避けなければならない。 | ||
使用後最短4週間で依存(dependence)が形成される。その後の退薬によって反跳現象(rebound | 使用後最短4週間で依存(dependence)が形成される。その後の退薬によって反跳現象(rebound phenomenon)や退薬症候(離脱症状)が見られる。反跳現象はベンゾジアゼピン系薬により抑えられていた症状が、退薬後より強く現れるものであり、不安、焦燥、不眠などが認められる。退薬症候(離脱症状)(withdrawal symptom)はベンゾジアゼピン系薬中止によりそれまでには認められていなかった症状が新たに出現するものである<ref name=ref16b>'''辻 敬一郎、田島 治'''<br>ベンゾジアゼピンの依存と離脱症状<br>臨床精神医学. 35: 1669-1674, 2006.</ref>。不安や焦燥、不眠、イライラ、抑うつ気分、記憶障害、集中力障害に加え、身体症状として発汗や心悸亢進、悪心、嘔吐、食欲低下、体重減少、筋肉痛、振戦、けいれんが、さらに[[知覚]]障害として知覚過敏や味覚異常、身体動揺感などが見られる<ref name=ref17><pubmed>8099577</pubmed></ref>。依存形成の危険因子としては、半減期が短い、高力価、高用量のベンゾジアゼピン系薬、そして長期投与などが挙げられており、このようなベンゾジアゼピン系薬の使用において、より投与中止が困難、つまり、依存が形成されやすいことになる。このため長期投与にしないよう配慮する<ref name=ref16b />。 | ||
====筋弛緩作用==== | ====筋弛緩作用==== | ||
| 91行目: | 89行目: | ||
cognitive function disorder | cognitive function disorder | ||
服用後の[[健忘]](amnesia)([[前向性健忘]])(anterograde | 服用後の[[健忘]](amnesia)([[前向性健忘]])(anterograde amnesia)が認められる。Barkerらによるメタ解析によると、ベンゾジアゼピン系薬服用者は、非服用者と比較して、認知的タスク、特に言語性記憶(verbal memory)の領域が障害されていた。なお、ベンゾジアゼピン系薬を中止して6ヶ月後に認知機能がすべての領域において改善したが、過去にベンゾジアゼピン系薬を常用していた者は非服用者と比較して、認知的タスクの多くで劣り、特に言語性記憶の領域では障害が認められていた<ref name=ref18><pubmed>14731058</pubmed></ref>。認知機能障害が消失するまでには、かなりの期間が必要ということになる。 | ||
精神運動性の遂行能力低下、実行速度の低下も見られる。同じメタ解析でも、ベンゾジアゼピン系薬は有意に交通事故を増加させることが判明している<ref name=ref18><pubmed>14731058</pubmed></ref>。したがって、車の運転をするときには、できるだけベンゾジアゼピン系薬を減量する必要がある。ベンゾジアゼピン系薬の服用により、事故やけがの危険性が増すともされている<ref name=ref3 />。なおTsunodaら<ref name=ref19><pubmed>20054834</pubmed></ref>は、[[睡眠]]薬ではあるが高齢者においてベンゾジアゼピン系薬を漸減し、ほぼ中止することによって認知機能の改善を見たと報告している。 | |||
またアルコールとの併用でこうした障害がより悪化することもあるため、アルコールは控えさせる必要がある。 | またアルコールとの併用でこうした障害がより悪化することもあるため、アルコールは控えさせる必要がある。 | ||
| 105行目: | 103行目: | ||
paradoxical reaction | paradoxical reaction | ||
ごくまれにベンゾジアゼピン系薬を投与するとかえって不安、 緊張が高まり、興奮や攻撃性が増すことがある。この奇異反応は、高用量を用いた場合に起こりやすいが、 特に若年者においての報告が多い<ref name=ref20><pubmed>12779114</pubmed></ref> <ref name=ref15 />。また、脱抑制(disinhibition)が生じ、興奮や過活動が生じることもある。その頻度はベンゾジアゼピン系薬服用者の1%未満から20%までと幅があり、患者背景やアルコールとの併用によって影響される<ref name=ref3 />。 | |||
== | == セロトニン<sub>1A</sub>受容体部分作動薬 == | ||
[[serotonin]] 1A receptor partial against | [[serotonin]] <sub>1A</sub> receptor partial against | ||
セロトニン<sub>1A</sub>受容体部分作動薬は、ベンゾジアゼピン系薬のように全身に作用せず、本来不安、抑うつに関与する大脳辺縁系の<sub>1A</sub>受容体を中心に刺激することで作用する。 | |||
===特徴=== | ===特徴=== | ||
ベンゾジアゼピン系薬にみられる鎮静・催眠作用、 筋弛緩、依存性、記憶障害などの有害事象が少なく、長期の投与や高齢者に相応しい。また重症筋無力症などベンゾジアゼピン系薬が禁忌とされる疾患にも好都合となる。しかし効果発現に2週間近くかかり、また効果が弱いことが欠点となっている。またSSRIなどとの併用でセロトニン症候群(serotonin syndrome)が生じる可能性もあり、注意を要する<ref name=ref9 />。 | |||
===作用機序=== | ===作用機序=== | ||
セロトニン系抗不安薬の作用機序はベンゾジアゼピン系薬のそれとは全く異なる。セロトニン([[5-HT]])受容体のサブタイプの1つである5-HT<sub>1A</sub>受容体は、セロトニン系神経細胞の細胞体や樹状突起に存在し、セロトニンや5-HT<sub>1A</sub>受容体アゴニストの刺激により、[[CAMP]]合成を抑制し、Gタンパクに共役したK+[[イオンチャネル]]を刺激することで、神経細胞の過分極を引き起こす<ref name=ref21><pubmed>11888546</pubmed></ref>。前[[シナプス]]5-HT<sub>1A</sub>受容体は自己受容体であり、これが刺激されると[[セロトニン神経]]伝達は抑制される。一方、後シナプス5-HT<sub>1A</sub>受容体が刺激されると、5-HT<sub>1A</sub>受容体を介したセロトニン神経伝達は促進される。セロトニン系抗不安薬は、主に縫線核や扁桃体、海馬などの前シナプスの5-HT<sub>1A</sub>自己受容体に部分アゴニストとして作用することで抗不安効果を発揮する<ref name=ref11 /> <ref name=ref7 />。 | |||
== 選択的セロトニン再取り込み阻害薬 == | == 選択的セロトニン再取り込み阻害薬 == | ||
SSRI | SSRI | ||
SSRIもセロトニンを活性化し、5- | SSRIもセロトニンを活性化し、5-HT<sub>1A</sub>受容体を刺激することで抗不安・パニック効果をもたらす。また強迫性障害や社交不安障害(social anxiety disorder)など神経症性障害に適応を持つ。ただ効果発現に時間がかかるため、頓用使用には適しておらず、治療初期にベンゾジアゼピン系薬と併用し、落ち着いてからSSRIを中心にという治療がなされている<ref name=ref9 />。 | ||
しかしながら、不安に対するセロトニンのメカニズムに関して、越野はさまざまな研究をレビューし、表3のように「不安障害において、セロトニンは過剰なのか、あるいは不足しているのかといった基本的なことが不明のままである。」と論じている<ref name=ref1 />。 | しかしながら、不安に対するセロトニンのメカニズムに関して、越野はさまざまな研究をレビューし、表3のように「不安障害において、セロトニンは過剰なのか、あるいは不足しているのかといった基本的なことが不明のままである。」と論じている<ref name=ref1 />。 | ||
| 152行目: | 150行目: | ||
| style="background-color:#d3d3d3; text-align:center" | 薬物 | | style="background-color:#d3d3d3; text-align:center" | 薬物 | ||
| style="background-color:#d3d3d3; text-align:center" | SSRI/SNRI | | style="background-color:#d3d3d3; text-align:center" | SSRI/SNRI | ||
| style="background-color:#d3d3d3; text-align:center" | | | style="background-color:#d3d3d3; text-align:center" | ベンゾジアゼピン系薬 | ||
| style="background-color:#d3d3d3; text-align:center" | | | style="background-color:#d3d3d3; text-align:center" | セロトニン<sub>1A</sub>作動薬 | ||
|- | |- | ||
| style="text-align:center" | 効果発現 | | style="text-align:center" | 効果発現 | ||
2014年1月10日 (金) 17:22時点における版
渡邊 衡一郎
杏林大学医学部精神神経科学教室
DOI XXXX/XXXX 原稿受付日:2014年1月9日 原稿完成日:2014年月日
担当編集委員:加藤 忠史(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:anxiolytics
ベンゾジアゼピン(BZD)系薬とセロトニン系薬が治療の中心となっている。
ベンゾジアゼピン系薬は、GABAA受容体と複合体を形成するベンゾジアゼピン受容体にアゴニストとして作用する。種々の不安・焦燥・緊張を認める病態に効果をもたらす。ただ依存性が問題となるため、漫然と使用しないことが望ましく、日中の眠気・ふらつき、頭痛、脱力・倦怠感などの副作用が出現することもある。また服用後の健忘が認められ、過量摂取では呼吸抑制に働くこともあり、注射剤、特に静注の際は緩徐に投与する必要がある。使用によりかえって不安、緊張が高まり、興奮や攻撃性が増すこともごくまれにある。
セロトニン1A受容体部分作動薬は、ベンゾジアゼピン系薬のように全身に作用せず、不安に関与する大脳辺縁系の同受容体を刺激することで作用する。ベンゾジアゼピン系薬にみられる有害事象が少なく、長期投与や高齢者に相応しい。また重症筋無力症などベンゾジアゼピン系薬が禁忌とされる疾患にも好ましい。しかし効果が弱く、また発現に2週間近くかかることが欠点となる。
選択的セロトニン再取り込み阻害薬(SSRI)もセロトニンを活性化し、5-HT1A受容体を刺激することで抗不安効果をもたらす。強迫性障害や社交不安障害などに適応を持つが、効果発現に時間がかかるため、頓用使用には適しておらず、治療初期にベンゾジアゼピン系薬と併用し、落ち着いてからSSRIを中心にという治療がなされる。
歴史
[1]
[2]

[1]
不安障害など不安を持つ患者に対して、1940年代まではアルコールやバルビツール酸製剤(barbiturate)が、その鎮静効果を活かして用いられてきた。しかしこれらは不安そのものを解消する薬物ではなかった。1951年に臨床に登場したメプロバメート(meprobamate)は、不安を特異的に軽減する作用にちなんでトランキライザー(tranquilizer、 精神安定剤)と名付けられ一時代を築いたが、依存性・乱用などの問題のため短期間で臨床から姿を消した[3]。 1955年Sternbachにより最初のベンゾジアゼピン(BZD)(benzodiazepine)系薬物クロルジアゼポキシド(chlordiazepoxide)が合成され、1957年、これが強い鎮静作用、抗けいれん作用、筋弛緩作用を持つことが確認された。この薬物はメプロバメートより抗不安作用、安全性において遙かに優れており、その後1960年に海外で上市された。続いて合成されたのが、1963年に上市されたジアゼパム(diazepam)である。この2剤は世界的に広く汎用され、ジアゼパムは本邦でもいまだに広く使用されている[4] [5]。以後、多数のベンゾジアゼピン系薬物が開発され全盛を誇った。しかし、ベンゾジアゼピン系抗不安薬をもってしても過鎮静効果(oversedation)や精神運動機能低下などの有害作用、あるいはアルコールとの併用により生じる問題などに加え、長期服用に伴う弊害が指摘されるようになった。
米国のブリストル・マイヤーズ社は1968年にアザピロン(azapirone)誘導体のブスピロン(buspirone)を合成したが、その後の研究でジアゼパムと同等の抗不安効果があることが明らかになり、最初のベンゾジアゼピン受容体に作用しない抗不安薬として1985年に西ドイツ、1986年に米国で承認された[6] [3]。住友製薬(現、大日本住友製薬)は、このブスピロン(buspirone)を改良し抗コンフリクト作用を強めた同じアザピロン(azapirone)系のセロトニン5-HT1A受容体部分作動薬であるタンドスピロン(tandospirone)を開発し[7]、本邦では1996年に上市した[3]。
1990年頃からは、最初は抗うつ薬と認知された選択的セロトニン再取り込み阻害薬(SSRI)が、パニック障害(panic disorder)や強迫性障害(obsessive compulsive disorder)をはじめとする多くの不安障害にも有効なことが証明された。こうして現在は、ベンゾジアゼピン系抗不安薬とセロトニン系の薬物が不安障害や種々の不安症状に対する治療薬の中心となっている。
ベンゾジアゼピン系薬物
作用機序
ベンゾジアゼピン系薬は、神経細胞の細胞体と樹上突起に分布するγ-アミノ酪酸A(GABAA)受容体(GABAA receptor)に存在するベンゾジアゼピン受容体(benzodiazepine receptor)にアゴニストとして作用する[8] [9]。ベンゾジアゼピン受容体は[[GABAA受容体|GABAA受容体]]と塩素イオン(Cl-)チャンネル(Cl- channel)と複合体を形成する。薬物が受容体に結合するとアロステリック(allosteric)にGABAA受容体が活性化され、Cl-チャンネルが開口し、Cl-が細胞内に流入し、過分極となることで鎮静に働くとされる(図1)。こうして大脳辺縁系の神経活動を抑制し、効果をもたらす[10] [1]。
GABAA受容体にはベンゾジアゼピン系薬以外にも、バルビツール酸(barbituric acid)、エタノール(ethanol)、ニューロステロイド(neurosteroid)、ピクロトキシン(picrotoxinin)などの結合部位が存在し、これらの薬物もGABAの作用をアロステリックに調節しているが、同時に直接的にもCl-の通過性を高める作用がある。そのためバルビツールやアルコールなどの過量摂取時には生理的限界を超えて作用し、呼吸抑制をもたらし、ときに致死的となりえ危険が大きい。他方、ベンゾジアゼピン系薬は直接にはCl-の通過性に影響せず、内在性のGABAの効果を増強するものの、これは生理的刺激を最大にするだけである。したがって、過量服用しても身体的な影響は限定されており、比較的安全性が高い[11] [3]。
GABAA受容体の脳内分布としては、縫線核や扁桃体、海馬、視床下部などが知られている[12] [9]。Maliziaらは1998年にフルマゼニル(flumazenil)を用いたPET研究で、パニック障害の患者ではベンゾジアゼピン結合が正常人に比べて全体的に低下し、特に眼窩・前頭皮質と島において著明なことを報告している[13]。
GABAA受容体は2個のαサブユニットと2個のβサブユニット、1個のγサブユニットからなり、ベンゾジアゼピン結合部位はαサブユニットとγサブユニットにまたがって存在すると考えられている。αサブユニットはα1~α6の6種類が存在することが知られており、既存のベンゾジアゼピン系薬はα1~α3、α5を持つGABAA受容体にアゴニストとして作用し、高い親和性を有している。それぞれのサブユニットに対するベンゾジアゼピン系薬の作用も解明されてきており、α1サブユニットは鎮静作用と抗けいれん作用に、α2サブユニットは抗不安作用と筋弛緩作用に、α3とα5サブユニットは筋弛緩作用に関与することがわかってきている[8] [2] [9]。(図2)
作用
基本的に精神科疾患のみならず、種々の不安・焦燥・緊張を認める病態に効果をもたらす。身体的な疾患でその発症や経過に心理的因子が密接に関係している場合、ベンゾジアゼピン系薬を用いて不安、緊張などを緩和し、精神療法への導入を図ることを考える。他の向精神薬と比して効果発現が速いのも特徴である。またアルコール離脱症状の予防などにも用いられる[1]。
作用の強弱と半減期の長短に応じた分類は表1のようになる。臨床ではその強弱よりも半減期の長短に注目するとわかりやすい。半減期と特徴との関係を表2に示す[1]。
| 半減期 | 使用される場合 | 欠点 |
| 短い | ・発作性の症状を抑える際に ・不安が予想される状況での症状出現の予防に |
・依存性がつきやすい ・離脱症状が出現しやすい ・1日何度も服用しなければならない |
| 長い | ・いつ起こるかわからない症状の予防に ・夜間や早朝に出現する症状 |
・持ち越し効果 |
投与法
依存性が問題となるため、漫然と使用しないことが望ましく、特に使い初めは頓用使用とすることが勧められる。こうした依存性は半減期(half-life)の短い薬物でより認められるため、中長期的な使用においては必要性を再検討し、できるだけ長時間のものに置き換えるか、あるいは同様に抗不安・焦燥効果のあるSSRI(SSRI)などに置き換えていくことが望ましい。必要最少量を短期間使用する原則を理解する。継続投与が必要と判断される際は作用時間を考慮し、終日不安となる場合は長時間作用型の薬物を投与する。短時間作用型の薬物は、発作を止める場合や苦手な状況にさらされる時などの頓用投与に適している。
また抗不安薬のみに頼らず、環境調整や心理療法の導入、SSRIの使用も検討する。退薬症候(不安、焦燥など)も起こりうるため、中止の際はゆるやかな漸減(2週間毎に1/4量ずつ程度)が望ましい[1]。
(特殊な状況下での投与) 肝・腎障害の患者ではより低用量で開始する。高齢者は転倒、錯乱などの危険性が増大しうるため、初回投与量は半量位から開始する。妊娠中(特に妊娠初期)には通常推奨されない。妊娠後期に服用した母親の子供は離脱を経験することがある。また、授乳により母乳中へ薬物移行がみられるため薬物を中止するか人工栄養が推奨される[14] [1]。
副作用
持ち越し効果
hang over / carry over
長時間作用型のベンゾジアゼピン系薬の効果が翌朝以降も持続するために、日中の眠気・ふらつき、頭痛、脱力・倦怠感などの症状が出現することがある。高齢者ほどこの効果が出やすい。肝機能低下時やベンゾジアゼピン系薬の肝代謝を阻害する薬物を服用している際には代謝が遅延する点、腎機能低下時では排泄が遅延する点にも注意する必要がある[15]。
常用量依存
usual-dose dependence
漫然と投与すると、以前と同量では効果が期待できず、同等の効果発現のためには増量が必要となる。これを免れるためには有効最少量を投与し、短時間作用型の漫然投与を避ける。また効果がないからといって、最高用量まで安易に増やす[16]ことや同効薬(例えば短時間型同士など)の併用はより耐性(tolerance)形成に働くため、避けなければならない。
使用後最短4週間で依存(dependence)が形成される。その後の退薬によって反跳現象(rebound phenomenon)や退薬症候(離脱症状)が見られる。反跳現象はベンゾジアゼピン系薬により抑えられていた症状が、退薬後より強く現れるものであり、不安、焦燥、不眠などが認められる。退薬症候(離脱症状)(withdrawal symptom)はベンゾジアゼピン系薬中止によりそれまでには認められていなかった症状が新たに出現するものである[17]。不安や焦燥、不眠、イライラ、抑うつ気分、記憶障害、集中力障害に加え、身体症状として発汗や心悸亢進、悪心、嘔吐、食欲低下、体重減少、筋肉痛、振戦、けいれんが、さらに知覚障害として知覚過敏や味覚異常、身体動揺感などが見られる[18]。依存形成の危険因子としては、半減期が短い、高力価、高用量のベンゾジアゼピン系薬、そして長期投与などが挙げられており、このようなベンゾジアゼピン系薬の使用において、より投与中止が困難、つまり、依存が形成されやすいことになる。このため長期投与にしないよう配慮する[17]。
筋弛緩作用
高齢者ではふらつきや転倒につながり、腰部骨折の危険も大きくなるが、この作用を逆に利用して緊張型頭痛や肩こりに用いられることもある。
認知機能障害
cognitive function disorder
服用後の健忘(amnesia)(前向性健忘)(anterograde amnesia)が認められる。Barkerらによるメタ解析によると、ベンゾジアゼピン系薬服用者は、非服用者と比較して、認知的タスク、特に言語性記憶(verbal memory)の領域が障害されていた。なお、ベンゾジアゼピン系薬を中止して6ヶ月後に認知機能がすべての領域において改善したが、過去にベンゾジアゼピン系薬を常用していた者は非服用者と比較して、認知的タスクの多くで劣り、特に言語性記憶の領域では障害が認められていた[19]。認知機能障害が消失するまでには、かなりの期間が必要ということになる。
精神運動性の遂行能力低下、実行速度の低下も見られる。同じメタ解析でも、ベンゾジアゼピン系薬は有意に交通事故を増加させることが判明している[19]。したがって、車の運転をするときには、できるだけベンゾジアゼピン系薬を減量する必要がある。ベンゾジアゼピン系薬の服用により、事故やけがの危険性が増すともされている[5]。なおTsunodaら[20]は、睡眠薬ではあるが高齢者においてベンゾジアゼピン系薬を漸減し、ほぼ中止することによって認知機能の改善を見たと報告している。
またアルコールとの併用でこうした障害がより悪化することもあるため、アルコールは控えさせる必要がある。
呼吸抑制
respiratory depression
過量服用で呼吸抑制に働くこともある。注射剤、特に静注の際は緩徐に投与する必要がある。
奇異反応
paradoxical reaction
ごくまれにベンゾジアゼピン系薬を投与するとかえって不安、 緊張が高まり、興奮や攻撃性が増すことがある。この奇異反応は、高用量を用いた場合に起こりやすいが、 特に若年者においての報告が多い[21] [15]。また、脱抑制(disinhibition)が生じ、興奮や過活動が生じることもある。その頻度はベンゾジアゼピン系薬服用者の1%未満から20%までと幅があり、患者背景やアルコールとの併用によって影響される[5]。
セロトニン1A受容体部分作動薬
serotonin 1A receptor partial against
セロトニン1A受容体部分作動薬は、ベンゾジアゼピン系薬のように全身に作用せず、本来不安、抑うつに関与する大脳辺縁系の1A受容体を中心に刺激することで作用する。
特徴
ベンゾジアゼピン系薬にみられる鎮静・催眠作用、 筋弛緩、依存性、記憶障害などの有害事象が少なく、長期の投与や高齢者に相応しい。また重症筋無力症などベンゾジアゼピン系薬が禁忌とされる疾患にも好都合となる。しかし効果発現に2週間近くかかり、また効果が弱いことが欠点となっている。またSSRIなどとの併用でセロトニン症候群(serotonin syndrome)が生じる可能性もあり、注意を要する[1]。
作用機序
セロトニン系抗不安薬の作用機序はベンゾジアゼピン系薬のそれとは全く異なる。セロトニン(5-HT)受容体のサブタイプの1つである5-HT1A受容体は、セロトニン系神経細胞の細胞体や樹状突起に存在し、セロトニンや5-HT1A受容体アゴニストの刺激により、CAMP合成を抑制し、Gタンパクに共役したK+イオンチャネルを刺激することで、神経細胞の過分極を引き起こす[22]。前シナプス5-HT1A受容体は自己受容体であり、これが刺激されるとセロトニン神経伝達は抑制される。一方、後シナプス5-HT1A受容体が刺激されると、5-HT1A受容体を介したセロトニン神経伝達は促進される。セロトニン系抗不安薬は、主に縫線核や扁桃体、海馬などの前シナプスの5-HT1A自己受容体に部分アゴニストとして作用することで抗不安効果を発揮する[12] [9]。
選択的セロトニン再取り込み阻害薬
SSRI
SSRIもセロトニンを活性化し、5-HT1A受容体を刺激することで抗不安・パニック効果をもたらす。また強迫性障害や社交不安障害(social anxiety disorder)など神経症性障害に適応を持つ。ただ効果発現に時間がかかるため、頓用使用には適しておらず、治療初期にベンゾジアゼピン系薬と併用し、落ち着いてからSSRIを中心にという治療がなされている[1]。
しかしながら、不安に対するセロトニンのメカニズムに関して、越野はさまざまな研究をレビューし、表3のように「不安障害において、セロトニンは過剰なのか、あるいは不足しているのかといった基本的なことが不明のままである。」と論じている[3]。
●5-HT過剰説
|
おわりに
現段階では不安障害に対し抗不安作用を発揮する薬物間の特徴において表4のように対比できる。こうしたメリット・デメリットを把握して、個々の患者の背景や希望に即して薬物を選択することが望ましいと考える。
| 薬物 | SSRI/SNRI | ベンゾジアゼピン系薬 | セロトニン1A作動薬 |
| 効果発現 | 遅い | 速い | 遅い |
| 治療耐性 | No | Little | No |
| 乱用 | - | + | - |
| 離脱症状 | + | ++ | - |
| アルコールとの相互作用 | + | +++ | + |
| 鎮静 | - | ++ | - |
| 健忘 | - | ++ | - |
| 過量服薬用時の危険性 | - | + | - |
関連項目
参考文献
- ↑ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 渡邊 衡一郎(浦部昌夫、島田和幸、川合眞一 編)
抗不安薬 睡眠薬
今日の治療薬 2013 解説と便覧 :2013、 838-857 - ↑ 2.0 2.1 木内 祐二
ベンゾジアゼピン受容体サブタイプと睡眠薬の薬理作用
分子精神医学 : 2002、 2(3);58(262)-65(269) - ↑ 3.0 3.1 3.2 3.3 3.4 越野 好文
不安障害の薬理学的理解と臨床への活用
臨床精神薬理 : 2012、 15(8);1317-1324 - ↑
Lader, M. (2011).
Benzodiazepines revisited--will we ever learn? Addiction (Abingdon, England), 106(12), 2086-109. [PubMed:21714826] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 寺尾 岳
中止しにくい向精神病薬と多剤併用
精神科治療学 :2012、 27(1); 81-86 - ↑
Cole, J.C., & Rodgers, R.J. (1994).
Ethological evaluation of the effects of acute and chronic buspirone treatment in the murine elevated plus-maze test: comparison with haloperidol. Psychopharmacology, 114(2), 288-96. [PubMed:7838922] [WorldCat] [DOI] - ↑ 中村 三孝
セロトニン(5-HT)1A作動薬の薬効薬理作用
臨床精神薬理 : 1998、1(5);497-505 - ↑ 8.0 8.1
Möhler, H., Fritschy, J.M., & Rudolph, U. (2002).
A new benzodiazepine pharmacology. The Journal of pharmacology and experimental therapeutics, 300(1), 2-8. [PubMed:11752090] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2 9.3 辻 敬一郎、田島 治
抗不安薬
日本臨牀 : 2012、 70(1);42-46 - ↑ Stahl SM 訳 仙波純一
精神薬理学エセンシャルズ -神経科学的基礎と応用- 第3版
メディカル・サイエンス・インターナショナル:2010 - ↑
Sandford, J.J., Argyropoulos, S.V., & Nutt, D.J. (2000).
The psychobiology of anxiolytic drugs. Part 1: Basic neurobiology. Pharmacology & therapeutics, 88(3), 197-212. [PubMed:11337025] [WorldCat] [DOI] - ↑ 12.0 12.1
Menard, J., & Treit, D. (1999).
Effects of centrally administered anxiolytic compounds in animal models of anxiety. Neuroscience and biobehavioral reviews, 23(4), 591-613. [PubMed:10073896] [WorldCat] - ↑
Malizia, A.L., Cunningham, V.J., Bell, C.J., Liddle, P.F., Jones, T., & Nutt, D.J. (1998).
Decreased brain GABA(A)-benzodiazepine receptor binding in panic disorder: preliminary results from a quantitative PET study. Archives of general psychiatry, 55(8), 715-20. [PubMed:9707382] [WorldCat] [DOI] - ↑ Stahl. SM. 訳 仙波純一
精神科治療薬処方ガイド
メディカル・サイエンス・インターナショナル:2006 - ↑ 15.0 15.1 菅原 裕子、 石郷岡 純
Benzodiazepineの有効性・安全性の予測因子
臨床精神薬理 : 2009、 12; 61-68 - ↑ 村崎 光邦
抗不安薬の臨床用量依存
精神経誌 :1996、 98;612-621 - ↑ 17.0 17.1 辻 敬一郎、田島 治
ベンゾジアゼピンの依存と離脱症状
臨床精神医学. 35: 1669-1674, 2006. - ↑
Sussman, N. (1993).
Treating anxiety while minimizing abuse and dependence. The Journal of clinical psychiatry, 54 Suppl, 44-51. [PubMed:8099577] [WorldCat] - ↑ 19.0 19.1
Barker, M.J., Greenwood, K.M., Jackson, M., & Crowe, S.F. (2004).
Cognitive effects of long-term benzodiazepine use: a meta-analysis. CNS drugs, 18(1), 37-48. [PubMed:14731058] [WorldCat] [DOI] - ↑
Tsunoda, K., Uchida, H., Suzuki, T., Watanabe, K., Yamashima, T., & Kashima, H. (2010).
Effects of discontinuing benzodiazepine-derivative hypnotics on postural sway and cognitive functions in the elderly. International journal of geriatric psychiatry, 25(12), 1259-65. [PubMed:20054834] [WorldCat] [DOI] - ↑
Robin, C., & Trieger, N. (2002).
Paradoxical reactions to benzodiazepines in intravenous sedation: a report of 2 cases and review of the literature. Anesthesia progress, 49(4), 128-32. [PubMed:12779114] [PMC] [WorldCat] - ↑
Hoyer, D., Hannon, J.P., & Martin, G.R. (2002).
Molecular, pharmacological and functional diversity of 5-HT receptors. Pharmacology, biochemistry, and behavior, 71(4), 533-54. [PubMed:11888546] [WorldCat] [DOI]