神経筋接合部
英語名:neuromuscular junction
同義語:神経終板
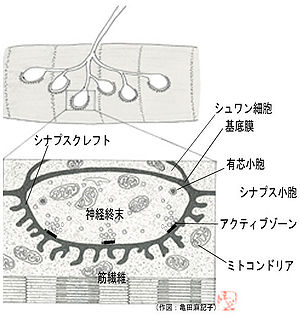
運動神経終末と筋肉組織の接着部。神経終板とも呼ばれる。シナプスが形成され、筋収縮を引き起こす神経伝達が行われる。脊椎動物の神経筋接合部では、神経終末からアセチルコリンが放出され、筋肉細胞に存在する受容体に受け取られる。これにより、筋肉細胞に脱分極が引き起こされ、その脱分極が筋線維全体に広がり、筋収縮が引き起こされる。
構造
図は脊椎動物の神経筋接合部を模式的に示したものである。神経終末と筋肉細胞間にはシナプス間隙(シナプスクレフト)と呼ばれる間隙構造があり、筋肉細胞側にはヒダのような陥没構造が見られる。間隙内には基底膜と呼ばれる細胞外マトリックスが存在している。コラーゲンIV、ラミニン、アセチルコリンエステラーゼ、ヘパラン硫酸プロテオグリカンなどが主な成分である。前シナプス側である神経終末には、神経伝達物質、アセチルコリンを含んだシナプス小胞が多数存在し、特に、シナプス小胞が集まっている場所をアクティブゾーンと呼ぶ。アクティブゾーン近傍には、電位依存性カルシウムチャンネルが存在し、運動神経の興奮に伴って、速やかな伝達物質放出が可能になっている。小胞にはこれ以外に、電子密度の高い部分を持つ有芯小胞もある。後シナプス側には、伝達物質を受け取るための伝達物質受容体が集合しており、1平方μmあたり、約1万個にも達する。接合部から離れた部位では1平方μmあたり10個程度であることから、その集合度合いは驚異的である。神経筋接合部には神経と筋線維だけでなく、シュワン細胞も存在し、神経終末を覆っている。このシュワン細胞の覆いは、神経終末を保護する働きがある。それ以外にも、神経損傷の際の神経リモデリングなど、積極的に神経筋接合部の形成・維持機能に関わっていることが明らかになりつつある[1], [2]。
神経伝達機構
神経筋接合部は、神経科学研究の良い材料として使われてきた。特に、神経伝達物質放出機構に関する研究が行われ、数々の重要な知見が得られた。たとえば、カエルの神経筋接合部を用いて、神経伝達物質放出のシナプス遅延時間が測定された[3]。25度の室温では、約0.5msと測定され、シナプス間隙をアセチルコリンが拡散する時間よりも長かった。この時間は、温度によって変化し、例えば、2度では、7msへと延長された。直接アセチルコリンを微小イオン電気泳動法により投与した場合は、遅延時間は、約150μsであり、この場合は温度によってあまり変化しなかった。これらのことから、遅延は、神経伝達物質放出機構により生じていると考えられた。また、神経伝達物質放出には、神経終末膜の脱分極時に細胞外のカルシウムイオンが必要であること[4]が、カルシウムイオンの微小イオン電気泳動法による投与により示された。さらに、アセチルコリン放出は、一定の単位ずつ行われるという量子仮説が提唱され[5]た。カエルの神経筋接合部の微小終板電位を測定すると、電位の大きさは、最小の物の整数倍になっており、伝達物質放出の量子性が推測された。通常の終板電位に対しても、哺乳類神経筋接合部において、高マグネシウム下での測定により、量子性について確認された[6]。また、ヘビの神経筋接合部において、非常に細いガラス電極を用いたアセチルコリンの微小電気泳動法による投与により、ひとつの量子は、アセチルコリン約7000分子からなることが示された[7]。
シナプス形成に関わる分子機構
さらに、脊椎動物の神経筋接合部を用いて、発生過程におけるシナプス形成過程の分子機構の研究が進められた。基底膜のように神経筋接合部特有の構造もあるが、基本的なシナプス前後の構造、例えば、アクティブゾーンや受容体集積部位などは、神経―神経間のシナプスと同様の構造であり、共通のシナプス形成機構が存在すると考えられ、良いモデル系となっている。Xenopus胚から単離・培養された神経筋接合部のモデル系を用いて、神経終末が筋肉細胞に接触すると、数秒以内にアセチルコリン放出が観測され、20分後には放出量の増大が見られた。このことから、筋肉細胞と神経終末が接触すると数分以内に、機能的なシナプス結合が形成されることが明らかになった[8]。シナプス構造の分化過程のうちシナプス部へのアセチルコリン受容体の集積は、最初に、神経終末が筋肉細胞に接触してから、数時間以内に始まる。神経筋接合部におけるアセチルコリン受容体の集積は、コリン作動性神経終末特異的であり、神経細胞から集積を促す分子が分泌されていると考えられ、アグリンという蛋白質が同定された[9]。アグリンは、ヘパラン硫酸プロテオグリカンであり、ラミニンやヘパリン、ヘパリン結合タンパク質、インテグリンなどと相互作用する部位をもつ[10]。さらに、アグリンの受容体の一部として、muscle-specific receptor tyrosine kinase (MuSK)が同定され[11]、以降、シナプス後部の構造構築に働く細胞内シグナル機構の研究が盛んに行われている。近年では、分泌型glycoproteinであるWntがMuSKのリガンドとして働く可能性が示され[12]、研究の新展開が見られる。アセチルコリン受容体の集合だけでなく、合成も神経細胞の接触により引き起こされることも示されている[2]。
シナプス除去に関わる分子機構
脊椎動物の神経筋接合部は、初期シナプス形成の良いモデルとなっているだけでなく、出来上がったシナプスが再編される過程であるシナプス競合のモデルとしても研究が盛んである。脊椎動物の神経筋接合部では、発生初期において、一本の筋繊維上に、複数の神経繊維の終末がシナプスを形成するが、やがて、一本の神経繊維からの終末だけが残るようになる。これは、複数の神経終末間で競合が起こり、シナプス除去の機構が働いた結果起こると考えられている[13], [14], [15]。シナプス除去は、神経細胞の活動を抑制すると、抑制されることから、神経活動依存的であることが示されている[16]。アセチルコリンのアンタゴニスト、α-Bungarotoxinを微小領域に投与すると、投与された領域はシナプス除去される。しかし、筋繊維全体にα-Bungarotoxinが投与されると、シナプス競合は起こらない[17]。さらに、神経活動依存的に筋肉細胞側からの因子を奪い合う結果起こる可能性が考えられている [18]。
無脊椎動物の神経筋接合部
他の神経科学研究同様、神経筋接合部を用いた研究においても、無脊椎動物の神経筋接合部は優れた研究対象となっている。特に、遺伝学的手法・分子生物学的手法が容易に用いることができ、機能分子の同定が容易に行えるショウジョウバエ幼虫の神経筋接合部を用いての研究が盛んになった。
脊椎動物の神経筋接合部との相違点
ショジョウバエ幼虫神経筋接合部では、神経伝達物質としてアセチルコリンではなく、グルタミン酸が用いられている。どの神経繊維がどの筋肉細胞に接合部を形成するかが同定されており、シナプス形成機構研究の良いモデル系となっている.脊椎動物の骨格筋とは異なり、幼虫の筋肉細胞には電位依存性ナトリウムチャンネルが存在せず、脱分極が広がらないため、筋肉細胞の大きさに合わせて、神経終末の拡大がみられる。また、脊椎動物の神経筋接合部とは異なり、発生過程において、最初から、決まった神経繊維が特定の筋肉細胞にシナプスを形成し、シナプス除去の機構はあまり必要ないと考えられていたが、近年では、神経活動を抑制すると、多シナプス状態が見られる[19]ことから、不要なシナプスを作らないようにする機構も存在している可能性も考えられるている。
シナプス形成機構に関わる分子機構の同定
この系を用いて、運動神経細胞による特異的標的選択機構が研究され、運動神経細胞とその標的の筋肉細胞には、細胞表面に存在し、目印として働くと考えられる同じ標的認識分子が発現していることが明らかになった[20] 。さらに、脊椎動物において、神経軸索の誘導や反発因子として働いているネトリン、セマフォリンのショウジョウバエホモログも、特定の筋肉細胞において発現し、標的選択機構に関与することが示されている[21]。また最近、Wntシグナルが神経筋接合部の特異性に関わることが明らかになっている[22]。
シナプス成熟機構・可塑性に関わる分子機構の同定
幼虫の成長に伴い、筋肉細胞の成長に合わせたシナプス終末の成長が見られる。このため、筋肉細胞の大きさに合わせたシナプス成熟・大きさの調節に関わる分子機構解明のための良いモデルともなっている。この過程には、筋肉細胞からの逆行性因子が関わっていると考えられ、成長因子、骨形成因子 (bone morphogenetic protein, BMP)シグナル系[23]やCaMKII[24], [25]が関与している可能性が示唆されている。
関連項目
参考文献
- ↑ Nichols JG, Martin AR, Wallace BG, Fuchs PA. In From Neuron to Brain, Fourth Edition, Chapter 11.
- ↑ 2.0 2.1
Hall, Z.W., & Sanes, J.R. (1993).
Synaptic structure and development: the neuromuscular junction. Cell, 72 Suppl, 99-121. [PubMed:8428377] [WorldCat] [DOI] - ↑
Katz, B., & Miledi, R. (1965).
The effect of temperature on the synaptic delay at the neuromuscular junction. The Journal of physiology, 181(3), 656-70. [PubMed:5880384] [PMC] [WorldCat] [DOI] - ↑
Katz, B., & Miledi, R. (1967).
The timing of calcium action during neuromuscular transmission. The Journal of physiology, 189(3), 535-44. [PubMed:6040160] [PMC] [WorldCat] [DOI] - ↑
FATT, P., & KATZ, B. (1952).
Spontaneous subthreshold activity at motor nerve endings. The Journal of physiology, 117(1), 109-28. [PubMed:14946732] [PMC] [WorldCat] - ↑
BOYD, I.A., & MARTIN, A.R. (1956).
Spontaneous subthreshold activity at mammalian neural muscular junctions. The Journal of physiology, 132(1), 61-73. [PubMed:13320372] [PMC] [WorldCat] [DOI] - ↑
Kuffler, S.W., & Yoshikami, D. (1975).
The number of transmitter molecules in a quantum: an estimate from iontophoretic application of acetylcholine at the neuromuscular synapse. The Journal of physiology, 251(2), 465-82. [PubMed:171380] [PMC] [WorldCat] [DOI] - ↑
Evers, J., Laser, M., Sun, Y.A., Xie, Z.P., & Poo, M.M. (1989).
Studies of nerve-muscle interactions in Xenopus cell culture: analysis of early synaptic currents. The Journal of neuroscience : the official journal of the Society for Neuroscience, 9(5), 1523-39. [PubMed:2723739] [WorldCat] - ↑
McMahan, U.J., Horton, S.E., Werle, M.J., Honig, L.S., Kröger, S., Ruegg, M.A., & Escher, G. (1992).
Agrin isoforms and their role in synaptogenesis. Current opinion in cell biology, 4(5), 869-74. [PubMed:1329871] [WorldCat] [DOI] - ↑
Denzer, A.J., Schulthess, T., Fauser, C., Schumacher, B., Kammerer, R.A., Engel, J., & Ruegg, M.A. (1998).
Electron microscopic structure of agrin and mapping of its binding site in laminin-1. The EMBO journal, 17(2), 335-43. [PubMed:9430625] [PMC] [WorldCat] [DOI] - ↑
DeChiara, T.M., Bowen, D.C., Valenzuela, D.M., Simmons, M.V., Poueymirou, W.T., Thomas, S., ..., & Yancopoulos, G.D. (1996).
The receptor tyrosine kinase MuSK is required for neuromuscular junction formation in vivo. Cell, 85(4), 501-12. [PubMed:8653786] [WorldCat] [DOI] - ↑
Luo, Z.G., Wang, Q., Zhou, J.Z., Wang, J., Luo, Z., Liu, M., ..., & Mei, L. (2002).
Regulation of AChR clustering by Dishevelled interacting with MuSK and PAK1. Neuron, 35(3), 489-505. [PubMed:12165471] [WorldCat] [DOI] - ↑
Redfern, P.A. (1970).
Neuromuscular transmission in new-born rats. The Journal of physiology, 209(3), 701-9. [PubMed:5499804] [PMC] [WorldCat] [DOI] - ↑
Brown, M.C., Jansen, J.K., & Van Essen, D. (1976).
Polyneuronal innervation of skeletal muscle in new-born rats and its elimination during maturation. The Journal of physiology, 261(2), 387-422. [PubMed:978579] [PMC] [WorldCat] [DOI] - ↑
Balice-Gordon, R.J., & Lichtman, J.W. (1993).
In vivo observations of pre- and postsynaptic changes during the transition from multiple to single innervation at developing neuromuscular junctions. The Journal of neuroscience : the official journal of the Society for Neuroscience, 13(2), 834-55. [PubMed:8426240] [WorldCat] - ↑
FATT, P., & KATZ, B. (1952).
Spontaneous subthreshold activity at motor nerve endings. The Journal of physiology, 117(1), 109-28. [PubMed:14946732] [PMC] [WorldCat] - ↑
Balice-Gordon, R.J., & Lichtman, J.W. (1994).
Long-term synapse loss induced by focal blockade of postsynaptic receptors. Nature, 372(6506), 519-24. [PubMed:7990923] [WorldCat] [DOI] - ↑ Nichols JG, Martin AR, Wallace BG, Fuchs PA. In From Neuron to Brain, Fourth Edition, Chapter 23.
- ↑
Jarecki, J., & Keshishian, H. (1995).
Role of neural activity during synaptogenesis in Drosophila. The Journal of neuroscience : the official journal of the Society for Neuroscience, 15(12), 8177-90. [PubMed:8613752] [WorldCat] - ↑ 能瀬聡直、ショウジョウバエ運動神経細胞による標的選択機構. 実験医学,2002,20(5), 151−4.
- ↑
Winberg, M.L., Mitchell, K.J., & Goodman, C.S. (1998).
Genetic analysis of the mechanisms controlling target selection: complementary and combinatorial functions of netrins, semaphorins, and IgCAMs. Cell, 93(4), 581-91. [PubMed:9604933] [WorldCat] [DOI] - ↑
Inaki, M., Yoshikawa, S., Thomas, J.B., Aburatani, H., & Nose, A. (2007).
Wnt4 is a local repulsive cue that determines synaptic target specificity. Current biology : CB, 17(18), 1574-9. [PubMed:17764943] [WorldCat] [DOI] - ↑
McCabe, B.D., Marqués, G., Haghighi, A.P., Fetter, R.D., Crotty, M.L., Haerry, T.E., ..., & O'Connor, M.B. (2003).
The BMP homolog Gbb provides a retrograde signal that regulates synaptic growth at the Drosophila neuromuscular junction. Neuron, 39(2), 241-54. [PubMed:12873382] [WorldCat] [DOI] - ↑
Haghighi, A.P., McCabe, B.D., Fetter, R.D., Palmer, J.E., Hom, S., & Goodman, C.S. (2003).
Retrograde control of synaptic transmission by postsynaptic CaMKII at the Drosophila neuromuscular junction. Neuron, 39(2), 255-67. [PubMed:12873383] [WorldCat] [DOI] - ↑
Kazama, H., Morimoto-Tanifuji, T., & Nose, A. (2003).
Postsynaptic activation of calcium/calmodulin-dependent protein kinase II promotes coordinated pre- and postsynaptic maturation of Drosophila neuromuscular junctions. Neuroscience, 117(3), 615-25. [PubMed:12617966] [WorldCat] [DOI]
(執筆者:森本高子 担当編集委員:河西春郎)