カルシウムカルモジュリン依存性タンパク質キナーゼ
竹本−木村 さやか
東京大学 大学院医学系研究科
DOI:10.14931/bsd.4566 原稿受付日:2014年4月22日 原稿完成日:2014年5月3日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英:Ca2+/calmodulin-dependent protein kinase、英略語:CaMK
カルシウムカルモジュリン依存性タンパク質キナーゼは、細胞内カルシウム濃度が上昇した際にカルシウムカルモジュリン複合体の直接結合により活性化される、セリン/スレオニンタンパク質リン酸化酵素である。複数の基質をリン酸化する多機能性カルシウムカルモジュリン依存性タンパク質キナーゼと、特定の基質を標的とするMLCK、eEF-2キナーゼなどが存在する。前者には、CaMKI、CaMKII、CaMKIVサブファミリーが知られ、特に脳内において豊富に存在し、シナプス可塑性や遺伝子発現制御、細胞骨格制御などの神経機能修飾において幅広い役割を担う。
歴史
1968年に骨格筋においてcAMPによるグリコーゲンの分解がタンパク質リン酸化により媒介されることが発見され、cAMPやcGMP、Ca2+といったセカンドメッセンジャーが細胞機能に及ぼす影響の多くが、タンパク質リン酸化により媒介されると考えられるようになった[1][2]。Ca2+によるタンパク質リン酸化活性の促進がまず報告されたのは、ホスホリラーゼキナーゼやミオシン軽鎖キナーゼ (myosin light chain kinase, MLCK)である。脳内における最初のCaMKII活性の報告は、シナプトソーム膜のCa2+依存的なリン酸化において、カルモジュリンが必要であるとの報告にさかのぼる[3]。
その後、1980年代初頭にトリプトファン水酸化酵素やシナプシンIを基質として、カルシウムカルモジュリン依存性タンパク質キナーゼII(Ca2+/calmodulin-dependent protein kinase II, CaMKII)が同定され[4][5]、複数のグループにより精製分離された。また、CaMKIは、シナプシンIを基質として、CaMKIIとは異なるリン酸化部位を標的とするリン酸化酵素として、同定・分離された[5][6]。
次いで1989年に、小脳顆粒細胞に豊富に存在する新たなCaMKとしてCaMKIVが報告された[7]。これらの、カルシウムカルモジュリン依存性タンパク質キナーゼ活性は、多組織に比べ脳において活性が高いことが示され、その後脳機能における研究が著しく展開され、シナプス可塑性や遺伝子発現制御、細胞骨格制御などの神経細胞機能修飾において幅広い機能を担うことが明らかとなった。
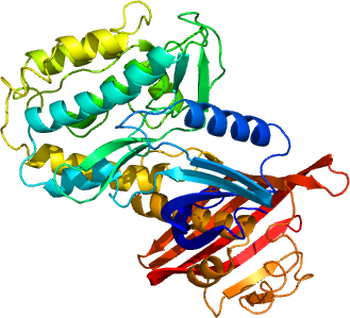
活性調節に重要なリン酸化部位を示す。
3SOA [8]より。
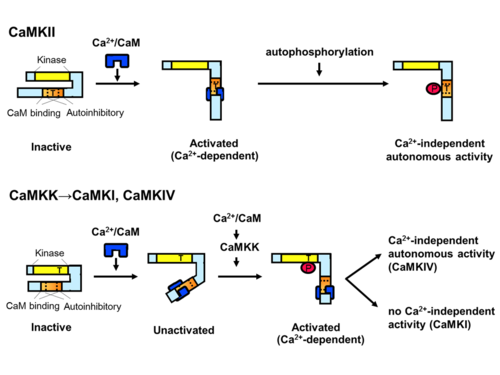
(上段)CaMKIIはCa2+/カルモジュリンの結合による活性化に伴い自己リン酸化を生じ、Ca2+-independent activity(autonomy)を獲得する。(下段)CaMKIならびにCaMKIVの活性化には、Ca2+/カルモジュリンの結合に加え、CaMKKによるキナーゼドメインactivation loop内スレオニン残基のリン酸化が必要で、CaMKK→CaMKI/IVカスケードを構成する。CaMKIVには本リン酸化に伴い、Ca2+-independent activityが付与される。
分類
Ca2+/カルモジュリンの結合によって活性化されるカルシウムカルモジュリン依存性タンパク質キナーゼも、特定の基質を標的とする"dedicated kinase"と、幅広い基質選択性を有した、多機能性カルシウムカルモジュリン依存性タンパク質キナーゼ"multifunctional kinase"に分類される。前者には、MLCK、eEF-2キナーゼ(CaMKIII)などが含まれ、後者には多機能性CaMKであるCaMKI、CaMKII、CaMKIVが分類される。多機能性CaMKは、ほとんどの組織に存在するが特に脳内での活性が高いことが古くから知られている。幅広い基質選択性により、複数の基質を細胞内でリン酸化することが可能で、その結果、多彩な神経細胞Ca2+上昇に応答した神経細胞機能修飾を担うと考えられている。
| 分類 | サブタイプ | ヒトにおける遺伝子名 | データベース上での遺伝子、タンパク質情報 | マウス脳における発現(Allen Brain Atlasより) | ||
| RefSeq | UniProt | HUGO | ||||
| CaMKI | α | CAMK1 | NM_003656 | Q14012 | ID1459 | 70445646 |
| β | PNCK | NM_001039582 | Q6P2M8 | ID13415 | 828 | |
| γ | CAMK1G | NM_020439 | Q96NX5 | ID14585 | 643550 | |
| δ | CAMK1D | NM_020397 | Q8IU85 | ID19341 | 69540302 | |
| CaMKII | α | CAMK2A | NM_015981 | Q9UQM7 | ID1460 | 79360274 |
| β | CAMK2B | NM_001220 | Q13554 | ID1461 | 70719036 | |
| γ | CAMK2G | NM_172171 | Q8WU40 | ID1463 | 190 | |
| δ | CAMK2D | NM_172127 | Q4G1A8 | ID1462 | 68668030 | |
| CaMKIV | CAMK4 | NM_001744 | Q16566 | ID1464 | 69540314 | |
多機能性CaMKの構造と活性化機構
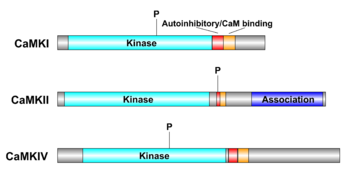
いずれのCaMKも、カルシウムカルモジュリン複合体の非存在下では、自己抑制ドメイン(autoinhibitory domain)により自己抑制されており、活性化にはカルシウムカルモジュリン複合体の結合が必要である。更に、リン酸化による制御を受けるが、その様式はCaMKIIとCaMKI、CaMKIVとで大きく異なっている[9]。
CaMKII
哺乳類のCaMKIIは、4つの遺伝子(CAMK2A (αサブユニット), CAMK2B (βサブユニット), CAMK2G (γサブユニット), CAMK2D (δサブユニット))によりコードされ、スプライスバリアントを含めると、40以上のアイソフォームによって構成される。基本構造として、N末端からATP結合ドメインを含むキナーゼドメイン、調節ドメイン(自己抑制ドメインとCa2+/カルモジュリン結合ドメインから構成)、C末端の多量体形成を担う自己会合ドメインを有する。ホロエンザイムは自己会合ドメインを介した会合により典型的には12量体を形成するとされる。自己抑制状態では、キナーゼドメイン内基質結合ポケットに自己抑制ドメインが偽基質として結合しており、Ca2+/カルモジュリンが隣接する領域に結合し自己抑制が解除されるとリン酸化能を発揮する[8][10]。これに伴い、調節ドメイン内のスレオニン残基(CaMKIIα のT286)が自己リン酸化されると、自己抑制が生じなくなり、Ca2+/カルモジュリン非存在化においても酵素活性を有する能力(autonomy)を発揮する。また、T286のリン酸化に伴いCaMに対する親和性が亢進する、CaM trappingという現象が知られ[11]、autonomyとともに、in vitroおよび培養細胞内[12]において計測される、非線形的な酵素活性化に寄与すると考えられている。特に、autonomyの状態に移行するかどうかは、Ca2+上昇の周波数に依存しており[13]、後述するLTPなどのシナプス可塑性発揮において重要な性質とされる。
CaMKK-CaMKI経路とCaMKK-CaMKVI 経路
哺乳類のCaMKIは、4種類の遺伝子(CAMK1 (αサブユニット), PNCK (βサブユニット), CAMK1G (γサブユニット), CAMK1D (δサブユニット))、CaMKIVは1種類の遺伝子(CAMK4)によりコードされる。基本構造は共通で、N末端からATP結合ドメインを含むキナーゼドメイン、自己抑制ドメインとCa2+/カルモジュリン結合ドメインから構成される調節ドメインからなる。リン酸化能発揮には、CaMKIIと同様に、調節ドメインの自己結合によるキナーゼドメインの抑制がCa2+/カルモジュリンの結合によって解除されることが必要である。また、キナーゼドメインactivation loop内に存在するスレオニン残基が上流キナーゼであるカルシウムカルモジュリン依存性タンパク質キナーゼキナーゼ(Calcium/calmodulin-dependent protein kinase kinase, CaMKK)によってリン酸化されると活性化されるという、CaMKIIにはない他のリン酸化酵素と共通した活性化メカニズムを有する。この、上流キナーゼであるCaMKKも活性化にCa2+/カルモジュリンを必要とするため、CaMKK-CaMKI、CaMKK-CaMKIVという、カルシウム依存的なリン酸化カスケードを構成する[14][15]。また、CaMKIVはCaMKKによるリン酸化を受けると、Ca2+/カルモジュリン非存在化においても酵素活性を発揮することが知られている[16]。
神経系における多機能性CaMKの機能
CaMKII
神経系において、α およびβアイソフォームが、αホモ多量体またはαとβのヘテロ多量体として存在し、海馬では総タンパク質のうち1-2%を占め特に興奮性シナプス、特にシナプス後膜肥厚に豊富に存在する。自己リン酸化によりautonomyを獲得するCaMKIIの生化学的特徴から記憶分子候補として注目され、薬理学的な手法に加え、遺伝子欠損マウスを用いた研究が推進され、CaMKIIαノックアウトマウスが海馬依存的な空間学習ならびに海馬LTPの異常を示すこと[17][18]、更にautonomyの重要性が自己リン酸化サイトT286の点変異導入マウス、T286Aノックインマウス[19]ならびにT286Dトランスジェニックマウス[20]などにより示された。CaMKIIによるシナプス増強作用はバレル野や視覚野などにおいても広く観察されている[21]。
NMDA型グルタミン酸受容体などと結合しシナプス後膜に局在し、AMPA型グルタミン酸受容体のリン酸化を介したコンダクタンスの増加と、膜貫通AMPA受容体結合タンパク質 (transmembrane AMPA receptor-interacting protein, TARP)のリン酸化を介したAMPA型グルタミン酸受容体のシナプス後膜へ輸送が、主たるCaMKIIを介したLTP誘導の分子基盤と考えられている[22]。また、CaMKII βは線維状アクチンに結合することでアクチン線維束形成に寄与し、スパイン内に豊富に存在しスパイン構造を保持する構造タンパク質としての機能も有するとされる[23][24][25]。
更に近年明らかとなった新機能として、CaMKIIα との相互作用による、プロテアソームのスパイン局在制御[26]、主要な脳内エンドカンナビノイドである2-アラキドノイルグリセロール (2-arachidonoylglycerol, 2-AG)合成酵素、ジアシルグリセロールリパーゼ (diacylglycerol lipase-α, DGLα)の活性抑制作用[27]、CaMKIIβとArcタンパク質の相互作用を介した Arcの非活性シナプス集積、ならびにAMPA型グルタミン酸受容体のエンドサイトーシス調節作用[28]などが挙げられる。
CaMKIV
CaMKIVは核内に非常に多く、神経活動依存的に転写因子CREBをリン酸化し活性化する[29]。その結果、c-fosやArc、zif268(egr-1)、脳由来神経栄養因子(BDNF)等の最初期遺伝子群など、長期的な可塑的変化に必要なタンパク質の転写を神経活動依存的に促進するとされる。遺伝子改変マウスを用いた研究が進められ、細胞機能と合致し、ノックアウトマウスにおいて海馬LTP障害、小脳LTD障害とともにCREBリン酸化の低下が[30]、行動レベルでは小脳機能障害[31]および長期恐怖記憶の異常[32]が報告されている。先に述べたCaMKIIを介した短期シナプス可塑性に加えて、シナプス刺激によってもうひとつのCaMキナーゼ経路であるCaMKK-CaMKIV経路が活性化されることが、長期シナプス可塑性を引き起こすために必要であり長期記憶の成立に寄与すると考えられている。
CaMKI
CaMKIの局在はアイソフォームによって異なっており、CaMKIαが細胞質に存在するのに対し、CaMKIγはC末端のパルミトイル化、プレニル化2重脂質修飾による膜アンカー型キナーゼである。上述の、記憶学習・神経可塑性など高次脳機能における研究が著しく進むCaMKIIやCaMKIVに比べ、CaMKIファミリーの神経機能は長年全く不明で、“orphan kinase”とも呼ばれていたが、神経初代培養やスライス培養系の研究が近年進み神経細胞形態制御に深く寄与することが示されている。これらには、軸索樹状突起伸展制御[33][34][35]、スパイン形成制御[36]などが含まれ、神経回路形成において重要な役割を担うと考えられる。一方記憶・学習などの個体行動制御における役割は未だ不明である[37][38]。
関連項目
参考文献
- ↑
Greengard, P. (1978).
Phosphorylated proteins as physiological effectors. Science (New York, N.Y.), 199(4325), 146-52. [PubMed:22932] [WorldCat] [DOI] - ↑
Nestler, E.J., & Greengard, P. (1983).
Protein phosphorylation in the brain. Nature, 305(5935), 583-8. [PubMed:6312325] [WorldCat] [DOI] - ↑
Schulman, H., & Greengard, P. (1978).
Stimulation of brain membrane protein phosphorylation by calcium and an endogenous heat-stable protein. Nature, 271(5644), 478-9. [PubMed:628428] [WorldCat] [DOI] - ↑
Yamauchi, T., & Fujisawa, H. (1980).
Evidence for three distinct forms of calmodulin-dependent protein kinases from rat brain. FEBS letters, 116(2), 141-4. [PubMed:7409141] [WorldCat] [DOI] - ↑ 5.0 5.1
Kennedy, M.B., & Greengard, P. (1981).
Two calcium/calmodulin-dependent protein kinases, which are highly concentrated in brain, phosphorylate protein I at distinct sites. Proceedings of the National Academy of Sciences of the United States of America, 78(2), 1293-7. [PubMed:6785753] [PMC] [WorldCat] [DOI] - ↑
Nairn, A.C., Hemmings, H.C., & Greengard, P. (1985).
Protein kinases in the brain. Annual review of biochemistry, 54, 931-76. [PubMed:2411213] [WorldCat] [DOI] - ↑
Ohmstede, C.A., Jensen, K.F., & Sahyoun, N.E. (1989).
Ca2+/calmodulin-dependent protein kinase enriched in cerebellar granule cells. Identification of a novel neuronal calmodulin-dependent protein kinase. The Journal of biological chemistry, 264(10), 5866-75. [PubMed:2538431] [WorldCat] - ↑ 8.0 8.1
Chao, L.H., Stratton, M.M., Lee, I.H., Rosenberg, O.S., Levitz, J., Mandell, D.J., ..., & Kuriyan, J. (2011).
A mechanism for tunable autoinhibition in the structure of a human Ca2+/calmodulin- dependent kinase II holoenzyme. Cell, 146(5), 732-45. [PubMed:21884935] [PMC] [WorldCat] [DOI] - ↑
Soderling, T.R., & Stull, J.T. (2001).
Structure and regulation of calcium/calmodulin-dependent protein kinases. Chemical reviews, 101(8), 2341-52. [PubMed:11749376] [WorldCat] - ↑
Stratton, M.M., Chao, L.H., Schulman, H., & Kuriyan, J. (2013).
Structural studies on the regulation of Ca2+/calmodulin dependent protein kinase II. Current opinion in structural biology, 23(2), 292-301. [PubMed:23632248] [PMC] [WorldCat] [DOI] - ↑
Meyer, T., Hanson, P.I., Stryer, L., & Schulman, H. (1992).
Calmodulin trapping by calcium-calmodulin-dependent protein kinase. Science (New York, N.Y.), 256(5060), 1199-202. [PubMed:1317063] [WorldCat] [DOI] - ↑
Fujii, H., Inoue, M., Okuno, H., Sano, Y., Takemoto-Kimura, S., Kitamura, K., ..., & Bito, H. (2013).
Nonlinear decoding and asymmetric representation of neuronal input information by CaMKIIα and calcineurin. Cell reports, 3(4), 978-87. [PubMed:23602566] [WorldCat] [DOI] - ↑
De Koninck, P., & Schulman, H. (1998).
Sensitivity of CaM kinase II to the frequency of Ca2+ oscillations. Science (New York, N.Y.), 279(5348), 227-30. [PubMed:9422695] [WorldCat] [DOI] - ↑
Tokumitsu, H., Brickey, D.A., Glod, J., Hidaka, H., Sikela, J., & Soderling, T.R. (1994).
Activation mechanisms for Ca2+/calmodulin-dependent protein kinase IV. Identification of a brain CaM-kinase IV kinase. The Journal of biological chemistry, 269(46), 28640-7. [PubMed:7961813] [WorldCat] - ↑
Haribabu, B., Hook, S.S., Selbert, M.A., Goldstein, E.G., Tomhave, E.D., Edelman, A.M., ..., & Means, A.R. (1995).
Human calcium-calmodulin dependent protein kinase I: cDNA cloning, domain structure and activation by phosphorylation at threonine-177 by calcium-calmodulin dependent protein kinase I kinase. The EMBO journal, 14(15), 3679-86. [PubMed:7641687] [PMC] [WorldCat] - ↑
Tokumitsu, H., Hatano, N., Inuzuka, H., Yokokura, S., Nozaki, N., & Kobayashi, R. (2004).
Mechanism of the generation of autonomous activity of Ca2+/calmodulin-dependent protein kinase IV. The Journal of biological chemistry, 279(39), 40296-302. [PubMed:15262966] [WorldCat] [DOI] - ↑
Silva, A.J., Paylor, R., Wehner, J.M., & Tonegawa, S. (1992).
Impaired spatial learning in alpha-calcium-calmodulin kinase II mutant mice. Science (New York, N.Y.), 257(5067), 206-11. [PubMed:1321493] [WorldCat] [DOI] - ↑
Silva, A.J., Stevens, C.F., Tonegawa, S., & Wang, Y. (1992).
Deficient hippocampal long-term potentiation in alpha-calcium-calmodulin kinase II mutant mice. Science (New York, N.Y.), 257(5067), 201-6. [PubMed:1378648] [WorldCat] [DOI] - ↑
Giese, K.P., Fedorov, N.B., Filipkowski, R.K., & Silva, A.J. (1998).
Autophosphorylation at Thr286 of the alpha calcium-calmodulin kinase II in LTP and learning. Science (New York, N.Y.), 279(5352), 870-3. [PubMed:9452388] [WorldCat] [DOI] - ↑
Mayford, M., Bach, M.E., Huang, Y.Y., Wang, L., Hawkins, R.D., & Kandel, E.R. (1996).
Control of memory formation through regulated expression of a CaMKII transgene. Science (New York, N.Y.), 274(5293), 1678-83. [PubMed:8939850] [WorldCat] [DOI] - ↑
Fox, K., & Wong, R.O. (2005).
A comparison of experience-dependent plasticity in the visual and somatosensory systems. Neuron, 48(3), 465-77. [PubMed:16269363] [WorldCat] [DOI] - ↑
Lisman, J., Yasuda, R., & Raghavachari, S. (2012).
Mechanisms of CaMKII action in long-term potentiation. Nature reviews. Neuroscience, 13(3), 169-82. [PubMed:22334212] [PMC] [WorldCat] [DOI] - ↑
Okamoto, K., Narayanan, R., Lee, S.H., Murata, K., & Hayashi, Y. (2007).
The role of CaMKII as an F-actin-bundling protein crucial for maintenance of dendritic spine structure. Proceedings of the National Academy of Sciences of the United States of America, 104(15), 6418-23. [PubMed:17404223] [PMC] [WorldCat] [DOI] - ↑
Bosch, M., & Hayashi, Y. (2012).
Structural plasticity of dendritic spines. Current opinion in neurobiology, 22(3), 383-8. [PubMed:21963169] [PMC] [WorldCat] [DOI] - ↑
Hell, J.W. (2014).
CaMKII: claiming center stage in postsynaptic function and organization. Neuron, 81(2), 249-65. [PubMed:24462093] [PMC] [WorldCat] [DOI] - ↑
Bingol, B., Wang, C.F., Arnott, D., Cheng, D., Peng, J., & Sheng, M. (2010).
Autophosphorylated CaMKIIalpha acts as a scaffold to recruit proteasomes to dendritic spines. Cell, 140(4), 567-78. [PubMed:20178748] [WorldCat] [DOI] - ↑
Shonesy, B.C., Wang, X., Rose, K.L., Ramikie, T.S., Cavener, V.S., Rentz, T., ..., & Colbran, R.J. (2013).
CaMKII regulates diacylglycerol lipase-α and striatal endocannabinoid signaling. Nature neuroscience, 16(4), 456-63. [PubMed:23502535] [PMC] [WorldCat] [DOI] - ↑
Okuno, H., Akashi, K., Ishii, Y., Yagishita-Kyo, N., Suzuki, K., Nonaka, M., ..., & Bito, H. (2012).
Inverse synaptic tagging of inactive synapses via dynamic interaction of Arc/Arg3.1 with CaMKIIβ. Cell, 149(4), 886-98. [PubMed:22579289] [PMC] [WorldCat] [DOI] - ↑
Bito, H., Deisseroth, K., & Tsien, R.W. (1996).
CREB phosphorylation and dephosphorylation: a Ca(2+)- and stimulus duration-dependent switch for hippocampal gene expression. Cell, 87(7), 1203-14. [PubMed:8980227] [WorldCat] [DOI] - ↑
Ho, N., Liauw, J.A., Blaeser, F., Wei, F., Hanissian, S., Muglia, L.M., ..., & Chatila, T.A. (2000).
Impaired synaptic plasticity and cAMP response element-binding protein activation in Ca2+/calmodulin-dependent protein kinase type IV/Gr-deficient mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(17), 6459-72. [PubMed:10964952] [PMC] [WorldCat] - ↑
Ribar, T.J., Rodriguiz, R.M., Khiroug, L., Wetsel, W.C., Augustine, G.J., & Means, A.R. (2000).
Cerebellar defects in Ca2+/calmodulin kinase IV-deficient mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(22), RC107. [PubMed:11069976] [PMC] [WorldCat] - ↑
Wei, F., Qiu, C.S., Liauw, J., Robinson, D.A., Ho, N., Chatila, T., & Zhuo, M. (2002).
Calcium calmodulin-dependent protein kinase IV is required for fear memory. Nature neuroscience, 5(6), 573-9. [PubMed:12006982] [WorldCat] [DOI] - ↑
Wayman, G.A., Impey, S., Marks, D., Saneyoshi, T., Grant, W.F., Derkach, V., & Soderling, T.R. (2006).
Activity-dependent dendritic arborization mediated by CaM-kinase I activation and enhanced CREB-dependent transcription of Wnt-2. Neuron, 50(6), 897-909. [PubMed:16772171] [WorldCat] [DOI] - ↑
Takemoto-Kimura, S., Ageta-Ishihara, N., Nonaka, M., Adachi-Morishima, A., Mano, T., Okamura, M., ..., & Bito, H. (2007).
Regulation of dendritogenesis via a lipid-raft-associated Ca2+/calmodulin-dependent protein kinase CLICK-III/CaMKIgamma. Neuron, 54(5), 755-70. [PubMed:17553424] [WorldCat] [DOI] - ↑
Ageta-Ishihara, N., Takemoto-Kimura, S., Nonaka, M., Adachi-Morishima, A., Suzuki, K., Kamijo, S., ..., & Bito, H. (2009).
Control of cortical axon elongation by a GABA-driven Ca2+/calmodulin-dependent protein kinase cascade. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(43), 13720-9. [PubMed:19864584] [PMC] [WorldCat] [DOI] - ↑
Saneyoshi, T., Wayman, G., Fortin, D., Davare, M., Hoshi, N., Nozaki, N., ..., & Soderling, T.R. (2008).
Activity-dependent synaptogenesis: regulation by a CaM-kinase kinase/CaM-kinase I/betaPIX signaling complex. Neuron, 57(1), 94-107. [PubMed:18184567] [PMC] [WorldCat] [DOI] - ↑
Wayman, G.A., Lee, Y.S., Tokumitsu, H., Silva, A.J., Silva, A., & Soderling, T.R. (2008).
Calmodulin-kinases: modulators of neuronal development and plasticity. Neuron, 59(6), 914-31. [PubMed:18817731] [PMC] [WorldCat] [DOI] - ↑
Takemoto-Kimura, S., Suzuki, K., Kamijo, S., Ageta-Ishihara, N., Fujii, H., Okuno, H., & Bito, H. (2010).
Differential roles for CaM kinases in mediating excitation-morphogenesis coupling during formation and maturation of neuronal circuits. The European journal of neuroscience, 32(2), 224-30. [PubMed:20946112] [WorldCat] [DOI]