「PDZドメインタンパク質」の版間の差分
細 →構造 |
細 →分類 |
||
| (3人の利用者による、間の10版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">坪山 幸太郎、[http://researchmap.jp/tanakasj 田中 慎二]、[http://researchmap.jp/shigeookabe 岡部 繁男]</font><br> | <font size="+1">坪山 幸太郎、[http://researchmap.jp/tanakasj 田中 慎二]、[http://researchmap.jp/shigeookabe 岡部 繁男]</font><br> | ||
''東京大学大学院医学系研究科''<br> | ''東京大学大学院医学系研究科''<br> | ||
DOI:<selfdoi /> 原稿受付日:2013年10月31日 原稿完成日:2015年12月30日<br> | |||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
英語名:PDZ domain protein 独:PDZ-Domänen Proteine 仏:protéines à domaine PDZ | |||
{{box|text= | {{box|text= | ||
PDZドメインとは、様々な足場タンパク質において共通してみられる、80から90アミノ酸からなるタンパク質ドメインであり、PDZドメインを有するタンパク質をPDZドメインタンパク質と総称する。同様なドメインが[[wikipedia:ja:バクテリア|バクテリア]]、[[wikipedia:ja:酵母|酵母]]、[[ショウジョウバエ]]など様々な生物種のタンパク質に存在することがわかっている。 | |||
PDZドメインは、リガンドタンパク質のC末端に結合する。この相互作用によって、シグナル伝達や細胞内輸送に関わる大きなタンパク質複合体が形成される。神経細胞では[[PSD-95]]ファミリー、[[PICK1]]、[[Shank]]などがPDZドメインを含む代表的なタンパク質である。細胞内におけるタンパク質の組成や空間配置は、PDZドメインタンパク質によって厳密に制御されていると考えられている。 | |||
}} | }} | ||
{{Pfam_box | |||
| Symbol = PDZ | |||
| Name = | |||
| image =1BFE.pdb | |||
| width =200 | |||
| caption =PSD-95 第3PDZドメインの立体構造。1BFEによる。 | |||
| Pfam= PF00595 | |||
| InterPro= IPR001478 | |||
| SMART= PDZ | |||
| PROSITE= PDOC50106 | |||
| SCOP = 1lcy | |||
| TCDB = | |||
| OPM family= | |||
| OPM protein= | |||
| CDD = cd00136 | |||
| PDB= | |||
{{PDB3|1l1j}}B:248-262 {{PDB3|1lcy}}A:388-442 {{PDB3|1fc7}}A:151-232 | |||
{{PDB3|1fc9}}A:151-232 {{PDB3|1fcf}}A:151-232 {{PDB3|1fc6}}A:151-232 | |||
{{PDB3|1ueq}}A:426-492 {{PDB3|1ujv}}A:639-680 {{PDB3|1i92}}A:14-91 | |||
{{PDB3|1g9o}}A:14-91 {{PDB3|1q3o}}A:663-754 {{PDB3|1q3p}}A:663-754 | |||
{{PDB3|1uep}}A:778-859 {{PDB3|1wfv}}A:1147-1226 {{PDB3|1uew}}A:920-1007 | |||
{{PDB3|2cs5}}A:517-602 {{PDB3|1qav}}A:81-161 {{PDB3|2pdz}}A:81-161 | |||
{{PDB3|1z86}}A:81-161 {{PDB3|1z87}}A:81-161 {{PDB3|1pdr}} :466-544 | |||
{{PDB3|1tq3}}A:313-391 {{PDB3|1be9}}A:313-391 {{PDB3|1bfe}}A:313-391 | |||
{{PDB3|1tp5}}A:313-391 {{PDB3|1tp3}}A:313-391 {{PDB3|1um7}}A:386-464 | |||
{{PDB3|1iu2}}A:65-149 {{PDB3|1iu0}}A:65-149 {{PDB3|1kef}}A:65-149 | |||
{{PDB3|1zok}}A:224-308 {{PDB3|1qlc}}A:160-244 {{PDB3|2byg}}A:193-277 | |||
{{PDB3|2fe5}}A:226-310 {{PDB3|1wi2}}A:47-125 {{PDB3|1wha}}A:871-947 | |||
{{PDB3|1x5q}}A:728-812 {{PDB3|1t2m}}A:993-1073 {{PDB3|1um1}}A:974-1056 | |||
{{PDB3|1wf8}}A:504-589 {{PDB3|1gm1}}A:1357-1439 {{PDB3|1ozi}}A:1357-1439 | |||
{{PDB3|1vj6}}A:1357-1439 {{PDB3|1d5g}}A:1368-1450 {{PDB3|3pdz}}A:1368-1450 | |||
{{PDB3|1q7x}}A:1368-1450 {{PDB3|1uju}}A:1100-1189 {{PDB3|1wi4}}A:22-94 | |||
{{PDB3|1l6o}}A:254-339 {{PDB3|1mc7}}A:251-336 {{PDB3|1n7t}}A:1323-1407 | |||
{{PDB3|1mfg}}A:1323-1407 {{PDB3|1mfl}}A:1323-1407 {{PDB3|1uez}}A:140-219 | |||
{{PDB3|1uf1}}A:279-357 {{PDB3|1x5n}}A:211-289 {{PDB3|1ihj}}A:17-103 | |||
{{PDB3|1uhp}}A:249-336 {{PDB3|1uit}}A:1240-1316 {{PDB3|1x6d}}A:412-495 | |||
{{PDB3|2csj}}A:10-94 {{PDB3|1m5z}}A:988-1067 {{PDB3|2css}}A:605-688 | |||
{{PDB3|1zub}}A:619-702 {{PDB3|1wfg}}A:668-753 {{PDB3|1ufx}}A:816-887 | |||
{{PDB3|1qau}}A:17-96 {{PDB3|1b8q}}A:17-96 {{PDB3|1u38}}A:656-740 | |||
{{PDB3|1u37}}A:656-740 {{PDB3|1u3b}}A:656-740 {{PDB3|1x45}}A:656-740 | |||
{{PDB3|1p1d}}A:471-557 {{PDB3|1p1e}}A:471-557 {{PDB3|1x5r}}A:456-542 | |||
{{PDB3|1v62}}A:248-329 {{PDB3|1n7f}}A:672-751 {{PDB3|1n7e}}A:672-751 | |||
{{PDB3|1wf7}}A:5-82 {{PDB3|1rgw}}A:4-81 {{PDB3|1vb7}}A:3-81 | |||
{{PDB3|1i16}} :533-616 {{PDB3|1v6b}}A:752-838 {{PDB3|2f5y}}B:300-373 | |||
{{PDB3|1whd}}A:18-92 {{PDB3|1ybo}}A:114-191 {{PDB3|1v1t}}B:114-191 | |||
{{PDB3|1obz}}B:114-191 {{PDB3|1n99}}A:114-191 {{PDB3|1wh1}}A:419-501 | |||
{{PDB3|1va8}}A:256-333 {{PDB3|1kwa}}A:490-568 {{PDB3|1nf3}}D:157-247 | |||
{{PDB3|1rzx}}A:160-250 {{PDB3|1oby}}B:198-270 {{PDB3|1obx}}A:198-270 | |||
{{PDB3|1nte}}A:198-270 {{PDB3|1r6j}}A:198-270 {{PDB3|1u39}}A:747-820 | |||
{{PDB3|1y7n}}A:747-820 | |||
}} | |||
== 名称の変遷 == | == 名称の変遷 == | ||
PDZドメインは、まずPSD-95に含まれるということが発見され、[[グリシン]]、[[wikipedia:ja:ロイシン|ロイシン]]、グリシン、[[wikipedia:ja:フェニルアラニン|フェニルアラニン]]という特徴的な4つのアミノ酸の繰り返し配列があることから、GLGFと名付けられた。次いで、[[Drosophila disc large tumor suppressor]]([[Dlg1]])にも存在していることが確認され、Dlg homologous region(DHR)とも呼ばれることになった。その直後、zonula occludens-1 protein(ZO-1)にも存在することがわかり、最終的に、<u>P</u>SD-95、<u>D</u>lg1、<u>Z</u>O-1の頭文字を時系列にそって、PDZドメインと呼ばれるようになった<ref name=ref1><pubmed>7482701</pubmed></ref>。 | |||
== 構造 == | == 構造 == | ||
| 21行目: | 73行目: | ||
[[image:PDZ fig1.jpg|thumb|350px|'''図1.PDZドメインの構造'''<ref name=ref6><pubmed>15378037</pubmed></ref><br>紫色の矢印がリガンドタンパク質を表す。許可を得て転載。]] | [[image:PDZ fig1.jpg|thumb|350px|'''図1.PDZドメインの構造'''<ref name=ref6><pubmed>15378037</pubmed></ref><br>紫色の矢印がリガンドタンパク質を表す。許可を得て転載。]] | ||
[[image:PDZ fig2.jpg|thumb|350px|'''図2.PDZドメインを持つタンパク質の例'''<ref name=ref6><pubmed>15378037</pubmed></ref><br>許可を得て転載。]] | |||
一般的に、PDZドメインは、6つの[[wikipedia:ja:βストランド構造|βストランド構造]](βA-F)と2つの[[wikipedia:ja:αヘリックス構造|αヘリックス構造]](αA-B)からなる。リガンドタンパク質はアンチパラレルとなるβストランド構造を持ち、PDZドメインのβBとαBとの間の溝にはまり込むことで結合する。これをβ-strand additionと呼ぶ。PDZドメインのC末端とN末端は非常に近接しているため、PDZドメインが複数並んでいる場合、リガンドタンパク質も近接して位置することになる。この構造的特徴によりリガンドタンパク質間の相互作用が促進されると考えられている<ref name=ref2><pubmed>11741967</pubmed></ref> <ref name=ref3><pubmed>14739991</pubmed></ref> <ref name=ref4><pubmed>11591811</pubmed></ref>。 | |||
===リガンドタンパク質のC末端構造=== | ===リガンドタンパク質のC末端構造=== | ||
リガンドタンパク質においてPDZドメインとの結合に重要な構造は、先述した溝と相互作用するC末端部分の4つのアミノ酸残基である<ref name=ref2 /> | リガンドタンパク質においてPDZドメインとの結合に重要な構造は、先述した溝と相互作用するC末端部分の4つのアミノ酸残基である<ref name=ref2 />。両者の安定な結合にはPDZドメインのβBストランド構造との間の[[wikipedia:ja:水素結合|水素結合]]が寄与している。 | ||
=== | ===分類=== | ||
PDZドメインタンパク質とリガンドタンパク質との結合は、αBの最初のアミノ酸残基とリガンドタンパク質のC末端から3番目の位置(C(-2))のアミノ酸残基との相互作用によっている<ref name=ref2 />。そのため、リガンドタンパク質のC(-2)に位置するアミノ酸の種類によって、それと結合するPDZドメインタンパク質の分類が行われている。 | PDZドメインタンパク質とリガンドタンパク質との結合は、αBの最初のアミノ酸残基とリガンドタンパク質のC末端から3番目の位置(C(-2))のアミノ酸残基との相互作用によっている<ref name=ref2 />。そのため、リガンドタンパク質のC(-2)に位置するアミノ酸の種類によって、それと結合するPDZドメインタンパク質の分類が行われている。 | ||
クラス Iには、PSD-95などが含まれ、C(-2)には、[[セリン]]または[[スレオニン]]が存在している。 | |||
クラス IIには、[[PICK1]]などが含まれ、C(-2)には、[[wikipedia:ja:疎水性アミノ酸|疎水性アミノ酸]]残基が存在している。クラス IIIには、[[nNOS]]などが含まれ、C(-2)には、[[グルタミン酸]]や[[アルギニン酸]]といった負の電荷をもつアミノ酸が存在する。 | |||
C(-2)の位置のアミノ酸も重要であるが、その一つN末端側のC(-3)の位置のアミノ酸も、PDZドメインタンパク質とリガンドタンパク質との特異的な結合において重要である事がわかっている。 | C(-2)の位置のアミノ酸も重要であるが、その一つN末端側のC(-3)の位置のアミノ酸も、PDZドメインタンパク質とリガンドタンパク質との特異的な結合において重要である事がわかっている。 | ||
{| class="wikitable | {| class="wikitable" | ||
|+ 表1.PDZドメインの分類 | |+ 表1.PDZドメインの分類 | ||
|- | |- | ||
! Class!! C末端配列!! リガンドタンパク質!! PDZドメインタンパク質 | |||
|- | |- | ||
| | |colspan="4" | '''Class I''' | ||
| | |||
|- | |- | ||
| rowspan="3" | X-S/T-X-V | | rowspan="3" | X-S/T-X-V | ||
| E-S-D-V | | E-S-D-V | ||
| NMDAR2A/B | | [[NMDAR2A]]/[[NMDAR2B|B]] | ||
| PSD-95 (PDZ2) | | PSD-95 (PDZ2) | ||
|- | |- | ||
| T-T-R-V | | T-T-R-V | ||
| | | [[ニューロリギン]] | ||
| PSD-95 (PDZ3) | | PSD-95 (PDZ3) | ||
|- | |- | ||
| E-S-L-V | | E-S-L-V | ||
| | | [[ナトリウムチャネル|電位依存性ナトリウムチャネル]] | ||
| | | [[シントロフィン]] | ||
|- | |- | ||
| rowspan="2" | X-S/T-X-L | | rowspan="2" | X-S/T-X-L | ||
| Q-T-R-L | | Q-T-R-L | ||
| GKAP | | [[GKAP]] | ||
| Shank | | [[Shank]] | ||
|- | |- | ||
| S-S-T-L | | S-S-T-L | ||
| mGluR5 | | [[代謝活性型グルタミン酸受容体]][[mGluR5]] | ||
| Shank | | Shank | ||
|- | |- | ||
| | |colspan="4" | '''Class II''' | ||
| | |||
|- | |- | ||
| rowspan="4" | X-φ-X-φ | | rowspan="4" | X-φ-X-φ | ||
| S-V-K-I | | S-V-K-I | ||
| GluR2 | | [[AMPA型グルタミン酸受容体]][[GluR2]] | ||
| PICK-1, GRIP (PDZ5) | | PICK-1, [[GRIP]] (PDZ5) | ||
|- | |- | ||
| S-V-E-V | | S-V-E-V | ||
| EphB2 | | [[EphB2]] | ||
| PICK-1, GRIP (PDZ6) | | PICK-1, GRIP (PDZ6) | ||
|- | |- | ||
| E-F-Y-A | | E-F-Y-A | ||
| | | [[シンデカン]] | ||
| CASK | | [[CASK]] | ||
|- | |- | ||
| E-Y-Y-V | | E-Y-Y-V | ||
| | | [[ニューレキシン]] | ||
| CASK | | CASK | ||
|- | |- | ||
| | |colspan="4" | '''Class III''' | ||
| | |||
|- | |- | ||
| X-D-X-V | | X-D-X-V | ||
| V-D-S-V | | V-D-S-V | ||
| | | [[メラトニン受容体]] | ||
| nNOS | | nNOS | ||
|- | |- | ||
| 103行目: | 147行目: | ||
X:任意のアミノ酸、φ:疎水性アミノ酸 | X:任意のアミノ酸、φ:疎水性アミノ酸 | ||
===特徴=== | |||
PDZドメインタンパク質の特徴として、PDZドメインを複数もつ分子が多いということがあげられる<ref name=ref2 />。現在発見されているタンパク質の中では、13個のPDZドメインをもつ[[MUPP1]]が最も多くPDZドメインを持つタンパク質として知られている<ref name=ref5><pubmed>9537516</pubmed></ref>。また、複数のPDZドメインは連続したグループとして存在しており、このような構造的特徴がPDZドメインに結合するリガンドタンパク質を協調的に働かせるのに資していると考えられている。 | |||
==調整機構== | ==調整機構== | ||
PDZドメインタンパク質とリガンドタンパク質の相互作用は[[リン酸化]]によって調節される<ref name=ref6 />。典型的には、リガンドタンパク質のC末端のリン酸化によって、PDZドメインとの相互作用が阻害される。例えば、[[カリウムチャネル]]や[[β1アドレナリン受容体]]などのC末端がリン酸化されることによって、PSD-95のPDZドメインとの結合能が低下する。また、PDZドメインのリン酸化もリガンドタンパク質との相互作用に影響を及ぼす。例えば、[[Ca2+/カルモジュリン依存製タンパク質キナーゼII|Ca<sup>2+</sup>/カルモジュリン依存製タンパク質キナーゼII]] ([[Ca2+/calmodulin dependent protein kinase II|Ca<sup>2+</sup>/calmodulin dependent protein kinase II]], [[CaMKII]])依存的に[[synapse-associated protein97]]([[SAP97]])のPDZドメインがリン酸化されることによって、[[NMDA受容型グルタミン酸]]のサブユニットの[[NR2A]]との相互作用が低下する。 | |||
==機能== | ==機能== | ||
PDZドメインはタンパク質間の相互作用に重要な役割を果たす。PDZドメインを含むタンパク質は受容体やシグナル分子といった情報伝達に関連するタンパク質の位置を調節し、シグナル伝達のための超分子複合体の足場タンパク質として機能する<ref name=ref2 />。例えば、ショウジョウバエにおいて、PDZドメインを複数もつ[[InaD]]は、光情報伝達回路中の[[イオンチャネル]]とシグナル分子を一つにまとめている<ref name=ref7><pubmed>21703451</pubmed></ref>。 | |||
==関連項目== | |||
*[[PSD-95]] | |||
*[[足場タンパク質]] | |||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2015年12月30日 (水) 16:25時点における最新版
坪山 幸太郎、田中 慎二、岡部 繁男
東京大学大学院医学系研究科
DOI:10.14931/bsd.4395 原稿受付日:2013年10月31日 原稿完成日:2015年12月30日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:PDZ domain protein 独:PDZ-Domänen Proteine 仏:protéines à domaine PDZ
PDZドメインとは、様々な足場タンパク質において共通してみられる、80から90アミノ酸からなるタンパク質ドメインであり、PDZドメインを有するタンパク質をPDZドメインタンパク質と総称する。同様なドメインがバクテリア、酵母、ショウジョウバエなど様々な生物種のタンパク質に存在することがわかっている。
PDZドメインは、リガンドタンパク質のC末端に結合する。この相互作用によって、シグナル伝達や細胞内輸送に関わる大きなタンパク質複合体が形成される。神経細胞ではPSD-95ファミリー、PICK1、ShankなどがPDZドメインを含む代表的なタンパク質である。細胞内におけるタンパク質の組成や空間配置は、PDZドメインタンパク質によって厳密に制御されていると考えられている。
PSD-95 第3PDZドメインの立体構造。1BFEによる。 | |||||||||
| Identifiers | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Symbol | PDZ | ||||||||
| Pfam | PF00595 | ||||||||
| InterPro | IPR001478 | ||||||||
| SMART | PDZ | ||||||||
| PROSITE | PDOC50106 | ||||||||
| SCOP | 1lcy | ||||||||
| SUPERFAMILY | 1lcy | ||||||||
| CDD | cd00136 | ||||||||
| |||||||||
名称の変遷
PDZドメインは、まずPSD-95に含まれるということが発見され、グリシン、ロイシン、グリシン、フェニルアラニンという特徴的な4つのアミノ酸の繰り返し配列があることから、GLGFと名付けられた。次いで、Drosophila disc large tumor suppressor(Dlg1)にも存在していることが確認され、Dlg homologous region(DHR)とも呼ばれることになった。その直後、zonula occludens-1 protein(ZO-1)にも存在することがわかり、最終的に、PSD-95、Dlg1、ZO-1の頭文字を時系列にそって、PDZドメインと呼ばれるようになった[1]。
構造
PDZドメインの構造
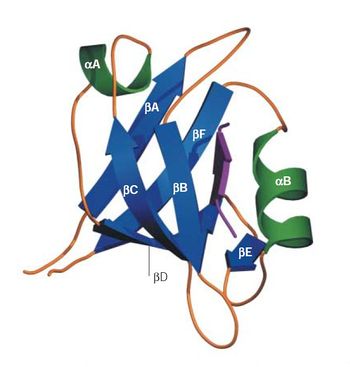
紫色の矢印がリガンドタンパク質を表す。許可を得て転載。
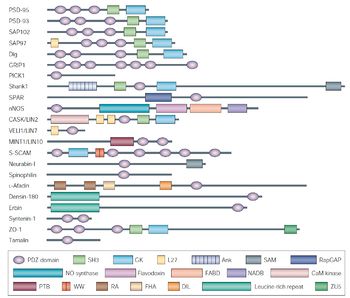
許可を得て転載。
一般的に、PDZドメインは、6つのβストランド構造(βA-F)と2つのαヘリックス構造(αA-B)からなる。リガンドタンパク質はアンチパラレルとなるβストランド構造を持ち、PDZドメインのβBとαBとの間の溝にはまり込むことで結合する。これをβ-strand additionと呼ぶ。PDZドメインのC末端とN末端は非常に近接しているため、PDZドメインが複数並んでいる場合、リガンドタンパク質も近接して位置することになる。この構造的特徴によりリガンドタンパク質間の相互作用が促進されると考えられている[3] [4] [5]。
リガンドタンパク質のC末端構造
リガンドタンパク質においてPDZドメインとの結合に重要な構造は、先述した溝と相互作用するC末端部分の4つのアミノ酸残基である[3]。両者の安定な結合にはPDZドメインのβBストランド構造との間の水素結合が寄与している。
分類
PDZドメインタンパク質とリガンドタンパク質との結合は、αBの最初のアミノ酸残基とリガンドタンパク質のC末端から3番目の位置(C(-2))のアミノ酸残基との相互作用によっている[3]。そのため、リガンドタンパク質のC(-2)に位置するアミノ酸の種類によって、それと結合するPDZドメインタンパク質の分類が行われている。
クラス Iには、PSD-95などが含まれ、C(-2)には、セリンまたはスレオニンが存在している。
クラス IIには、PICK1などが含まれ、C(-2)には、疎水性アミノ酸残基が存在している。クラス IIIには、nNOSなどが含まれ、C(-2)には、グルタミン酸やアルギニン酸といった負の電荷をもつアミノ酸が存在する。
C(-2)の位置のアミノ酸も重要であるが、その一つN末端側のC(-3)の位置のアミノ酸も、PDZドメインタンパク質とリガンドタンパク質との特異的な結合において重要である事がわかっている。
| Class | C末端配列 | リガンドタンパク質 | PDZドメインタンパク質 |
|---|---|---|---|
| Class I | |||
| X-S/T-X-V | E-S-D-V | NMDAR2A/B | PSD-95 (PDZ2) |
| T-T-R-V | ニューロリギン | PSD-95 (PDZ3) | |
| E-S-L-V | 電位依存性ナトリウムチャネル | シントロフィン | |
| X-S/T-X-L | Q-T-R-L | GKAP | Shank |
| S-S-T-L | 代謝活性型グルタミン酸受容体mGluR5 | Shank | |
| Class II | |||
| X-φ-X-φ | S-V-K-I | AMPA型グルタミン酸受容体GluR2 | PICK-1, GRIP (PDZ5) |
| S-V-E-V | EphB2 | PICK-1, GRIP (PDZ6) | |
| E-F-Y-A | シンデカン | CASK | |
| E-Y-Y-V | ニューレキシン | CASK | |
| Class III | |||
| X-D-X-V | V-D-S-V | メラトニン受容体 | nNOS |
X:任意のアミノ酸、φ:疎水性アミノ酸
特徴
PDZドメインタンパク質の特徴として、PDZドメインを複数もつ分子が多いということがあげられる[3]。現在発見されているタンパク質の中では、13個のPDZドメインをもつMUPP1が最も多くPDZドメインを持つタンパク質として知られている[6]。また、複数のPDZドメインは連続したグループとして存在しており、このような構造的特徴がPDZドメインに結合するリガンドタンパク質を協調的に働かせるのに資していると考えられている。
調整機構
PDZドメインタンパク質とリガンドタンパク質の相互作用はリン酸化によって調節される[2]。典型的には、リガンドタンパク質のC末端のリン酸化によって、PDZドメインとの相互作用が阻害される。例えば、カリウムチャネルやβ1アドレナリン受容体などのC末端がリン酸化されることによって、PSD-95のPDZドメインとの結合能が低下する。また、PDZドメインのリン酸化もリガンドタンパク質との相互作用に影響を及ぼす。例えば、Ca2+/カルモジュリン依存製タンパク質キナーゼII (Ca2+/calmodulin dependent protein kinase II, CaMKII)依存的にsynapse-associated protein97(SAP97)のPDZドメインがリン酸化されることによって、NMDA受容型グルタミン酸のサブユニットのNR2Aとの相互作用が低下する。
機能
PDZドメインはタンパク質間の相互作用に重要な役割を果たす。PDZドメインを含むタンパク質は受容体やシグナル分子といった情報伝達に関連するタンパク質の位置を調節し、シグナル伝達のための超分子複合体の足場タンパク質として機能する[3]。例えば、ショウジョウバエにおいて、PDZドメインを複数もつInaDは、光情報伝達回路中のイオンチャネルとシグナル分子を一つにまとめている[7]。
関連項目
参考文献
- ↑
Kennedy, M.B. (1995).
Origin of PDZ (DHR, GLGF) domains. Trends in biochemical sciences, 20(9), 350. [PubMed:7482701] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Kim, E., & Sheng, M. (2004).
PDZ domain proteins of synapses. Nature reviews. Neuroscience, 5(10), 771-81. [PubMed:15378037] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3 3.4
Hung, A.Y., & Sheng, M. (2002).
PDZ domains: structural modules for protein complex assembly. The Journal of biological chemistry, 277(8), 5699-702. [PubMed:11741967] [WorldCat] [DOI] - ↑
Jeleń, F., Oleksy, A., Smietana, K., & Otlewski, J. (2003).
PDZ domains - common players in the cell signaling. Acta biochimica Polonica, 50(4), 985-1017. [PubMed:14739991] [WorldCat] - ↑
Harris, B.Z., & Lim, W.A. (2001).
Mechanism and role of PDZ domains in signaling complex assembly. Journal of cell science, 114(Pt 18), 3219-31. [PubMed:11591811] [WorldCat] - ↑
Ullmer, C., Schmuck, K., Figge, A., & Lübbert, H. (1998).
Cloning and characterization of MUPP1, a novel PDZ domain protein. FEBS letters, 424(1-2), 63-8. [PubMed:9537516] [WorldCat] [DOI] - ↑
Liu, W., Wen, W., Wei, Z., Yu, J., Ye, F., Liu, C.H., ..., & Zhang, M. (2011).
The INAD scaffold is a dynamic, redox-regulated modulator of signaling in the Drosophila eye. Cell, 145(7), 1088-101. [PubMed:21703451] [WorldCat] [DOI]
