臨界期
杉山 清佳
新潟大学
DOI:10.14931/bsd.6426 原稿受付日:2015年9月1日 原稿完成日:2015年月日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名: Critical period (Sensitive period) 同義語: 敏感期、感受性期
臨界期とは、神経回路網の可塑性が一過的に高まる生後の限られた時期であり、生涯にわたる学習とは一線を画する。脳の神経回路は、生後の体験・経験により成長する。特に、視覚や聴覚などの感覚の機能や、母国語の習得に関わる神経回路は、臨界期の経験によって集中的に形成される。近年の遺伝子改変マウスを用いた研究から、臨界期のメカニズムが少しずつ明らかになってきている。視覚(眼優位性)モデルにおいては、大脳皮質の抑制性介在ニューロンの発達が臨界期の可塑性の制御に重要であることが示唆されている。
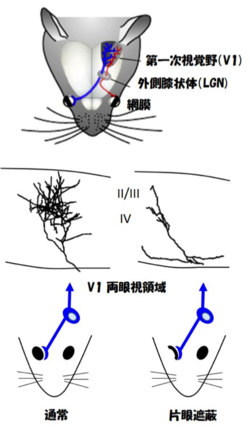
網膜鼻側からの軸索(青色)は視交差を通り反対側の外側膝状体に投射する。耳側からの軸索の一部(赤色)は同側に投射し、大脳視覚野の両眼視領域において両眼の情報が統合される。臨界期に片眼を閉じると、閉じた眼からの入力を担う外側膝状体細胞の軸索は退縮し、眼優位性の変化と視力の低下が引き起こされる。
イントロダクション
Konrad Lorenz(1958)によって提唱された「刷り込み」の現象は、行動学からの臨界期への最初のアプローチと考えられる[1]。ニワトリやカモなど早成性の鳥では、孵化の直後から目が見えており、数時間の内に近くにいる親鳥の姿を記憶する(刷り込む)。ヒヨコは鳥の形をした物に惹かれる傾向があるが、暗闇の中で飼育されるとその傾向を失う。興味深いことに、鳥類だけでなく、ヒトの新生児も顔の形に惹かれる傾向があり、数か月の内にヒトとサルの顔を区別することが出来るようになることが知られている[2]。神経科学の分野では、Hubel とWiesel(1963)によって示された「眼優位性可塑性(ocular dominance plasticity)」が、半世紀以上にわたり臨界期研究の良いモデルとなっている[3]。さらに近年では、英語耳や絶対音感の臨界期が取り上げられ、臨界期は幼児教育の分野にも影響を与えている。
昨今の神経科学分野における盛んな研究活動により、一定の期間に観察された神経細胞の可塑性に対して「臨界期」という言葉が頻繁に使われるようになっている。一方、従来からの臨界期モデルに焦点を当てると、臨界期とは次のような特徴を持つ期間であることが分かる。
- 競合する2つ以上の入力が経験(活動)依存的に選択される。
- 入力の選択は神経細胞の刈り込み・伸長など脳内の形態学的な変化に帰結する。
- 始まりと終わりの時期は齢に依らず経験によって決まる。さらに、最も重要な特徴として、「臨界期」は可塑性が一過的に亢進する生後の限られた期間であり、生涯にわたる学習などの可塑性とは一線を画することが挙げられる。
臨界期の例
回路形成の臨界期モデル
近年の動物モデルの解析から、運動系と感覚系(視覚、体性感覚、嗅覚、聴覚)において、生後間もない臨界期が観察されている[4]。中枢神経と末梢神経の発生発達期には、神経細胞から伸びた過剰な軸索が神経活動に依存して競合的に刈り込まれ、一生涯の機能的回路が形成される。
例えば、
また
回路再編の臨界期モデル
生後の早い時期に観察される臨界期は、広く張り巡らされた神経回路を神経活動によって厳選し、緻密化するための時期である。一方で、動物個体に経験の偏りが生じたとき、既存の回路を再編するための臨界期も存在する[4]。
例えば、歌を覚える鳥類(オウム/インコ類、ハチドリ類、鳴禽類)には、歌を覚えるための臨界期がある。鳴禽類のキンカチョウは、孵化後20日から90日頃までに歌を学習し、臨界期に覚えた1つの歌を生涯歌い続けることが知られている。キンカチョウは歌を学習するための特別な回路を持っており、臨界期であれば回路の再編によって歌を覚えなおすことが出来る。歌の学習ができる動物種はヒトを含め非常に稀である。
ヒトの言語習得の過程も、キンカチョウの歌学習に似た「感覚学習(聞き覚え)」と「感覚運動学習(発声学習)」の段階を踏むことが示唆されている。
また、猛禽類のフクロウでは、視覚と聴覚から得られた標的(獲物)の位置情報を一致させるための臨界期が存在する。臨界期のフクロウにプリズムゴーグルをつけ視覚の位置情報を20度以上ずらすと、視覚と聴覚のズレを修正するように聴覚の回路が再構築される。
どちらの眼からの入力を多く受けるか(眼優位性)は、臨界期の視覚経験に依存して可塑的に変化する[3][6] 。眼優位性可塑性は現在までに神経生理学、神経解剖学、分子生物学などの様々な見地から解析され、臨界期のメカニズムを探求する上で良いモデルとなっている。マウスからヒトまで、両目で見た情報は大脳皮質の第一次視覚野で初めて統合され、物の立体的特徴は正確に捉えられる。げっ歯類では、網膜神経節細胞からの軸索の多くは反対側の視覚野に伸び、一部が同側の視覚野に投射して両眼視領域を形成する。ネコやヒトでは、左右の網膜からの入力は両側の視覚野に投射し、第4層において互いに分離して縞模様を作り、第2/3層において初めて統合される。幼年期(ヒトでは9歳頃まで)に偏った視覚経験を受けると(例えば、片眼に長期間眼帯をすると)、閉じられた眼からの情報よりも開いた眼からの情報を多く受け取るように、神経回路が作り変えられる。その結果、閉じられた眼の入力を中継する外側膝状体細胞の軸索(視床-皮質投射)は、視覚野において著しく萎縮し、閉じられた眼の視力は弱くなる(弱視)。弱視は、就学前までの子どもの2~4%に見られる決して珍しくない疾患である。げっ歯類でも同様に、生後20 - 40日頃に眼優位性の臨界期があり、臨界期に閉じられた眼の視力は弱くなる。マウスからヒトまで、弱視を回復するためには可塑性が高い臨界期のうちに治療を施す必要があり、大人になってからの治療では回復が難しいことが知られている。治療は、良い方の眼にアイパッチを施し、さらに弱視の眼(多くは遠視である)を眼鏡で矯正するという方法が一般的である。一方、子どもの精神的な負担を軽減するために、治療の時間を短くする研究も行われている。弱視の眼で見る機会を増やすよう工夫されたテトリスゲームを行うことで、両眼視のトレーニングを行い、効率的に治療する方法も開発され始めている。
生後の大脳視覚野には、眼優位性だけでなく、方位選択性(orientation/direction selectivity)の臨界期もある[4]。ネコの第一次視覚野においては、特定の方位の動きに強く反応する(特定の方位選択性を持つ)細胞が集まり、カラム構造を形成する。視覚野においてそれぞれのカラム構造は方位マップを形成しており、隣りあったカラムは似た方位選択性を見せる。げっ歯類では、方位選択性を持つ細胞がゴマ塩状に分布し(編集部コメント:salt-and-pepperの訳かと思いますが、判りにくいと思います)、カラム構造を形成することはない。 方位マップも観察されず、似た方位選択性を持つ細胞が視覚野に離れて存在する。方位選択性は経験に依存して形成され、その臨界期は、眼優位性より少し先行する。げっ歯類では、両眼視領域の細胞は両眼からの入力を同時に受けることが多い。そのため、両眼視領域の単一細胞の方位選択性は、臨界期の経験により両眼で統一されることが重要である。
臨界期のメカニズム
臨界期は、大きく2つの時期に分けられる。1つ目は、遺伝子設計図に従い伸展した神経回路が、早期の神経活動により機能的に刈り込まれる臨界期、2つ目は、個体が独自の経験、刺激を継続的に受けることにより、既存の神経回路が再編される臨界期である。前者の神経回路の刈り込みには、回路で使用される神経伝達物質とその受容体のシグナル伝達系の役割が重要である。さらに、出生によるセロトニン量の減少や、C1q補体ファミリーなどの免疫系因子が軸索の分離や刈り込みに関与することが示唆されている[5]。
後者の臨界期には、眼優位性可塑性の研究から、回路で使用される神経伝達物質/受容体や片眼遮蔽により活性化される因子(tPAなど)に加え、興奮-抑制バランスが重要であることが分かってきている。未熟な脳では興奮性活動が相対的に強いが、抑制機能が発達して自発発火が抑えられ、視覚入力による発火が顕著になると眼優位性の臨界期が活性化される。
抑制性介在ニューロンのなかでも、パルブアルブミン陽性細胞の機能発達が臨界期を制御する鍵と考えられる[7]。臨界期の可塑性の高まりは、興奮-抑制バランスが入力に応じて柔軟に変化する時期に見られ、特に、優位な入力をより多く受け取るように抑制機能が作用する。さらに、興奮-抑制性バランスが固定化されると、臨界期が終わると推測される[8]。パルブアルブミン陽性細胞の機能発達に関与する分子(GAD65、BDNF、Otx2、NARP)を欠損したマウスでは、臨界期が誘導されない[4][9][10]。また細胞形態や抑制機能の固定化に関与する分子(Nogo受容体、コンドロイチン硫酸プロテオグリカン、Lynx1)を欠損したマウスでは、臨界期が終わらないことが示唆されている[11]。
一方で、方位選択性の臨界期には、抑制性介在ニューロンの発達よりもむしろ興奮性シナプスの可塑性が重要である。GAD65やOtx2の欠損マウスでは方位選択性が正常に形成されるのに対し、NR2A(GluRε1)やPSD-95の欠損マウスでは、眼優位性可塑性の異常よりも、方位選択性の形成不全のほうが顕著に見られる[4][9]。ほぼ同時期に同じ視覚野において見られる臨界期でも、回路によって可塑性のメカニズムは異なることが示唆される。
参考文献
- ↑
LORENZ, K.Z. (1958).
The evolution of behavior. Scientific American, 199(6), 67-74 passim. [PubMed:13615332] [WorldCat] [DOI] - ↑
Pascalis, O., de Haan, M., & Nelson, C.A. (2002).
Is face processing species-specific during the first year of life? Science (New York, N.Y.), 296(5571), 1321-3. [PubMed:12016317] [WorldCat] [DOI] - ↑ 3.0 3.1
WIESEL, T.N., & HUBEL, D.H. (1963).
SINGLE-CELL RESPONSES IN STRIATE CORTEX OF KITTENS DEPRIVED OF VISION IN ONE EYE. Journal of neurophysiology, 26, 1003-17. [PubMed:14084161] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3 4.4
Hensch, T.K. (2004).
Critical period regulation. Annual review of neuroscience, 27, 549-79. [PubMed:15217343] [WorldCat] [DOI] - ↑ 5.0 5.1
Kano, M., & Hashimoto, K. (2009).
Synapse elimination in the central nervous system. Current opinion in neurobiology, 19(2), 154-61. [PubMed:19481442] [WorldCat] [DOI] - ↑ NW DAW
Visual Development
Plenum (New York):1995 - ↑
Yazaki-Sugiyama, Y., Kang, S., Câteau, H., Fukai, T., & Hensch, T.K. (2009).
Bidirectional plasticity in fast-spiking GABA circuits by visual experience. Nature, 462(7270), 218-21. [PubMed:19907494] [WorldCat] [DOI] - ↑
Kuhlman, S.J., Olivas, N.D., Tring, E., Ikrar, T., Xu, X., & Trachtenberg, J.T. (2013).
A disinhibitory microcircuit initiates critical-period plasticity in the visual cortex. Nature, 501(7468), 543-6. [PubMed:23975100] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Sugiyama, S., Di Nardo, A.A., Aizawa, S., Matsuo, I., Volovitch, M., Prochiantz, A., & Hensch, T.K. (2008).
Experience-dependent transfer of Otx2 homeoprotein into the visual cortex activates postnatal plasticity. Cell, 134(3), 508-20. [PubMed:18692473] [WorldCat] [DOI] - ↑
Gu, Y., Huang, S., Chang, M.C., Worley, P., Kirkwood, A., & Quinlan, E.M. (2013).
Obligatory role for the immediate early gene NARP in critical period plasticity. Neuron, 79(2), 335-46. [PubMed:23889936] [PMC] [WorldCat] [DOI] - ↑
Bavelier, D., Levi, D.M., Li, R.W., Dan, Y., & Hensch, T.K. (2010).
Removing brakes on adult brain plasticity: from molecular to behavioral interventions. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(45), 14964-71. [PubMed:21068299] [PMC] [WorldCat] [DOI]