エンドソーム
小林 穂高、福田 光則
東北大学大学院生命科学研究科生命機能科学専攻
DOI:10.14931/bsd.1039 原稿受付日:2012年4月11日 原稿完成日:2013年5月25日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:endosome 独:Endosom 仏:endosome
エンドソームはエンドサイトーシスによって細胞内へと取り込まれた様々な物質の選別・分解・再利用などを制御するオルガネラの総称である。エンドソームは形態的な特徴や機能的な特徴をもとに、初期エンドソーム(early endosome)[1] [2]・後期エンドソーム(late endosome)[3][4]・リサイクリングエンドソーム(recycling endosome)[5][6]に大別される。エンドソームは膜輸送の中継地点として機能することで細胞内の物質輸送を司ることから、神経機能をはじめとする様々な生命現象において重要な役割を果たしている。
エンドソームの種類と機能
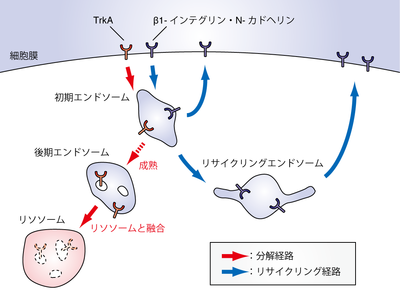
エンドソームは初期エンドソーム・後期エンドソーム・リサイクリングエンドソームに大別される。エンドサイトーシスによって細胞内へと取り込まれた物質は、まず初期エンドソームへと輸送される。初期エンドソームを起点として、分解される物質(TrkA)は分解経路へと、細胞膜で再利用される物質(β1-インテグリン、N-カドヘリン)はリサイクリング経路へと選別されていく。初期エンドソームにおいて分解経路へと選別された物質は、初期エンドソームに留まる。そして初期エンドソームが後期エンドソームへと成熟すると、後期エンドソームがリソソームと融合し、内腔小胞ごと膜貫通型のタンパク質も分解される。初期エンドソームにおいてリサイクリング経路へと選別された物質は、初期エンドソームから直接、あるいは核近傍のリサイクリングエンドソームへと輸送されたのち、細胞膜へと戻され再利用される。
エンドソームは形態的な特徴や機能的な特徴をもとに、初期エンドソーム・後期エンドソーム・リサイクリングエンドソームに大別される(図1)。
初期エンドソーム
初期エンドソームは、エンドサイトーシスされた物質を選別する場として機能するオルガネラである[1] [2]。このため、初期エンドソームは選別エンドソーム(sorting endosome)とも呼ばれている。エンドサイトーシスによって細胞内へと取り込まれた物質は、まず細胞辺縁部に存在する初期エンドソームへと輸送される。初期エンドソームを起点として、分解される物質は分解経路へと、細胞膜で再利用される物質はリサイクリング経路へと選別されていく。分解経路へと選別される物質としては受容体型チロシンキナーゼのようなシグナル伝達因子受容体が良く知られており、モノユビキチン化などが選別のシグナルとして用いられている。一方、リサイクリング経路へと選別される物質としてはインテグリンやカドヘリンといった接着因子などが知られているが、選別のシグナルについては未だ良くわかっていない。
また、初期エンドソームはエンドサイトーシスされた受容体を用いることでシグナル伝達の場としても機能することがあるため、シグナリングエンドソーム(signaling endosome)と呼ばれることもある[7]。初期エンドソームを識別するためのマーカータンパク質としては、Rab5や初期エンドソーム抗原-1(Early endosome antigen, EEA1)が有名である。また、初期エンドソームには、ホスファチジルイノシトールの一種であるPI(3)Pが豊富に存在しており、EEA-1などのタンパク質の初期エンドソームへの局在化などに寄与している[8]。
後期エンドソーム
後期エンドソームは、リソソームと融合することで内容物を分解へと導くオルガネラである[3][4]。初期エンドソームにおいて分解経路へと選別された物質は、後期エンドソームを介して最終的にリソソームで分解される。ただし、後期エンドソームは初期エンドソームが成熟したオルガネラであるため、分解される物質は膜輸送によって初期エンドソームから後期エンドソームへと輸送されるわけではない。後期エンドソームは初期エンドソームから成熟するにともない、プロトンポンプの働きによって内腔のpHが低下するとともに、核近傍へと移動していく。さらに、後期エンドソームではシグナル伝達因子受容体のような膜貫通型タンパク質がモノユビキチン化などによって認識され、エンドソーム膜ごと内腔へとくびり取られる。このため、後期エンドソームの内部には多数の内腔小胞が存在することになり、後期エンドソームは多胞体(MVB: multivesicular body)とも呼ばれる。後期エンドソームがリソソームと融合すると、内腔小胞ごと膜貫通型のタンパク質も分解される。
また、後期エンドソームはゴルジ体との間で膜輸送による物質のやり取りを行っているため、後期エンドソームはリソソームで働く分解酵素をゴルジ体からリソソームへと輸送するための中継オルガネラとしても機能している[9]。後期エンドソームを識別するためのマーカータンパク質としては、Rab7やマンノース-6リン酸受容体(M6PR)が有名である。また、後期エンドソームには、ホスファチジルイノシトールの一種であるPI(3,5)P2が豊富に存在しており、MVBの形成促進などに関与することが知られている[8]。
リサイクリングエンドソーム
リサイクリングエンドソームは、エンドサイトーシスされた物質を再び細胞膜へと戻す過程を制御するオルガネラである)[5][6]。初期エンドソームにおいてリサイクリング経路へと選別された物質は、初期エンドソームから直接、あるいは核近傍のリサイクリングエンドソームへと輸送されたのち、細胞膜へと戻され再利用される。このエンドサイトーシスによって細胞内へと取り込んだ物質を再び細胞膜へと戻す過程はendocytic recyclingと呼ばれているため、リサイクリングエンドソームはERC(endocytic recycling compartment)とも呼ばれる。リサイクリングエンドソームは、小胞やオルガネラの輸送過程においてレールとして機能する微小管の集合地点、微小管形成中心(MTOC: microtubule-organizingcenter)を取り囲むように存在しており、COS-1 細胞などでは初期エンドソームや後期エンドソームとは空間的な配置が明らかに異なる[10]。この微小管形成中心を取り囲むようなリサイクリングエンドソームの配置は、ある方向から細胞内へと取り込んだ物質を別の異なる方向へと戻すendocytic recyclingに重要と考えられる。実際、リサイクリングエンドソームは、神経細胞のような極性を持つ細胞の極性輸送を制御するオルガネラとしても知られている。ただし、リサイクリングエンドソームを介してリサイクルされる物質の全てが極性をもってリサイクルされるわけではない。
リサイクリングエンドソームは、後期エンドソームと同様にゴルジ体との間で膜輸送による物質のやり取りを行っていることが報告されている[11]。このため、リサイクリングエンドソームは初期エンドソームとゴルジ体を、あるいはゴルジ体と細胞膜を繋ぐ中継オルガネラとしても機能している。最近、リサイクリングエンドソームとリソソームとの間でも膜輸送よる物質のやり取りの可能性が示唆されており[12]、中継オルガネラとしてのリサイクリングエンドソームの機能は今後さらに注目されるものと考えられる。リサイクリングエンドソームを識別するためのマーカータンパク質としては、Rab11やトランスフェリン受容体(TfR)が有名である。また、リサイクリングエンドソームには、ホスファチジルセリン(PS)や、PI(4)P、PI(4,5)P2といった脂質が存在しており、中でもPSはリサイクリングエンドソームからゴルジ体への輸送経路に必要なことが最近明らかになっている[13][14]。
エンドソームを介する膜輸送と神経機能
エンドソームは小胞輸送(膜輸送)の中継地点として機能することで細胞内の物質輸送を司ることから、神経機能をはじめとする様々な生命現象において重要な役割を果たしている。
神経成長因子のシグナル伝達
神経細胞の分化・生存を制御する神経成長因子(NGF: nerve growth factor)の受容体TrkAはエンドサイトーシスによって初期エンドソームへと輸送されたのち、後期エンドソームを介してリソソームへと輸送される[15](図1)。TrkAをリソソームへと輸送し分解へと導くことは、NGFによるシグナル伝達を適切なタイミングで止める上で重要と考えられている。実際、TrkA の初期エンドソームへの輸送は低分子量GTP結合タンパク質のRab5によって制御されており、Rab5の機能が損なわれると神経細胞の分化が過度に進行することが報告されている[16]。さらに、TrkAの後期エンドソームからリソソームへの輸送はRab7によって制御されており、Rab7の機能が損なわれることによっても神経細胞の分化が過度に進行することが報告されている[17]。
神経細胞の移動・形態形成
神経細胞の移動・形態形成を制御する細胞接着因子であるβ1-インテグリンやN-カドヘリンは、エンドサイトーシスによって初期エンドソームへと輸送されたのち、リサイクリングエンドソームを介して再び細胞膜へと輸送される[18](図1)。このβ1-インテグリンやN-カドヘリンのendocytic recyclingは、神経細胞の移動・形態形成に必要な接着部位の再編成を行う上で重要と考えられている。実際、Rab5依存的なN-カドヘリンの初期エンドソームへの輸送が損なわれると、大脳皮質の神経細胞移動が阻害されることが報告されている[19]。また、β1-インテグリンのリサイクリングエンドソームから細胞膜への輸送は、Rab11によって制御されており、Rab11 の機能が損なわれると神経細胞の形態形成に異常が生じることも知られている[20]。最近では、リサイクリングエンドソームに局在し、神経細胞の形態形成に関与する因子としてRab17やRab35といった因子も報告されている[21][22]。さらに、神経細胞でのendocytic recyclingの方向性を決定する重要な因子の一つとして、Protrudinと呼ばれるRab11結合因子が知られている[23][24]。
シナプス小胞の形成・シナプス可塑性
エンドソームは、シナプス前終末におけるシナプス小胞のリサイクリングにも密接に関与している。例えば、神経伝達物質の放出後、細胞膜上に移行したシナプス小胞の構成因子はクラスリン依存性のエンドサイトーシスによって取り込まれ、初期エンドソームへと輸送される。そして初期エンドソームにおいてシナプス小胞の構成因子の再選別・再濃縮が行われ、再びシナプス小胞が形成される[25]。ただし、シナプス小胞のリサイクリングの全てがこの過程を経るわけではない。さらに、エンドソームは長期増強・長期抑圧などの記憶・学習にも関与することが明らかになっている。
例えば、カルシウム流入に伴うAMPA型グルタミン酸受容体のシナプス後膜への輸送は長期増強を促進することが知られているが[26]、このAMPA型グルタミン酸受容体はリサイクリングエンドソームから供給される[27]。一方、シナプス後膜上のAMPA型グルタミン酸受容体がエンドサイトーシスによって取り込まれ、初期エンドソームを経由して後期エンドソームへ輸送されると、長期抑圧が促進される[28][29]。従って、エンドサイトーシスによって初期エンドソームへと取り込まれたAMPA型グルタミン酸受容体を、後期エンドソーム(分解経路)とリサイクリングエンドソーム(リサイクリング経路)のどちらに選別するかは、長期増強・長期抑圧を制御する上で極めて重要である。この選別機構の詳細なメカニズムは未だ明らかになっていないが、興味深いことにAMPA型グルタミン酸受容体の主要なサブユニットであるGluR2は、NMDA刺激依存的に分解経路へ、AMPA刺激依存的にリサイクリング経路へと選別されることが報告されている[30]。
関連項目
参考文献
- ↑ 1.0 1.1
Scita, G., & Di Fiore, P.P. (2010).
The endocytic matrix. Nature, 463(7280), 464-73. [PubMed:20110990] [WorldCat] [DOI] - ↑ 2.0 2.1
Piper, R.C., & Lehner, P.J. (2011).
Endosomal transport via ubiquitination. Trends in cell biology, 21(11), 647-55. [PubMed:21955996] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Woodman, P.G., & Futter, C.E. (2008).
Multivesicular bodies: co-ordinated progression to maturity. Current opinion in cell biology, 20(4), 408-14. [PubMed:18502633] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Huotari, J., & Helenius, A. (2011).
Endosome maturation. The EMBO journal, 30(17), 3481-500. [PubMed:21878991] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
van Ijzendoorn, S.C. (2006).
Recycling endosomes. Journal of cell science, 119(Pt 9), 1679-81. [PubMed:16636069] [WorldCat] [DOI] - ↑ 6.0 6.1
Grant, B.D., & Donaldson, J.G. (2009).
Pathways and mechanisms of endocytic recycling. Nature reviews. Molecular cell biology, 10(9), 597-608. [PubMed:19696797] [PMC] [WorldCat] [DOI] - ↑
Sorkin, A., & von Zastrow, M. (2009).
Endocytosis and signalling: intertwining molecular networks. Nature reviews. Molecular cell biology, 10(9), 609-22. [PubMed:19696798] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1
De Matteis, M.A., & Godi, A. (2004).
PI-loting membrane traffic. Nature cell biology, 6(6), 487-92. [PubMed:15170460] [WorldCat] [DOI] - ↑
Pfeffer, S.R. (2009).
Multiple routes of protein transport from endosomes to the trans Golgi network. FEBS letters, 583(23), 3811-6. [PubMed:19879268] [PMC] [WorldCat] [DOI] - ↑
Misaki, R., Nakagawa, T., Fukuda, M., Taniguchi, N., & Taguchi, T. (2007).
Spatial segregation of degradation- and recycling-trafficking pathways in COS-1 cells. Biochemical and biophysical research communications, 360(3), 580-5. [PubMed:17606221] [WorldCat] [DOI] - ↑
Ang, A.L., Taguchi, T., Francis, S., Fölsch, H., Murrells, L.J., Pypaert, M., ..., & Mellman, I. (2004).
Recycling endosomes can serve as intermediates during transport from the Golgi to the plasma membrane of MDCK cells. The Journal of cell biology, 167(3), 531-43. [PubMed:15534004] [PMC] [WorldCat] [DOI] - ↑
Matsui, T., Itoh, T., & Fukuda, M. (2011).
Small GTPase Rab12 regulates constitutive degradation of transferrin receptor. Traffic (Copenhagen, Denmark), 12(10), 1432-43. [PubMed:21718402] [WorldCat] [DOI] - ↑
Jović, M., Kieken, F., Naslavsky, N., Sorgen, P.L., & Caplan, S. (2009).
Eps15 homology domain 1-associated tubules contain phosphatidylinositol-4-phosphate and phosphatidylinositol-(4,5)-bisphosphate and are required for efficient recycling. Molecular biology of the cell, 20(11), 2731-43. [PubMed:19369419] [PMC] [WorldCat] [DOI] - ↑
Uchida, Y., Hasegawa, J., Chinnapen, D., Inoue, T., Okazaki, S., Kato, R., ..., & Arai, H. (2011).
Intracellular phosphatidylserine is essential for retrograde membrane traffic through endosomes. Proceedings of the National Academy of Sciences of the United States of America, 108(38), 15846-51. [PubMed:21911378] [PMC] [WorldCat] [DOI] - ↑
Moises, T., Dreier, A., Flohr, S., Esser, M., Brauers, E., Reiss, K., ..., & Krüttgen, A. (2007).
Tracking TrkA's trafficking: NGF receptor trafficking controls NGF receptor signaling. Molecular neurobiology, 35(2), 151-9. [PubMed:17917104] [WorldCat] - ↑
Liu, J., Lamb, D., Chou, M.M., Liu, Y.J., & Li, G. (2007).
Nerve growth factor-mediated neurite outgrowth via regulation of Rab5. Molecular biology of the cell, 18(4), 1375-84. [PubMed:17267689] [PMC] [WorldCat] [DOI] - ↑
Saxena, S., Bucci, C., Weis, J., & Kruttgen, A. (2005).
The small GTPase Rab7 controls the endosomal trafficking and neuritogenic signaling of the nerve growth factor receptor TrkA. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(47), 10930-40. [PubMed:16306406] [PMC] [WorldCat] [DOI] - ↑
Blackmore, M., & Letourneau, P.C. (2006).
L1, beta1 integrin, and cadherins mediate axonal regeneration in the embryonic spinal cord. Journal of neurobiology, 66(14), 1564-83. [PubMed:17058193] [WorldCat] [DOI] - ↑
Kawauchi, T., Sekine, K., Shikanai, M., Chihama, K., Tomita, K., Kubo, K., ..., & Hoshino, M. (2010).
Rab GTPases-dependent endocytic pathways regulate neuronal migration and maturation through N-cadherin trafficking. Neuron, 67(4), 588-602. [PubMed:20797536] [WorldCat] [DOI] - ↑
Eva, R., Dassie, E., Caswell, P.T., Dick, G., ffrench-Constant, C., Norman, J.C., & Fawcett, J.W. (2010).
Rab11 and its effector Rab coupling protein contribute to the trafficking of beta 1 integrins during axon growth in adult dorsal root ganglion neurons and PC12 cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(35), 11654-69. [PubMed:20810886] [PMC] [WorldCat] [DOI] - ↑
Mori, Y., Matsui, T., Furutani, Y., Yoshihara, Y., & Fukuda, M. (2012).
Small GTPase Rab17 regulates dendritic morphogenesis and postsynaptic development of hippocampal neurons. The Journal of biological chemistry, 287(12), 8963-73. [PubMed:22291024] [PMC] [WorldCat] [DOI] - ↑
Kobayashi, H., & Fukuda, M. (2012).
Rab35 regulates Arf6 activity through centaurin-β2 (ACAP2) during neurite outgrowth. Journal of cell science, 125(Pt 9), 2235-43. [PubMed:22344257] [WorldCat] [DOI] - ↑
Sann, S., Wang, Z., Brown, H., & Jin, Y. (2009).
Roles of endosomal trafficking in neurite outgrowth and guidance. Trends in cell biology, 19(7), 317-24. [PubMed:19540123] [WorldCat] [DOI] - ↑
Shirane, M., & Nakayama, K.I. (2006).
Protrudin induces neurite formation by directional membrane trafficking. Science (New York, N.Y.), 314(5800), 818-21. [PubMed:17082457] [WorldCat] [DOI] - ↑
Sudhof, T.C. (2004).
The synaptic vesicle cycle. Annual review of neuroscience, 27, 509-47. [PubMed:15217342] [WorldCat] [DOI] - ↑
Malinow, R., Mainen, Z.F., & Hayashi, Y. (2000).
LTP mechanisms: from silence to four-lane traffic. Current opinion in neurobiology, 10(3), 352-7. [PubMed:10851179] [WorldCat] [DOI] - ↑
Wang, Z., Edwards, J.G., Riley, N., Provance, D.W., Karcher, R., Li, X.D., ..., & Ehlers, M.D. (2008).
Myosin Vb mobilizes recycling endosomes and AMPA receptors for postsynaptic plasticity. Cell, 135(3), 535-48. [PubMed:18984164] [PMC] [WorldCat] [DOI] - ↑
Sheng, M., & Lee, S.H. (2001).
AMPA receptor trafficking and the control of synaptic transmission. Cell, 105(7), 825-8. [PubMed:11439178] [WorldCat] [DOI] - ↑
Malinow, R., & Malenka, R.C. (2002).
AMPA receptor trafficking and synaptic plasticity. Annual review of neuroscience, 25, 103-26. [PubMed:12052905] [WorldCat] [DOI] - ↑
Lee, S.H., Simonetta, A., & Sheng, M. (2004).
Subunit rules governing the sorting of internalized AMPA receptors in hippocampal neurons. Neuron, 43(2), 221-36. [PubMed:15260958] [WorldCat] [DOI]