標的認識
英語名: target recognition

延髄の下オリーブ核は軸索を小脳に投射する。軸索は橋の背部で小脳に入り、そこから小脳皮質に投射する。小脳皮質ではいくつかの細胞の中で一つのプルキンエ細胞に特異的なシナプスを形成する。その特徴的な形態により、この軸索は登上線維とよばれるが、この形態はラモニイカハールによってもその著書の中で描写されている。
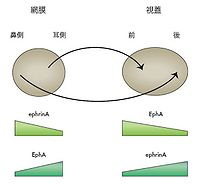
ニワトリの系において網膜の神経節細胞は視蓋にその軸索を投射する。その時に、網膜の鼻側にある細胞は視蓋の後側に、耳側にある細胞は視蓋の前側に軸索を送る。このトポグラフィックな投射は、視蓋に前後軸に沿ってグレディエントを形成してエフリンAが発現し、その受容体であるEphAが網膜の神経節細胞において内外軸に沿ってグレディエントを形成して発現していて、その両者の相互作用によってできる。
正常に脳が機能するにはそれを支える神経細胞群がシナプス結合によって回路を形成し、回路に入力してきた情報を的確に処理し、出力に変える必要がある。こういった神経回路は脳内のワイヤリングの過程により形成されるが、そのワイヤリングにおいて神経回路が「正しく」形成されるには特異的にシナプスが形成される必要がある。この過程を標的認識という。標識認識ためには神経細胞の軸索が正しい脳内の領域に到着する必要があり、その領域内にある神経細胞の中から正しい神経細胞を認識し、その細胞上の正しい細胞内のコンパートメント(樹状突起の一部)にシナプスを形成する必要がある。また、この場合、ある線維とある細胞がランダムではなく特異的な結合を果たし、特異的な情報(トポグラフィックカルな情報)を伝達しなければならない。このためには、これらのそれぞれの過程で特異的な標的認識を行う認識分子(recognition molecule)が関与していると考えられる。
標的認識とは
正常に脳が機能するにはそれを支える神経細胞群がシナプス結合によって回路を形成し、回路に入力してきた情報を的確に処理し、出力に変える必要がある。こういった神経回路は脳内のワイヤリングの過程により形成されるが、そのワイヤリングにおいて神経回路が「正しく」形成されるにはシナプス形成の過程で特異的な標的認識が行われる必要がある。そのためには神経細胞の軸索(例えば延髄の下オリーブ核の神経細胞の軸索である登上線維)が(途中、延髄で正中線を越えて対側にはいり、その後、背外側の縁を上行し、小脳脚を経て)正しい脳内の領域(小脳)に到着する必要があり、その領域内(小脳皮質)にある神経細胞の中から正しい神経細胞(プルキンエ細胞)を認識し、その細胞上の正しい細胞内のコンパートメント(樹状突起の一部)にシナプスを形成する必要がある。また、この場合、ある線維とある細胞がランダムではなく特異的な結合を果たし、特異的な情報(トポグラフィックカルな情報)を伝達しなければならない(そのうえ一本の登上線維は1つのプルキンエ細胞と結合し、幾つものプルキンエ細胞とは結合しない)(1本の登上線維は複数のプルキンエ細胞とシナプスを作るのではなかったかと思います。御確認下さい。)(図1)。このためには、これらのそれぞれの過程で特異的な標的認識を行う認識分子(recognition molecule)が関与していると考えられる。
標的認識は主に神経発生における2つの過程で起こる可能性があるが、ここでは主にシナプス形成における標的認識を例にその概念を説明し、軸索ガイダンスにおける中間ターゲットの認識については軸索ガイダンスの項及び、ガイドポスト細胞の項を参照のこと。
歴史的な考察
Santiago Ramon y Cajalが前世紀の初頭にその詳細な組織学的解析から、神経の突起が周りにあるシグナルを選択的に感知しながら目的地へ進んでいるのではないかと推測し、走化性に似た現象が神経系の形成に重要なのではないかと提唱していた。それに対して主に末梢神経の再生の実験結果から1920年代から30年代にはPaul A Weissらによる、神経系の線維の結合は主に物理的な制約で決定され、その結合は決して特異的なものではなくランダムであり、その後にその回路を使用する事によって、その使われた特定の回路が最終的に残るという説が主流を占めていた。
その説に対してWeissの学生であったRoger Sperryは40年代から50年代にわたって行った彼の一連のカエルやイモリといった動物の眼を使った神経再生の実験により、神経の回路形成にはやはり選択性が存在し、そのメカニズムについて化学親和説を提唱した[1]。
この化学親和説には2つの概念が含まれており、1つは神経細胞はそれぞれの細胞、線維におそらく化学物質からなる個々を認識するタグがついており、これによってお互いを区別して、その化学親和性で神経細胞はおそらく一個の細胞のレベルで特異的な神経結合を作る事ができるというもので、もう1つは特に視覚系で明らかであるが、その線維投射のパターンが規則正しく、トポグラフィックであることから、少数のモルフォゲンの様な濃度勾配を形成するような分子群がこの化学親和性を担う物質として機能するというものである(図2)。化学親和説については激しい論争があったが、やがて分子レベルでの解析、また数理モデル等に支えられ、神経発生の分野で一般に受け入れられる概念となり、現在の標的認識の概念は基本的にこの化学親和説の流れを汲んでいる。
神経系において皮質構造をなすところXやYがあり、また、核構造をなすZがあるとする。その中のYに投射しX、Zには投射しない軸索は神経系の様々なところから来るとする(A、B、C)。そして、この線維はYの中のある特定の細胞(薄緑色の細胞群)にシナプスを形成し、その場合、Aは樹状突起の遠位側に、Bは樹状突起の近位側に、Cは細胞体にそれぞれシナプスを形成するとする。こういった場合、それぞれの過程で特異的な標的認識が必要となる。
特にシナプス形成における特異性とそれをサポートする分子
シナプス形成をはじめとする標的認識においては2つのレベルでの特異性が必要となる。神経細胞が機能を果たすには、ある神経細胞は特異的な神経細胞と結合し、神経回路を形成する必要があり(例えば、下オリーブ核の線維はプルキンエ細胞に、橋核の線維は顆粒細胞に、顆粒細胞の線維はプルキンエ細胞に)、このレベルでの標的認識の特異性(細胞種のレベル)がまず必要となる。
また、同じ細胞群の中である特異的な細胞と結合する必要がある。例えば位置情報が重要な場合はトポグラフィカルな結合を果たす必要がある。また、情報処理において、同じ情報は同じ脳内での部位にいく必要がある。例えば嗅覚において嗅上皮内の同じ嗅覚受容体からの線維は嗅球内の同じ糸球体につながる必要がある。また、視覚において、同側と対側の眼で捉えられた視覚野の同じ情報は最終的に視覚野の同じ位置につながる必要がある。したがって、同じ細胞集団の中でも特異的に個々の細胞を認識する必要があり、このレベルでの標的認識の特異性(個々の細胞レベル)も必要となる。
上記の様にシナプス形成には様々な過程が必要であり、その中で特異性をサポートする必要がある[2]。その分子メカニズムがどうなっているかについては完全には明らかにされていない。個々の細胞レベルでの特異性は鍵と鍵穴のような認識分子があり、それが無数に存在することで達成されるのではないかという様に提唱はされているが、それを支えることができるほどの多様性のある分子としてはDscam、ニューレキシンとプロトカドヘリンしか存在しないし、こういった分子が本当にその多様性でこういった特異的な標的認識を担っているかどうかについてはまだ証明はされていない(以下のChemoaffinity revisitedを参照の事)。一つの分子ではなく、幾つかの分子の組み合わせでそういった多様性が生み出されるという説もある。
但し、最近の報告では、ターゲットの領域にたどり着くのにはある分子メカニズムが必要であるが、そのあとの正しい細胞を見つけるのはどこの位置に正しい細胞があるかによって形成されるという例もあり、その場合、位置を変えるとつなぎ替えがおこってしまうことも報告されている[3]。したがって、一個の細胞レベルで区別する様なメカニズムは存在しないのかもしれない。
Chemoaffinity revisited
上記のようなタイトルのレビューが2010年のCellにでた[4]。内容は、Dscamやプロトカドヘリンの様な分子は多様性をもつので、化学親和説で特異性を担う分子タグとして機能しているかもしれないという様に考えられていたが、実はこれらの分子は特異的な相互作用を担う分子タグではなく、自己と他者を見分けるためのタグとして使われているのではないかという内容のレビューである。従って、Sperryの仮想した多様な特異性を担う分子は存在しないということを意味する訳ではなく、Dscamやプロトカドヘリンといった分子はその役割を果たしていないのではないかということである。ただし、彼らは鍵と鍵穴のような多様な分子は実際は必要ないのではないかとも述べている。
標的認識に関与する分子メカニズム
ショウジョウバエの眼では8つの細胞からなる神経細胞のユニットが整然と配置されていて、これによって視覚が担われている。その8つの細胞にはR1-8とそれぞれ名前がつけられているが、R1-6はlaminaで中継ニューロンにシナプスを形成するのに対し、R7、R8はmedullaに軸索を投射し、そこでシナプスを形成する。R1-6の中継ニューロンは(L: lamina neuron)やはりmedullaに投射するが、そのシナプスを形成する層がR7,R8のシナプスが形成される層とは異なる。TM, TMY: tangential medulla neurons, DM: distal medulla intrinsic neurons, これらは中継ニューロンでそれぞれ異なる視覚情報を中枢へ伝える。
いずれにしても分子メカニズムとしては、まず、目的の領域に達する機構(様々な軸索ガイダンスのメカニズム)、そして領域内のどこに到着するかを決定する機構(おそらく神経伸長促進因子か抑制性因子とその受容体の発現レベルによって形成される)、そして特異的な細胞集団を見つける機構(おそらく細胞接着因子及び抑制因子)、そして細胞内の特異的なコンパートメントを見つける機構(おそらく細胞接着因子及び抑制因子)が必要である(図3)。 この過程で特異性は、それぞれの神経細胞において、標示されているシグナルに対する受容体の発現の変化、発現されている受容体の組み合わせの変化、また、受容体の下流のシグナル系路の変化によって、それぞれのシグナルへの応答性が変わることによって形成されると考えられる。詳細な分子メカニズムについては軸索ガイダンスの項を参照のこと。
各論
ここではごく限られた例につき、簡単に述べることにする。詳しくはそれぞれの文献を参照のこと。
ショウジョウバエにおけるターゲティング
ショウジョウバエの体節筋はステレオティピックな形態を示す筋肉のセットからなる。それぞれの筋に投射する神経細胞(RP1, 2, 3, 4, 5a, 6/7b, 8a, aCC)は神経管内に存在しそこから軸索を伸長するが、軸索は途中特異的な神経束を形成し(赤丸)、また途中の様々な特定の部位で(赤丸)束から分かれてそれぞれの特異的な標的である筋肉に投射する。それぞれの特定の部位で様々な分子メカニズムが関与している事が明らかにされつつある。
ショウジョウバエの眼は8つの神経細胞(R1-R8)からなる単位の集合体として存在し、これらは高次視覚野であるlamina(日本語訳がございましたら御願い致します)、medulla(日本語訳がございましたら御願い致します)に線維を送るが、R1-R6、R7、R8の軸索はそれぞれシナプスを形成するターゲットが異なる(Rubinら、Zipurskyら)(図4)。この分子メカニズムとしては、 カドヘリン、プロトカドヘリンや受容体型チロシンフォスファターゼ(チロシンキナーゼは無いでしょうか?)等が関与している事が示されている。また、標的野におけるグリア細胞の存在や標的に達するまでの軸索—軸索相互作用がこういった標的認識に重要である事も示されている[5]。
ショウジョウバエの体節の筋群はステレオティピックな配置をしており、それへの神経支配は神経管に存在する運動神経細胞からの線維が行う。この筋群への運動神経のターゲティングの系は特異的なターゲッティングのメカニズムを探る系として研究されてきた(図5)[6]。この過程には様々な軸索ガイダンスに関わる分子や神経細胞接着因子等が関与している。また、最後のところの神経筋接合部の形成についても分子レベルで研究が行われており、上記の分子の他、骨形成因子 (BMP)なども関与している。
またショウジョウバエの嗅覚系であるキノコ体(Mushroom body)(キノコ体は必ずしも嗅覚情報とは限らないので、嗅覚系とは言えないのではないかと思います。御確認下さい)ヘのターゲッティングについても研究が進められている。これにはマウスで明らかにされている様なトポグラフィックなマッピングのメカニズムも関与しているようである[7]。
脊椎動物の視覚系、嗅覚系におけるターゲティング
Sperryの流れを汲み、視覚系において標的認識がどうなっているかは精力的に研究が進められてきた。網膜内でのトポグラフィックな情報が視蓋/上丘、外側膝状体、そして視覚野において保存される必要があり、それを支える分子群が同定されている。代表的なものはEph受容体-エフリンシステムである[8]。また、坂野らによってマウスの嗅覚系におけるトポグラフィックな情報を担ったセマフォリン-ニューロピリンシステムによる標的認識の機構が明らかにされている[9]。これらについてはトポグラフィックマッピングの項を参照されたい。
大脳皮質での領域特異的ターゲティング
マウスのE14の脳において、体性感覚の情報は体性感覚野へ(SM)また、辺縁系からの情報は辺縁系皮質領域へ(PR)、それぞれ投射する。PRの領域にはLAMPという細胞接着因子が発現している。この時期にLAMP陽性の皮質領域を感覚野へ移植すると辺縁系からの線維は移植された感覚野へ投射する様になる。
かつて、Pasko RakicとDennis O'Learyの間で大脳皮質の発生に関して論争があった[10]。Protomap vs Protocortexと呼ばれたもので、端的に言えば大脳は領域ごとに発生の早い段階から遺伝的に決定されているという説と、そうではなくて大脳は他の神経細胞(領域)とつながったあとに領域ごとに差が出てくるという説である。Rakicの弟子であるPat Levittは、もし大脳皮質の領域が早い段階で決定されているならば、例えばある皮質領域に特異的にでている分子があるはずであると考え、それを探したところ辺縁系皮質領域に特異的にでている分子を得た。これはLAMPと呼ばれる細胞接着因子であるが、この分子の発現をマーカーとしてこれに皮質の移植の実験を組み合わせる事によって、辺縁系皮質領域は辺縁系からの線維を引き寄せるメカニズムがある事が示されている(図6)[11]。この標的認識に関わる分子はLAMPそのものである可能性もある。
神経細胞内での特定のコンパートメントへのターゲティング
プルキンエ細胞は様々な介在ニューロンから投射を受けるが、そのシナプスの形成される場所は特異的な細胞内コンパートメントに形成される。バスケット細胞は軸索のイニシャルセグメント(AIS)にシナプスを形成するが、その形成には神経細胞接着因子であるneurofascinのプルキンエ細胞内での濃度勾配様の局在が(neurofascinがイニシャルセグメントのところに集中する)重要であることが明らかになっている。
マウスの海馬では、脳の様々な領域からの入力が錐体細胞の樹状突起の特異的な領域にターゲッティングをすることが知られている。CA3領域の一番外側の層には内側嗅皮質からのtemporoammonic fiber、中間部にはCA3錐体細胞自身の連合線維、そして一番の近位の層には歯状回の顆粒細胞からの苔状線維がシナプスを形成する。この層特異的なターゲッティングには様々なガイダンス分子、例えば、ネトリン、Eph受容体、セマフォリン、スリット、リーリンそして細胞接着因子などが関与している[12]。
大脳皮質や小脳皮質には様々な介在ニューロンが存在し、これら多様なもののそれぞれが錐体細胞やプルキンエ細胞の細胞内の特異的なコンパートメントにシナプスを形成することが知られている。例えばシャンデリア細胞は軸索の起始部に、バスケット細胞は軸索の起始部や樹状突起側の細胞体のところに、マルチノーニ細胞(マルチノッチ細胞でしょうか?)は樹状突起の遠位部に、それぞれシナプスを形成する[13]。プルキンエ細胞の場合にはこれは細胞接着因子に依存しておこることが示されている(図7)[14]。
小脳でのターゲティング
延髄の下オリーブ核(右側)にはSC1/DM-GRASP/BEN/ALCAM陽性のところ(黒色)と陰性のところがある。これらSC1/DM-GRASP/BEN/ALCAM陽性の領域の神経細胞はSC1/DM-GRASP/BEN/ALCAM陽性のプルキンエ細胞の存在する小脳皮質領域(左側、黒色)に投射する。SC1/DM-GRASP/BEN/ALCAM陽性の領域は小脳皮質においては矢状断面に沿ったストライプ状に配列している。
小脳の回路については昔から精力的に研究が行われてきた。小脳に入ってくる2つの主な入力は延髄の下オリーブ核からの登上線維と橋の橋核からの苔状線維であるが、この2つは前者がプルキンエ細胞、後者が顆粒細胞とそれぞれターゲットが異なる。これらの線維が小脳皮質の発達に伴ってどうやって小脳皮質まできて、どういう発達過程を示すかについては詳細な記載がされているが(例えばConstantino SoteloやCarol Masonら)、これらのターゲッティングが分子レベルでどうなっているかについてはまだ明らかになっていない(一つの登上線維が一つのプルキンエ細胞とシナプスを作るようになるリファイメントの過程については日本の狩野らの仕事により分子メカニズムが明らかにされてきている)。Constantine Soteloは登上線維のプルキンエ細胞ヘのターゲティングに関わる分子に非常に興味を持っていて、彼は小脳のプルキンエ細胞は矢状断面でグループを作り、それに下オリーブ核からの登上線維がトポグラフィックにターゲティングすることに注目、小脳で矢状断面に沿ったストライプ状に発現する細胞接着因子を探した。そのうちの一つが細胞接着因子のActivated leukocyte cell adhesion molecule (ALCAMあるいはSC1/DM-GRASP/BEN)である。しかしながら、この分子が登上線維とプルキンエ細胞のマッチングに関与しているかどうかの検証はなされていない(図8)[15]。
脊髄内外における運動神経を中心としたターゲッティング(Tom Jessellら)
脊髄内の運動神経カラムはその支配する四肢筋の位置により、外側群(緑色)と内側群(黄色)に分かれる。運動神経細胞の軸索は神経束を形成し脊髄から出るが四肢へ入るところで四肢の内側にある筋群(medial LMC)と外側にある筋群(lateral LMC)に投射するものでその投射方向が分かれる。この過程には図に示されているような様々な分子メカニズムが関与していることが明らかにされてきている。eAs: ephrinAs, Npn2: neuropilin2
Tom Jessellは長年にわたり脊髄の系を使って神経発生の研究を続けてきている。脊髄の中で運動神経細胞はある特定の筋に支配神経を送るがその神経細胞はその支配筋からの感覚のフィードバックを受ける。その細胞特異的なループ系路の形成に関わる分子メカニズムが明らかにされつつある。また、脊髄の中での介在ニューロンを介した運動神経細胞への局所サーキットの形成にも特異的な標的認識が必要であるがこれについても分子メカニズムが明らかにされつつある[16][17]。また、運動神経細胞は四肢の筋肉を支配するが、脊髄の運動神経細胞カラム内の神経細胞の位置によって、支配する四肢の筋肉の位置が決定されるというトポグラフィックマップが存在する。この四肢の筋肉の標的認識には様々なガイダンス分子が関与することが知られ、セマフォリンやEph受容体-エフリンなどが関与することが明らかにされている(図9)[18]。
Waiting period
標的認識に関連して、waiting periodという概念がある。これは軸索が脳内の正しい領域に到達したあとに、正しい神経細胞にシナプスを形成する前に、軸索が待機する時期のことをさす。この間にターゲット細胞が成熟し、その後、軸索がシナプスを形成する。大脳皮質にはいって来る視床からの線維や、小脳皮質にはいってくる線維がこういう行動を示すことが知られている。
関連項目
参考文献
- ↑
SPERRY, R.W. (1963).
CHEMOAFFINITY IN THE ORDERLY GROWTH OF NERVE FIBER PATTERNS AND CONNECTIONS. Proceedings of the National Academy of Sciences of the United States of America, 50, 703-10. [PubMed:14077501] [PMC] [WorldCat] [DOI] - ↑
Benson, D.L., Colman, D.R., & Huntley, G.W. (2001).
Molecules, maps and synapse specificity. Nature reviews. Neuroscience, 2(12), 899-909. [PubMed:11733797] [WorldCat] [DOI] - ↑
Jessell, T.M., Sürmeli, G., & Kelly, J.S. (2011).
Motor neurons and the sense of place. Neuron, 72(3), 419-24. [PubMed:22078502] [WorldCat] [DOI] - ↑
Zipursky, S.L., & Sanes, J.R. (2010).
Chemoaffinity revisited: dscams, protocadherins, and neural circuit assembly. Cell, 143(3), 343-53. [PubMed:21029858] [WorldCat] [DOI] - ↑
Sanes, J.R., & Zipursky, S.L. (2010).
Design principles of insect and vertebrate visual systems. Neuron, 66(1), 15-36. [PubMed:20399726] [PMC] [WorldCat] [DOI] - ↑
Keshishian, H., Broadie, K., Chiba, A., & Bate, M. (1996).
The drosophila neuromuscular junction: a model system for studying synaptic development and function. Annual review of neuroscience, 19, 545-75. [PubMed:8833454] [WorldCat] [DOI] - ↑
Imai, T., Sakano, H., & Vosshall, L.B. (2010).
Topographic mapping--the olfactory system. Cold Spring Harbor perspectives in biology, 2(8), a001776. [PubMed:20554703] [PMC] [WorldCat] [DOI] - ↑
Feldheim, D.A., & O'Leary, D.D. (2010).
Visual map development: bidirectional signaling, bifunctional guidance molecules, and competition. Cold Spring Harbor perspectives in biology, 2(11), a001768. [PubMed:20880989] [PMC] [WorldCat] [DOI] - ↑
Mori, K., & Sakano, H. (2011).
How is the olfactory map formed and interpreted in the mammalian brain? Annual review of neuroscience, 34, 467-99. [PubMed:21469960] [WorldCat] [DOI] - ↑
Schlaggar, B.L. (2011).
Mapping genetic influences on cortical regionalization. Neuron, 72(4), 499-501. [PubMed:22099452] [PMC] [WorldCat] [DOI] - ↑
Barbe, M.F., & Levitt, P. (1992).
Attraction of specific thalamic input by cerebral grafts depends on the molecular identity of the implant. Proceedings of the National Academy of Sciences of the United States of America, 89(9), 3706-10. [PubMed:1570290] [PMC] [WorldCat] [DOI] - ↑
Tawarayama, H., Yoshida, Y., Suto, F., Mitchell, K.J., & Fujisawa, H. (2010).
Roles of semaphorin-6B and plexin-A2 in lamina-restricted projection of hippocampal mossy fibers. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(20), 7049-60. [PubMed:20484647] [PMC] [WorldCat] [DOI] - ↑
Marín, O. (2012).
Interneuron dysfunction in psychiatric disorders. Nature reviews. Neuroscience, 13(2), 107-20. [PubMed:22251963] [WorldCat] [DOI] - ↑
Ango, F., di Cristo, G., Higashiyama, H., Bennett, V., Wu, P., & Huang, Z.J. (2004).
Ankyrin-based subcellular gradient of neurofascin, an immunoglobulin family protein, directs GABAergic innervation at purkinje axon initial segment. Cell, 119(2), 257-72. [PubMed:15479642] [WorldCat] [DOI] - ↑
Chédotal, A., Pourquié, O., Ezan, F., San Clemente, H., & Sotelo, C. (1996).
BEN as a presumptive target recognition molecule during the development of the olivocerebellar system. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(10), 3296-310. [PubMed:8627367] [WorldCat] - ↑
Betley, J.N., Wright, C.V., Kawaguchi, Y., Erdélyi, F., Szabó, G., Jessell, T.M., & Kaltschmidt, J.A. (2009).
Stringent specificity in the construction of a GABAergic presynaptic inhibitory circuit. Cell, 139(1), 161-74. [PubMed:19804761] [PMC] [WorldCat] [DOI] - ↑
Sürmeli, G., Akay, T., Ippolito, G.C., Tucker, P.W., & Jessell, T.M. (2011).
Patterns of spinal sensory-motor connectivity prescribed by a dorsoventral positional template. Cell, 147(3), 653-65. [PubMed:22036571] [PMC] [WorldCat] [DOI] - ↑
Luria, V., Krawchuk, D., Jessell, T.M., Laufer, E., & Kania, A. (2008).
Specification of motor axon trajectory by ephrin-B:EphB signaling: symmetrical control of axonal patterning in the developing limb. Neuron, 60(6), 1039-53. [PubMed:19109910] [WorldCat] [DOI]
(執筆者:櫻井武 担当編集委員:大隅典子)