カルシウムドメイン
英語名:Calcium domain
カルシウムイオン(Ca2+)がチャネルを通過して生じる細胞内の遊離カルシウム濃度上昇の空間的分布領域。カルシウムドメインは細胞外からのカルシウム流入、または小胞体からのカルシウム流出によって形成される。
カルシウムドメイン仮説
Chad & Eckert[1]によって提唱された。電位依存性カルシウムチャネルが短時間、開口することにより、細胞外から細胞内に流入したカルシウムは、細胞質にある内在性カルシウムバッファーの作用により、細胞膜の内側に沿って半円形に濃度分布すると推定され、その空間分布をカルシウムドメインと呼んだ(図1)。カルシウムドメインを形成する最小ユニットは単一チャネルであるが、複数チャネルのカルシウムドメインが重複すると、より大きなカルシウムドメインが形成される。カルシウムドメインの重複の程度はチャネル当たりのカルシウム流入量と、カルシウムチャネルの分布密度によって決定される。
関与するチャネル
- 細胞外カルシウムの細胞内流入を媒介するチャネル:電位依存性カルシウムチャネル、カルシウム透過型チャネル(NMDA型グルタミン酸受容体チャネル、機械力受容チャネル、TRPチャネル、環状ヌクレオチド依存性チャネル、store-operated CRACチャネルなど)
- 細胞内カルシウムストアから細胞質への流出を媒介するチャネル:リアノジン受容体チャネル、IP3受容体チャネル。
機能的役割
- カルシウムチャネルの調節:細部内カルシウムによってカルシウムチャネルは活性化または不活性化される。
- カルシウム依存性チャネルの活性化:カルシウム依存性カリウムチャネル、カルシウム依存性塩素チャネルが知られる。
- 神経伝達物質の開口放出:シナプトタグミンなどの低親和性カルシウム結合タンパク質により媒介される。
- シナプス小胞の取り込み(エンドサイトーシス):シナプトタグミンなどの低親和性カルシウム結合タンパク質により媒介されるものと、カルモジュリンなどの比較的低親和性カルシウム結合タンパク質により媒介されるものがある。
- シナプス伝達の修飾:カルモジュリンとの結合を介して、後シナプス受容体の密度、または前シナプス末端からの伝達物質放出を増強する。
- 筋収縮。
- 細胞内ストアカルシウムの放出促進(リアノジン受容体チャネル、IP3受容体チャネルからのカルシウムに依存したカルシウムの放出)。
- 成長円錐の伸長(TRPCチャネルなどからのカルシウム流入)。
サイズ
カルシウムドメインのサイズは、多くの場合、光学解像度の限界を超えるため実測できない。そのため次善の策として、カルシウム結合速度の異なるカルシウムキレート剤(表1)を細胞内に負荷して、それによるカルシウム依存性機能の抑制率を定量して、ドメインサイズを推定することが行われている。
表1[2]
| キレート剤 | Kon(1/M.s) | KD (μM) |
| BAPTA | 4.0 x 108 | 0.22 |
| EGTA | 2.5 x 106 | 0.18 |
キレート剤の存在下におけるカルシウムの拡散距離 λは
λ = (DCa/KonB)0.5
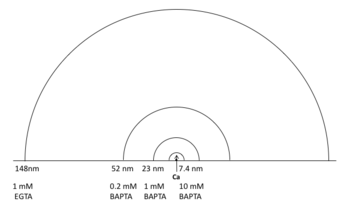
で近似される。ここでDCaは細胞質内におけるカルシウムの拡散定数(220 μm2/s)[2]、Bはキレート剤の濃度に相当する。 この式から推定される カルシウムドメインのサイズは図1のようになる。 例えば、細胞内カルシウムドメインに依存する機能が10 mM EGTAによってブロックされた場合、この機能に関わるカルシウムドメインのサイズは> 94 nmと推定される。10 mM EGTA によってはブロックされないが1 mM BAPTAによって完全にブロックされる場合は23 nm- 94 nm、10 mM BAPTAでブロックされない場合は< 7.4 nmと推定される。
マイクロドメインとナノドメイン
便宜上、カルシウムドメインのサイズが10-20 nm以下のものをナノドメイン、100-200 nm以上のものをマイクロドメインと呼び分けることが行われている[3]。しかし一方「マイクロドメイン」はカルシウムドメインの総称としても使われるので注意を要する。
参考文献
- ↑
Chad, J.E., & Eckert, R. (1984).
Calcium domains associated with individual channels can account for anomalous voltage relations of CA-dependent responses. Biophysical journal, 45(5), 993-9. [PubMed:6329349] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1
Naraghi, M., & Neher, E. (1997).
Linearized buffered Ca2+ diffusion in microdomains and its implications for calculation of [Ca2+] at the mouth of a calcium channel. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(18), 6961-73. [PubMed:9278532] [WorldCat] - ↑
Neher, E. (1998).
Vesicle pools and Ca2+ microdomains: new tools for understanding their roles in neurotransmitter release. Neuron, 20(3), 389-99. [PubMed:9539117] [WorldCat] [DOI]
(執筆者:高橋智幸 担当編集委員:尾藤晴彦)