「瞬目反射条件づけ」の版間の差分
細編集の要約なし |
Ykishimoto (トーク | 投稿記録) 細編集の要約なし |
||
| (同じ利用者による、間の1版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0109518 岸本 泰司]</font><br> | <font size="+1">[http://researchmap.jp/read0109518 岸本 泰司]</font><br> | ||
''徳島文理大学香川薬学部''<br> | ''徳島文理大学香川薬学部''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2015年8月14日 原稿完成日:2015年月日<br> | ||
担当編集委員:[http://researchmap.jp/tsuyoshimiyakawa 宮川 剛](藤田保健衛生大学)<br> | 担当編集委員:[http://researchmap.jp/tsuyoshimiyakawa 宮川 剛](藤田保健衛生大学)<br> | ||
</div> | </div> | ||
2016年1月22日 (金) 01:53時点における版
英語名: eyeblink conditioning、eyeblink classical conditioning 英略称:EBC、EBCC 独:Lidschlagkonditionierung 仏: conditionnement du clignement de paupières
同義語: 瞬目反射の条件づけ、瞬膜反射条件づけ、まばたき反射条件づけ
瞬目反射条件づけは、聴覚刺激もしくは視覚刺激を条件刺激とし、角膜や眼瞼への穏やかな刺激を無条件刺激として両刺激を繰り返し対提示すると、条件刺激だけでまばたきの条件反射が出現する古典的(パブロフ型)条件づけの一種である。マウスからヒトにいたるまで多様な種でそのメカニズムが研究され、脊椎動物の記憶・学習系の中で、その責任神経回路がもっとも詳らかにされた行動パラダイムの一つである。また、CSとUSの時間的関係によって、大きく遅延課題と痕跡課題の2種類が存在し、前者は小脳依存性の運動学習として、後者は海馬依存性の連合学習としてよく記述・利用される。遅延課題において小脳が記憶形成の場であるとの根拠は、主にウサギの脳損傷実験と小脳疾患患者の臨床例より得られた。遺伝子改変マウスに本学習系が適応された90年代以降は、記憶形成に重要な機能分子が同定され、特定のシナプスの役割も明らかにされつつある。また、多様な神経・精神疾患患者での研究報告例もあり、こうした疾患モデルマウスの認知機能の評価系としても有用性が期待される。
瞬目反射条件づけとは
瞬目反射条件づけは、古典的条件づけ(パブロフ型条件づけ)の一種であり、記憶・学習の基盤となる神経構造や機構を研究するための行動課題として長年実験心理学や神経生理学の分野で利用されてきた。
古典的条件づけは、「本来は生理的な反応を引き起こさない条件刺激(CS ; conditioned stimulus)」と「生理的な反応(無条件反射、UR; unconditioned responses)を引き起こす無条件刺激(US ; unconditioned stimulus)」を組み合わせて繰り返し提示すると、CSを与えただけでURに類似した応答である条件反射(CR ; conditioned responses)が見られるようになる学習形態である。最もよく知られている例はいわゆる“パブロフの犬”であり、CSとしてメトロノームの音を、USとして肉を用い、これらの対刺激を繰り返し提示することによって、音のみで唾液の分泌が生じるようになる[1]。
瞬目条件づけの場合、通常、聴覚刺激もしくは視覚刺激をCSとし、瞬目を引き起こすUSとしては、角膜や眼瞼への穏やかな空気刺激もしくは電気刺激が用いられる。このCSとUSを組み合わせて何度も繰り返し提示すると、被験動物は、やがてUSに先行するCSのみでまばたきや瞬膜の伸張を起こすようになる。学習の度合いはCRの出現率、すなわちある試行中でCRが出現した試行数の割合によって示される。動物種やパラダイム(後述する)によってその値は大きく異なるものの、ウサギの場合、よく訓練されると非常に高い学習率(90%以上)に到達する。
瞬目反射条件づけの現象についての最も初期の報告はヒトを対象としたもので、1922年の文献まで遡ることができる[2]。その後、心理学における行動主義の台頭に相まって、多くの重要な心理学的知見が、この瞬目反射条件づけを利用して発見された。例えば、ハンフリーズ効果、すなわち、連続強化よりも部分強化で条件づけられた行動の方が、消去抵抗が強くなるという現象は、瞬目反射条件づけを用いて発見されたものである[3](この効果の発見により、瞬目反射条件づけの実験では通常CSとUSの対提示だけではなく10回に1回程度CSのみ、あるいはさらにUSのみの試行を組み合わせて行うことが多い)。
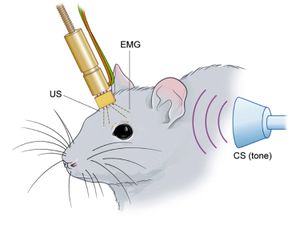
60年代、Isidore Gormezanoによりウサギに瞬目反射条件づけが導入されて以降は、数多くの実験動物を用いた生理・心理学的研究が実施された[4]。我が国においても、主にヒトを用いた瞬目反射条件づけの心理学的研究が盛んに行われていた時期がある[5]。1980年代後半になり、Ronald W. Skeltonによって、発達・加齢と学習との相関を調べる目的で、ラットに対して非拘束下での瞬目反射条件づけを可能とする手技が開発された(図1)[6]。90年代に入ると、この方法論がノックアウトマウスにそのまま適用され、瞬目反射条件づけの行動遺伝学が開始された[7]。特に、小脳のシナプス可塑性である長期抑圧(Long-term depression; LTD)(後述)と瞬目反射条件づけ遅延課題との関係性が集中的に調べられることになる[7]。こうした行動遺伝学的研究によって、代謝活性型グルタミン酸受容体1型(mGluR1)、GFAP、PLCβ4、GluRδ2、内在性カンナビノイド受容体CB1Rなど多くの分子が小脳LTDと瞬目反射条件づけ遅延課題の双方に必要であることが明らかとなり[7][8][9][10][11]、前庭動眼反射と同様、瞬目反射条件づけにおいても、LTDが記憶形成の神経基盤であるとの「小脳LTD仮説(後述)」が90年代後半には説得力をもって醸成されていった。今世紀に入り、瞬目反射条件づけ痕跡課題も遺伝子改変マウスに適応され、海馬におけるシナプス可塑性との相関性が示唆されている[12]。さらには、特定の時期かつ特定の神経細胞のみで機能を失活させたミュータントマウスに適用することにより、小脳や海馬における特定のシナプス回路が瞬目反射条件づけの記憶形成や保持に果たす役割も詳らかにされつつある[13][14][15] 。詳細は後述する遅延課題の場合、その 記憶痕跡の場が、主に小脳にあることから、とりわけ神経科学の分野で小脳依存性学習もしくは運動学習としてよく分類・記述される。小脳が記憶形成の場であるとの論拠は、主に実験動物の脳損傷実験と小脳疾患患者の臨床例よりもたらされた[16][17]。また多くのニューラルネットワークモデルによっても瞬目反射条件づけの小脳理論が構築され、行動実験の結果との擦り合わせが図られている。
マウス、ラット、モルモット、ネコ、サル、そしてヒトにいたるまで多様なほ乳類種を実験動物種としてそのメカニズムが研究されてきたことも本学習の特徴的な点である(歴史的に最も集中的に調べられてきた動物種はウサギである。また特殊な標本を利用して、カメなどの非ほ乳類での研究例も存在する) [18][19][20]。瞬目反射条件づけは、脊椎動物の記憶・学習系の中で、その責任神経回路がもっとも詳らかにされている行動パラダイムの一つである[17]。また、実験動物とヒトの双方において、ほぼ同一の課題で学習能力を測定できる数少ない学習系の一つとしても独自性があり(例えば、げっ歯類で頻用される水迷路試験をそのままの課題でヒトに適用することは不可能である)、モデルマウスで得られた行動データを、ヒトを対象とした臨床的知見に照らし合わせて考察することも可能となる。また、パラダイムの使い分け(CSとUSの時間関係を変えること)により、小脳と海馬それぞれの機能を評価できることも本学習系がもつ優位性のひとつである。さらに、仮に筋萎縮や麻痺といった四肢の障害がある場合でも(例えば運動失調を持つモデル動物でも)、まばたき反射はその出力が比較的最後まで保存されることから、認知機能を評価しやすいと考えられる。
方法
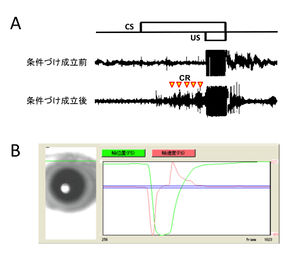
瞬目の主動筋である眼輪筋(orbicularis oculi muscle)の筋電図(EMG)法は、有効で感度の高い瞬目の検出法と考えられ、現在では多くの動物種の瞬目反射条件づけ研究において頻用される瞬き出力の計測法である(図2A)。人間やサルを対象とする場合、左下眼瞼と外眼角部に装着した電極対によって眼輪筋筋電図が測定され、USとしては通常空気刺激が用いられる[16]。眼輪筋筋電図法の短所として顔面部への電極装着による異物感があげられるが、瞬目反射の動作筋そのものの活動を記録するという意味においてもっとも適した計測法とされる[5]。一方、ラットやマウスに対しては、通常、上瞼の裏側に4本の電極を埋め込み、そのうち2本を眼輪筋筋電図の取得、残る2本をUSとしての電気刺激に用いる方法論が適用される(図1)。各電極は頭部に取り付けられた着脱可能なコネクタを介して、筋電計に繋がれる。眼輪筋筋電図法以外の瞬目測定法としては、ビデオカメラを用いて瞼の位置を物理的にトラッキングする方法(図2B)や、小型の磁気サーチコイルを用いた方法論があり、必要に応じて使い分けられる [20][5]。
遅延課題と痕跡課題
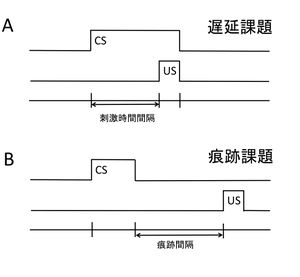
他の古典的条件づけと同様に、CSとUSが提示される順序が、瞬目反射条件づけの成立に決定的な要因となる。CSより前にUSが提示されるような課題(逆向性条件づけ)では、原則的に学習の成立は困難である。一方、CSがUSに先行する課題(先行性条件づけ)で、学習が成立しやすい。CSの開始とUSの開始の時間的間隔を刺激時間間隔(Interstimulus Interval; ISI)と呼び、ウサギの場合この間隔が200 -250 ms程度で最も学習獲得効率が大きくなることが知られている[4]。
瞬目反射条件づけには、USとCSの時間特性の違いによって、遅延(delay)課題と痕跡(trace)課題の2種類の行動パラダイムが存在する(図3)。遅延課題は、CSとUSに時間的な重なりがあり、かつ同時に終了するようなパラダイムである(図3A)。痕跡課題では、CSが終了してからUSが提示される。言いかえれば、痕跡課題では、CSとUSの間に無刺激の期間(痕跡間隔; trace interval)が挿入される(図3B)。
両課題ともその学習獲得に小脳が必要であるが、痕跡課題においては、その痕跡間隔が十分に大きい場合、記憶の獲得に小脳に加えて海馬が必須となる。例えば、ウサギやマウスでは痕跡間隔が500 ms以上の場合、ラットでは250 ms以上の場合、痕跡課題が海馬依存性学習になることが示されている[15][21][22]。なお、遅延課題の場合、海馬を除去しても学習は成立するが、海馬ニューロンの活動を電気的に、あるいはスコポラミンの投与などで薬理学的に撹乱させると、CRの獲得が遅くなることが知られている[23]。従って、遅延課題の成立に海馬は不要であるものの、海馬の異常は遅延課題に影響を与えるという意味において両者は関連性を持っているわけである。実際70年代までは、遅延課題を対象とした研究でも、小脳より海馬ニューロン活動との関連が興味の中心とされていた。小脳と遅延課題との関係が実験的に検討され始めたのは80年代になってからである。ところで、小脳は痕跡課題においても必要であると先述したが、小脳皮質のシナプス可塑性に障害を持つノックアウトマウスや小脳皮質の唯一の出力細胞であるプルキンエ細胞(PC)が消失したpcd(Purkinje cell deficient)マウスでは、痕跡課題の学習能力が正常に保たれていることが発見されてから、痕跡課題には小脳皮質は必須ではないという同意が得られつつある[24][25]。つまり、小脳核は、遅延、痕跡両課題に必須であるものの、小脳皮質は遅延課題のみで重要な役割を担っている可能性がある。
瞬目反射条件づけの神経回路とLTD仮説
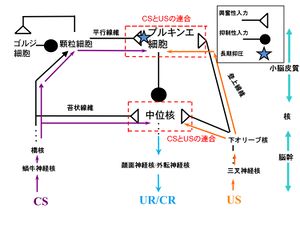
瞬目反射条件づけ(遅延課題)に関わる小脳神経回路図を簡略化して示したものである。CSの情報は、顆粒細胞を辿って小脳皮質のプルキンエ細胞に入力するとともに、苔状繊維を通って中位核にも入力する(紫色の矢印で示す)。他方、USの情報は、下オリーブ核から登上繊維を通ってプルキンエ細胞に入力するとともに、中位核にも入力する(橙色の矢印で示す)。従って、小脳皮質と小脳核の二つの部位でCS-USの連合が生じる。小脳LTDは、一定期間平行線維とプルキンエ細胞間のシナプス伝達効率が低下する現象である[26] 。小脳LTD仮説によれば、プルキンエ細胞から中位核への抑制性出力により、通常はCSのみでCRは出現しないが、LTDによってこの抑制が解除されるとCSのみでCRを発現する経路が顕在化すると考えられている。
瞬目反射条件づけ(遅延課題)に関与する小脳の神経回路について概説する。簡略化した模式図を図4に示した。
瞬目の反射経路
USが角膜に到達すると、その感覚情報は三叉神経核(trigeminal nucleus)に運ばれ、外転神経核に中継される。これらの神経核からの出力が、USに対する瞬目の無条件反射を引き起こす様々な眼筋を制御している。
CS経路
CSとしての聴覚や視覚情報は、橋核(pontine nuclei)を経由する。もっとも一般的なCSが音の場合、聴覚情報は蝸牛神経核を経て、橋核から苔状線維(mossy fiber)を伝わり、小脳皮質に入る。小脳皮質では、この情報は顆粒細胞(granule cells)に受け継がれ、その軸索である平行線維(parallel fiber)を辿ってプルキンエ細胞(Purkinje cell, PC)へ入力する。また、苔状線維は小脳核にも投射しシナプスを形成しており、CS情報は直接小脳核に入力されることにも注意されたい。
US経路
US情報は、三叉神経核を経由して延髄の下オリーブ核(inferior olive, IO)に投射する。下オリーブ核は登上線維(climbing fiber, CF)の起始核であり、その結果USに関する情報は小脳核とプルキンエ細胞の双方に入力することになる。
小脳におけるCS-US入力の統合と長期抑圧
CSとUSの情報は、小脳において2つの部位、小脳皮質と小脳核で連合される(図4)。小脳核の中でも、瞬目反射条件づけに殊に重要とされる領域は中位核(interpositus nucleus)である。橋核と下オリーブ核からそれぞれ運ばれてきたCSとUS情報の統合に加え、中位核のニューロンは小脳皮質のプルキンエ細胞から強力なGABA作動性の抑制性入力を受けている。中位核から出力された情報は、赤核を経て、瞬目の運動出力を担う顔面神経核や外転神経核へと投射される。すなわち、小脳核は、CSとUSの収斂の場であるだけでなく、小脳からの情報出力を担う構造でもある。
なお、平行線維とプルキンエ細胞間にはシナプス伝達効率の長期抑圧(LTD)が生じることが知られている(図4)。プルキンエ細胞の抑制性の出力が解除されることで、驚愕反射としても知られる「音を聴いて瞬きが起こる経路」が顕れるという説明がこのモデルの眼目である[27] 。前述したように、これまでにLTDに欠損があるマウス系統の多くで瞬目反射条件づけ(遅延課題)の記憶形成に重篤な障害が起きていることが示されてきた。これは、小脳LTDと瞬目反射条件づけが少なくとも同じ分子基盤を共有していることを強く示す証左であった。ところが、2000年代に入ると、小脳LTDは、運動記憶の形成そのものよりも、学習の表出のタイミングなど修飾的な役割を担うとする研究が報告され[28]、さらには小脳LTDが障害されているミュータントマウスでも、前庭動眼反射とともに瞬目反射条件づけ(遅延課題)の学習能力は全く正常であると主張する報告が提出され、小脳学習の研究分野に大きなインパクトを与えた[29]。しかしながら、こうした研究も遺伝子改変マウスにおける行動とシナプス機能の相関関係を論じたものであり、因果関係を必ずしも明確にしたものではない。実際、依然としてLTDの障害と瞬目反射条件づけの障害の相関関係を示した論文は、現在も報告され続けている[30][31]。
小脳皮質vs.小脳核の論争
1980年代に南カルフォルニア大学のRichard F. Thompsonのグループが、同側の小脳破壊(小脳皮質と小脳核の両方の破壊)によって、瞬目反射条件づけ遅延課題の学習獲得が失われることを発見し[16]、これが瞬目反射条件づけ(遅延課題)に小脳が必要であるとのコンセンサスの礎となった(当初、小脳破壊は単純に、CRの出力を損傷させているだけで、記憶の形成を阻害している訳ではないという反論もアイオワ大学の研究者からなされ、両者との間で論争となったことも付記する[32][33])。しかし、小脳核を完全に傷つけずに小脳皮質のみを除去することは実際的には困難であることから、その後小脳皮質が瞬目反射条件づけ(遅延課題)に必須であるかどうかについての議論が長く続くことになる。Thompsonらが、小脳核の重要性を強調したのに対し(ただし彼らのグループは後に、ミュータントマウスを用いてむしろ後者の立場も支持する一連の研究を行ったことは留意すべきである)、代表的にはユニヴァーシティ・カレッジ・ロンドンのChristopher H. Yeoのグループは、注意深い損傷実験により、小脳皮質がより瞬目反射条件づけ(遅延課題)の学習獲得に重要であるとの言説を唱えた[34]。以下の2項でさらに、小脳皮質と小脳核の役割に着目したより具体的な研究例を紹介する。
小脳皮質の重要性についての議論
小脳皮質の中でも特に重要な領域とされるのが、第VI半球小葉と前葉である。これらの部位の損傷・除去、不活性化、もしくは発現分子の欠損によって、瞬目反射条件づけ(遅延課題)の学習が阻害されるとの多くの報告がある。LavondとSteinmetzは、小脳核を残したまま、第VI半球小葉と小脳前葉を含む大きな領域を吸引除去したところ、瞬目反射条件づけ(遅延課題)の学習が著明に障害されることを示した[35]。ただし、一度学習が成立した後に、こうした領域を除去してもCRの発現に大きな影響は見られないことから、学習の保持には重要ではないとされた。また、GABAA受容体アゴニストであるムシモルやAMPA型グルタミン酸受容体アンタゴニストCNQXを小脳第VI半球小葉に注入しても、同様に瞬目反射条件づけ(遅延課題)の学習が阻害される[17]。ただし、こうした方法論も、小脳核の機能を完全に保持したままでの実行が難しい可能性があり、小脳皮質の小脳核に対する相対的優位性については未だに評価が定まっていない。なお、小脳皮質の唯一の出力細胞であるプルキンエ細胞が欠落したpcdマウスでも、小脳皮質除去動物と同様に、瞬目反射条件づけ(遅延課題)の学習獲得が著明に障害されていた [36]。とはいえ、この実験結果も、学習が完全に抑制されるわけではなかったことから、むしろ小脳皮質が遅延課題の記憶形成に必須ではないとの文脈で参照されることが多い[37]。また、平行線維からプルキンエ細胞に対する神経伝達物質の放出を可逆的に阻害できるマウスを利用した研究によれば、小脳皮質における神経伝達が瞬目反射条件づけの記憶成立には必須でなく、CRの表出に重要であることが示唆されている[14]。
小脳核(中位核)の重要性についての議論
Richard F. Thompsonのグループは、前中位核(anterior interpositus nucleus)のみに限局した損傷でも、同側小脳損傷(皮質と核の双方の損傷)の場合と同程度に、1) ナイーブ動物での瞬目反射条件づけ(遅延課題)の獲得を妨げること、さらに、2) よく学習が成立した後でさえCRの出現を完全に阻害すること、を示した[17]。また、局所的なムシモルや麻酔剤の投与、あるいは冷却によって中位核を可逆的に不活性化しても、被験動物でCRが出現しなくなることなどが相次いで報告された。瞬目反射条件づけ中の中位核ニューロン活動のマルチユニット活動解析からは、中位核ニューロンはCRの表出に先んじて活動を始め、さらにこの神経発火の時間パターンはCR表出の時間パターンを非常に良く予測することも明らかにされた[38]。in vivoの電気生理学的研究によって、中位核においては長期増強の存在も報告されていることもあり[39]、現時点において中位核は瞬目反射条件づけの記憶形成において最も重要な部位と認識されるに至っている[40]。
瞬目反射条件づけの消去
条件づけが成立した後に、USを伴わずCSだけ繰り返し提示するとCRは次第に消失する。これを実験的消去と呼ぶ。しかし、一見完全に消去が起こった場合でも記憶痕跡が消失した訳ではなく、しばらく時間をおいてからCSを提示すると、CRがある程度生起する。これを自発的回復と称する。また、消去試行後直ちにCS-USの対提示を繰り返した場合では、CRは急速に発現し、初回よりも少ない試行回数で元の学習到達率まで回復する。こうした現象は、実験的消去が単純に古い記憶の忘却ではなく、別の新しい学習(消去学習; extinction learning)であることを示唆している。消去後のCRの復活はその新しい記憶のさらなる消去を意味しているとも考えられる。なお、瞬目反射条件づけの消去の神経基盤として小脳平衡線維とプルキンエ細胞間の長期増強を想定するモデルも存在する[41]。
神経・精神疾患と瞬目反射条件づけ
ヒトを対象とした臨床研究によって、多様な神経・精神疾患の患者で瞬目反射条件づけの学習異常が報告されている。ごく一部を本項で紹介する。
- アルツハイマー型認知症患者では遅延課題および痕跡課題の両課題で有意な障害が観察されるが、その障害の度合いは遅延課題でより顕著であるという報告もある[42][43][44]。
- 統合失調症の患者では、初期の研究では遅延課題における顕著な学習の亢進が報告されたが[45]、近年では、むしろ学習障害を示す報告が多い[46][47]。統合失調型パーソナリティ障害の罹患者でも、顕著な学習障害が見られるという[48]。
- パーキンソン病患者においては、遅延課題の学習獲得の速度が速くなる傾向にあるのに対し、多系統萎縮症患者では学習障害が観察された[49][50] 。
- 自閉症スペクトラムと診断された小児では、痕跡課題のCRは正常であるが、遅延課題におけるCRのタイミングに異常が見られた[51][52]。
こうした疾患のモデル動物の認知機能の評価系としても有用性が期待されるところである。
展望・課題
この100年ほどのあいだに,様々な領域の技術の発展を取り込みながら、瞬目反射条件づけの分子・神経機構が解析されてきた。特に小脳の神経回路において詳らかにされた遅延課題の学習機構は、記憶学習の生物学的研究における最大の事績の一つと言える。しかし一方で、未だに記憶の獲得や保持に関わる新しい分子やシナプス回路が発見され続けていることから窺い知れるよう、瞬目反射条件づけの研究には、まだ実のところ「正解」がわからない現在進行形の課題も多分に残されている。将来的にはより直接的な方法論(たとえば光遺伝学[53])によって、特に小脳皮質の本質的な役割が解き明かされることを期待したい。また、特性の異なる遅延課題と痕跡課題の両パラダイムを活用することで、瞬目反射条件づけは、疾患モデル動物の認知機能の単なる測定法に留まらず、治療法の探索への応用など,今後は前臨床研究や創薬のツールとしても有望であると考えられる。
参考文献
- ↑ I P Pavlov
Conditioned reflexes: an investigation of the physiological activity of the cerebral cortex
Oxford University Press(Oxford):1927 - ↑ H Cason
The conditioned eyelid reaction
J. Exp. Psychol. 5(3); 153-196.:1922 - ↑ L G Humphreys
The effect of random alteration of reinforcement on the acquisition and extinction of conditioned eyeblink reactions
J. Exp. Psychol. 25(2); 141-158.:1939 - ↑ 4.0 4.1
SCHNEIDERMAN, N., & GORMEZANO, I. (1964).
CONDITIONING OF THE NICTITATING MEMBRANE OF THE RABBIT AS A FUNCTION OF CS-US INTERVAL. Journal of comparative and physiological psychology, 57, 188-95. [PubMed:14168641] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 山田冨美雄
瞬目反射の先行刺激効果:その心理学的意義と応用
多賀出版(東京):1993 - ↑
Skelton, R.W. (1988).
Bilateral cerebellar lesions disrupt conditioned eyelid responses in unrestrained rats. Behavioral neuroscience, 102(4), 586-90. [PubMed:3166733] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Aiba, A., Kano, M., Chen, C., Stanton, M.E., Fox, G.D., Herrup, K., ..., & Tonegawa, S. (1994).
Deficient cerebellar long-term depression and impaired motor learning in mGluR1 mutant mice. Cell, 79(2), 377-88. [PubMed:7954803] [WorldCat] - ↑
Shibuki, K., Gomi, H., Chen, L., Bao, S., Kim, J.J., Wakatsuki, H., ..., & Itohara, S. (1996).
Deficient cerebellar long-term depression, impaired eyeblink conditioning, and normal motor coordination in GFAP mutant mice. Neuron, 16(3), 587-99. [PubMed:8785056] [WorldCat] [DOI] - ↑
Kishimoto, Y., & Kano, M. (2006).
Endogenous cannabinoid signaling through the CB1 receptor is essential for cerebellum-dependent discrete motor learning. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(34), 8829-37. [PubMed:16928872] [PMC] [WorldCat] [DOI] - ↑
Miyata, M., Kim, H.T., Hashimoto, K., Lee, T.K., Cho, S.Y., Jiang, H., ..., & Shin, H.S. (2001).
Deficient long-term synaptic depression in the rostral cerebellum correlated with impaired motor learning in phospholipase C beta4 mutant mice. The European journal of neuroscience, 13(10), 1945-54. [PubMed:11403688] [WorldCat] [DOI] - ↑
Kishimoto, Y., Kawahara, S., Fujimichi, R., Mori, H., Mishina, M., & Kirino, Y. (2001).
Impairment of eyeblink conditioning in GluRdelta2-mutant mice depends on the temporal overlap between conditioned and unconditioned stimuli. The European journal of neuroscience, 14(9), 1515-21. [PubMed:11722613] [WorldCat] [DOI] - ↑
Kishimoto, Y., Kawahara, S., Mori, H., Mishina, M., & Kirino, Y. (2001).
Long-trace interval eyeblink conditioning is impaired in mutant mice lacking the NMDA receptor subunit epsilon 1. The European journal of neuroscience, 13(6), 1221-7. [PubMed:11285019] [WorldCat] [DOI] - ↑
Kishimoto, Y., Fujimichi, R., Araishi, K., Kawahara, S., Kano, M., Aiba, A., & Kirino, Y. (2002).
mGluR1 in cerebellar Purkinje cells is required for normal association of temporally contiguous stimuli in classical conditioning. The European journal of neuroscience, 16(12), 2416-24. [PubMed:12492436] [WorldCat] [DOI] - ↑ 14.0 14.1
Wada, N., Kishimoto, Y., Watanabe, D., Kano, M., Hirano, T., Funabiki, K., & Nakanishi, S. (2007).
Conditioned eyeblink learning is formed and stored without cerebellar granule cell transmission. Proceedings of the National Academy of Sciences of the United States of America, 104(42), 16690-5. [PubMed:17923666] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1
Kishimoto, Y., Nakazawa, K., Tonegawa, S., Kirino, Y., & Kano, M. (2006).
Hippocampal CA3 NMDA receptors are crucial for adaptive timing of trace eyeblink conditioned response. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(5), 1562-70. [PubMed:16452679] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2
McCormick, D.A., & Thompson, R.F. (1984).
Cerebellum: essential involvement in the classically conditioned eyelid response. Science (New York, N.Y.), 223(4633), 296-9. [PubMed:6701513] [WorldCat] [DOI] - ↑ 17.0 17.1 17.2 17.3
Krupa, D.J., Thompson, J.K., & Thompson, R.F. (1993).
Localization of a memory trace in the mammalian brain. Science (New York, N.Y.), 260(5110), 989-91. [PubMed:8493536] [WorldCat] [DOI] - ↑ D S Woodruff-Pak, J E Steinmetz
Eyeblink Classical Conditioning, Volume 1: Applications in Human
Kluwer Academic Publishers(Boston):2000 - ↑ D S Woodruff-Pak, J E Steinmetz
Eyeblink Classical Conditioning, Volume 2: Animal Models
Kluwer Academic Publishers(Boston):2000 - ↑ 20.0 20.1
Kishimoto, Y., Yamamoto, S., Suzuki, K., Toyoda, H., Kano, M., Tsukada, H., & Kirino, Y. (2015).
Implicit Memory in Monkeys: Development of a Delay Eyeblink Conditioning System with Parallel Electromyographic and High-Speed Video Measurements. PloS one, 10(6), e0129828. [PubMed:26068663] [PMC] [WorldCat] [DOI] - ↑
Moyer, J.R., Deyo, R.A., & Disterhoft, J.F. (1990).
Hippocampectomy disrupts trace eye-blink conditioning in rabbits. Behavioral neuroscience, 104(2), 243-52. [PubMed:2346619] [WorldCat] [DOI] - ↑
Weiss, C., Bouwmeester, H., Power, J.M., & Disterhoft, J.F. (1999).
Hippocampal lesions prevent trace eyeblink conditioning in the freely moving rat. Behavioural brain research, 99(2), 123-32. [PubMed:10512579] [WorldCat] [DOI] - ↑
Solomon, P.R., Solomon, S.D., Schaaf, E.V., & Perry, H.E. (1983).
Altered activity in the hippocampus is more detrimental to classical conditioning than removing the structure. Science (New York, N.Y.), 220(4594), 329-31. [PubMed:6836277] [WorldCat] [DOI] - ↑
Brown, K.L., Agelan, A., & Woodruff-Pak, D.S. (2010).
Unimpaired trace classical eyeblink conditioning in Purkinje cell degeneration (pcd) mutant mice. Neurobiology of learning and memory, 93(3), 303-11. [PubMed:19931625] [PMC] [WorldCat] [DOI] - ↑
Kishimoto, Y., Kawahara, S., Suzuki, M., Mori, H., Mishina, M., & Kirino, Y. (2001).
Classical eyeblink conditioning in glutamate receptor subunit delta 2 mutant mice is impaired in the delay paradigm but not in the trace paradigm. The European journal of neuroscience, 13(6), 1249-53. [PubMed:11285022] [WorldCat] [DOI] - ↑
Ito, M. (1989).
Long-term depression. Annual review of neuroscience, 12, 85-102. [PubMed:2648961] [WorldCat] [DOI] - ↑ M Ito
The cerebellum and neural control
Raven Press(New York):1984 - ↑
Koekkoek, S.K., Hulscher, H.C., Dortland, B.R., Hensbroek, R.A., Elgersma, Y., Ruigrok, T.J., & De Zeeuw, C.I. (2003).
Cerebellar LTD and learning-dependent timing of conditioned eyelid responses. Science (New York, N.Y.), 301(5640), 1736-9. [PubMed:14500987] [WorldCat] [DOI] - ↑
Schonewille, M., Gao, Z., Boele, H.J., Veloz, M.F., Amerika, W.E., Simek, A.A., ..., & De Zeeuw, C.I. (2011).
Reevaluating the role of LTD in cerebellar motor learning. Neuron, 70(1), 43-50. [PubMed:21482355] [PMC] [WorldCat] [DOI] - ↑
Ohtani, Y., Miyata, M., Hashimoto, K., Tabata, T., Kishimoto, Y., Fukaya, M., ..., & Aiba, A. (2014).
The synaptic targeting of mGluR1 by its carboxyl-terminal domain is crucial for cerebellar function. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(7), 2702-12. [PubMed:24523559] [PMC] [WorldCat] [DOI] - ↑
Piochon, C., Kloth, A.D., Grasselli, G., Titley, H.K., Nakayama, H., Hashimoto, K., ..., & Hansel, C. (2014).
Cerebellar plasticity and motor learning deficits in a copy-number variation mouse model of autism. Nature communications, 5, 5586. [PubMed:25418414] [PMC] [WorldCat] [DOI] - ↑
Welsh, J.P., & Harvey, J.A. (1989).
Cerebellar lesions and the nictitating membrane reflex: performance deficits of the conditioned and unconditioned response. The Journal of neuroscience : the official journal of the Society for Neuroscience, 9(1), 299-311. [PubMed:2913208] [WorldCat] - ↑
Steinmetz, J.E., Lavond, D.G., Ivkovich, D., Logan, C.G., & Thompson, R.F. (1992).
Disruption of classical eyelid conditioning after cerebellar lesions: damage to a memory trace system or a simple performance deficit? The Journal of neuroscience : the official journal of the Society for Neuroscience, 12(11), 4403-26. [PubMed:1432102] [WorldCat] - ↑
Yeo, C.H., Hardiman, M.J., & Glickstein, M. (1985).
Classical conditioning of the nictitating membrane response of the rabbit. II. Lesions of the cerebellar cortex. Experimental brain research, 60(1), 99-113. [PubMed:4043286] [WorldCat] [DOI] - ↑
Lavond, D.G., & Steinmetz, J.E. (1989).
Acquisition of classical conditioning without cerebellar cortex. Behavioural brain research, 33(2), 113-64. [PubMed:2765164] [WorldCat] [DOI] - ↑
Chen, L., Bao, S., Lockard, J.M., Kim, J.K., & Thompson, R.F. (1996).
Impaired classical eyeblink conditioning in cerebellar-lesioned and Purkinje cell degeneration (pcd) mutant mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(8), 2829-38. [PubMed:8786457] [WorldCat] - ↑
Freeman, J.H., & Steinmetz, A.B. (2011).
Neural circuitry and plasticity mechanisms underlying delay eyeblink conditioning. Learning & memory (Cold Spring Harbor, N.Y.), 18(10), 666-77. [PubMed:21969489] [PMC] [WorldCat] [DOI] - ↑
Berthier, N.E., & Moore, J.W. (1990).
Activity of deep cerebellar nuclear cells during classical conditioning of nictitating membrane extension in rabbits. Experimental brain research, 83(1), 44-54. [PubMed:2073949] [WorldCat] [DOI] - ↑
Racine, R.J., Wilson, D.A., Gingell, R., & Sunderland, D. (1986).
Long-term potentiation in the interpositus and vestibular nuclei in the rat. Experimental brain research, 63(1), 158-62. [PubMed:3015653] [WorldCat] [DOI] - ↑
Lee, K.H., Mathews, P.J., Reeves, A.M., Choe, K.Y., Jami, S.A., Serrano, R.E., & Otis, T.S. (2015).
Circuit mechanisms underlying motor memory formation in the cerebellum. Neuron, 86(2), 529-40. [PubMed:25843404] [PMC] [WorldCat] [DOI] - ↑
Mauk, M.D. (1997).
Roles of cerebellar cortex and nuclei in motor learning: contradictions or clues? Neuron, 18(3), 343-6. [PubMed:9115728] [WorldCat] [DOI] - ↑
Woodruff-Pak, D.S., Finkbiner, R.G., & Sasse, D.K. (1990).
Eyeblink conditioning discriminates Alzheimer's patients from non-demented aged. Neuroreport, 1(1), 45-8. [PubMed:2129854] [WorldCat] [DOI] - ↑
Solomon, P.R., Levine, E., Bein, T., & Pendlebury, W.W. (1991).
Disruption of classical conditioning in patients with Alzheimer's disease. Neurobiology of aging, 12(4), 283-7. [PubMed:1961358] [WorldCat] [DOI] - ↑
Woodruff-Pak, D.S., & Papka, M. (1996).
Alzheimer's disease and eyeblink conditioning: 750 ms trace vs. 400 ms delay paradigm. Neurobiology of aging, 17(3), 397-404. [PubMed:8725901] [WorldCat] [DOI] - ↑
Sears, L.L., Andreasen, N.C., & O'Leary, D.S. (2000).
Cerebellar functional abnormalities in schizophrenia are suggested by classical eyeblink conditioning. Biological psychiatry, 48(3), 204-9. [PubMed:10924663] [WorldCat] [DOI] - ↑
Edwards, C.R., Newman, S., Bismark, A., Skosnik, P.D., O'Donnell, B.F., Shekhar, A., ..., & Hetrick, W.P. (2008).
Cerebellum volume and eyeblink conditioning in schizophrenia. Psychiatry research, 162(3), 185-94. [PubMed:18222655] [PMC] [WorldCat] [DOI] - ↑
Bernard, J.A., & Mittal, V.A. (2014).
Cerebellar-motor dysfunction in schizophrenia and psychosis-risk: the importance of regional cerebellar analysis approaches. Frontiers in psychiatry, 5, 160. [PubMed:25505424] [PMC] [WorldCat] [DOI] - ↑
Forsyth, J.K., Bolbecker, A.R., Mehta, C.S., Klaunig, M.J., Steinmetz, J.E., O'Donnell, B.F., & Hetrick, W.P. (2012).
Cerebellar-dependent eyeblink conditioning deficits in schizophrenia spectrum disorders. Schizophrenia bulletin, 38(4), 751-9. [PubMed:21148238] [PMC] [WorldCat] [DOI] - ↑
Daum, I., Schugens, M.M., Breitenstein, C., Topka, H., & Spieker, S. (1996).
Classical eyeblink conditioning in Parkinson's disease. Movement disorders : official journal of the Movement Disorder Society, 11(6), 639-46. [PubMed:8914089] [WorldCat] [DOI] - ↑
von Lewinski, F., Schwan, M., Paulus, W., Trenkwalder, C., & Sommer, M. (2013).
Impairment of brainstem implicit learning paradigms differentiates multiple system atrophy (MSA) from idiopathic Parkinson syndrome. BMJ open, 3(9), e003098. [PubMed:24038003] [PMC] [WorldCat] [DOI] - ↑
Oristaglio, J., Hyman West, S., Ghaffari, M., Lech, M.S., Verma, B.R., Harvey, J.A., ..., & Malone, R.P. (2013).
Children with autism spectrum disorders show abnormal conditioned response timing on delay, but not trace, eyeblink conditioning. Neuroscience, 248, 708-18. [PubMed:23769889] [PMC] [WorldCat] [DOI] - ↑
Frings, M., Gaertner, K., Buderath, P., Gerwig, M., Christiansen, H., Schoch, B., ..., & Timmann, D. (2010).
Timing of conditioned eyeblink responses is impaired in children with attention-deficit/hyperactivity disorder. Experimental brain research, 201(2), 167-76. [PubMed:19777220] [WorldCat] [DOI] - ↑
Heiney, S.A., Kim, J., Augustine, G.J., & Medina, J.F. (2014).
Precise control of movement kinematics by optogenetic inhibition of Purkinje cell activity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(6), 2321-30. [PubMed:24501371] [PMC] [WorldCat] [DOI]