転写制御因子
転写制御因子
英:transcriptional regulator
同義語:転写調節因子
転写制御因子は、ゲノムDNA上の特定の塩基配列に結合し、RNAポリメラーゼによる転写を促進あるいは抑制するタンパク質の一群である。DNAに結合するドメインと転写制御に関わるドメインを有する。DNA結合ドメインなどの構造上の特徴により、いくつかのファミリーに分類される。転写制御因子の活性はリン酸化などの様々な制御を受け、神経発生から脳高次機能までの多くの過程に関わる。転写制御因子をコードすると推測される遺伝子は、ヒトゲノムにおいておよそ2000個程度存在する[1][2]。
転写制御因子とは
遺伝子の転写は、RNAポリメラーゼがDNAを鋳型として相補的なRNAを5’から3’の方向へ合成する反応である。転写制御因子は、DNA上の転写制御配列に直接結合し、転写を促進あるいは抑制する。転写の効率を上げるものを転写活性化因子、下げるものを転写抑制因子という。一方、DNAに直接結合せず、転写制御因子とRNAポリメラーゼの仲介役として転写を調節するタンパク質複合体はメディエーターと呼ばれる。メディエーターの機能は多岐に渡り、転写を活性化するコアクチベーターや、転写を抑制するコリプレッサーとして働く。コアクチベーターにはヒストンをアセチル化するCBPなど、クロマチンを制御するものもある。転写制御因子が認識し、結合する配列は転写制御配列といい、転写の活性化に働く配列をエンハンサー、抑制するものはサイレンサーと呼ばれる。
転写制御機構
in vitroの解析により、転写は、TATAボックスなどのコアプロモーター上でTBP(TATA-binding protein)やTAFs (TBP-associated factors)などの基本転写因子がRNAポリメラーゼと転写開始前複合体を形成することにより開始されることが示されている[3][4][5]。この転写は基本転写と呼ばれる。生体内では、様々な転写制御因子が働き、その組み合わせにより遺伝子の転写量は組織や発生の時期で異なる[6]。
転写活性化の機構
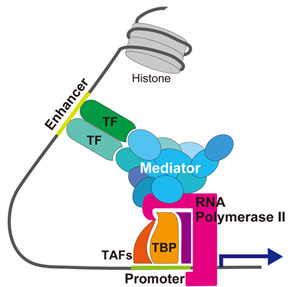
転写の活性化とは、転写の効率が高まることを言い、転写開始と伸長のそれぞれの段階で起こりうる。よく知られている活性化のモデルは、転写活性化因子がエンハンサーなどに結合し、基本転写因子と相互作用してプロモーター領域における転写開始前複合体の形成を安定化することである[7]。 一方、多くの転写活性化因子の作用にはメディエーターの働きが必要であると考えられている(図1) [7]。転写活性化においてメディエーターは、転写制御因子の転写活性化ドメインやRNAポリメラーゼに直接結合し、タンパク質間相互作用を介して転写開始前複合体の形成を促進することにより、転写の開始を促進し、コアクチベーターとして機能する[7]。真核細胞のDNAはヒストンに巻きついてヌクレオソームを形成し、それがさらに高次のクロマチン構造を取っていることから、ヌクレオソーム構造を弛緩させる作用を持つ因子がコアクチベーターとして重要な役割を果たす。CBPなどのヒストンアセチル基転移活性を持つコアクチベーターは、ヒストンをアセチル化することによりヒストンとDNA間の親和性を弱めて転写制御因子をアクセスしやすくしていると考えられている[8]。一方、SWI/SNFファミリーに代表されるATP依存性クロマチン再構成複合体もコアクチベーターとして重要であり、ATPの加水分解で生じるエネルギーを用いて直接ヌクレオソーム構造を変化させることにより、転写制御因子やRNAポリメラーゼの接近を促し転写の活性化に寄与する[9]。
転写抑制の機構
転写抑制因子の多くはクロマチンの構造を変化させるコリプレッサーの作用を介して転写を抑制する。転写抑制因子がサイレンサーなどの転写抑制配列に結合すると、Grg/TLEやNcoR/SMRTなどのコリプレッサーはヒストン脱アセチル化酵素をリクルートしてヒストンのアセチル基を除去し、ヌクレオソームを安定化させることにより遺伝子を不活性化する[8][10][11]。ヒストンメチル基転移酵素を引き寄せることにより、ヒストンの特定部位をメチル化し、転写が休止した状態のクロマチンを維持することにより転写を抑制する場合もある。転写抑制因子NRSF/RESTはneural restrictive silencer elementに結合し、メディエーターを介してヒストン脱アセチル化酵素やヒストンメチル基転移酵素と相互作用し、神経系特異的遺伝子の発現を抑制する[7]。また、メディエーターのなかでもキナーゼドメインを有するものは転写制御因子をリン酸化して分解を促進したり、基本転写因子をリン酸化して転写開始前複合体の形成を阻害するなど、コリプレッサーとして働くことが明らかとなっている[12]。
転写制御因子結合領域(エンハンサーやサイレンサー)
転写制御因子が認識・結合する標的となる転写調節領域(エンハンサーやサイレンサー)は、それぞれ特有のヌクレオチド配列から成っているが、多くの転写制御因子では、その認識ヌクレオチド配列は長いもので10ヌクレオチド程度、短いもので4ヌクレオチド程度が固定されているだけで、その他のヌクレオチドはかなり変動する。転写活性化因子が特異的に結合し、転写活性化に働く領域をエンハンサーといい、転写抑制に働く領域はサイレンサーと呼ばれる。転写開始部位の上流であることも下流であることもある。遺伝子発現は多くの場合、複数のエンハンサーやサイレンサーによって制御され、その領域に結合する転写制御因子の組み合わせによりどの遺伝子が発現するかが決まる[13]。あるDNA配列における転写制御因子の予想結合部位はMatInspector software (http://www.genomatix.de/index.html) を使って調べることができる。
構造
転写制御因子は、DNA結合ドメインとタンパク質間相互作用を介して転写制御に必須な機能を持ったドメインを有する。各機能領域の配列や数は転写制御因子によって異なる。DNA結合ドメインは転写制御配列に結合する領域で、転写調節作用に必須である。転写活性化ドメイン(transactivation domain)は他のタンパク質(コアクチベーターなど)と結合するための領域でそのアミノ酸配列の特徴から、酸性アミノ酸領域、グルタミン酸に富む領域、プロリンに富む領域などに分類されている。シグナル検知領域またはリガンド結合領域と呼ばれる領域は、外部からのシグナル因子による制御を受け、転写制御因子の活性変化をもたらす。
DNA結合ドメインによる分類
転写制御因子は、DNA結合ドメインの構造的なモチーフから、下の表のようにHomeodomain、basic Helix-Loop-Helix (bHLH)、Zinc finger、Leucine zipperなどいくつかのファミリーに分けられる。転写制御因子のリストはTRANSFACデータベース(http://www.gene-regulation.com)から入手可能である。
Homeodomain
ホメオボックスがコードするタンパク質ドメインで、60アミノ酸からなる。ショウジョウバエの体軸に沿ったパターン形成に関与する転写制御因子から見出されたモチーフで、ヒトを含む高等動物でもよく保存されている。Helix-turn-helix構造を持ち、2番目のヘリックスがDNAを認識する。アミノ酸配列の類似性やタンパク質間相互作用に必要なモチーフの有無からさらにサブファミリーに分けられる。
Zinc finger
GATAファミリー因子などに見られる構造で、2個のヒスチジンと2個のシステインが亜鉛イオンに配位結合することで、DNAと結合する部分のαヘリックス構造が安定化され、DNAに結合する。共通するアミノ酸配列に基づいて、C2H2タイプ、C4タイプなどに分類されている。ステロイドホルモン受容体などの核内受容体は、各種ホルモンなどのリガンドと直接結合することにより制御される転写制御因子で、DNAに結合するZinc finger領域とリガンド結合領域を有する[14][15]。
basic Helix-Loop-Helix (bHLH)
HLHはプロニューラル因子に代表される神経細胞分化に必須な転写制御因子に見られ、転写制御因子間の結合に重要な構造である。二量体を形成した転写制御因子の2つの塩基性領域がDNAを認識する。
Leucine zipper
アミノ酸7つごとにロイシンあるいはイソロイシンが配置された特徴的なαヘリックス構造を持ち、転写制御因子の二量体形成に関わる。形成された二量体の塩基性領域がDNAを認識する。
| DNA結合ドメイン | ファミリー | 例 |
|---|---|---|
| Homeodomain | Hox | HoxA1,HoxC8 |
| Pax | Pax2,Pax6 | |
| Emx | Emx2 | |
| Nkx | Nkx2.2,Nkx6.1 | |
| En | En1 | |
| Bar | Barhl1,Barhl2 | |
| Paired-like | Phox2a,DRG11 | |
| POU | Brn3a | |
| Winged helix/forkhead | Fox | FoxG1(Bf1),FoxO,FoxP2 |
| Basic helix-loop-helix | bHLH | Mash1,Neurogenin2, Math1,NeuroD,Ptf1a,Hes1,Hey1,Olig2,Tal1 |
| bHLH-PAS | Per1,Clk | |
| T-box | Tbr1,Tbx21(T-bet) | |
| HMG-box | Sox | Sox2,Sox9,Sox10 |
| Hmga2 | ||
| Tcf/LEF | Tcf3,Tcf4 | |
| ETS | Pea3,Er81 | |
| Zinc finger | C2H2型 | Gli1,Nrsf/REST,Zif268,Krox20,Fezl |
| Kruppel-like | Klf4 | |
| Gata | Gata2,Gata3 | |
| Nuclear hormone receptor | RARα1, RXR | |
| Rel homology domain | Rbpjκ/CBF1,NF-κB, NFAT | |
| MH1 domain | Smad | Smad2, Smad4 |
| Leucine zipper | C-Fos,CREB | |
| novel | CaRF | CaRF |
転写制御因子の活性制御
転写制御因子は外界からの刺激や細胞の分化段階によって動的に制御されている。転写制御因子をコードする遺伝子の発現制御は主要な制御点となる。転写制御因子は自身の転写を制御することも知られ、細胞内での転写制御因子の発現レベルを低く維持するメカニズムの一つとなっている。
一方、迅速な活性調節には翻訳後の制御が重要である。細胞内に不活性化型で存在する転写制御因子はリン酸化やユビキチン化、リガンドとの直接の結合、転写阻害因子の解離、プロテアーゼによる分解などにより活性が制御される[16]。転写制御因子のリン酸化・脱リン酸化は細胞膜や細胞質で相互作用している分子との解離、さらに核内への移行を引き起こすこともあり、転写制御因子の活性状態(DNAやコアクチベーターと結合し得るか否か)に影響を与える。シグナル経路の仲介因子であるSmadやCBF-1は、リガンドと受容体の結合によって活性が制御され、STAT蛋白はリン酸化を受けることでDNAに結合できるようになる[5]。核内受容体はステロイドホルモンなどのリガンドが結合すると、核内に移行してDNAに直接結合し転写を制御する転写制御因子として機能する[5]。
転写の開始には転写制御因子のみならず基本転写因子やメディエーターとの結合が必要であり、転写活性化因子が転写を開始するためには、これらの必要なタンパク質が全て存在し、結合可能な状態である必要がある。また、転写制御因子の多くは単独で機能せず、DNA上の制御領域において他の構造的に類似した因子と二量体を形成し、機能を発揮する。bHLH型のタンパク質は、E2aなどの遍在するbHLH型のタンパク質とヘテロダイマーを形成してDNAに結合する一方で、異なるコアクチベーターやコリプレッサーと相互作用することにより状況に応じて特定の遺伝子の発現を制御する[17]。
DNAのメチル化状態も転写制御因子の作用に影響する。転写されている遺伝子のプロモーター領域は低メチル化状態にあり、不活性な遺伝子は高度にメチル化されている。メチル化されたDNAを特異的に認識して結合する蛋白質が存在し、このメチル化DNA結合蛋白質とヒストン修飾を介して転写が阻害される。
生体内での役割
細胞間シグナル伝達への応答
細胞間の情報伝達は、ある細胞が放出した分子が、別の細胞内にシグナル伝達の連鎖反応(カスケード)を引き起こすことによって行われ、多くの場合、カスケードの下流に転写制御因子が働き、細胞応答に必須な遺伝子の活性化や不活性化を制御する[5]。Transforming Growth Factor beta (TGF-β)はTGF-β受容体に結合し、Smad2とSmad3をリン酸化する。リン酸化されたSmadタンパク質はSmad4とヘテロダイマーを形成し、核に移行する[18]。同様に、Statタンパク質の二量体化や核移行は膜受容体に結合するJAKキナーゼによって制御される。CREBは、様々なシグナル刺激によりcAMP依存性タンパク質リン酸化酵素やCa2+カルモジュリン依存性タンパク質リン酸化酵素などのリン酸化酵素によりリン酸化されて活性化状態になる[19]。CaRFはカルシウムの流入によって特異的に活性化される。Wntタンパク質が受容体Frizzledと結合すると、細胞内でβ-cateninは遊離し、HMG型タンパク質TCF/Lef1とヘテロダイマーを形成して核内に移行し、転写制御因子として機能する[20]。Gliタンパク質はHedgehogタンパク質に結合するPatched膜受容体の下流エフェクター因子である。RBP-J/CBF1はNotch受容体がリガンドとの結合後に放出される細胞内領域と相互作用することによって活性化される。
神経発生の過程において細胞間シグナル伝達は多種類の細胞型が生み出されるメカニズムの一つとして重要である。シグナル分子の濃度勾配によって転写制御因子の濃度や活性の勾配が形成され、細胞型に応じて異なる遺伝子の転写が制御される。脊髄の発生過程においては、底板から分泌されるShhの濃度勾配が下流の転写制御因子Gliの濃度勾配を形成し、背腹軸に沿って領域特異的に標的遺伝子群を活性化することにより、複数の異なる神経細胞が生み出される[21]。
発生・細胞分化
多細胞生物の発生は多数の転写制御因子によって制御される。神経発生初期においては、Pax6やEmx2、Nkxファミリーといった複数のタイプのHomeodomainタンパク質が神経管の前後軸や背腹軸に沿って特異的に発現し、終脳の領域化を制御する[22]。さらにForkhead ファミリーに属するBf1は終脳の特異化を制御する一方で、大脳神経細胞が正常に分化する上で必須である。Hoxのサブファミリーのタンパク質は後脳や脊髄の前後軸に沿った領域の特異性を決定し、運動神経細胞の正常な発達に必須である[23]。
Mash1やMath1などのbHLH型タンパク質bHLH因子はプロニューラル因子と呼ばれ、NeuroDなどの神経分化を制御するbHLH型因子の発現を活性化して神経分化を促進するとともに、領域特異性や神経伝達物質の種類などの神経細胞の個性を決定する[24]。一方、Hes1やHes5などのbHLH型タンパク質はプロニューラル因子の発現を抑制したり、プロニューラル因子のDNAへの結合を妨げることにより、神経分化を抑制する[25]。プロニューラル因子Math1は、Bar型のHomeodomainタンパク質をコードする遺伝子Mbh1を直接活性化し、交連神経細胞の個性を決定する[26]。小脳においてMath1はグルタミン作動性の顆粒細胞の分化を制御し、GABA作動性神経細胞産生に必須なPtf1aと拮抗する[27]。bHLH型タンパク質Olig2は脊髄運動神経細胞の分化を制御するとともに、オリゴデンドロサイトの生成にも必須である[28]。同じくbHLH型タンパク質SCL/Tal1は脊髄においてOlig2の発現領域に隣接して発現し、Olig2と拮抗して介在神経細胞やアストロサイトの領域特異的な分化に作用する[28]。DlxやPOU型のHomeodomainタンパク質は特定の神経細胞の正常な分化や細胞移動に必須である[29]。
Sox2やSox10などのHMG boxタンパク質はプロニューラル因子の活性を阻害し、神経分化を抑制することにより、神経幹細胞を維持する[30]。
転写制御因子のなかで最も大きいファミリーを構成するC2H2型のZinc fingerタンパク質は、発生にとどまらず多様な現象に関わる。多くは特定の組織や神経細胞の分化に必須の働きをする一方で、Neural restrictive silencer factor(Nrsf/Rest)は非神経細胞においてイオンチャンネルや神経伝達物質などの神経細胞特異的な遺伝子の発現を抑制する[31]。
軸索伸長、細胞極性
多くの転写制御因子は発生過程の異なる時期において発現し、多様な機能を示す。プロニューラル因子Ngn2は神経分化を制御する一方で細胞移動や軸索投射を制御する機能を持つ[32][33]。軸索投射はLIM型 やBar型のHomeodomainタンパク質によっても制御される。Mbh1はLIM型Homeodomainタンパク質Lhx2の発現制御を介して、交連神経細胞に必須な軸索受容体の発現を制御する[34]。運動神経や感覚神経の軸索が標的筋肉の近傍に到着すると、表皮からのシグナルによってPea3やEr81などのETSタンパク質の発現が誘導され、軸索の枝分かれが制御される[35]。Zinc finger型のKlfファミリー因子は網膜神経細胞において時期特異的に発現し、軸索伸長を正や負に制御するとともに、損傷した網膜において再生軸索の伸長を制御する活性を持つ[36]。
軸索や樹状突起などで構成される神経細胞の特徴的な形態は、細胞の極性に由来する。Winged helixファミリーのFoxOは細胞極性を制御する因子の発現を調節し、神経細胞の極性を制御する[37]。
高次機能
C-FosやCREBなどのLeucine zipperタンパク質は、様々な細胞外からのシグナルの仲介物質として機能する一方で、神経活動による制御を受け、学習や記憶、耽溺に関わる[38][39]。NF-κBは発生過程においては神経軸索の伸長や投射、樹状突起の形態を制御し、神経突起の正常な発達に必須の役割を担い、成体においては樹状突起のスパインの数を変化させ、学習や記憶に関わる[38]。Zif268は様々な刺激によって誘導され、学習や記憶に関わることが示唆されている。FoxP2は発声や言語発達に重要な役割を果たし、ヒトにおけるその異常は言語障害に関わることが示唆されている[40]。
環境への応答
環境刺激に対しても転写制御因子の作用が関わっている。低酸素状態ではbHLH/PAS型因子のHIF-1α、HIF-2αなどが誘導される。概日リズムを司る遺伝子群として、period (per), Clock (Clk)などがあり、恒常的な光刺激などで発現が変化する[41]。
細胞周期調節
多くの転写制御因子が細胞周期の調節に関与する。細胞周期調節は特にがん遺伝子やがん抑制遺伝子によって誘導される転写制御因子の働きが重要である。細胞周期のG1チェックポイントにおいて、癌抑制遺伝子RbはCyclin dependent kinase inhibitorであるp21Cip1の作用を受けて活性化され、転写制御因子E2Fと結合して、Cyclinなどの転写を制御する。HMG型因子Hmga2は胎生期に多く発現し、癌抑制遺伝子p16Ink4aやp19Arfの発現を制御して神経幹細胞の維持を制御する。
病理
転写制御因子は生物の発生や細胞間シグナル伝達、細胞周期制御などで重要な役割を果たすため、その変異はヒトの疾患の原因となることがある(TRANSFACデータベース参照)。MECP2の変異による神経発達疾患であるレット症候群や、FOXP2の変異との相関があると考えられている発達性言語協調障害などの例がある[40]。
- ↑
Babu, M.M., Luscombe, N.M., Aravind, L., Gerstein, M., & Teichmann, S.A. (2004).
Structure and evolution of transcriptional regulatory networks. Current opinion in structural biology, 14(3), 283-91. [PubMed:15193307] [WorldCat] [DOI] - ↑
Vaquerizas, J.M., Kummerfeld, S.K., Teichmann, S.A., & Luscombe, N.M. (2009).
A census of human transcription factors: function, expression and evolution. Nature reviews. Genetics, 10(4), 252-63. [PubMed:19274049] [WorldCat] [DOI] - ↑
Levine, M., & Tjian, R. (2003).
Transcription regulation and animal diversity. Nature, 424(6945), 147-51. [PubMed:12853946] [WorldCat] [DOI] - ↑ ’’’Tetsuichiro Saito’’’
Transcription factor. Encyclopedia of Neuroscience
‘’Springer-Verlag Gmbh Berlin Heidelberg’’:2009 - ↑ 5.0 5.1 5.2 5.3
Malik, S., & Roeder, R.G. (2010).
The metazoan Mediator co-activator complex as an integrative hub for transcriptional regulation. Nature reviews. Genetics, 11(11), 761-72. [PubMed:20940737] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref4"が異なる内容で複数回定義されています - ↑
Lee, T.I., & Young, R.A. (2013).
Transcriptional regulation and its misregulation in disease. Cell, 152(6), 1237-51. [PubMed:23498934] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2 7.3
Malik, S., & Roeder, R.G. (2010).
The metazoan Mediator co-activator complex as an integrative hub for transcriptional regulation. Nature reviews. Genetics, 11(11), 761-72. [PubMed:20940737] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref2"が異なる内容で複数回定義されています - ↑ 8.0 8.1
Bannister, A.J., & Kouzarides, T. (2011).
Regulation of chromatin by histone modifications. Cell research, 21(3), 381-95. [PubMed:21321607] [PMC] [WorldCat] [DOI] - ↑
Hargreaves, D.C., & Crabtree, G.R. (2011).
ATP-dependent chromatin remodeling: genetics, genomics and mechanisms. Cell research, 21(3), 396-420. [PubMed:21358755] [PMC] [WorldCat] [DOI] - ↑
Cinnamon, E., & Paroush, Z. (2008).
Context-dependent regulation of Groucho/TLE-mediated repression. Current opinion in genetics & development, 18(5), 435-40. [PubMed:18721877] [WorldCat] [DOI] - ↑
Hayakawa, T., & Nakayama, J. (2011).
Physiological roles of class I HDAC complex and histone demethylase. Journal of biomedicine & biotechnology, 2011, 129383. [PubMed:21049000] [PMC] [WorldCat] [DOI] - ↑
Chen, W., & Roeder, R.G. (2011).
Mediator-dependent nuclear receptor function. Seminars in cell & developmental biology, 22(7), 749-58. [PubMed:21854863] [PMC] [WorldCat] [DOI] - ↑
Ong, C.T., & Corces, V.G. (2011).
Enhancer function: new insights into the regulation of tissue-specific gene expression. Nature reviews. Genetics, 12(4), 283-93. [PubMed:21358745] [PMC] [WorldCat] [DOI] - ↑
McKenna, N.J., & O'Malley, B.W. (2010).
SnapShot: Nuclear receptors I. Cell, 142(5), 822-822.e1. [PubMed:20813267] [WorldCat] [DOI] - ↑
McKenna, N.J., & O'Malley, B.W. (2010).
SnapShot: Nuclear receptors II. Cell, 142(6), 986.e1. [PubMed:20850017] [WorldCat] [DOI] - ↑
Kageyama, R., Ohtsuka, T., & Kobayashi, T. (2008).
Roles of Hes genes in neural development. Development, growth & differentiation, 50 Suppl 1, S97-103. [PubMed:18430159] [WorldCat] [DOI] - ↑
Powell, L.M., & Jarman, A.P. (2008).
Context dependence of proneural bHLH proteins. Current opinion in genetics & development, 18(5), 411-7. [PubMed:18722526] [PMC] [WorldCat] [DOI] - ↑
Dutko, J.A., & Mullins, M.C. (2011).
SnapShot: BMP signaling in development. Cell, 145(4), 636, 636.e1-2. [PubMed:21565618] [WorldCat] [DOI] - ↑
Zieg, J., Greer, P.L., & Greenberg, M.E. (2008).
SnapShot: Ca(2+)-dependent transcription in neurons. Cell, 134(6), 1080-1080.e2. [PubMed:18805099] [WorldCat] [DOI] - ↑
Macdonald, B.T., Semenov, M.V., & He, X. (2007).
SnapShot: Wnt/beta-catenin signaling. Cell, 131(6), 1204. [PubMed:18083108] [WorldCat] [DOI] - ↑
Dessaud, E., McMahon, A.P., & Briscoe, J. (2008).
Pattern formation in the vertebrate neural tube: a sonic hedgehog morphogen-regulated transcriptional network. Development (Cambridge, England), 135(15), 2489-503. [PubMed:18621990] [WorldCat] [DOI] - ↑
Hébert, J.M., & Fishell, G. (2008).
The genetics of early telencephalon patterning: some assembly required. Nature reviews. Neuroscience, 9(9), 678-85. [PubMed:19143049] [PMC] [WorldCat] [DOI] - ↑
Dalla Torre di Sanguinetto, S.A., Dasen, J.S., & Arber, S. (2008).
Transcriptional mechanisms controlling motor neuron diversity and connectivity. Current opinion in neurobiology, 18(1), 36-43. [PubMed:18524570] [WorldCat] [DOI] - ↑
Bertrand, N., Castro, D.S., & Guillemot, F. (2002).
Proneural genes and the specification of neural cell types. Nature reviews. Neuroscience, 3(7), 517-30. [PubMed:12094208] [WorldCat] [DOI] - ↑
Kageyama, R., Ohtsuka, T., & Kobayashi, T. (2007).
The Hes gene family: repressors and oscillators that orchestrate embryogenesis. Development (Cambridge, England), 134(7), 1243-51. [PubMed:17329370] [WorldCat] [DOI] - ↑
Saba, R., Johnson, J.E., & Saito, T. (2005).
Commissural neuron identity is specified by a homeodomain protein, Mbh1, that is directly downstream of Math1. Development (Cambridge, England), 132(9), 2147-55. [PubMed:15788459] [WorldCat] [DOI] - ↑
Kawauchi, D., & Saito, T. (2008).
Transcriptional cascade from Math1 to Mbh1 and Mbh2 is required for cerebellar granule cell differentiation. Developmental biology, 322(2), 345-54. [PubMed:18723012] [WorldCat] [DOI] - ↑ 28.0 28.1
Rowitch, D.H., & Kriegstein, A.R. (2010).
Developmental genetics of vertebrate glial-cell specification. Nature, 468(7321), 214-22. [PubMed:21068830] [WorldCat] [DOI] - ↑
Chédotal, A., & Rijli, F.M. (2009).
Transcriptional regulation of tangential neuronal migration in the developing forebrain. Current opinion in neurobiology, 19(2), 139-45. [PubMed:19428236] [WorldCat] [DOI] - ↑
Pevny, L.H., & Nicolis, S.K. (2010).
Sox2 roles in neural stem cells. The international journal of biochemistry & cell biology, 42(3), 421-4. [PubMed:19733254] [WorldCat] [DOI] - ↑
Ballas, N., & Mandel, G. (2005).
The many faces of REST oversee epigenetic programming of neuronal genes. Current opinion in neurobiology, 15(5), 500-6. [PubMed:16150588] [WorldCat] [DOI] - ↑
Heng, J.I., Nguyen, L., Castro, D.S., Zimmer, C., Wildner, H., Armant, O., ..., & Guillemot, F. (2008).
Neurogenin 2 controls cortical neuron migration through regulation of Rnd2. Nature, 455(7209), 114-8. [PubMed:18690213] [WorldCat] [DOI] - ↑
Hand, R., & Polleux, F. (2011).
Neurogenin2 regulates the initial axon guidance of cortical pyramidal neurons projecting medially to the corpus callosum. Neural development, 6, 30. [PubMed:21864333] [PMC] [WorldCat] [DOI] - ↑
Kawauchi, D., Muroyama, Y., Sato, T., & Saito, T. (2010).
Expression of major guidance receptors is differentially regulated in spinal commissural neurons transfated by mammalian Barh genes. Developmental biology, 344(2), 1026-34. [PubMed:20599893] [WorldCat] [DOI] - ↑
Dalla Torre di Sanguinetto, S.A., Dasen, J.S., & Arber, S. (2008).
Transcriptional mechanisms controlling motor neuron diversity and connectivity. Current opinion in neurobiology, 18(1), 36-43. [PubMed:18524570] [WorldCat] [DOI] - ↑
Moore, D.L., Apara, A., & Goldberg, J.L. (2011).
Krüppel-like transcription factors in the nervous system: novel players in neurite outgrowth and axon regeneration. Molecular and cellular neurosciences, 47(4), 233-43. [PubMed:21635952] [PMC] [WorldCat] [DOI] - ↑
de la Torre-Ubieta, L., & Bonni, A. (2011).
Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron, 72(1), 22-40. [PubMed:21982366] [PMC] [WorldCat] [DOI] - ↑ 38.0 38.1
Alberini, C.M. (2009).
Transcription factors in long-term memory and synaptic plasticity. Physiological reviews, 89(1), 121-45. [PubMed:19126756] [PMC] [WorldCat] [DOI] - ↑
Robison, A.J., & Nestler, E.J. (2011).
Transcriptional and epigenetic mechanisms of addiction. Nature reviews. Neuroscience, 12(11), 623-37. [PubMed:21989194] [PMC] [WorldCat] [DOI] - ↑ 40.0 40.1
Kang, C., & Drayna, D. (2011).
Genetics of speech and language disorders. Annual review of genomics and human genetics, 12, 145-64. [PubMed:21663442] [WorldCat] [DOI] - ↑
Kewley, R.J., Whitelaw, M.L., & Chapman-Smith, A. (2004).
The mammalian basic helix-loop-helix/PAS family of transcriptional regulators. The international journal of biochemistry & cell biology, 36(2), 189-204. [PubMed:14643885] [WorldCat] [DOI]
(執筆担当者: 室山優子、斎藤哲一郎 担当編集委員: 大隅典子)