MAP2
佐藤 啓介、寺田 純雄
東京医科歯科大学 医歯薬学総合研究科 神経機能形態学分野
DOI:10.14931/bsd.4347 原稿受付日:2013年10月31日 原稿完成日:2014年4月28日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:Microtubule-associated protein 2 英略語:MAP2
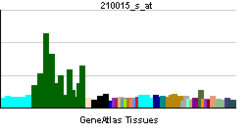
MAP2は、脊椎動物のニューロンに豊富に存在する微小管結合タンパク質である。古典的MAPs(Microtubule Associated Proteins)、もしくは構造的MAPsと呼ばれる一群の微小管結合タンパク質のグループに属する。MAP2遺伝子にコードされ、複数のスプライシング変異体が存在する。MAP2自身の微小管への直接的な作用および他のタンパク質を微小管にリクルートすることによる間接的な作用により、微小管の重合状態や構造安定性を調節する機能を持つ考えられている。神経前駆細胞から分化すると発現し始め、成熟したニューロンでは軸索には殆ど存在せず樹状突起と細胞体にほぼ特異的に局在する。
構造
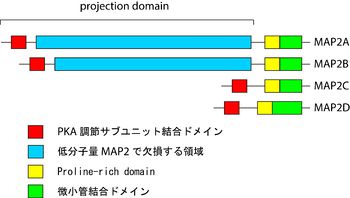
哺乳類には少なくともMAP2A、B、C、Dの4つのスプライシング変異体が存在する[1]。MAP2AとMAP2Bは高分子量でそれぞれ280 kDaと270 kDa、MAP2CとMAP2Dは低分子量でそれぞれ70 kDaと75 kDaである[2]。C末端領域は微小管結合領域を持ち、それより上流はprojection domainと呼ばれる(図参照)。高分子量MAP2と低分子量MAP2の大きさの違いは、主にprojection domainの長さの違いによる。
微小管結合領域は、リン酸化部位となるKXGS motifを含む微小管結合反復配列を持つ。そのすぐN末端側にプロリンに富む領域(Proline-rich domain; PRD)がある。殆どの領域は二次構造を形成しないと考えられているが、N末端に存在するcAMP依存性タンパク質リン酸化酵素 (protein kinase A, PKA)の調節サブユニットとの結合部位は両親媒性のへリックスを形成する[3]。
発現と局在
発生と発現
MAP2は神経前駆細胞から分化すると発現し始める。MAP2Cが最も早く発現し、成熟すると一部の組織を除いて発現がみられなくなる[4]。MAP2Aの発現は発生初期では低いが、MAP2Cの発現が低下する頃に発現が強まり、それ以降は恒常的に発現する[5]。MAP2Bは発生初期から成熟後に至るまで、全ての発生段階で発現している[6]。MAP2Dは、発生段階の小脳や嗅球など特定の部位で強く発現が見られる[7]。
細胞内局在
成熟したニューロンでは、MAP2は樹状突起と細胞体にほぼ特異的に局在し、軸索には殆ど存在しない。このため、免疫染色などで樹状突起を軸索と区別するマーカーとしてよく用いられる。ただし発生初期段階のニューロンにおいて、MAP2Cは細胞体と樹状突起に加えて軸索にも存在する[8]。
ニューロンのマーカーとして使用されるが、ニューロン以外にも下垂体後葉の星状膠細胞(astrocyte)や発現量は低いが希突起膠細胞(oligodendrocyte)にも発現がみられる[9] [10]。また神経系以外でも精巣、卵巣などにも発現する [11] [12]。
機能
微小管動態の制御
微小管は+端において脱重合と伸長を繰り返す、動的不安定性(dynamic instability)と呼ばれる性質を持つ。脱重合から伸長への状態の変化をrescue、伸長から脱重合への状態の変化をcatastropheという。In vitroの研究から、catastropheを抑制することによる微小管の重合の促進や安定化がMAP2の主な機能であると考えられている[13][14]。
また、微小管同士の間隔の調節(spacing)にも寄与しているとされる[15]。神経系以外の細胞にMAP2を発現させると、微小管の束化が起こる[16] [17]。MAP2の二量体形成による微小管同士の架橋や、微小管の剛性・安定性が増加した結果起こる非特異的な束化などがメカニズムとして提唱されている。
この現象の神経系での意義は明らかではないが、細胞レベルでの研究からは微小管結合領域での線維状アクチンとの結合を介して突起の形成に関連する可能性が推測されている[18]。MAP2Cを神経芽細胞腫細胞に発現させると突起の形成を誘導するが、線維状アクチンと結合できない変異体を発現させても突起を形成は誘導されないことから、線維状アクチンへの結合能はMAP2の機能にとって重要であると考えられる[19]。
他タンパク質との相互作用
他のタンパク質を微小管にリクルートするのもMAP2の重要な働きである。
PKAは環状AMP(cAMP)の結合により調節サブユニットが解離することによって活性化されるキナーゼで、ニューロンに存在する様々なタンパク質をリン酸化する。MAP2はPKAの調節サブユニットに結合し、MAP2のノックアウトマウスでは樹状突起のPKAが著しく減少していることから、樹状突起におけるPKAの主要な結合相手はMAP2であると考えられる[20][21][22]。MAP2自身もPKAによってリン酸化される他、PKAを局在化することによりリン酸化を介したシグナリングに寄与していると推測される。
他にも複数のキナーゼやRasの活性制御に関わるタンパク質への結合が見出されているのに加え、MAP2がニューロステロイドの受容体となるという報告もあり、これらのシグナル伝達を介して微小管や樹状突起の構造や動態が制御されていると考えられる[23][24][25]。
リン酸化
MAP2は先述した微小管結合領域のKXGS motifをはじめ多くのリン酸化部位を持ち、実際に様々なキナーゼの基質となる[23]。リン酸化はMAP2の微小管との結合能を低下させることから、MAP2のリン酸化状態を変化させることにより、微小管の動態を調節することができる。実際に、発生の段階によってMAP2のリン酸化状態が変化することが報告されており、ニューロンの形態変化においてMAP2を介した微小管動態の調節が重要であることが示唆される[23]。
ノックアウトマウス
個体レベルでのMAP2の機能については、MAP2のノックアウトマウスが作製、解析されている[26][22]。MAP2ノックアウトマウスでは脳の形態に異常は見られなかったが、海馬ニューロンの樹状突起の短縮や小脳プルキンエ細胞の樹状突起における微小管の密度の低下が観察された。ただし、このノックアウトマウスでは、失われたMAP2の機能が機能的重複を持つ他の古典的MAPsで補償されている可能性がある。これを支持する知見として、古典的MAPsの一つMAP1Bを同時にノックアウトしたMAP2MAP1Bダブルノックアウトマウスでは、出生後間もなく致死となり、脳の層構造の形成や神経突起の伸長に異常が見られるなど、MAP2やMAP1Bの単独ノックアウトマウスと比べて重篤な障害を呈したと報告されている[26]。
関連項目
参考文献
- ↑
Dehmelt, L., & Halpain, S. (2005).
The MAP2/Tau family of microtubule-associated proteins. Genome biology, 6(1), 204. [PubMed:15642108] [PMC] [WorldCat] [DOI] - ↑
Farah, C.A., & Leclerc, N. (2008).
HMWMAP2: new perspectives on a pathway to dendritic identity. Cell motility and the cytoskeleton, 65(7), 515-27. [PubMed:18473367] [WorldCat] [DOI] - ↑
Malmendal, A., Halpain, S., & Chazin, W.J. (2003).
Nascent structure in the kinase anchoring domain of microtubule-associated protein 2. Biochemical and biophysical research communications, 301(1), 136-42. [PubMed:12535652] [WorldCat] [DOI] - ↑
Garner, C.C., Brugg, B., & Matus, A. (1988).
A 70-kilodalton microtubule-associated protein (MAP2c), related to MAP2. Journal of neurochemistry, 50(2), 609-15. [PubMed:3121794] [WorldCat] [DOI] - ↑
Chung, W.J., Kindler, S., Seidenbecher, C., & Garner, C.C. (1996).
MAP2a, an alternatively spliced variant of microtubule-associated protein 2. Journal of neurochemistry, 66(3), 1273-81. [PubMed:8769894] [WorldCat] [DOI] - ↑
Riederer, B., & Matus, A. (1985).
Differential expression of distinct microtubule-associated proteins during brain development. Proceedings of the National Academy of Sciences of the United States of America, 82(17), 6006-9. [PubMed:3898077] [PMC] [WorldCat] [DOI] - ↑
Ferhat, L., Represa, A., Ferhat, W., Ben-Ari, Y., & Khrestchatisky, M. (1998).
MAP2d mRNA is expressed in identified neuronal populations in the developing and adult rat brain and its subcellular distribution differs from that of MAP2b in hippocampal neurones. The European journal of neuroscience, 10(1), 161-71. [PubMed:9753123] [WorldCat] [DOI] - ↑
Meichsner, M., Doll, T., Reddy, D., Weisshaar, B., & Matus, A. (1993).
The low molecular weight form of microtubule-associated protein 2 is transported into both axons and dendrites. Neuroscience, 54(4), 873-80. [PubMed:8341422] [WorldCat] [DOI] - ↑
Matsunaga, W., Miyata, S., Itoh, M., Kiyohara, T., & Maekawa, S. (2002).
Expression of high levels of tubulin and microtubule-associated protein 2d in the neurohypophysial astrocytes of adult rat. Neuroscience, 111(1), 151-62. [PubMed:11955719] [WorldCat] [DOI] - ↑
Müller, R., Heinrich, M., Heck, S., Blohm, D., & Richter-Landsberg, C. (1997).
Expression of microtubule-associated proteins MAP2 and tau in cultured rat brain oligodendrocytes. Cell and tissue research, 288(2), 239-49. [PubMed:9082959] [WorldCat] [DOI] - ↑
Loveland, K.L., Hayes, T.M., Meinhardt, A., Zlatic, K.S., Parvinen, M., de Kretser, D.M., & McFarlane, J.R. (1996).
Microtubule-associated protein-2 in the rat testis: a novel site of expression. Biology of reproduction, 54(4), 896-904. [PubMed:8924511] [WorldCat] [DOI] - ↑
Salvador, L.M., Flynn, M.P., Avila, J., Reierstad, S., Maizels, E.T., Alam, H., ..., & Hunzicker-Dunn, M. (2004).
Neuronal microtubule-associated protein 2D is a dual a-kinase anchoring protein expressed in rat ovarian granulosa cells. The Journal of biological chemistry, 279(26), 27621-32. [PubMed:15056665] [PMC] [WorldCat] [DOI] - ↑
Itoh, T.J., & Hotani, H. (1994).
Microtubule-stabilizing activity of microtubule-associated proteins (MAPs) is due to increase in frequency of rescue in dynamic instability: shortening length decreases with binding of MAPs onto microtubules. Cell structure and function, 19(5), 279-90. [PubMed:7850890] [WorldCat] [DOI] - ↑
Gamblin, T.C., Nachmanoff, K., Halpain, S., & Williams, R.C. (1996).
Recombinant microtubule-associated protein 2c reduces the dynamic instability of individual microtubules. Biochemistry, 35(38), 12576-86. [PubMed:8823195] [WorldCat] [DOI] - ↑
Chen, J., Kanai, Y., Cowan, N.J., & Hirokawa, N. (1992).
Projection domains of MAP2 and tau determine spacings between microtubules in dendrites and axons. Nature, 360(6405), 674-7. [PubMed:1465130] [WorldCat] [DOI] - ↑
Lewis, S.A., Ivanov, I.E., Lee, G.H., & Cowan, N.J. (1989).
Organization of microtubules in dendrites and axons is determined by a short hydrophobic zipper in microtubule-associated proteins MAP2 and tau. Nature, 342(6249), 498-505. [PubMed:2511449] [WorldCat] [DOI] - ↑
Weisshaar, B., Doll, T., & Matus, A. (1992).
Reorganisation of the microtubular cytoskeleton by embryonic microtubule-associated protein 2 (MAP2c). Development (Cambridge, England), 116(4), 1151-61. [PubMed:1338311] [WorldCat] - ↑
Dehmelt, L., & Halpain, S. (2004).
Actin and microtubules in neurite initiation: are MAPs the missing link? Journal of neurobiology, 58(1), 18-33. [PubMed:14598367] [WorldCat] [DOI] - ↑
Roger, B., Al-Bassam, J., Dehmelt, L., Milligan, R.A., & Halpain, S. (2004).
MAP2c, but not tau, binds and bundles F-actin via its microtubule binding domain. Current biology : CB, 14(5), 363-71. [PubMed:15028210] [WorldCat] [DOI] - ↑
Obar, R.A., Dingus, J., Bayley, H., & Vallee, R.B. (1989).
The RII subunit of cAMP-dependent protein kinase binds to a common amino-terminal domain in microtubule-associated proteins 2A, 2B, and 2C. Neuron, 3(5), 639-45. [PubMed:2561973] [WorldCat] [DOI] - ↑
Rubino, H.M., Dammerman, M., Shafit-Zagardo, B., & Erlichman, J. (1989).
Localization and characterization of the binding site for the regulatory subunit of type II cAMP-dependent protein kinase on MAP2. Neuron, 3(5), 631-8. [PubMed:2701845] [WorldCat] [DOI] - ↑ 22.0 22.1
Harada, A., Teng, J., Takei, Y., Oguchi, K., & Hirokawa, N. (2002).
MAP2 is required for dendrite elongation, PKA anchoring in dendrites, and proper PKA signal transduction. The Journal of cell biology, 158(3), 541-9. [PubMed:12163474] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1 23.2
Sánchez, C., Díaz-Nido, J., & Avila, J. (2000).
Phosphorylation of microtubule-associated protein 2 (MAP2) and its relevance for the regulation of the neuronal cytoskeleton function. Progress in neurobiology, 61(2), 133-68. [PubMed:10704996] [WorldCat] - ↑
Huang, J., Furuya, A., & Furuichi, T. (2007).
Very-KIND, a KIND domain containing RasGEF, controls dendrite growth by linking Ras small GTPases and MAP2. The Journal of cell biology, 179(3), 539-52. [PubMed:17984326] [PMC] [WorldCat] [DOI] - ↑
Fontaine-Lenoir, V., Chambraud, B., Fellous, A., David, S., Duchossoy, Y., Baulieu, E.E., & Robel, P. (2006).
Microtubule-associated protein 2 (MAP2) is a neurosteroid receptor. Proceedings of the National Academy of Sciences of the United States of America, 103(12), 4711-6. [PubMed:16537405] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1
Teng, J., Takei, Y., Harada, A., Nakata, T., Chen, J., & Hirokawa, N. (2001).
Synergistic effects of MAP2 and MAP1B knockout in neuronal migration, dendritic outgrowth, and microtubule organization. The Journal of cell biology, 155(1), 65-76. [PubMed:11581286] [PMC] [WorldCat] [DOI]