睡眠障害
髙江洲義和
東京医科大学 精神医学講座
井上雄一
代々木睡眠クリニック
DOI:10.14931/bsd.1237 原稿受付日:2012年5月1日 原稿完成日:2012年5月24日
担当編集委員:加藤 忠史(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:sleep disorder 独:Schlafstörung 仏:trouble du sommeil
睡眠障害とは、夜よく眠れない不眠症のみならず、過眠症、概日リズム障害、睡眠時異常行動などの睡眠の量的・質的・リズム的に異常のある状態が含まれる。現在は、睡眠障害国際分類第2版(The International classification of sleep disorders, second edition:ICSD-2)[1]が広く臨床利用されており、不眠症群、概日リズム睡眠障害群、睡眠関連呼吸障害群、中枢性過眠症群、睡眠時随伴症群、睡眠関連運動障害群に6大別される。
睡眠調節のメカニズム
睡眠は、皮質脳波活動の上昇と筋弛緩、急速眼球運動などを示すREM(Rapid Eye Movement)睡眠と、睡眠深度依存性の脳波の徐化傾向を示すnon-REM睡眠で構成されており、ヒトでは、1晩の睡眠中にこれらが周期的に出現する。睡眠と覚醒、REM睡眠とnon-REM睡眠の発現および切り替えを担う神経機構としては、脳内のコリン作動性、モノアミン作動性およびGABA作動性ニューロン、ヒスタミン、オレキシン神経系の相互作用が重要な役割を果たすと考えられている。
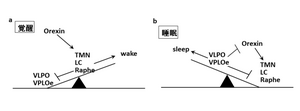
睡眠覚醒調節においては、睡眠恒常性維持機構と体内時計機構の2つが重要視される。恒常性維持機構は、活動によってもたらされる疲労や生体の損傷回復と関連しており、プロスタグランジンD2やアデノシンなどの睡眠物質と関連して睡眠が誘導されるが、先行する睡眠の量的不足の度合いにより、その後の睡眠の長さや質が調節される。すなわち、睡眠不足の状態が続くと深いnon-REM睡眠が増加し、疲労に応じて大脳を休息させることがわかっている。一方、体内時計の中枢は視交叉上核(suprachiasmatic nucleus: SCN)にあり、体温や血圧、脈拍などの自律神経系に加え、ホルモン分泌、免疫系、代謝系など、約24時間の周期をもってリズムを刻む生体活動を支配する。体内時計は概日リズムを発振すると共に、これを外界の明暗周期(昼夜のサイクル)に合わせる機能をもつ。体内時計が朝を認識すると、身体は日中の活動に適した状態になる。また、通常の起床時刻の14~16時間後に、眠りの準備が始まる(図1)[2]。 睡眠中枢は覚醒の抑制を引き起こし、睡眠を誘発するが、逆に、睡眠中枢が抑制されている場合は、覚醒中枢が活性化されて覚醒が維持される。このように睡眠中枢と覚醒中枢が交互に活動することにより睡眠覚醒の調節を行う生体機構をflip-flop機構と呼ぶ(図2)。
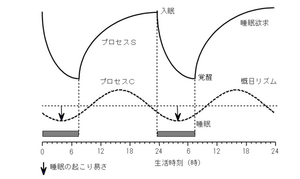
覚醒期間中に一方向性に増加する何らかの過程(Sプロセス)が、睡眠閾値に達すると睡眠が生じる。Sプロセスは睡眠期間中、指数関数的に減少し、覚醒閾値に達したところで睡眠は終了する。睡眠閾値の開始と終了を決める上限と閾値レベルがサーカディアンリズム(Cプロセス)を持つと考えられている。
睡眠障害
不眠症
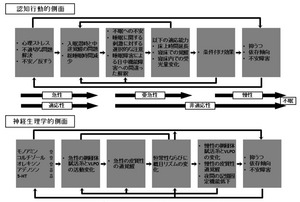
不眠は、一般人口の4~5人に1人と有病率の高いcommon diseaseだが、近年不眠の長期化による抑うつ症状発現、QOLの悪化、耐糖能障害や高血圧発現のリスクの上昇など、心身への悪影響が大きいことが明らかにされ、治療対応の重要性が強調されている。誰にでも起こり得る不眠がなぜ一部で慢性化するのかという点については、従来神経症的なメカニズムにより説明されることが多かったが、最近では、生理学的ならびに、認知心理学的過覚醒傾向と熟睡感の障害の問題が重視されるようになっている。急性ストレスでの不眠の発現は一般的な現象だが、これが慢性化する過程で、焦り、不安の増強と相まって過覚醒傾向を生じ、さらに飲酒量の増加や、床上時間の増加などの不適切な対処行動を生むことで悪循環に陥ると考えられる。不眠症のメカニズムを考えるときに、これらの認知行動学的側面に加えて、神経生理学的側面についても検討する必要がある。すなわち、徐波睡眠に関連するセロトニン神経系の機能変化や、間脳下垂体系副腎皮質(hypothalamic pituitary adrenal axis:HPA)機能亢進による夜間のコルチゾール分泌量の上昇、覚醒系に関与するヒスタミンを含む後部視床下部に存在する結節乳頭核(tuberomammillary nucleus :TMN)の細胞群、オレキシン神経系の活動亢進により覚醒水準の上昇がおきる。それにより、網様体賦活系と睡眠中枢である腹外側視索前野(ventrolateral preoptic area :VLPO)およびそれに関連する神経系の活動に変化がもたらされ、不眠症状が引き起こされる(図3)[3]。
不眠症に対する薬物療法としては、ベンゾジアゼピン(benzodiazepine :BZ)ないしそのアゴニストの薬剤が第一選択となっている。BZ系睡眠薬の作用機序は、脳内のBZ受容体へ結合して、Cl-イオンの細胞内への流入を促進することにより細胞の興奮を起こりにくくすることにある。BZ受容体はγ-アミノ酪酸(γ-aminobutyric :GABA)受容体とともにGABA‐BZ‐Cl-イオンチャンネル複合体を形成し、GABA系の活性を高める。BZ受容体はω1~ω5の5つに分類されるが、BZ系の睡眠薬のほとんどはω1、ω2受容体に非選択的に結合する。ω1受容体は脳全体に分布するが、特に小脳、淡蒼球、大脳皮質に高密度で、一方ω2受容体は大脳辺縁系、脊髄に多く分布している。現時点ではω1受容体は主に催眠・鎮静作用に関係し、ω2受容体は主に抗不安作用、筋弛緩作用に関係していると考えられており、睡眠薬ではω1選択性の高い薬剤が治療薬として選択される機会が比較的多い。BZ系睡眠薬は、緊張‐不安水準の抑制とともに、睡眠恒常性機構への作用(アデノシン・プロスタグランジンD2などとともにVLPOからTMNにいたる睡眠促進細胞群を活性化)に関与している可能性が推定されている。
不眠症の治療として、近年、認知行動療法(cognitive behavioral therapy, CBT)の重要性が強調されている[4]。CBTは、不眠を遷延化させている悪循環の要因となっている生活習慣と認知パターンを修正させることで、問題の解決につなげるものである。不眠症患者の現在の症状・状況と行動パターンの関係についての機能分析を十分に行ったうえで、心理教育、睡眠衛生指導、リラクゼーション、刺激制御法(眠れなくなったら寝床を離れ、眠気がついてから寝床に戻るようにさせるもの)と睡眠制限療法(眠れなけば、寝床の上で過ごす時間を切り縮めるもの)を含めた睡眠スケジュール法、認知行動療法(睡眠に対する思い込みが行動・気分にどのような影響を及ぼしているかを明らかにし、悪循環から離れられるように気づかせていくもの)を組み合わせたパッケージを用いて治療を行う。CBTのプロセスは、患者自身に認知的過覚醒を理解させる方向に働くことは疑いのないところだが、これ以外の生理的な機構に直接働く可能性は乏しいと思われる。
概日リズム睡眠障害
前述したように、睡眠は体内時計に依存して発現する生体現象である。それゆえ、睡眠は、覚醒中の精神身体活動量などの内部または外部環境要因の影響だけでなく、睡眠覚醒リズムの維持に関わる体内時計リズムからの制御を強く受ける。概日リズム睡眠障害は、この体内時計機能の障害により発症するものである。
睡眠覚醒、自律神経系、メラトニン、コルチゾールなどの内分泌系、代謝系活動にみられる約24時間周期のリズムは概日リズムと呼ばれ、体内時計によって支配されている。これらのリズムは、光刺激や運動、摂食など様々な外因によって修飾され、外界環境へ同調する。生物時計システムは、環境情報の変化を時計本体に伝える入力部、システムの中枢をなし自律的な24時間リズムを形成する時計本体、そして時計から発振される概日シグナルにより諸生理機能リズムを駆動する出力部から構成されている。
哺乳類の中枢時計は、SCNに存在するが、ほとんどの組織・器官の細胞にも生物時計(末梢時計)が備わっており、中枢時計SCNから発振される概日シグナルが末梢時計に階層的に作用し、生体リズムを統合している。もっとも強力な同調因子である光刺激は、その入力情報が網膜から網膜視床下部路を経由してSCNに直接伝えられ、これにより中枢リズムの位相がリセット(前進もしくは後退)されることで、個体の生体リズムが環境因子に順応する。体内時計システムに関わるほとんどの遺伝子は、SCNにおいて約24時間の転写日周リズムを示し、この時計遺伝子群の転写・翻訳制御のフィードバックループが体内時計発信機構の中核をなす。全身の時計遺伝子が自律的に作る約25時間の概日リズム(circadian rhythm)は朝の光で位相が毎日補正されて、24時間の外界周期に適応する。 概日リズム睡眠障害は、睡眠内容そのものは正常であるが、望ましい時間帯に睡眠をとることが困難になり社会生活に支障を来すもので、概日リズムを司る体内時計の発振機構、もしくは時計の同調機能の障害により生じる。睡眠相後退型は、睡眠時間帯が非常に遅れており、望ましい時刻に入眠および覚醒することが困難で、遅刻・欠勤の重要な原因となる。
それに対し、睡眠相前進型は、睡眠時間帯が著しく前にずれ、極端な早寝早起きの状態となる。自由継続型は、24時間のリズムに適合できないために入眠・覚醒時刻が毎日1時間程度遅れ、定まった時刻に入眠および覚醒することができないために、昼夜の生活が逆転する期間が生じる。自由継続型は、体内時計に明暗情報が入力されないために、24時間周期に同調できない全盲者に多い。不規則型は、1日の中に睡眠エピソードが不規則に3回以上起こり、その持続時間も一定しない。この型の障害はアルツハイマー型などの認知症高齢者に併発することが多い。
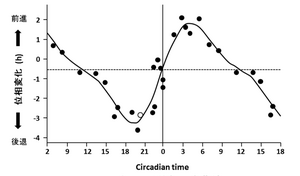
概日リズム睡眠障害の治療として、ヒトの体内時計位相変化部分に高照度光を照射する高照度光療法がある。早朝の時間帯に高照度光を照射すると深部体温リズムやメラトニンリズムなどの概日リズム位相が早まり、夜の就寝時刻前後に高照度光を照射すると概日リズム位相が遅くなる。光による生体リズムの同調は光パルスに対する位相反応曲線(phase response curve:PRC)によって説明することができる。恒暗条件下において光パルスを与えると、その照射時刻によってリズムの位相変位の度合いが変化するが、照射時刻と位相変位の関係を関数プロットしたものが位相反応曲線である(図4)[5]。高照度光療法は、これを応用して、光照射器を用いて高照度光を一定時間照射し、睡眠相を望ましい時間帯に矯正するという方法である。本療法には通常2500 lux以上の高照度光が用いられる。
メラトニン分泌が体内時計によって制御されている一方で、外部から投与したメラトニンも生体リズムの位相を変化させる働きがあることが明らかにされている。夕方にメラトニンを投与すると生体リズムの位相は早まり、朝に投与すると逆に遅れる。これは夕の光が生物時計を遅らせ、朝の光が体内時計を早めるのとちょうど反対の位相反応である。このような特徴から、概日リズム睡眠障害の治療に対するメラトニン投与の有効性が確立されている。実際の投与法については、0.5~1 mgを実際に入眠にできる時刻(前夜入眠した時刻)の6~7時間前、または望まれる入眠時刻の2~3時間前に投与する方法が主体である。
睡眠時無呼吸症候群
睡眠時無呼吸症候群では、睡眠時に繰り返し呼吸停止状態(無呼吸:apnea)と換気量の減少状態(低換気:hypopnea)を呈する。無呼吸とは鼻孔あるいは口のレベルで少なくとも10秒以上呼吸が停止する状態であり、無呼吸中の努力呼吸の有無から次の3タイプに分類される。
- 閉塞型(obstructive sleep apnea:OSA)は無呼吸中、呼吸努力が認められ、胸郭と腹壁は奇異運動を示す。
- 中枢型(central sleep apnea:CSA)では呼吸中枢から出力が消失するため、胸郭および腹壁の動きがなくなる。
- 混合型(mixed sleep apnea:MSA)では、無呼吸エピソード中に中枢型から閉塞型に移行する。このうち最も頻度が高いのがOSAであり、中咽頭部での閉塞によるものが最多である。
閉塞性無呼吸をきたす原因は大きく機能的因子と形態学的因子に分けられる。機能的因子としては、入眠とともに上気道開大筋群の緊張低下により、上気道の保腔力が弱まって、気道が狭くなることがあげられる。特に仰臥位では、軟口蓋や舌根が後方に沈下しやすく咽頭腔が狭くなる。上気道に構造的あるいは機能的異常がなければ、睡眠中に必要な換気は維持されるが、これに上気道の形態学的な狭窄が加わると、持続性のいびきや無呼吸と覚醒反応に伴う過換気からなるOSAを生じる。形態学的狭窄を生じる要因として、扁桃肥大、咽頭狭窄、肥満、小顎や下顎後退、鼻閉を生じる鼻疾患などがある。日本人は欧米人と比較して小顎傾向にあるため、肥満の程度が低くてもOSAを発症しやすい。
OSAでは、無呼吸‐低呼吸により、低酸素血症、高CO2血症、過度の胸腔内陰圧の亢進、呼吸イベント終了時の覚醒反応の多発などが起こる。この無呼吸中の低酸素血症および覚醒反応に伴って、交感神経活動が亢進し覚醒直後に頂点となる血圧上昇がみられ、この血圧変動によりOSA患者は夜間睡眠中に高血圧になると考えられている。また、間欠的低酸素血症を生じるので、虚血・再潅流と同様な組織障害を起こすと考えられている。OSASによる低酸素血症は病態上特に重要視されており、交感神経活動の亢進、血管へのストレス、炎症、凝固機能の亢進、代謝機能障害を起こし、脳・心血管障害の誘因となる。
OSAでは、昼間の眠気や集中力障害から患者自身のQOLが損なわれ、さらには交通事故の要因になるなど社会的な問題を生じ得る。また、1時間あたりの無呼吸・低呼吸指数(apnea hypopnea index:AHI)30以上の重症OSAでは心血管イベントが高率に発症し、死亡率を少なくとも3倍以上高めることから、積極的な治療が必要となる。
OSAの治療としては経鼻的持続陽圧呼吸療法(nasal Continuous positive airway pressure: n-CPAP)が第一選択となる。n-CPAPは鼻腔から陽圧をかけて、気道を開存維持させるもので、中等症以上のOSAが適応となる。適切なn-CPAP治療により、呼吸障害の改善につれて夜間睡眠と日中の傾眠症状の改善が得られ、長期的にはOSAに起因する高血圧症や生命予後の改善がみられる。しかし、鼻腔通気が不良の場合、高齢者や自覚症状の少ない患者ではコンプライアンスが不良である。その他の治療法としては、睡眠時に下顎を前方に移動する口腔内装置や、口蓋垂軟口蓋咽頭形成術などの手術療法があるが、重症例での有効性のエビデンスは乏しい。
レム睡眠行動障害
睡眠時随伴症(パラソムニア)では、入眠時あるいは睡眠中、睡眠からの覚醒時に、望ましくない身体行動や体験を生じる。この群に属する病態は、non-REMパラソムニアとREMパラソムニアの2つに大別される。レム睡眠行動障害(REM sleep behavior disorder;RBD)はREMパラソムニアの1つであり、夢に関連した異常行動を示すものである。症状としてはREM睡眠期に一致して(夜間中~後期に多い)、はっきりとした大きな寝言あるいは発声、腕を振り回す、布団を蹴る、座る、手足をばたつかせるといった複雑な動作が起こる。持続時間は数分以内と短く、覚醒を促すと、夢内容を内省できる。夢内容は、人や動物などに追われる、攻撃されるなど、不快で恐怖に満ちた悪夢が多い。異常行動は夢の中の体験を反映するため、寝室周囲の障害物を回避できずに衝突し、自身もしくはベッドパートナーが受傷することが少なくない。
RBDは大きく特発性と二次性に分けることができる。二次性RBDには、アルコールや睡眠薬の離脱時、三環系抗うつ薬などの中枢作動薬によるもの、脳幹病変を有する神経疾患に基づくものなどがある。
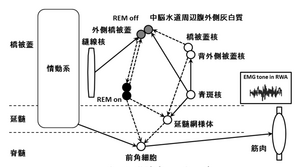
ネコを使った実験では、REM睡眠は情動系の抑制と骨格筋脱力の出現が重要であり、骨格筋脱力は、コリン系の中脳橋被蓋核(pedunculopontine tegmental nucleus:PPN)と外背側被蓋核(laterodorsal tegmental nucleus:LDTN)、アドレナリン系の青斑核(locus coeruleus:LC)から延髄巨大細胞網様体(medullary magnocellular reticular formation:MCRF)を介した系により生じることがわかっている。また、齧歯類を用いた実験により、ネコのLCに相当する下外側背側核(sublateral dorsal nucleus:SLD)がREM睡眠を促進する働きをもっており、反対に中脳水道周辺の腹外側灰白質(ventrolateral part of the periaqueductal grey matter:vlPAG)、外側橋被蓋(lateral pontine tegmentum:LPT)はREM睡眠を抑制することが示されている。ネコのLC、SLDの破壊により、RBDが生じることがわかっているが、ヒトにおいてもLCなどが主病変として注目されている。BoeveらによるRBDの発症機序のスキーマを示す(図5)[6]。
RBDの治療としては、まず患者や家族に病態を十分理解させ、寝室環境を工夫して、患者自身およびベッドパートナーの受傷リスクを低減する必要がある。また、発症の誘因、あるいは増悪因子として、アルコール飲用や心理的ストレスが関与していると推測される場合はこれらへの対応を検討すべきである。薬物療法としては、クロナゼパムが第一選択薬とされており、0.5‐1.5 mg/日が投与される。高齢者ではふらつき、転倒といった副作用に注意が必要である。本剤の作用機序については、脳幹部の橋被蓋核付近のREM睡眠実行系への作用や、辺縁系へ働いて情動を安定化させる作用などが推察されている。これらの他に、メラトニンあるいはドーパミンアゴニストであるプラミペキソールの効果も報告されている。
レストレスレッグス症候群
レストレスレッグス(restless legs syndrome:RLS)は、安静時または夕方から夜間にかけて脚の不快感が生じ、これに伴い下肢を動かしたくなる衝動感にかられる感覚運動障害であり、これによる入眠障害を来すものである。本症の50~80%に周期性四肢運動障害(Pediatric Limb Movement Disorder:PLMD)の合併がみられる。RLSでは、脳内ドパミン神経系の機能異常もしくは貯蔵鉄の欠乏が2大要因として挙げられる。また、家族内発症例が少なくないことから、遺伝的要因の関与も重要視される(レストレスレッグス症候群参照)。
関連項目
参考文献
- ↑ American Academy of Sleep Medicine
International classification of sleep disorders, 2nd ed.:Diagnostic and cording manual American Academy of Sleep Medicine:2005 - ↑
Borbély, A.A. (1982).
A two process model of sleep regulation. Human neurobiology, 1(3), 195-204. [PubMed:7185792] [WorldCat] - ↑
Riemann, D., Spiegelhalder, K., Feige, B., Voderholzer, U., Berger, M., Perlis, M., & Nissen, C. (2010).
The hyperarousal model of insomnia: a review of the concept and its evidence. Sleep medicine reviews, 14(1), 19-31. [PubMed:19481481] [WorldCat] [DOI] - ↑
Morin, C.M., Bootzin, R.R., Buysse, D.J., Edinger, J.D., Espie, C.A., & Lichstein, K.L. (2006).
Psychological and behavioral treatment of insomnia:update of the recent evidence (1998-2004). Sleep, 29(11), 1398-414. [PubMed:17162986] [WorldCat] [DOI] - ↑
Khalsa, S.B., Jewett, M.E., Cajochen, C., & Czeisler, C.A. (2003).
A phase response curve to single bright light pulses in human subjects. The Journal of physiology, 549(Pt 3), 945-52. [PubMed:12717008] [PMC] [WorldCat] [DOI] - ↑
Boeve, B.F., Silber, M.H., Saper, C.B., Ferman, T.J., Dickson, D.W., Parisi, J.E., ..., & Braak, H. (2007).
Pathophysiology of REM sleep behaviour disorder and relevance to neurodegenerative disease. Brain : a journal of neurology, 130(Pt 11), 2770-88. [PubMed:17412731] [WorldCat] [DOI]