大脳皮質の局所神経回路
窪田芳之、川口泰雄
自然科学研究機構 生理学研究所 大脳神経回路論研究部門
DOI:10.14931/bsd.1938 原稿受付日:2012年6月6日 原稿完成日:2014年1月14日 更新日:2016年2月13日 更新日:2021年6月15日
担当編集委員:田中 啓治(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:cortical local microcircuit

LS: late spiking, FS: fast spiking, RS/BSNP: regular spiking/burst spiking, CCK: コレシストキニン
CCS: crossed-corticostriatal cell (CCS細胞)、CPn: corticopontine cell (CPn細胞)[2]

小胞型グルタミン酸トランスポーター Type 2 (VGLUT2)による免疫染色像[3]。
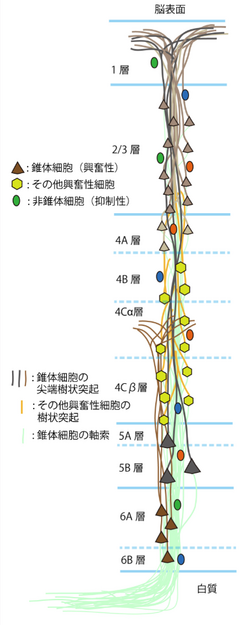
大脳皮質はヒトが生きて行く上で必要な高次脳機能を司る。興奮性の錐体細胞と、それを抑制性に制御する非錐体細胞が、他の皮質領野や皮質下の視床など様々な場所からの入力を統合処理し、その複雑な機能を実現している。1層から6層まであり、各層ごとに特有の入出力構造を持つ。神経細胞は高密度に分布しており、ヒトの大脳皮質には1立方ミリ容積あたり、1万6千個の神経細胞と1億3千万個を超えるシナプス構造、齧歯類の大脳皮質には、8万個の神経細胞と10億個を上回る数のシナプス構造が推定されている。
歴史
大脳皮質の神経細胞の概要が、解剖学的に示されたのは百年余前の事である。Santiago Ramón y Cajalによって、ゴルジ染色法により神経細胞が染色され、光学顕微鏡による観察とスケッチで、長く脳表面に向かって伸展する特徴的な尖端樹状突起(apical dendrite)を持つ錐体細胞(pyramidal cell)や、比較的小さい非錐体細胞(nonpyramidal cell)等が詳細に描画され、報告された。それらは、現在の大脳皮質局所神経回路研究の礎となっている。
局所神経回路ユニットと機能円柱
大脳皮質は、解剖学的に、縦方向に神経細胞が柱状に並んでおり[4]、ミニ円柱(minicolumn)構造(80個の神経細胞で構成され、横方向に23μmの幅を持つ)と呼ばれている。横方向にこのミニ円柱構造が繰り返し分布している[5]。サルの大脳皮質の一次視覚野では、ひとつのミニ円柱構造の中に、18個の2/3層の錐体細胞、6個の5層の錐体細胞、10個の6層の錐体細胞の尖端樹状突起とその軸索(axon)が束をなし、上述の錐体細胞を含んだ64個の興奮性の神経細胞(錐体細胞、Spiny stellate 細胞等)と16個の抑制性の非錐体細胞がその周りを取り囲む様に分布し、それらが互いにシナプス結合で連絡し合いながら、一種の機能的なユニット構造を構成していると考えられている[1]。数百個のミニ円柱が集まり、良く似た形をした物体に視覚的に反応する幅約400 µmの機能円柱(column)構造を形成していると考えられている[6]。ただし、まだミニ円柱構造と機能円柱構造との間の関係は明らかにはなっていない。
局所神経回路の構造
大脳皮質の局所神経回路は、錐体細胞、非錐体細胞、他の大脳皮質や視床からの興奮性入力線維、中脳の縫線核(raphe nucleus)からのセロトニン線維、大脳基底核(basal nucleus)からのアセチルコリン線維、腹側被蓋野(ventral tegmental area)からのドーパミン線維等の求心性線維等から構成される。錐体細胞は、大脳皮質の興奮性出力信号細胞であり、2/3層、5層、6層に分布している。4層にある興奮性細胞は、主に有棘星状細胞(spiny stellate細胞)や星状錐体細胞(Star pyramid細胞)である。これらの興奮性神経細胞は、層毎に、入力源や出力先が異なる事が知られている(図2)。それらの興奮性出力細胞の活動を抑制性非錐体細胞が抑制性の伝達物質GABAによる作用で抑制し制御する。抑制性非錐体細胞は、1層から6層まで分布しており、形態や発火特性、発現する神経伝達物質の異なるサブタイプが多く存在する[7](図3)。これらの抑制性非錐体細胞のサブタイプは、シナプス結合して抑制作用を及ぼすターゲットの場所が異なる事[3]、活動様式が異なる事が知られており[8]、局所神経回路の中での役割が異なると考えられている[9] [10]。さらに、外部からの興奮性信号と縫線核等それ以外の活動を調整する信号等が複雑に作用し合う。
興奮性結合
大脳皮質の局所神経回路の興奮性シナプス結合の中では、錐体細胞間のシナプス結合と、視床からの求心性神経線維から錐体細胞へのシナプス結合の性質が比較的良く知られている。
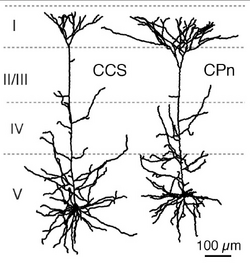
皮質の興奮性細胞間のシナプス結合様式は、近年、ペア電気生理記録法により詳細に検討され報告されている[11]。それによると、4層の興奮生細胞から2/3層の細胞へシナプス結合があり、また4層の興奮性細胞は他の4層の細胞とも結合が強い。さらに4層の興奮性細胞は6層にも少ないながら結合している。2/3層の錐体細胞は、同じ層の中でシナプス結合を作り、5層の錐体細胞に最も強いシナプス結合で信号を送る。5層の錐体細胞は同じ層の錐体細胞と結合し、6層の錐体細胞にも信号を送る。6層の錐体細胞は、4層5層6層の錐体細胞にもシナプス結合する事が報告されている。5層の錐体細胞間の結合特性はさらに解析が進んでいる。5層錐体細胞は、対側皮質へ投射するもの投射するもの(commissural cell; COM細胞)と橋核へ行くもの(corticopontine cell; CPn細胞)に分かれる。前頭葉の大脳皮質のCOM細胞には、対側線条体にも投射するもの(crossed-corticostriatal cell; CCS細胞)がある。5層錐体細胞投射サブタイプの間で、樹状突起形態や生理的性質が分化している(図4)。そしてこれらサブタイプの組み合わせで、結合方向性、相互結合頻度、短期可塑性が異なっている。[12] [2] [13] [14]。
一方、視床皮質神経線維を選択的に発現する小胞型グルタミン酸トランスポーター Type 2 (VGLUT2)をマーカーとして使うことで、視床由来神経線維の神経末端の皮質内分布と皮質細胞への結合様式が明らかとなった[15]。前頭葉では、1層上部、4層、5層下部(5b層)に、より多くの視床皮質線維の神経末端が分布している(図5)。その神経終末の大半は錐体細胞の棘突起に入力し、その棘突起の1割には抑制性シナプスが同時に入力し、視床からの興奮性信号を選択的に抑制すると考えられている[3] [16]。
抑制性結合
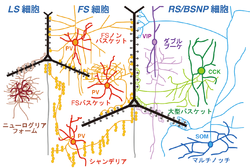
GABAを伝達物質とする抑制性非錐体細胞には少なくとも十数種類のサブタイプがあり、それぞれ異なった役割で皮質活動を制御する(図3)[10] [13] [17] [18] [19] [20]。
バスケット細胞
最も多数をしめるサブタイプは バスケット細胞であり、fast spiking (FS)型の発火様式を示す。非錐体細胞のおよそ3割程度をしめる集団で、互いにギャップ結合(電気シナプス)で結合し、錐体細胞等の細胞体や樹状突起の細胞体近位部に抑制性シナプスを形成し、錐体細胞の発火を押さえたり、発火のタイミングの制御をする[21]。
シャンデリア細胞
バスケット細胞だけでなくもう一つの抑制性非錐体細胞サブタイプであるシャンデリア細胞もFS型発火様式を示す。シャンデリア細胞の数は少ない。その神経終末は縦方向に10個程度が数珠状に並び、ほぼ全ての錐体細胞の軸索起始部にシナプス結合し[22]、錐体細胞の発火を強く制御する。FS細胞は、ほぼ全てがカルシウム結合タンパク質パルブアルブミン(parvalbumin)を発現している。
マルチノッチ細胞
2番目に多い抑制性非錐体細胞のサブタイプは神経ペプチドソマトスタチン(somatostatin)を発現するマルチノッチ細胞(Martinotti細胞)である。非錐体細胞の中では唯一高密度の棘突起(約1個/µm)をもつ[23]。軸索は、1層まで分岐しながら伸展し、錐体細胞のタフト樹状突起等の末端の樹状突起にもシナプスを作り、興奮性入力信号を直接抑制する。
ダブルブーケ細胞
3番目に多い抑制性非錐体細胞のサブタイプはダブルブーケ細胞(Double bouquet細胞)と呼ばれており、軸索がまとまって束となり白質方向に下降するのが特徴である。カルシウム結合タンパク質のカルレチニン(calretinin)や神経ペプチドVIP、CRF等を発現する。結合のターゲットには錐体細胞に加えてdouble bouquet細胞を含む非錐体細胞も含まれる。
ニューログリアフォーム細胞
Late spiking発火特性を持つのは、ニューログリアフォーム細胞(Neurogliaform細胞)である。樹状突起や軸索は、自身の細胞体近傍に密に分岐している。ラットでは、細胞体でα-actinin 2を発現する[7]。また、長い抑制効果を示すGABAB受容体反応を後シナプス細胞に引き起こす[24]。
水平軸索結合
ネコの一次視覚野の錐体細胞は、軸索を水平方向に0.5 – 3mm程のばし、そこで終末側枝を多数分岐している[25]。水平軸索結合は、サルの下側頭回や[26]、ネコの一次聴覚野でもよく調べられている[27]。この水平軸索は、最長で8mmまで走行する。ネコ1次視覚野では、この水平軸索結合は、同じ方向選択性を持つ機能円柱(orientation column)どうしをつなぐ役割を持っている[28]。また、網膜の一部を壊すと、その視野に対応していた皮質部位は、一時的に視覚刺激応答しなくなる。しかし、しばらくすると、それまでは閾値以下の興奮しか起こせなかった周囲の正常部位にある錐体細胞の水平軸索からの入力が強化され、視覚応答するようになる[29] [30]。この結果から、皮質領域内に機能しない部位ができた際にすぐに代償の信号ルートを作る為の予備的な回路の役割を水平軸索が持つとの考えが提唱されている。
シナプス結合選択性
大脳新皮質2/3層内の錐体細胞のうち軸索側枝により直接結合している細胞同士は、直接結合していない細胞同士より、共通の4層興奮性神経細胞からの興奮入力をより多く受ける傾向がある。一方、5層から2/3層内の錐体細胞への興奮性入力や4層から2/3層内の錐体細胞への抑制性入力に関しては、このような選択的な入力パターンは見られない[31]。さらに、抑制性細胞サブタイプであるパルブアルブミン陽性のFS細胞やソマトスタチン陽性のマルチノッチ細胞では、周囲にある錐体細胞を選択性なく神経支配している事が知られている[32] [33]。錐体細胞からの興奮性結合の一部には層やターゲットの細胞タイプによる選択性がある一方、抑制性細胞は周辺の細胞にランダムに結合していると考えられる。
関連項目
参考文献
- ↑ 1.0 1.1
Peters, A., & Sethares, C. (1996).
Myelinated axons and the pyramidal cell modules in monkey primary visual cortex. The Journal of comparative neurology, 365(2), 232-55. [PubMed:8822167] [WorldCat] [DOI] - ↑ 2.0 2.1
Morishima, M., Morita, K., Kubota, Y., & Kawaguchi, Y. (2011).
Highly differentiated projection-specific cortical subnetworks. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(28), 10380-91. [PubMed:21753015] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2
Kubota, Y., Hatada, S., Kondo, S., Karube, F., & Kawaguchi, Y. (2007).
Neocortical inhibitory terminals innervate dendritic spines targeted by thalamocortical afferents. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(5), 1139-50. [PubMed:17267569] [PMC] [WorldCat] [DOI] - ↑
Jones, E.G. (2000).
Microcolumns in the cerebral cortex. Proceedings of the National Academy of Sciences of the United States of America, 97(10), 5019-21. [PubMed:10805761] [PMC] [WorldCat] [DOI] - ↑
Maruoka, H., Kubota, K., Kurokawa, R., Tsuruno, S., & Hosoya, T. (2011).
Periodic organization of a major subtype of pyramidal neurons in neocortical layer V. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(50), 18522-42. [PubMed:22171052] [PMC] [WorldCat] [DOI] - ↑
Fujita, I., Tanaka, K., Ito, M., & Cheng, K. (1992).
Columns for visual features of objects in monkey inferotemporal cortex. Nature, 360(6402), 343-6. [PubMed:1448150] [WorldCat] [DOI] - ↑ 7.0 7.1
Kubota, Y., Shigematsu, N., Karube, F., Sekigawa, A., Kato, S., Yamaguchi, N., ..., & Kawaguchi, Y. (2011).
Selective coexpression of multiple chemical markers defines discrete populations of neocortical GABAergic neurons. Cerebral cortex (New York, N.Y. : 1991), 21(8), 1803-17. [PubMed:21220766] [WorldCat] [DOI] - ↑
Klausberger, T., & Somogyi, P. (2008).
Neuronal diversity and temporal dynamics: the unity of hippocampal circuit operations. Science (New York, N.Y.), 321(5885), 53-7. [PubMed:18599766] [PMC] [WorldCat] [DOI] - ↑
Kawaguchi, Y., & Kubota, Y. (1997).
GABAergic cell subtypes and their synaptic connections in rat frontal cortex. Cerebral cortex (New York, N.Y. : 1991), 7(6), 476-86. [PubMed:9276173] [WorldCat] [DOI] - ↑ 10.0 10.1
Kubota, Y. (2014).
Untangling GABAergic wiring in the cortical microcircuit. Current opinion in neurobiology, 26, 7-14. [PubMed:24650498] [WorldCat] [DOI] - ↑
Thomson, A.M., & Bannister, A.P. (2003).
Interlaminar connections in the neocortex. Cerebral cortex (New York, N.Y. : 1991), 13(1), 5-14. [PubMed:12466210] [WorldCat] [DOI] - ↑
Morishima, M., & Kawaguchi, Y. (2006).
Recurrent connection patterns of corticostriatal pyramidal cells in frontal cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(16), 4394-405. [PubMed:16624959] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1
Otsuka, T., & Kawaguchi, Y. (2011).
Cell diversity and connection specificity between callosal projection neurons in the frontal cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(10), 3862-70. [PubMed:21389241] [PMC] [WorldCat] [DOI] - ↑ 川口 泰雄
大脳皮質内興奮性回路の機能分化
“ブレインサイエンス・レビュー 2009”(伊藤正男・川合述史編集)クバプロ、東京 - ↑
Fujiyama, F., Hioki, H., Tomioka, R., Taki, K., Tamamaki, N., Nomura, S., ..., & Kaneko, T. (2003).
Changes of immunocytochemical localization of vesicular glutamate transporters in the rat visual system after the retinofugal denervation. The Journal of comparative neurology, 465(2), 234-49. [PubMed:12949784] [WorldCat] [DOI] - ↑
Chiu, C.Q., Lur, G., Morse, T.M., Carnevale, N.T., Ellis-Davies, G.C., & Higley, M.J. (2013).
Compartmentalization of GABAergic inhibition by dendritic spines. Science (New York, N.Y.), 340(6133), 759-62. [PubMed:23661763] [PMC] [WorldCat] [DOI] - ↑
Somogyi, P., Tamás, G., Lujan, R., & Buhl, E.H. (1998).
Salient features of synaptic organisation in the cerebral cortex. Brain research. Brain research reviews, 26(2-3), 113-35. [PubMed:9651498] - ↑ 窪田 芳之
皮質局所神経回路の興奮性抑制性入力特性
“ブレインサイエンス・レビュー 2008”(伊藤正男・川合述史編集)クバプロ、東京、p45-72 - ↑
Jiang, X., Shen, S., Cadwell, C.R., Berens, P., Sinz, F., Ecker, A.S., ..., & Tolias, A.S. (2015).
Principles of connectivity among morphologically defined cell types in adult neocortex. Science (New York, N.Y.), 350(6264), aac9462. [PubMed:26612957] [PMC] [WorldCat] [DOI] - ↑
Jiang, X., Wang, G., Lee, A.J., Stornetta, R.L., & Zhu, J.J. (2013).
The organization of two new cortical interneuronal circuits. Nature neuroscience, 16(2), 210-8. [PubMed:23313910] [PMC] [WorldCat] [DOI] - ↑
Kubota, Y., Kondo, S., Nomura, M., Hatada, S., Yamaguchi, N., Mohamed, A.A., ..., & Kawaguchi, Y. (2015).
Functional effects of distinct innervation styles of pyramidal cells by fast spiking cortical interneurons. eLife, 4. [PubMed:26142457] [PMC] [WorldCat] [DOI] - ↑
Fariñas, I., & DeFelipe, J. (1991).
Patterns of synaptic input on corticocortical and corticothalamic cells in the cat visual cortex. II. The axon initial segment. The Journal of comparative neurology, 304(1), 70-7. [PubMed:2016413] [WorldCat] [DOI] - ↑
Kawaguchi, Y., Karube, F., & Kubota, Y. (2006).
Dendritic branch typing and spine expression patterns in cortical nonpyramidal cells. Cerebral cortex (New York, N.Y. : 1991), 16(5), 696-711. [PubMed:16107588] [WorldCat] [DOI] - ↑
Tamás, G., Lorincz, A., Simon, A., & Szabadics, J. (2003).
Identified sources and targets of slow inhibition in the neocortex. Science (New York, N.Y.), 299(5614), 1902-5. [PubMed:12649485] [WorldCat] [DOI] - ↑
Gilbert, C.D., & Wiesel, T.N. (1979).
Morphology and intracortical projections of functionally characterised neurones in the cat visual cortex. Nature, 280(5718), 120-5. [PubMed:552600] [WorldCat] [DOI] - ↑
Fujita, I., & Fujita, T. (1996).
Intrinsic Connections in the macaque inferior temporal cortex. The Journal of comparative neurology, 368(4), 467-86. [PubMed:8744437] [WorldCat] [DOI] - ↑
Ojima, H., & Takayanagi, M. (2004).
Cortical convergence from different frequency domains in the cat primary auditory cortex. Neuroscience, 126(1), 203-12. [PubMed:15145086] [WorldCat] [DOI] - ↑
Callaway, E.M., & Katz, L.C. (1991).
Effects of binocular deprivation on the development of clustered horizontal connections in cat striate cortex. Proceedings of the National Academy of Sciences of the United States of America, 88(3), 745-9. [PubMed:1704130] [PMC] [WorldCat] [DOI] - ↑
Das, A., & Gilbert, C.D. (1995).
Long-range horizontal connections and their role in cortical reorganization revealed by optical recording of cat primary visual cortex. Nature, 375(6534), 780-4. [PubMed:7596409] [WorldCat] [DOI] - ↑
Gilbert, C.D., Das, A., Ito, M., Kapadia, M., & Westheimer, G. (1996).
Spatial integration and cortical dynamics. Proceedings of the National Academy of Sciences of the United States of America, 93(2), 615-22. [PubMed:8570604] [PMC] [WorldCat] [DOI] - ↑
Yoshimura, Y., Dantzker, J.L., & Callaway, E.M. (2005).
Excitatory cortical neurons form fine-scale functional networks. Nature, 433(7028), 868-73. [PubMed:15729343] [WorldCat] [DOI] - ↑
Fino, E., & Yuste, R. (2011).
Dense inhibitory connectivity in neocortex. Neuron, 69(6), 1188-203. [PubMed:21435562] [PMC] [WorldCat] [DOI] - ↑
Packer, A.M., & Yuste, R. (2011).
Dense, unspecific connectivity of neocortical parvalbumin-positive interneurons: a canonical microcircuit for inhibition? The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(37), 13260-71. [PubMed:21917809] [PMC] [WorldCat] [DOI]