「エンドカンナビノイド」の版間の差分
細 →関連項目 |
細編集の要約なし |
||
| (2人の利用者による、間の13版が非表示) | |||
| 1行目: | 1行目: | ||
英語名: endocannabinoid | 英語名: endocannabinoid | ||
同義語:内因性カンナビノイド | 同義語:内因性カンナビノイド | ||
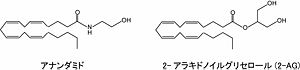
エンドカンナビノイド(内因性カンナビノイド)とは生体内で作られる[[カンナビノイド受容体]]のリガンドの総称である。[[wikipedia:ja:大麻|大麻]]草(学名:''Cannabis sativa'')に含まれる生理活性成分の総称名[[カンナビノイド]]に対して内因性のカンナビノイドであることから名付けられた。いわゆる脳内[[マリファナ]]類似物質である。主要なものとして[[アナンダミド]]と[[2—アラキドノイルグリセロール]](2-AG)があり、どちらも[[アラキドン酸]]を含む脂質性の物質である(図1)。 | |||
[[Image:Yukihashimotodani fig 1.jpg|thumb|right|300px|'''図1.エンドカンナビノイドの構造''']] | |||
== 種類 == | == 種類 == | ||
初めに発見されたエンドカンナビノイドはアナンダミド(またはN-アラキドノイルエタノールアミド)で1992年に[[wikipedia:ja:ブタ|ブタ]]の脳から抽出・同定された<ref><pubmed>1470919</pubmed></ref>。アナンダミド(anandamide)という名は[[wikipedia:ja:サンスクリット|サンスクリット]]語で「至福」を意味するanandaから取られた。2番目のエンドカンナビノイドとして1995年に[[wikipedia:ja:イヌ|イヌ]]の腸および[[wikipedia:ja:ラット|ラット]]の脳から2-AGが同定された<ref><pubmed>7605349</pubmed></ref><ref><pubmed>7575630</pubmed></ref>。この他にも、[[ノラジンエーテル]]、[[ | 初めに発見されたエンドカンナビノイドはアナンダミド(またはN-アラキドノイルエタノールアミド)で1992年に[[wikipedia:ja:ブタ|ブタ]]の脳から抽出・同定された<ref><pubmed>1470919</pubmed></ref>。アナンダミド(anandamide)という名は[[wikipedia:ja:サンスクリット|サンスクリット]]語で「至福」を意味するanandaから取られた。2番目のエンドカンナビノイドとして1995年に[[wikipedia:ja:イヌ|イヌ]]の腸および[[wikipedia:ja:ラット|ラット]]の脳から2-AGが同定された<ref><pubmed>7605349</pubmed></ref><ref><pubmed>7575630</pubmed></ref>。この他にも、[[ノラジンエーテル]]、[[''N''-アラキドノイルドーパミン]]など数種類がエンドカンナビノイドとして報告されているが生理的に機能しているかどうか明らかでない。現在のところアナンダミドと2-AGが生理的に主要なエンドカンナビノイドと考えられている。脳内の含有量は2-AGがアナンダミドに対しておよそ数十から数百倍多い。アナンダミドはカンナビノイド受容体以外にも[[バニロイド受容体]]のアゴニストとしても働くため、[[エンドバニロイド]]としても知られる。 | ||
== 生合成と分解 == | == 生合成と分解 == | ||
[[Image:Yukihashimotodani fig 2.jpg|thumb|right|300px|''' | [[Image:Yukihashimotodani fig 2.jpg|thumb|right|300px|'''図2.エンドカンナビノイドの生合成と分解経路'''<br>橋本谷祐輝 他:実験医学,Vol.28 No.20:3409-3414,2010より引用]] | ||
アナンダミドと2-AGの生合成には複数の経路が知られている。ここでは最も主要であると考えられている経路を示す<ref><pubmed>14595399</pubmed></ref><ref><pubmed>16678907</pubmed></ref>。アナンダミドと2-AGはどちらも膜の[[リン脂質]]から2つの酵素反応によって生成される。アナンダミドは[[ | アナンダミドと2-AGの生合成には複数の経路が知られている。ここでは最も主要であると考えられている経路を示す<ref><pubmed>14595399</pubmed></ref><ref><pubmed>16678907</pubmed></ref>。アナンダミドと2-AGはどちらも膜の[[リン脂質]]から2つの酵素反応によって生成される。アナンダミドは[[''N''-アシル転移酵素]]と[[ホスホリパーゼD]]、2-AGは[[ホスホリパーゼC]](PLC)と[[ジアシルグリセロールリパーゼ]](DGL)によって生成される(図2)。[[中枢神経系]]においてエンドカンナビノイドはもっぱら[[ニューロン]]で作られる。しかし[[グリア細胞]]も作ることができるとの報告がある<ref><pubmed>15371507</pubmed></ref>。どちらのエンドカンナビノイドも[[wikipedia:ja:加水分解|加水分解]]によって代謝される。アナンダミドは[[脂肪酸アミド加水分解酵素]](FAAH)、2-AGは[[モノアシルグリセロールリパーゼ]](MGL)によって分解される(図2)。これら主要経路以外にも[[シクロオキシゲナーゼー2]](COX-2)による[[酸化]]によってもアナンダミド、2-AGともに代謝される。また最近2-AGを選択的に分解する新たな酵素としてABHD6とABHD12が同定された<ref><pubmed>18096503</pubmed></ref>。 | ||
== カンナビノイド受容体 == | == カンナビノイド受容体 == | ||
| 143行目: | 43行目: | ||
=== アストロサイトを介した経路 === | === アストロサイトを介した経路 === | ||
ニューロンから放出されたエンドカンナビノイドは直接ニューロンのCB1受容体に作用するだけでなく[[アストロサイト]]のCB1受容体にも作用し、[[シナプス伝達]]を調節することが最近明らかになってきた。アストロサイトのCB1受容体の活性化によってアストロサイトから[[グルタミン酸]]が放出されシナプス前終末、あるいはシナプス後部の[[グルタミン酸受容体]]([[ | ニューロンから放出されたエンドカンナビノイドは直接ニューロンのCB1受容体に作用するだけでなく[[アストロサイト]]のCB1受容体にも作用し、[[シナプス伝達]]を調節することが最近明らかになってきた。アストロサイトのCB1受容体の活性化によってアストロサイトから[[グルタミン酸]]が放出されシナプス前終末、あるいはシナプス後部の[[グルタミン酸受容体]]([[NMDA受容体]]または代謝型グルタミン酸受容体)を活性化し[[シナプス可塑性]]を引き起こすことが海馬や大脳皮質で報告されている<ref><pubmed>20920795</pubmed></ref><ref><pubmed>22385967</pubmed></ref><ref><pubmed>22446881</pubmed></ref>。 | ||
=== TRPV1依存性LTD === | === TRPV1依存性LTD === | ||
海馬歯状回、[[側座核]]、[[分界条床核]]の興奮性シナプスにおいてアナンダミドが仲介するLTDが報告されている<ref><pubmed>21076423</pubmed></ref><ref><pubmed>21076424</pubmed></ref><ref><pubmed>22057189</pubmed></ref> | 海馬歯状回、[[側座核]]、[[分界条床核]]の興奮性シナプスにおいてアナンダミドが仲介するLTDが報告されている<ref><pubmed>21076423</pubmed></ref><ref><pubmed>21076424</pubmed></ref><ref><pubmed>22057189</pubmed></ref>。シナプス後部で作られたアナンダミドが細胞外に放出されずに、細胞内でシナプス後部のTRPV1を活性化することで引き起こされる。TRPV1を介した細胞内へのカルシウム流入が引き金となって[[AMPA受容体]]のエンドサイトーシスが起こると考えられている。 | ||
== 2-AGかアナンダミドか == | == 2-AGかアナンダミドか == | ||
| 156行目: | 56行目: | ||
#MGLを薬理的、遺伝子的に阻害してその現象が促進される。 | #MGLを薬理的、遺伝子的に阻害してその現象が促進される。 | ||
以上の場合、2-AGが仲介すると判断される。一方、アナンダミドの合成経路を特異的に阻害する薬剤や[[遺伝子欠損動物]]が存在しないことから、上記(1)か(2)が否定され、かつFAAHを阻害するとその現象が促進される場合、アナンダミドによって仲介されると判断される。 | 以上の場合、2-AGが仲介すると判断される。一方、アナンダミドの合成経路を特異的に阻害する薬剤や[[遺伝子欠損動物]]が存在しないことから、上記(1)か(2)が否定され、かつFAAHを阻害するとその現象が促進される場合、アナンダミドによって仲介されると判断される。 | ||
== 参考文献 == | |||
<references /> | |||
(執筆者:橋本谷祐輝、狩野方伸 担当編集委員:尾藤晴彦) | |||
2012年7月18日 (水) 11:30時点における版
英語名: endocannabinoid
同義語:内因性カンナビノイド
エンドカンナビノイド(内因性カンナビノイド)とは生体内で作られるカンナビノイド受容体のリガンドの総称である。大麻草(学名:Cannabis sativa)に含まれる生理活性成分の総称名カンナビノイドに対して内因性のカンナビノイドであることから名付けられた。いわゆる脳内マリファナ類似物質である。主要なものとしてアナンダミドと2—アラキドノイルグリセロール(2-AG)があり、どちらもアラキドン酸を含む脂質性の物質である(図1)。
種類
初めに発見されたエンドカンナビノイドはアナンダミド(またはN-アラキドノイルエタノールアミド)で1992年にブタの脳から抽出・同定された[1]。アナンダミド(anandamide)という名はサンスクリット語で「至福」を意味するanandaから取られた。2番目のエンドカンナビノイドとして1995年にイヌの腸およびラットの脳から2-AGが同定された[2][3]。この他にも、ノラジンエーテル、''N''-アラキドノイルドーパミンなど数種類がエンドカンナビノイドとして報告されているが生理的に機能しているかどうか明らかでない。現在のところアナンダミドと2-AGが生理的に主要なエンドカンナビノイドと考えられている。脳内の含有量は2-AGがアナンダミドに対しておよそ数十から数百倍多い。アナンダミドはカンナビノイド受容体以外にもバニロイド受容体のアゴニストとしても働くため、エンドバニロイドとしても知られる。
生合成と分解
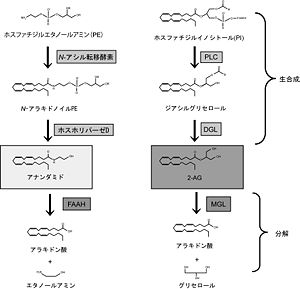
橋本谷祐輝 他:実験医学,Vol.28 No.20:3409-3414,2010より引用
アナンダミドと2-AGの生合成には複数の経路が知られている。ここでは最も主要であると考えられている経路を示す[4][5]。アナンダミドと2-AGはどちらも膜のリン脂質から2つの酵素反応によって生成される。アナンダミドは''N''-アシル転移酵素とホスホリパーゼD、2-AGはホスホリパーゼC(PLC)とジアシルグリセロールリパーゼ(DGL)によって生成される(図2)。中枢神経系においてエンドカンナビノイドはもっぱらニューロンで作られる。しかしグリア細胞も作ることができるとの報告がある[6]。どちらのエンドカンナビノイドも加水分解によって代謝される。アナンダミドは脂肪酸アミド加水分解酵素(FAAH)、2-AGはモノアシルグリセロールリパーゼ(MGL)によって分解される(図2)。これら主要経路以外にもシクロオキシゲナーゼー2(COX-2)による酸化によってもアナンダミド、2-AGともに代謝される。また最近2-AGを選択的に分解する新たな酵素としてABHD6とABHD12が同定された[7]。
カンナビノイド受容体
カンナビノイド受容体は7回膜貫通型のGi/oタンパク質共役型受容体でCB1とCB2の2種類がある。CB1は中枢神経系に、CB2は免疫系に多く発現している。CB1受容体は脳内に広く分布しており、特に大脳皮質、海馬、扁桃体、大脳基底核、視床、小脳などに多い。興奮性、抑制性のどちらのニューロンにもCB1受容体は発現するが、その発現パターンは脳部位によって異なる。例えば海馬では、一部の抑制性ニューロンに強く発現しており、これに比べて興奮性ニューロンには一様に低く発現している。海馬の抑制性ニューロンのうちでも、パルブアルブミン陽性バスケット細胞にはCB1受容体が存在せず、コレシストキニン陽性バスケット細胞に強く発現するといった、極めて選択的な発現パターンを示す。ニューロン内では、神経終末及び軸索に豊富に局在し、細胞体や樹状突起の発現は極めて低い。
脂質メディエーター
エンドカンナビノイドは脂質メディエーターとして中枢神経系においてさまざまな神経伝達調節を行っている[8]。主にCB1受容体の活性化を介してその効果を発揮する。CB1受容体は中枢神経系においてGタンパク質共役型受容体の中でも最も発現量の多い受容体として知られており、その発現領域も脳全体にわたっている。そのためエンドカンナビノイドの生理的作用は、記憶・認知、運動制御、鎮痛、食欲調節、報酬系の制御など多岐にわたる[8]。エンドカンナビノイドは病理的な条件下でも重要な役割を担っており、海馬でてんかん発作時に神経保護的役割を果たすことが知られている[9][10]。以下にシナプス伝達におけるエンドカンナビノイドの役割に限定して述べる。
逆行性シナプス伝達抑制
エンドカンナビノイドの脂質メディエーターとしての働きで最も詳しく調べられているのは逆行性伝達物質としての役割である[11][12][13]。
2-AGはシナプス後部から産生・放出されて逆行性にシナプス前終末に局在するCB1受容体を活性化する。活性化したCB1受容体は共役するGi/oタンパク質を介してシナプス前終末の電位依存性カルシウムチャネルの開口を抑制し、神経伝達物質の放出を抑制する。2-AGはシナプス後部のニューロンの脱分極によるカルシウムイオン流入、あるいはGq/11タンパク質共役型受容体の活性化によって産生される。シナプス後ニューロンで強い脱分極が起きると電位依存性カルシウムチャネルが開いてカルシウムが流入する。細胞内カルシウム濃度がマイクロモーラー以上に達すると、2-AGが産生される。また、グループI代謝型グルタミン酸受容体やM1/M3ムスカリン受容体といったGq/11タンパク質共役型受容体の活性化によってPLCβを介する経路で2-AG産生が引き起こされる。この場合、細胞内カルシウム上昇は必要ない[14]。上記受容体以外にもオレキシン受容体、セロトニン受容体、オキシトシン受容体、プロテアーゼ活性化受容体1型、エンドセリン受容体などによってもエンドカンナビノイド産生が引き起こされる。
さらに、こういった受容体の活性化と脱分極による細胞内へのカルシウム流入が同時におこると、2-AG産生が相乗的に促進される。これは、PLCβがカルシウム感受性を持つため、受容体活性化と同時に細胞内カルシウム濃度が高まると、PLCβ活性が増強するためである[15][16]。エンドカンナビノイドは脂質であるため細胞外へ放出される際、受動的に細胞膜を通り抜けると考えられる。しかしトランスポーターを介する可能性も否定できない。最近アナンダミドのトランスポーターの候補と考えられるFLATという分子が同定された[17]。2-AGに関してはトランスポーターの存在は現在報告されていない。
2-AGによる逆行性シナプス伝達抑制はこれまでに海馬、小脳、大脳基底核、大脳皮質、扁桃体、視床下部、脳幹などの様々な脳部位で報告されており普遍的な現象であることがわかる[8]。一方、アナンダミドに関してはごく一部のシナプスでのみ逆行性伝達物質として働く[18][19][20]。
2-AGによる逆行性シナプス伝達抑制は短期あるいは長期にシナプス伝達を抑制する。短期のシナプス伝達抑制としてdepolarization-induced suppression of inhibition/excitation (DSI/DSE)がよく知られている。2-AGによる長期のシナプス伝達抑制に関しては、多くのシナプスで長期抑圧(long-term depression: LTD)の誘導にCB1受容体の活性化が必須であることが明らかになっている[21]。多くの場合、LTD誘導刺激によって2-AGが逆行性シグナルとして働く。このようなLTDは海馬、小脳、線条体、大脳皮質などで詳しく調べられており、エンドカンナビノイドが記憶・学習、運動学習や運動制御、認知機能に重要な役割を果たしていることが示唆される[21]。
自己抑制
大脳皮質体性感覚野5層の低頻度発火型の抑制性ニューロンではエンドカンナビノイドが自己分泌によって作用する[22]。抑制性ニューロンに繰り返しの脱分極パルスを与えると、長時間に渡ってその細胞の膜電位が過分極する自己抑制が起こる。脱分極によって放出された2-AGが自身の細胞体のCB1受容体を活性化し、最終的に内向き整流性カリウムチャネルが活性化されることで引き起こされると考えられている。
アストロサイトを介した経路
ニューロンから放出されたエンドカンナビノイドは直接ニューロンのCB1受容体に作用するだけでなくアストロサイトのCB1受容体にも作用し、シナプス伝達を調節することが最近明らかになってきた。アストロサイトのCB1受容体の活性化によってアストロサイトからグルタミン酸が放出されシナプス前終末、あるいはシナプス後部のグルタミン酸受容体(NMDA受容体または代謝型グルタミン酸受容体)を活性化しシナプス可塑性を引き起こすことが海馬や大脳皮質で報告されている[23][24][25]。
TRPV1依存性LTD
海馬歯状回、側座核、分界条床核の興奮性シナプスにおいてアナンダミドが仲介するLTDが報告されている[26][27][28]。シナプス後部で作られたアナンダミドが細胞外に放出されずに、細胞内でシナプス後部のTRPV1を活性化することで引き起こされる。TRPV1を介した細胞内へのカルシウム流入が引き金となってAMPA受容体のエンドサイトーシスが起こると考えられている。
2-AGかアナンダミドか
CB1受容体依存的に引き起こされる短期や長期のシナプス可塑性がどちらのエンドカンナビノイドによって仲介されるのかについては、以下のような判別法がある。
- その現象がDGLを薬理的、遺伝子的に阻害して起こらなくなる。
- MGLを薬理的、遺伝子的に阻害してその現象が促進される。
以上の場合、2-AGが仲介すると判断される。一方、アナンダミドの合成経路を特異的に阻害する薬剤や遺伝子欠損動物が存在しないことから、上記(1)か(2)が否定され、かつFAAHを阻害するとその現象が促進される場合、アナンダミドによって仲介されると判断される。
参考文献
- ↑
Devane, W.A., Hanus, L., Breuer, A., Pertwee, R.G., Stevenson, L.A., Griffin, G., ..., & Mechoulam, R. (1992).
Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science (New York, N.Y.), 258(5090), 1946-9. [PubMed:1470919] [WorldCat] [DOI] - ↑
Mechoulam, R., Ben-Shabat, S., Hanus, L., Ligumsky, M., Kaminski, N.E., Schatz, A.R., ..., & Compton, D.R. (1995).
Identification of an endogenous 2-monoglyceride, present in canine gut, that binds to cannabinoid receptors. Biochemical pharmacology, 50(1), 83-90. [PubMed:7605349] [WorldCat] [DOI] - ↑
Sugiura, T., Kondo, S., Sukagawa, A., Nakane, S., Shinoda, A., Itoh, K., ..., & Waku, K. (1995).
2-Arachidonoylglycerol: a possible endogenous cannabinoid receptor ligand in brain. Biochemical and biophysical research communications, 215(1), 89-97. [PubMed:7575630] [WorldCat] [DOI] - ↑
Piomelli, D. (2003).
The molecular logic of endocannabinoid signalling. Nature reviews. Neuroscience, 4(11), 873-84. [PubMed:14595399] [WorldCat] [DOI] - ↑
Sugiura, T., Kishimoto, S., Oka, S., & Gokoh, M. (2006).
Biochemistry, pharmacology and physiology of 2-arachidonoylglycerol, an endogenous cannabinoid receptor ligand. Progress in lipid research, 45(5), 405-46. [PubMed:16678907] [WorldCat] [DOI] - ↑
Walter, L., Dinh, T., & Stella, N. (2004).
ATP induces a rapid and pronounced increase in 2-arachidonoylglycerol production by astrocytes, a response limited by monoacylglycerol lipase. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(37), 8068-74. [PubMed:15371507] [PMC] [WorldCat] [DOI] - ↑
Blankman, J.L., Simon, G.M., & Cravatt, B.F. (2007).
A comprehensive profile of brain enzymes that hydrolyze the endocannabinoid 2-arachidonoylglycerol. Chemistry & biology, 14(12), 1347-56. [PubMed:18096503] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2
Kano, M., Ohno-Shosaku, T., Hashimotodani, Y., Uchigashima, M., & Watanabe, M. (2009).
Endocannabinoid-mediated control of synaptic transmission. Physiological reviews, 89(1), 309-80. [PubMed:19126760] [WorldCat] [DOI] - ↑
Marsicano, G., Goodenough, S., Monory, K., Hermann, H., Eder, M., Cannich, A., ..., & Lutz, B. (2003).
CB1 cannabinoid receptors and on-demand defense against excitotoxicity. Science (New York, N.Y.), 302(5642), 84-8. [PubMed:14526074] [WorldCat] [DOI] - ↑
Monory, K., Massa, F., Egertová, M., Eder, M., Blaudzun, H., Westenbroek, R., ..., & Lutz, B. (2006).
The endocannabinoid system controls key epileptogenic circuits in the hippocampus. Neuron, 51(4), 455-66. [PubMed:16908411] [PMC] [WorldCat] [DOI] - ↑
Ohno-Shosaku, T., Maejima, T., & Kano, M. (2001).
Endogenous cannabinoids mediate retrograde signals from depolarized postsynaptic neurons to presynaptic terminals. Neuron, 29(3), 729-38. [PubMed:11301031] [WorldCat] [DOI] - ↑
Wilson, R.I., & Nicoll, R.A. (2001).
Endogenous cannabinoids mediate retrograde signalling at hippocampal synapses. Nature, 410(6828), 588-92. [PubMed:11279497] [WorldCat] [DOI] - ↑
Kreitzer, A.C., & Regehr, W.G. (2001).
Retrograde inhibition of presynaptic calcium influx by endogenous cannabinoids at excitatory synapses onto Purkinje cells. Neuron, 29(3), 717-27. [PubMed:11301030] [WorldCat] [DOI] - ↑
Maejima, T., Hashimoto, K., Yoshida, T., Aiba, A., & Kano, M. (2001).
Presynaptic inhibition caused by retrograde signal from metabotropic glutamate to cannabinoid receptors. Neuron, 31(3), 463-75. [PubMed:11516402] [WorldCat] [DOI] - ↑
Hashimotodani, Y., Ohno-Shosaku, T., Tsubokawa, H., Ogata, H., Emoto, K., Maejima, T., ..., & Kano, M. (2005).
Phospholipase Cbeta serves as a coincidence detector through its Ca2+ dependency for triggering retrograde endocannabinoid signal. Neuron, 45(2), 257-68. [PubMed:15664177] [WorldCat] [DOI] - ↑
Maejima, T., Oka, S., Hashimotodani, Y., Ohno-Shosaku, T., Aiba, A., Wu, D., ..., & Kano, M. (2005).
Synaptically driven endocannabinoid release requires Ca2+-assisted metabotropic glutamate receptor subtype 1 to phospholipase Cbeta4 signaling cascade in the cerebellum. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(29), 6826-35. [PubMed:16033892] [PMC] [WorldCat] [DOI] - ↑
Fu, J., Bottegoni, G., Sasso, O., Bertorelli, R., Rocchia, W., Masetti, M., ..., & Piomelli, D. (2011).
A catalytically silent FAAH-1 variant drives anandamide transport in neurons. Nature neuroscience, 15(1), 64-9. [PubMed:22101642] [PMC] [WorldCat] [DOI] - ↑
Lourenço, J., Matias, I., Marsicano, G., & Mulle, C. (2011).
Pharmacological activation of kainate receptors drives endocannabinoid mobilization. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(9), 3243-8. [PubMed:21368036] [PMC] [WorldCat] [DOI] - ↑
Caiati, M.D., Sivakumaran, S., Lanore, F., Mulle, C., Richard, E., Verrier, D., ..., & Cherubini, E. (2012).
Developmental regulation of CB1-mediated spike-time dependent depression at immature mossy fiber-CA3 synapses. Scientific reports, 2, 285. [PubMed:22368777] [PMC] [WorldCat] [DOI] - ↑
Lerner, T.N., & Kreitzer, A.C. (2012).
RGS4 is required for dopaminergic control of striatal LTD and susceptibility to parkinsonian motor deficits. Neuron, 73(2), 347-59. [PubMed:22284188] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1
Heifets, B.D., & Castillo, P.E. (2009).
Endocannabinoid signaling and long-term synaptic plasticity. Annual review of physiology, 71, 283-306. [PubMed:19575681] [PMC] [WorldCat] [DOI] - ↑
Bacci, A., Huguenard, J.R., & Prince, D.A. (2004).
Long-lasting self-inhibition of neocortical interneurons mediated by endocannabinoids. Nature, 431(7006), 312-6. [PubMed:15372034] [WorldCat] [DOI] - ↑
Navarrete, M., & Araque, A. (2010).
Endocannabinoids potentiate synaptic transmission through stimulation of astrocytes. Neuron, 68(1), 113-26. [PubMed:20920795] [WorldCat] [DOI] - ↑
Han, J., Kesner, P., Metna-Laurent, M., Duan, T., Xu, L., Georges, F., ..., & Zhang, X. (2012).
Acute cannabinoids impair working memory through astroglial CB1 receptor modulation of hippocampal LTD. Cell, 148(5), 1039-50. [PubMed:22385967] [WorldCat] [DOI] - ↑
Min, R., & Nevian, T. (2012).
Astrocyte signaling controls spike timing-dependent depression at neocortical synapses. Nature neuroscience, 15(5), 746-53. [PubMed:22446881] [WorldCat] [DOI] - ↑
Chávez, A.E., Chiu, C.Q., & Castillo, P.E. (2010).
TRPV1 activation by endogenous anandamide triggers postsynaptic long-term depression in dentate gyrus. Nature neuroscience, 13(12), 1511-8. [PubMed:21076423] [PMC] [WorldCat] [DOI] - ↑
Grueter, B.A., Brasnjo, G., & Malenka, R.C. (2010).
Postsynaptic TRPV1 triggers cell type-specific long-term depression in the nucleus accumbens. Nature neuroscience, 13(12), 1519-25. [PubMed:21076424] [PMC] [WorldCat] [DOI] - ↑
Puente, N., Cui, Y., Lassalle, O., Lafourcade, M., Georges, F., Venance, L., ..., & Manzoni, O.J. (2011).
Polymodal activation of the endocannabinoid system in the extended amygdala. Nature neuroscience, 14(12), 1542-7. [PubMed:22057189] [WorldCat] [DOI]
(執筆者:橋本谷祐輝、狩野方伸 担当編集委員:尾藤晴彦)