「低親和性神経成長因子受容体」の版間の差分
細編集の要約なし |
細 →軸索伸長の制御 |
||
| (4人の利用者による、間の27版が非表示) | |||
| 1行目: | 1行目: | ||
{{PBB|geneid=4804}} | {{PBB|geneid=4804}} | ||
英語名: Low-affinity nerve growth factor receptor 独:Nervenwachstumsfaktor-Rezeptor mit niedriger Affinität | 英語名: Low-affinity nerve growth factor receptor 独:Nervenwachstumsfaktor-Rezeptor mit niedriger Affinität | ||
同義語:低親和性神経栄養因子受容体、p75、p75<sup>NTR</sup> | 同義語:低親和性神経栄養因子受容体、p75、p75<sup>NTR</sup> | ||
| 14行目: | 6行目: | ||
[[Image:2. 神経栄養因子と受容体の構造.png|thumb|250px|'''図2.神経栄養因子と受容体の結合''']] | [[Image:2. 神経栄養因子と受容体の構造.png|thumb|250px|'''図2.神経栄養因子と受容体の結合''']] | ||
低親和性神経成長因子受容体 (p75)は、[[神経栄養因子]] (neurotrophin)に対する、分子量75 kDaの一回膜貫通型[[受容体]]であり、[[腫瘍壊死因子]] ([[tumour necrosis factor]], [[TNF]])受容体スーパーファミリーに属する (図1)。[[wikipedia:ja:哺乳類|哺乳類]]において、単量体で神経栄養因子nerve growth factor (NGF)、[[脳由来神経栄養因子]] ([[brain-derived neurotrophic factor]], [[BDNF]])、[[neurotrophin-3]] ([[NT-3]])、[[neurotrophin-4/5]] ([[NT-4/5]])と低親和性(Kd = 10<sup>-9</sup> M)にて結合し、[[|Trk受容体|tropomyosin receptor kinases (Trk) 受容体]]とのヘテロ二量体の形成により、高親和性(Kd = 10<sup>-11</sup> M)にて結合するようになると考えられている。p75は神経栄養因子との結合により、[[細胞死]]や細胞生存の調節、[[軸索伸長]]の制御など、多彩な機能を示す。また、神経栄養因子前駆体と結合し、細胞死を誘導する <ref><pubmed> 11114882 </pubmed></ref>。 | |||
==低親和性神経成長因子受容体とは== | ==低親和性神経成長因子受容体とは== | ||
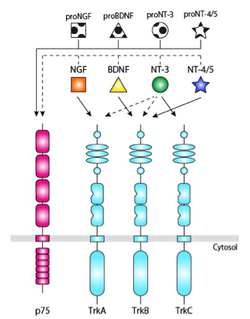
低親和性神経成長因子受容体 (p75)は、Johnsonらにより、神経栄養因子NGFの受容体として配列が同定された <ref><pubmed> 3022937 </pubmed></ref>。神経栄養因子とは、神経系において[[細胞増殖]]や[[分化]]の調節といった神経栄養作用を示す、構造や遺伝子配列の類似した液性因子である。哺乳類には、NGF、BDNF、NT-3、NT-4/5の4種類の神経栄養因子が存在し、Trkとp75の2種類の受容体を介して、神経系の細胞生存、細胞死、増殖、分化、軸索伸長といった多彩な作用を発揮する。Trk受容体には[[TrkA]]、[[TrkB]]、[[TrkC]]があり、各々の神経栄養因子は、特異的なTrk受容体に結合する。p75は全ての神経栄養因子と低親和性 (Kd = 10<sup>-9</sup> M)に結合する (図2)。多くの神経系の細胞において、p75はTrk受容体と共発現しており、リガンド依存性にも、非依存性にもTrk受容体と結合する。p75はTrk受容体とのヘテロ二量体の形成により、神経栄養因子と高親和性(Kd = 10<sup>-11</sup> M)に結合するようになると考えられている。 | |||
一方、神経栄養因子は前駆体から合成される。神経栄養因子前駆体が、[[トランスゴルジネットワーク]]で転換酵素による切断を受けて、C末端から活性型神経栄養因子を生じる。神経栄養因子前駆体は、細胞外に分泌される神経栄養因子のうち40~60%を占めることから、それ自体が生理作用を有すると考えられており、[[proNGF]]が[[交感神経]]細胞や[[オリゴデンドロサイト]]などのp75を発現する細胞において、細胞死を誘導することが示された。p75は神経栄養因子前駆体と高親和性 (Kd = ~2x10<sup>-10</sup> M)に結合し、細胞死を誘導する。一方、Trk受容体は神経栄養因子前駆体に対して、低親和性 (Kd = ~2x10<sup>-8</sup> M)である <ref name="ref3"><pubmed> 11729324 </pubmed></ref>。 | |||
==構造== | ==構造== | ||
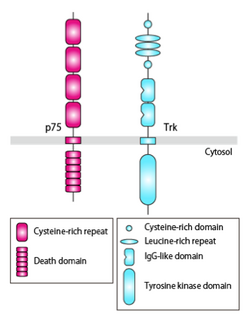
p75は、細胞外に神経栄養因子との結合に関与する4つのcysteine-rich repeatを有し、細胞内にJuxtamembrane domainと6つの[[wikipedia:ja:αヘリックス|α-helical]] domainからなる[[Death domain]]を有する ( | |||
p75は、細胞外に神経栄養因子との結合に関与する4つのcysteine-rich repeatを有し、細胞内にJuxtamembrane domainと6つの[[wikipedia:ja:αヘリックス|α-helical]] domainからなる[[Death domain]]を有する (図1)。TrkAとNGFは対照的な2:2の結合が知られていたが、p75とNGFは1:2で結合する。これは、p75との結合により、NGF二量体のうち、p75との非結合部位で立体構造変化が起こり、2つ目のp75との結合が阻害されるためである。p75の単量体がアポトーシスを誘導し、二量体化するとアポトーシス誘導作用が阻害されることが報告されているが、一つのモデルとして、神経栄養因子によるp75二量体の解離が、p75の活性化を引き起こすという説明がなされている。 | |||
==ファミリー== | ==ファミリー== | ||
全長のp75タンパク質とともに、少量ではあるが、4つのcystein rich repeatのうち3つを欠いたp75 short isoform (s-p75)も存在する。s- | 腫瘍壊死因子(tumour necrosis factor, TNF)受容体スーパーファミリーに属する。(編集コメント:サブタイプや選択的スプライス型の有無など御記述ください) | ||
全長のp75タンパク質とともに、少量ではあるが、4つのcystein rich repeatのうち3つを欠いたp75 short isoform (s-p75)も存在する。s-p75は、神経栄養因子と結合しないが、Trk受容体や狂犬病ウイルス糖タンパク質との結合能は保持されている。 | |||
==発現== | ==発現== | ||
(編集コメント:組織発現、細胞内発現パタンなどについて御記述ください) | |||
==神経系での機能 == | ==神経系での機能 == | ||
Trk受容体は細胞生存や軸索伸長など細胞に対して正の機能を調節するのに対し、p75は細胞死や細胞生存の調節、軸索伸長の制御など、正と負両方の調節を行う。他にも、シュワン細胞の遊走、[[ミエリン]]形成、[[シナプス]]形成の制御や、感覚神経機能、[[カルシウム]]流入の調節などの機能を示す。p75の下流では[[JNK]]、[[p53]]、[[NF-κB]]、[[TRAFs]]、[[SC-1]]、[[Rho]]、[[Rac]]などの分子が、多様な機能の制御に関わっている。 | |||
=== 細胞死誘導=== | === 細胞死誘導=== | ||
==== | ====ニューロトロフィンと細胞死==== | ||
p75は細胞内にDeath domainを有することから、細胞死を誘導する。当初、p75の強制発現により、細胞死が誘導され、NGF投与により抑制されることが示された。研究が進み、p75は神経栄養因子との結合によっても、細胞死を誘導することが示された。培養オリゴデンドロサイトはp75を発現しており、培養液中にNGFを添加すると細胞死が誘導される <ref><pubmed> 8878481 </pubmed></ref>。in vivoの実験において、最初にp75を介したリガンド依存性の細胞死が示されたのは、発生期の[[wikipedia:ja:鳥類|鳥類]][[網膜]]神経細胞である <ref><pubmed> 8774880 </pubmed></ref>。中和[[wikipedia:ja:抗体|抗体]]を用いてNGFやp75の活性を阻害すると、[[プログラム細胞死]]が抑制されたことから、内在性のNGFが網膜神経細胞死におけるプログラム細胞死を誘導することが示された。 | |||
NGFだけでなく、BDNFもまた、p75を介して神経細胞死を誘導する。[[交感神経細胞]]の培養系では、低濃度のNGF、[[wikipedia:ja:塩化カリウム|KCl]]で細胞生存が維持されるが、BDNFにより細胞死が誘導される(この細胞では、BDNFによるTrk受容体の活性化が誘導されない)。bdnf-/-マウス、p75-/-マウスの交感神経細胞は、WTに比べ、細胞死が抑制されることが示された。また、BDNF-/- | NGFだけでなく、BDNFもまた、p75を介して神経細胞死を誘導する。[[交感神経細胞]]の培養系では、低濃度のNGF、[[wikipedia:ja:塩化カリウム|KCl]]で細胞生存が維持されるが、BDNFにより細胞死が誘導される(この細胞では、BDNFによるTrk受容体の活性化が誘導されない)。bdnf-/-マウス、p75-/-マウスの交感神経細胞は、WTに比べ、細胞死が抑制されることが示された。また、BDNF-/-マウスの交感神経細胞は、WTに比べ、細胞数が増加していることが示された。これらの結果から、内在性のBDNFも、p75を介した神経細胞死を誘導することが明らかになった。 | ||
神経栄養因子前駆体もp75と結合して細胞死を誘導する。神経栄養因子前駆体は、成熟神経栄養因子よりも低濃度でp75に結合し、細胞死を誘導する <ref name=ref3 />。一方、Trk受容体に対する神経栄養因子の前駆体の親和性は、成熟神経栄養因子ほど高くない。神経栄養因子前駆体は、[[sortilin]]を介して、p75と結合する。sortilinは、分子量約95 kDaで、[[Vps10-domain]]を有する。sortilinは[[脳]]、[[脊髄]]、[[wikipedia:ja:筋|筋]] | 神経栄養因子前駆体もp75と結合して細胞死を誘導する。神経栄養因子前駆体は、成熟神経栄養因子よりも低濃度でp75に結合し、細胞死を誘導する <ref name="ref3" />。一方、Trk受容体に対する神経栄養因子の前駆体の親和性は、成熟神経栄養因子ほど高くない。神経栄養因子前駆体は、[[sortilin]]を介して、p75と結合する。sortilinは、分子量約95 kDaで、[[Vps10-domain]]を有する。sortilinは[[脳]]、[[脊髄]]、[[wikipedia:ja:筋|筋]]など様々な組織で発現している。神経栄養因子前駆体は、p75を介してアポトーシスを誘導するが、p75を発現する全ての細胞が神経栄養因子前駆体に反応するわけではない。sortilinがp75と共受容体を形成することが、神経栄養因子前駆体によるアポトーシスの誘導に必要である。sortilinとp75の両者を発現する[[上頸神経節]]神経細胞や[[wikipedia:ja:血管平滑筋|血管平滑筋]]細胞(SM-11)では、proNGFの投与で細胞死が誘導される。 | ||
p75は神経栄養因子以外のリガンドとも結合する。神経毒性を示す[[プリオン]]ペプチドPrPや[[βアミロイド]] | p75は神経栄養因子以外のリガンドとも結合する。神経毒性を示す[[プリオン]]ペプチドPrPや[[βアミロイド]]と結合する。これらのペプチドはp75との結合を介して、細胞死を誘導する。また、p75は、[[wikipedia:ja:狂犬病ウイルス|狂犬病ウイルス]]の[[wikipedia:ja:エンベロープ|エンベロープ]]上の糖タンパク質と結合し、ウイルス受容体としても働く。 | ||
====細胞死のシグナル伝達==== | ====細胞死のシグナル伝達==== | ||
| 56行目: | 47行目: | ||
細胞死誘導機構として、p75の下流でJNK/p53/[[Bax]]経路の活性化が報告されている。JNKの下流で、[[c-jun]]の[[リン酸化]]、p53、[[Bad]]、[[Bim]]の活性化、[[ミトコンドリア]]へのBaxの移行と[[チトクロームc]]の放出、[[カスパーゼ]]の活性化を介して神経細胞死が誘導される。さらに、JNKは[[Fasリガンド]] の発現を誘導し、[[Fas受容体]]の活性化を介して神経細胞死を誘導する。 | 細胞死誘導機構として、p75の下流でJNK/p53/[[Bax]]経路の活性化が報告されている。JNKの下流で、[[c-jun]]の[[リン酸化]]、p53、[[Bad]]、[[Bim]]の活性化、[[ミトコンドリア]]へのBaxの移行と[[チトクロームc]]の放出、[[カスパーゼ]]の活性化を介して神経細胞死が誘導される。さらに、JNKは[[Fasリガンド]] の発現を誘導し、[[Fas受容体]]の活性化を介して神経細胞死を誘導する。 | ||
p75自体は触媒活性を持たないが、様々な[[アダプタータンパク質]]と結合し、下流シグナルを活性化する。p75のアダプタータンパク質である[[neurotrophin receptor interacting factor]] ([[NRIF]])、[[neurotrophin associated cell death executor]] ([[NADE]])、[[neurotrophin receptor interacting melanoma-associated antigen homolog|neurotrophin receptor interacting melanoma-associated antigen (MAGE) homolog]] ([[NRAGE]])、[[TNF receptor associated factors]] ([[TRAFs]])は、単独で或いは協調して、JNK経路を活性化することで、p75依存性の細胞死を促進する。NRIFは組織全体に発現する[[ | p75自体は触媒活性を持たないが、様々な[[アダプタータンパク質]]と結合し、下流シグナルを活性化する。p75のアダプタータンパク質である[[neurotrophin receptor interacting factor]] ([[NRIF]])、[[neurotrophin associated cell death executor]] ([[NADE]])、[[neurotrophin receptor interacting melanoma-associated antigen homolog|neurotrophin receptor interacting melanoma-associated antigen (MAGE) homolog]] ([[NRAGE]])、[[TNF receptor associated factors]] ([[TRAFs]])は、単独で或いは協調して、JNK経路を活性化することで、p75依存性の細胞死を促進する。NRIFは組織全体に発現する[[zinc fingerタンパク質]]である。NRIF-/-マウスでは、網膜神経細胞におけるプログラム細胞死が抑制される。細胞死抑制の程度がp75-/-マウスやNGF-/-マウスと同程度であることから、p75がNRIFを介して細胞死を誘導することが推察される。 | ||
また、p75の活性化は、[[E3ユビキチンリガーゼ]]である[[TRAF6]]によるNRIF 63の[[ユビキチン化]] | また、p75の活性化は、[[E3ユビキチンリガーゼ]]である[[TRAF6]]によるNRIF 63の[[ユビキチン化]]を引き起こし、NRIFの核内移行を可能にする。加えて、NRIFの核内移行には、[[γ-セクレターゼ]]によるp75 ICDの切断が必要である。NRIFとTRAF6の相互作用を抑制すると、NRIFの核内移行や、細胞死が抑制される。TRAF6やNRIFを欠損した交感神経細胞では、JNKの活性化が抑制される。NADEはNGF刺激によるp75の活性化を介したアポトーシスの誘導に関与する。内在性にp75を発現するPC12細胞やnnr5細胞において、NADEはNGF存在下でp75と結合し、細胞死を誘導する。BDNF、NT-3、NT-4/5刺激ではp75/NADEによる細胞死は誘導されない。NADEのみを強制発現しても細胞死は誘導されない。 | ||
NRAGEはMAGEファミリーに属するタンパク質で、交感神経前駆細胞において、NGFによる細胞死シグナルを伝達する。NRAGEを強制発現することで、細胞増殖が抑制される。 | |||
[[Schwann cell factor 1]] ([[SC1]]) | [[Schwann cell factor 1]] ([[SC1]])はzinc fingerタンパク質で、細胞周期の進行を抑制する。NGF刺激でp75が活性化されると、SC1は細胞質から核内に移行し、細胞増殖を抑制する。COS-7細胞の核内にSC1を発現させると[[wikipedia:BrdU|BrdU]]の取り込みが減少することが示されている <ref><pubmed> 10485890 </pubmed></ref>。 | ||
低分子量Gタンパク質であるRhoファミリー分子も、p75の下流で細胞死の誘導に関与するという報告がある。PC12細胞や交感神経細胞では、[[Cdc42]]の活性化がJNKの活性化に必要である。オリゴデンドロサイトでは、Racの活性化がp75を介した細胞死に必要である。 | |||
JNK経路の活性化以外によっても、p75を介した細胞死が誘導される。内在性にp75を発現する交感神経細胞において、NGF除去により、p75の活性化を介した細胞死が誘導される <ref><pubmed> 9852160 </pubmed></ref> <ref><pubmed> 10894779 </pubmed></ref>。この系では、p53ファミリーに属する[[p73]]が主要な役割を果たすと考えられている。発生期の神経細胞ではp73のtruncated isoform([[deltaN-p73]])が発現しているが、NGF除去により細胞死が誘導されるときには、その発現が減少していることが示された。NGF除去やp53強制発現により、細胞死が誘導されるが、このとき、deltaN-p73を発現させることで細胞死が抑制される。また、p73の全てのisoformを欠損したp73-/-マウスでは、発生期における交感神経の細胞死が有為に増加する。以上から、deltaN-p73が発生期におけるp75を介した細胞死を抑制することが示唆される。 | JNK経路の活性化以外によっても、p75を介した細胞死が誘導される。内在性にp75を発現する交感神経細胞において、NGF除去により、p75の活性化を介した細胞死が誘導される <ref><pubmed> 9852160 </pubmed></ref>,<ref><pubmed> 10894779 </pubmed></ref>。この系では、p53ファミリーに属する[[p73]]が主要な役割を果たすと考えられている。発生期の神経細胞ではp73のtruncated isoform([[deltaN-p73]])が発現しているが、NGF除去により細胞死が誘導されるときには、その発現が減少していることが示された。NGF除去やp53強制発現により、細胞死が誘導されるが、このとき、deltaN-p73を発現させることで細胞死が抑制される。また、p73の全てのisoformを欠損したp73-/-マウスでは、発生期における交感神経の細胞死が有為に増加する。以上から、deltaN-p73が発生期におけるp75を介した細胞死を抑制することが示唆される。 | ||
=== 細胞生存 === | === 細胞生存 === | ||
神経栄養因子の結合により、p75の下流で活性化される分子として、[[NF-κB]]も報告されている。p75を介したNF-κBの活性化は、神経細胞生存を促す。NGFの結合により、p75とそのアダプタータンパク質である[[Traf 6]]が結合する。[[Interleukin-1 receptor-associated kinase]] ([[IRAK]])は、通常細胞質に局在するが、NGF刺激により、[[MyD88]]と結合し、受容体複合体にリクルートされる。MyD88は受容体複合体から解離し、IRAKはリン酸化され、活性化される。そして、[[非典型的タンパク質キナーゼC]] ([[atypical protein kinase C]], [[aPKC]])、[[p62]]がリクルートされる。さらに、aPKCの基質である[[IκBキナーゼ]] ([[IKK]]) | 神経栄養因子の結合により、p75の下流で活性化される分子として、[[NF-κB]]も報告されている。p75を介したNF-κBの活性化は、神経細胞生存を促す。NGFの結合により、p75とそのアダプタータンパク質である[[Traf 6]]が結合する。[[Interleukin-1 receptor-associated kinase]] ([[IRAK]])は、通常細胞質に局在するが、NGF刺激により、[[MyD88]]と結合し、受容体複合体にリクルートされる。MyD88は受容体複合体から解離し、IRAKはリン酸化され、活性化される。そして、[[非典型的タンパク質キナーゼC]] ([[atypical protein kinase C]], [[aPKC]])、[[p62]]がリクルートされる。さらに、aPKCの基質である[[IκBキナーゼ]] ([[IKK]])が活性化され、IκBがリン酸化を受けて分解され、NF-κBが核内で転写活性を示す <ref><pubmed> 16939974 </pubmed></ref>。一方で、NGF刺激により、TNF存在下におけるNF-κBの活性は増強するが、生理的な条件下では、NGFの結合によりNF-κBの活性化は誘導されないとする報告も存在し、議論の余地が残っている。 | ||
また、p75がTrk受容体を正に制御することが報告されている。内在性にTrkAとp75を発現しているPC12細胞において、NGF存在下、p75依存性にTrkのアダプタータンパク質である[[Shc]]のリン酸化が亢進することが示された。このとき、Trkのリン酸化その下流シグナルを伝達する[[Akt]]のリン酸化が亢進していることから、p75はShcと結合し、Trk経路のシグナルを増強すると考えられている <ref><pubmed> 15056278 </pubmed></ref>。 | また、p75がTrk受容体を正に制御することが報告されている。内在性にTrkAとp75を発現しているPC12細胞において、NGF存在下、p75依存性にTrkのアダプタータンパク質である[[Shc]]のリン酸化が亢進することが示された。このとき、Trkのリン酸化その下流シグナルを伝達する[[Akt]]のリン酸化が亢進していることから、p75はShcと結合し、Trk経路のシグナルを増強すると考えられている <ref><pubmed> 15056278 </pubmed></ref>。 | ||
| 76行目: | 67行目: | ||
=== 軸索伸長の制御 === | === 軸索伸長の制御 === | ||
p75は神経細胞死、細胞生存以外にも軸索伸長の制御を担うことが知られている。p75 exon III -/-マウスでは、交感神経と感覚神経の投射に異常が認められている <ref><pubmed> 8128229 </pubmed></ref> | p75は神経細胞死、細胞生存以外にも軸索伸長の制御を担うことが知られている。p75 exon III -/-マウスでは、交感神経と感覚神経の投射に異常が認められている <ref><pubmed> 8128229 </pubmed></ref>。野生型の成体マウスでは、上頸神経節から[[松果体]]への交感神経が投射しているが、p75 exon III-/-マウスでは、交感神経の投射が阻害されている。[[wikipedia:ja:汗腺|汗腺]]への交感神経の投射も阻害されている。これは、発生期における軸索伸長の異常が原因であると推察されている。また、このマウスでは、視床から大脳皮質への投射が障害されていることも示されている <ref><pubmed> 11978834 </pubmed></ref>。この投射経路は、発生期にsubplateの軸索を足場として利用すると考えられているが、p75exonIII-/-マウスでは、subplateの成長円錐が異常な形態(フィロポディアの減少)を示している。また、p75exonIII-/-マウスでは、subplateの軸索の一部が異常な投射を示している。これらの結果から、p75はin vivoで軸索の投射や伸長を制御することが示唆される。 | ||
内在性にp75を発現しているが、TrkAを発現していない[[wikipedia:ja:ニワトリ|ニワトリ]] | 内在性にp75を発現しているが、TrkAを発現していない[[wikipedia:ja:ニワトリ|ニワトリ]]胚の繊毛神経細胞(編集コメント:これで正しいかご確認ください)において、NGF刺激により軸索伸長が促進される。この分子機構として、p75によるRhoの活性制御が示されている。[[低分子量Gタンパク質]]の一種であるRhoファミリーは、[[アクチン]]骨格系を制御する因子で、RhoA、Rac、Cdc42などが含まれる。活性型であるGTP結合型RhoAは軸索伸長を抑制する。p75はRhoAと結合し、RhoAの活性を誘導するが、NGFがp75に結合すると、RhoAの活性が抑制され、神経突起の伸展が促進されることが示されている <ref><pubmed> 10595511 </pubmed></ref>。p75によるRhoAの不活性化には、[[cAMP]]-[[cAMP依存性タンパク質キナーゼ]][[PKA]]シグナルが関与している。神経栄養因子がp75に結合すると、細胞内cAMP濃度が上昇し、PKAが活性化される。p75はPKAによるリン酸化を受けて、RhoAを含む様々な分子が集積している[[脂質ラフト]]に移行し、下流へのシグナル伝える <ref><pubmed> 12682012 </pubmed></ref>。 | ||
一方で、p75はミエリンによる軸索伸長阻害にも関与することが報告されている。p75-/-マウスでは、通常は軸索の伸長が制限されるミエリンに富んだ領域であっても、異常な軸索伸長が観察されている <ref><pubmed> 10234043 </pubmed></ref>。ミエリンに含まれる軸索伸長阻害因子として、[[myelin associated glycoprotein]] ([[MAG]])、[[Nogo]]、[[oligodendrocyte glycoprotein]] ([[OMgp]]) などが存在する。これらの因子は構造は異なれど、全て[[Nogo受容体]] (NgR)に結合することが知られている。NgRは[[GPIアンカー型タンパク質]]で細胞内ドメインを持たない。そこで、p75がNgRと結合し、これらのミエリン由来軸索再生阻害因子のシグナルを細胞内に伝達する役割を担うことが明らかになった。この下流の分子機構には、p75を介したRhoの活性化が関与している。細胞内でRhoの活性は[[Rho guanine nucleotide dissociation inhibitor]] ([[Rho-GDI]])との結合により抑制されている。p75はRhoとRho-GDIの結合を解離することでRhoの活性化を誘導し、軸索伸長を阻害することが示されている <ref><pubmed> 12692556 </pubmed></ref>。 | 一方で、p75はミエリンによる軸索伸長阻害にも関与することが報告されている。p75-/-マウスでは、通常は軸索の伸長が制限されるミエリンに富んだ領域であっても、異常な軸索伸長が観察されている <ref><pubmed> 10234043 </pubmed></ref>。ミエリンに含まれる軸索伸長阻害因子として、[[myelin associated glycoprotein]] ([[MAG]])、[[Nogo]]、[[oligodendrocyte glycoprotein]] ([[OMgp]]) などが存在する。これらの因子は構造は異なれど、全て[[Nogo受容体]] (NgR)に結合することが知られている。NgRは[[GPIアンカー型タンパク質]]で細胞内ドメインを持たない。そこで、p75がNgRと結合し、これらのミエリン由来軸索再生阻害因子のシグナルを細胞内に伝達する役割を担うことが明らかになった。この下流の分子機構には、p75を介したRhoの活性化が関与している。細胞内でRhoの活性は[[Rho guanine nucleotide dissociation inhibitor]] ([[Rho-GDI]])との結合により抑制されている。p75はRhoとRho-GDIの結合を解離することでRhoの活性化を誘導し、軸索伸長を阻害することが示されている <ref><pubmed> 12692556 </pubmed></ref>。 | ||
== 動物モデル == | |||
Leeらは[[ジーンターゲッティング]]によりp75のexon3を欠損したマウスを作成した <ref><pubmed> 1317267 </pubmed></ref>。このマウスでは、全長のp75の発現は欠損しているが、p75の細胞外ドメインを欠いたshort isoform (s-p75)の発現が残っている。s-p75はNGFと結合しないが、TrkAと結合しうる。表現型として、生存率や繁殖に異常は認められないが、[[wikipedia:ja:潰瘍|潰瘍]]などの皮膚の障害を生じることが知られている。また、[[カルシトニン遺伝子関連ペプチド]]や[[サブスタンスP]]を発現する末梢性感覚神経の障害を伴い、熱刺激に対する反応性が弱いことが報告されている。 | Leeらは[[ジーンターゲッティング]]によりp75のexon3を欠損したマウスを作成した <ref><pubmed> 1317267 </pubmed></ref>。このマウスでは、全長のp75の発現は欠損しているが、p75の細胞外ドメインを欠いたshort isoform (s-p75)の発現が残っている。s-p75はNGFと結合しないが、TrkAと結合しうる。表現型として、生存率や繁殖に異常は認められないが、[[wikipedia:ja:潰瘍|潰瘍]]などの皮膚の障害を生じることが知られている。また、[[カルシトニン遺伝子関連ペプチド]]や[[サブスタンスP]]を発現する末梢性感覚神経の障害を伴い、熱刺激に対する反応性が弱いことが報告されている。 | ||
一方、von Schackらは、p75のexon4を欠損したマウスを作成した <ref><pubmed> 11559852 </pubmed></ref>。このマウスは、当初s-p75とFL- | 一方、von Schackらは、p75のexon4を欠損したマウスを作成した <ref><pubmed> 11559852 </pubmed></ref>。このマウスは、当初s-p75とFL-p75両方を欠損したものと考えられていたが、後に細胞膜貫通領域と細胞内ドメインを含む遺伝子産物が残存していることが判明した。この断片化されたタンパク質は、アポトーシスを誘導することが後に示された。それ故、exon4欠損マウスでは、血管障害などの原因で約40%のマウスが死亡する。また、これ以前にもp75の細胞内ドメインを発現するトランスジェニックマウスでは、交感神経や末梢感覚神経の細胞数の減少が認められている。これは、Trkの不活性化ではなく、p75の細胞内ドメイン自体が細胞死誘導経路の活性化因子として働くためと考えられている。 | ||
p75の細胞内ドメインを過剰発現するマウスでは、[[大脳皮質]]の細胞数の減少と、交感神経、感覚神経の細胞数の減少が確認されている。このマウスにおいて、Trk受容体の発現や活性状態には変化が無いのにもかかわらず、細胞数が減少することから、p75の細胞内ドメインが細胞死の誘導を決定する要因であると示唆される。 | p75の細胞内ドメインを過剰発現するマウスでは、[[大脳皮質]]の細胞数の減少と、交感神経、感覚神経の細胞数の減少が確認されている。このマウスにおいて、Trk受容体の発現や活性状態には変化が無いのにもかかわらず、細胞数が減少することから、p75の細胞内ドメインが細胞死の誘導を決定する要因であると示唆される。 | ||
== 疾患との関連 == | |||
p75の発現は胎生期に限局しており、生後は発現が減少する。しかし、成体でも損傷や[[虚血]]、[[てんかん]]発作後などの病理的な条件下では発現が上昇する <ref><pubmed> 15721744 </pubmed></ref>。 | |||
[[アルツハイマー病]]は[[タウ]] | [[アルツハイマー病]]は[[タウ]]タンパク質の異常リン酸化や、amyloid beta (Aβ) の凝集を特徴とする疾患である。アルツハイマー病の大脳皮質神経細胞では、p75の発現が確認されている <ref><pubmed> 1309947 </pubmed></ref>。Aβ がp75と結合すると、JNK経路が活性化され、アポトーシスが誘導される。内在性にp75を発現している[[神経堤]]由来の[[wikipedia:ja:メラニン細胞|メラニン細胞]]は、Aβの存在下、アポトーシスを起こす。 | ||
[[amyotrophic lateral sclerosis]] ([[ALS]])患者では、頸髄運動神経でp75の発現上昇が報告されている。また、ALSモデルマウスであるSOD1変異マウスでは、腰髄運動神経におけるp75の発現が上昇している <ref><pubmed> 11771768 </pubmed></ref>。このマウスは、生後4ヶ月で死亡する。 | |||
[[ | [[pilocarpin]]投与によるてんかんモデル動物では、[[海馬]]、[[梨状葉]]、[[内嗅皮質]]において、p75の発現上昇と、これに関連した神経細胞死が確認されている。 | ||
[[皮質脊髄路]]の神経細胞において、軸索切断3日後、p75の発現が上昇する。これは、細胞死が起こるタイミングと一致する。NT-3抗体の投与により細胞死が抑制されることから、内在性のNT-3によるp75の活性化が細胞死を誘導することが示されている。 | [[皮質脊髄路]]の神経細胞において、軸索切断3日後、p75の発現が上昇する。これは、細胞死が起こるタイミングと一致する。NT-3抗体の投与により細胞死が抑制されることから、内在性のNT-3によるp75の活性化が細胞死を誘導することが示されている。 | ||
== 関連項目 == | == 関連項目 == | ||
*[[軸索再生]] | *[[軸索再生]] | ||
*[[Nogo]] | *[[Nogo]] | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
(執筆者:藤田幸、山下俊英 担当編集委員:村上富士夫) | |||
2012年12月6日 (木) 00:19時点における版
英語名: Low-affinity nerve growth factor receptor 独:Nervenwachstumsfaktor-Rezeptor mit niedriger Affinität 同義語:低親和性神経栄養因子受容体、p75、p75NTR
低親和性神経成長因子受容体 (p75)は、神経栄養因子 (neurotrophin)に対する、分子量75 kDaの一回膜貫通型受容体であり、腫瘍壊死因子 (tumour necrosis factor, TNF)受容体スーパーファミリーに属する (図1)。哺乳類において、単量体で神経栄養因子nerve growth factor (NGF)、脳由来神経栄養因子 (brain-derived neurotrophic factor, BDNF)、neurotrophin-3 (NT-3)、neurotrophin-4/5 (NT-4/5)と低親和性(Kd = 10-9 M)にて結合し、[[|Trk受容体|tropomyosin receptor kinases (Trk) 受容体]]とのヘテロ二量体の形成により、高親和性(Kd = 10-11 M)にて結合するようになると考えられている。p75は神経栄養因子との結合により、細胞死や細胞生存の調節、軸索伸長の制御など、多彩な機能を示す。また、神経栄養因子前駆体と結合し、細胞死を誘導する [1]。
低親和性神経成長因子受容体とは
低親和性神経成長因子受容体 (p75)は、Johnsonらにより、神経栄養因子NGFの受容体として配列が同定された [2]。神経栄養因子とは、神経系において細胞増殖や分化の調節といった神経栄養作用を示す、構造や遺伝子配列の類似した液性因子である。哺乳類には、NGF、BDNF、NT-3、NT-4/5の4種類の神経栄養因子が存在し、Trkとp75の2種類の受容体を介して、神経系の細胞生存、細胞死、増殖、分化、軸索伸長といった多彩な作用を発揮する。Trk受容体にはTrkA、TrkB、TrkCがあり、各々の神経栄養因子は、特異的なTrk受容体に結合する。p75は全ての神経栄養因子と低親和性 (Kd = 10-9 M)に結合する (図2)。多くの神経系の細胞において、p75はTrk受容体と共発現しており、リガンド依存性にも、非依存性にもTrk受容体と結合する。p75はTrk受容体とのヘテロ二量体の形成により、神経栄養因子と高親和性(Kd = 10-11 M)に結合するようになると考えられている。
一方、神経栄養因子は前駆体から合成される。神経栄養因子前駆体が、トランスゴルジネットワークで転換酵素による切断を受けて、C末端から活性型神経栄養因子を生じる。神経栄養因子前駆体は、細胞外に分泌される神経栄養因子のうち40~60%を占めることから、それ自体が生理作用を有すると考えられており、proNGFが交感神経細胞やオリゴデンドロサイトなどのp75を発現する細胞において、細胞死を誘導することが示された。p75は神経栄養因子前駆体と高親和性 (Kd = ~2x10-10 M)に結合し、細胞死を誘導する。一方、Trk受容体は神経栄養因子前駆体に対して、低親和性 (Kd = ~2x10-8 M)である [3]。
構造
p75は、細胞外に神経栄養因子との結合に関与する4つのcysteine-rich repeatを有し、細胞内にJuxtamembrane domainと6つのα-helical domainからなるDeath domainを有する (図1)。TrkAとNGFは対照的な2:2の結合が知られていたが、p75とNGFは1:2で結合する。これは、p75との結合により、NGF二量体のうち、p75との非結合部位で立体構造変化が起こり、2つ目のp75との結合が阻害されるためである。p75の単量体がアポトーシスを誘導し、二量体化するとアポトーシス誘導作用が阻害されることが報告されているが、一つのモデルとして、神経栄養因子によるp75二量体の解離が、p75の活性化を引き起こすという説明がなされている。
ファミリー
腫瘍壊死因子(tumour necrosis factor, TNF)受容体スーパーファミリーに属する。(編集コメント:サブタイプや選択的スプライス型の有無など御記述ください)
全長のp75タンパク質とともに、少量ではあるが、4つのcystein rich repeatのうち3つを欠いたp75 short isoform (s-p75)も存在する。s-p75は、神経栄養因子と結合しないが、Trk受容体や狂犬病ウイルス糖タンパク質との結合能は保持されている。
発現
(編集コメント:組織発現、細胞内発現パタンなどについて御記述ください)
神経系での機能
Trk受容体は細胞生存や軸索伸長など細胞に対して正の機能を調節するのに対し、p75は細胞死や細胞生存の調節、軸索伸長の制御など、正と負両方の調節を行う。他にも、シュワン細胞の遊走、ミエリン形成、シナプス形成の制御や、感覚神経機能、カルシウム流入の調節などの機能を示す。p75の下流ではJNK、p53、NF-κB、TRAFs、SC-1、Rho、Racなどの分子が、多様な機能の制御に関わっている。
細胞死誘導
ニューロトロフィンと細胞死
p75は細胞内にDeath domainを有することから、細胞死を誘導する。当初、p75の強制発現により、細胞死が誘導され、NGF投与により抑制されることが示された。研究が進み、p75は神経栄養因子との結合によっても、細胞死を誘導することが示された。培養オリゴデンドロサイトはp75を発現しており、培養液中にNGFを添加すると細胞死が誘導される [4]。in vivoの実験において、最初にp75を介したリガンド依存性の細胞死が示されたのは、発生期の鳥類網膜神経細胞である [5]。中和抗体を用いてNGFやp75の活性を阻害すると、プログラム細胞死が抑制されたことから、内在性のNGFが網膜神経細胞死におけるプログラム細胞死を誘導することが示された。
NGFだけでなく、BDNFもまた、p75を介して神経細胞死を誘導する。交感神経細胞の培養系では、低濃度のNGF、KClで細胞生存が維持されるが、BDNFにより細胞死が誘導される(この細胞では、BDNFによるTrk受容体の活性化が誘導されない)。bdnf-/-マウス、p75-/-マウスの交感神経細胞は、WTに比べ、細胞死が抑制されることが示された。また、BDNF-/-マウスの交感神経細胞は、WTに比べ、細胞数が増加していることが示された。これらの結果から、内在性のBDNFも、p75を介した神経細胞死を誘導することが明らかになった。
神経栄養因子前駆体もp75と結合して細胞死を誘導する。神経栄養因子前駆体は、成熟神経栄養因子よりも低濃度でp75に結合し、細胞死を誘導する [3]。一方、Trk受容体に対する神経栄養因子の前駆体の親和性は、成熟神経栄養因子ほど高くない。神経栄養因子前駆体は、sortilinを介して、p75と結合する。sortilinは、分子量約95 kDaで、Vps10-domainを有する。sortilinは脳、脊髄、筋など様々な組織で発現している。神経栄養因子前駆体は、p75を介してアポトーシスを誘導するが、p75を発現する全ての細胞が神経栄養因子前駆体に反応するわけではない。sortilinがp75と共受容体を形成することが、神経栄養因子前駆体によるアポトーシスの誘導に必要である。sortilinとp75の両者を発現する上頸神経節神経細胞や血管平滑筋細胞(SM-11)では、proNGFの投与で細胞死が誘導される。
p75は神経栄養因子以外のリガンドとも結合する。神経毒性を示すプリオンペプチドPrPやβアミロイドと結合する。これらのペプチドはp75との結合を介して、細胞死を誘導する。また、p75は、狂犬病ウイルスのエンベロープ上の糖タンパク質と結合し、ウイルス受容体としても働く。
細胞死のシグナル伝達
細胞死誘導機構として、p75の下流でJNK/p53/Bax経路の活性化が報告されている。JNKの下流で、c-junのリン酸化、p53、Bad、Bimの活性化、ミトコンドリアへのBaxの移行とチトクロームcの放出、カスパーゼの活性化を介して神経細胞死が誘導される。さらに、JNKはFasリガンド の発現を誘導し、Fas受容体の活性化を介して神経細胞死を誘導する。
p75自体は触媒活性を持たないが、様々なアダプタータンパク質と結合し、下流シグナルを活性化する。p75のアダプタータンパク質であるneurotrophin receptor interacting factor (NRIF)、neurotrophin associated cell death executor (NADE)、neurotrophin receptor interacting melanoma-associated antigen (MAGE) homolog (NRAGE)、TNF receptor associated factors (TRAFs)は、単独で或いは協調して、JNK経路を活性化することで、p75依存性の細胞死を促進する。NRIFは組織全体に発現するzinc fingerタンパク質である。NRIF-/-マウスでは、網膜神経細胞におけるプログラム細胞死が抑制される。細胞死抑制の程度がp75-/-マウスやNGF-/-マウスと同程度であることから、p75がNRIFを介して細胞死を誘導することが推察される。
また、p75の活性化は、E3ユビキチンリガーゼであるTRAF6によるNRIF 63のユビキチン化を引き起こし、NRIFの核内移行を可能にする。加えて、NRIFの核内移行には、γ-セクレターゼによるp75 ICDの切断が必要である。NRIFとTRAF6の相互作用を抑制すると、NRIFの核内移行や、細胞死が抑制される。TRAF6やNRIFを欠損した交感神経細胞では、JNKの活性化が抑制される。NADEはNGF刺激によるp75の活性化を介したアポトーシスの誘導に関与する。内在性にp75を発現するPC12細胞やnnr5細胞において、NADEはNGF存在下でp75と結合し、細胞死を誘導する。BDNF、NT-3、NT-4/5刺激ではp75/NADEによる細胞死は誘導されない。NADEのみを強制発現しても細胞死は誘導されない。
NRAGEはMAGEファミリーに属するタンパク質で、交感神経前駆細胞において、NGFによる細胞死シグナルを伝達する。NRAGEを強制発現することで、細胞増殖が抑制される。
Schwann cell factor 1 (SC1)はzinc fingerタンパク質で、細胞周期の進行を抑制する。NGF刺激でp75が活性化されると、SC1は細胞質から核内に移行し、細胞増殖を抑制する。COS-7細胞の核内にSC1を発現させるとBrdUの取り込みが減少することが示されている [6]。
低分子量Gタンパク質であるRhoファミリー分子も、p75の下流で細胞死の誘導に関与するという報告がある。PC12細胞や交感神経細胞では、Cdc42の活性化がJNKの活性化に必要である。オリゴデンドロサイトでは、Racの活性化がp75を介した細胞死に必要である。
JNK経路の活性化以外によっても、p75を介した細胞死が誘導される。内在性にp75を発現する交感神経細胞において、NGF除去により、p75の活性化を介した細胞死が誘導される [7],[8]。この系では、p53ファミリーに属するp73が主要な役割を果たすと考えられている。発生期の神経細胞ではp73のtruncated isoform(deltaN-p73)が発現しているが、NGF除去により細胞死が誘導されるときには、その発現が減少していることが示された。NGF除去やp53強制発現により、細胞死が誘導されるが、このとき、deltaN-p73を発現させることで細胞死が抑制される。また、p73の全てのisoformを欠損したp73-/-マウスでは、発生期における交感神経の細胞死が有為に増加する。以上から、deltaN-p73が発生期におけるp75を介した細胞死を抑制することが示唆される。
細胞生存
神経栄養因子の結合により、p75の下流で活性化される分子として、NF-κBも報告されている。p75を介したNF-κBの活性化は、神経細胞生存を促す。NGFの結合により、p75とそのアダプタータンパク質であるTraf 6が結合する。Interleukin-1 receptor-associated kinase (IRAK)は、通常細胞質に局在するが、NGF刺激により、MyD88と結合し、受容体複合体にリクルートされる。MyD88は受容体複合体から解離し、IRAKはリン酸化され、活性化される。そして、非典型的タンパク質キナーゼC (atypical protein kinase C, aPKC)、p62がリクルートされる。さらに、aPKCの基質であるIκBキナーゼ (IKK)が活性化され、IκBがリン酸化を受けて分解され、NF-κBが核内で転写活性を示す [9]。一方で、NGF刺激により、TNF存在下におけるNF-κBの活性は増強するが、生理的な条件下では、NGFの結合によりNF-κBの活性化は誘導されないとする報告も存在し、議論の余地が残っている。
また、p75がTrk受容体を正に制御することが報告されている。内在性にTrkAとp75を発現しているPC12細胞において、NGF存在下、p75依存性にTrkのアダプタータンパク質であるShcのリン酸化が亢進することが示された。このとき、Trkのリン酸化その下流シグナルを伝達するAktのリン酸化が亢進していることから、p75はShcと結合し、Trk経路のシグナルを増強すると考えられている [10]。
軸索伸長の制御
p75は神経細胞死、細胞生存以外にも軸索伸長の制御を担うことが知られている。p75 exon III -/-マウスでは、交感神経と感覚神経の投射に異常が認められている [11]。野生型の成体マウスでは、上頸神経節から松果体への交感神経が投射しているが、p75 exon III-/-マウスでは、交感神経の投射が阻害されている。汗腺への交感神経の投射も阻害されている。これは、発生期における軸索伸長の異常が原因であると推察されている。また、このマウスでは、視床から大脳皮質への投射が障害されていることも示されている [12]。この投射経路は、発生期にsubplateの軸索を足場として利用すると考えられているが、p75exonIII-/-マウスでは、subplateの成長円錐が異常な形態(フィロポディアの減少)を示している。また、p75exonIII-/-マウスでは、subplateの軸索の一部が異常な投射を示している。これらの結果から、p75はin vivoで軸索の投射や伸長を制御することが示唆される。
内在性にp75を発現しているが、TrkAを発現していないニワトリ胚の繊毛神経細胞(編集コメント:これで正しいかご確認ください)において、NGF刺激により軸索伸長が促進される。この分子機構として、p75によるRhoの活性制御が示されている。低分子量Gタンパク質の一種であるRhoファミリーは、アクチン骨格系を制御する因子で、RhoA、Rac、Cdc42などが含まれる。活性型であるGTP結合型RhoAは軸索伸長を抑制する。p75はRhoAと結合し、RhoAの活性を誘導するが、NGFがp75に結合すると、RhoAの活性が抑制され、神経突起の伸展が促進されることが示されている [13]。p75によるRhoAの不活性化には、cAMP-cAMP依存性タンパク質キナーゼPKAシグナルが関与している。神経栄養因子がp75に結合すると、細胞内cAMP濃度が上昇し、PKAが活性化される。p75はPKAによるリン酸化を受けて、RhoAを含む様々な分子が集積している脂質ラフトに移行し、下流へのシグナル伝える [14]。
一方で、p75はミエリンによる軸索伸長阻害にも関与することが報告されている。p75-/-マウスでは、通常は軸索の伸長が制限されるミエリンに富んだ領域であっても、異常な軸索伸長が観察されている [15]。ミエリンに含まれる軸索伸長阻害因子として、myelin associated glycoprotein (MAG)、Nogo、oligodendrocyte glycoprotein (OMgp) などが存在する。これらの因子は構造は異なれど、全てNogo受容体 (NgR)に結合することが知られている。NgRはGPIアンカー型タンパク質で細胞内ドメインを持たない。そこで、p75がNgRと結合し、これらのミエリン由来軸索再生阻害因子のシグナルを細胞内に伝達する役割を担うことが明らかになった。この下流の分子機構には、p75を介したRhoの活性化が関与している。細胞内でRhoの活性はRho guanine nucleotide dissociation inhibitor (Rho-GDI)との結合により抑制されている。p75はRhoとRho-GDIの結合を解離することでRhoの活性化を誘導し、軸索伸長を阻害することが示されている [16]。
動物モデル
Leeらはジーンターゲッティングによりp75のexon3を欠損したマウスを作成した [17]。このマウスでは、全長のp75の発現は欠損しているが、p75の細胞外ドメインを欠いたshort isoform (s-p75)の発現が残っている。s-p75はNGFと結合しないが、TrkAと結合しうる。表現型として、生存率や繁殖に異常は認められないが、潰瘍などの皮膚の障害を生じることが知られている。また、カルシトニン遺伝子関連ペプチドやサブスタンスPを発現する末梢性感覚神経の障害を伴い、熱刺激に対する反応性が弱いことが報告されている。
一方、von Schackらは、p75のexon4を欠損したマウスを作成した [18]。このマウスは、当初s-p75とFL-p75両方を欠損したものと考えられていたが、後に細胞膜貫通領域と細胞内ドメインを含む遺伝子産物が残存していることが判明した。この断片化されたタンパク質は、アポトーシスを誘導することが後に示された。それ故、exon4欠損マウスでは、血管障害などの原因で約40%のマウスが死亡する。また、これ以前にもp75の細胞内ドメインを発現するトランスジェニックマウスでは、交感神経や末梢感覚神経の細胞数の減少が認められている。これは、Trkの不活性化ではなく、p75の細胞内ドメイン自体が細胞死誘導経路の活性化因子として働くためと考えられている。
p75の細胞内ドメインを過剰発現するマウスでは、大脳皮質の細胞数の減少と、交感神経、感覚神経の細胞数の減少が確認されている。このマウスにおいて、Trk受容体の発現や活性状態には変化が無いのにもかかわらず、細胞数が減少することから、p75の細胞内ドメインが細胞死の誘導を決定する要因であると示唆される。
疾患との関連
p75の発現は胎生期に限局しており、生後は発現が減少する。しかし、成体でも損傷や虚血、てんかん発作後などの病理的な条件下では発現が上昇する [19]。
アルツハイマー病はタウタンパク質の異常リン酸化や、amyloid beta (Aβ) の凝集を特徴とする疾患である。アルツハイマー病の大脳皮質神経細胞では、p75の発現が確認されている [20]。Aβ がp75と結合すると、JNK経路が活性化され、アポトーシスが誘導される。内在性にp75を発現している神経堤由来のメラニン細胞は、Aβの存在下、アポトーシスを起こす。
amyotrophic lateral sclerosis (ALS)患者では、頸髄運動神経でp75の発現上昇が報告されている。また、ALSモデルマウスであるSOD1変異マウスでは、腰髄運動神経におけるp75の発現が上昇している [21]。このマウスは、生後4ヶ月で死亡する。
pilocarpin投与によるてんかんモデル動物では、海馬、梨状葉、内嗅皮質において、p75の発現上昇と、これに関連した神経細胞死が確認されている。
皮質脊髄路の神経細胞において、軸索切断3日後、p75の発現が上昇する。これは、細胞死が起こるタイミングと一致する。NT-3抗体の投与により細胞死が抑制されることから、内在性のNT-3によるp75の活性化が細胞死を誘導することが示されている。
関連項目
参考文献
- ↑
Bibel, M., & Barde, Y.A. (2000).
Neurotrophins: key regulators of cell fate and cell shape in the vertebrate nervous system. Genes & development, 14(23), 2919-37. [PubMed:11114882] [WorldCat] [DOI] - ↑
Johnson, D., Lanahan, A., Buck, C.R., Sehgal, A., Morgan, C., Mercer, E., ..., & Chao, M. (1986).
Expression and structure of the human NGF receptor. Cell, 47(4), 545-54. [PubMed:3022937] [WorldCat] [DOI] - ↑ 3.0 3.1
Lee, R., Kermani, P., Teng, K.K., & Hempstead, B.L. (2001).
Regulation of cell survival by secreted proneurotrophins. Science (New York, N.Y.), 294(5548), 1945-8. [PubMed:11729324] [WorldCat] [DOI] - ↑
Casaccia-Bonnefil, P., Carter, B.D., Dobrowsky, R.T., & Chao, M.V. (1996).
Death of oligodendrocytes mediated by the interaction of nerve growth factor with its receptor p75. Nature, 383(6602), 716-9. [PubMed:8878481] [WorldCat] [DOI] - ↑
Frade, J.M., Rodríguez-Tébar, A., & Barde, Y.A. (1996).
Induction of cell death by endogenous nerve growth factor through its p75 receptor. Nature, 383(6596), 166-8. [PubMed:8774880] [WorldCat] [DOI] - ↑
Chittka, A., & Chao, M.V. (1999).
Identification of a zinc finger protein whose subcellular distribution is regulated by serum and nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America, 96(19), 10705-10. [PubMed:10485890] [PMC] [WorldCat] [DOI] - ↑
Aloyz, R.S., Bamji, S.X., Pozniak, C.D., Toma, J.G., Atwal, J., Kaplan, D.R., & Miller, F.D. (1998).
p53 is essential for developmental neuron death as regulated by the TrkA and p75 neurotrophin receptors. The Journal of cell biology, 143(6), 1691-703. [PubMed:9852160] [PMC] [WorldCat] [DOI] - ↑
Pozniak, C.D., Radinovic, S., Yang, A., McKeon, F., Kaplan, D.R., & Miller, F.D. (2000).
An anti-apoptotic role for the p53 family member, p73, during developmental neuron death. Science (New York, N.Y.), 289(5477), 304-6. [PubMed:10894779] [WorldCat] [DOI] - ↑
Reichardt, L.F. (2006).
Neurotrophin-regulated signalling pathways. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 361(1473), 1545-64. [PubMed:16939974] [PMC] [WorldCat] [DOI] - ↑
Epa, W.R., Markovska, K., & Barrett, G.L. (2004).
The p75 neurotrophin receptor enhances TrkA signalling by binding to Shc and augmenting its phosphorylation. Journal of neurochemistry, 89(2), 344-53. [PubMed:15056278] [WorldCat] [DOI] - ↑
Lee, K.F., Bachman, K., Landis, S., & Jaenisch, R. (1994).
Dependence on p75 for innervation of some sympathetic targets. Science (New York, N.Y.), 263(5152), 1447-9. [PubMed:8128229] [WorldCat] [DOI] - ↑
McQuillen, P.S., DeFreitas, M.F., Zada, G., & Shatz, C.J. (2002).
A novel role for p75NTR in subplate growth cone complexity and visual thalamocortical innervation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(9), 3580-93. [PubMed:11978834] [PMC] [WorldCat] [DOI] - ↑
Yamashita, T., Tucker, K.L., & Barde, Y.A. (1999).
Neurotrophin binding to the p75 receptor modulates Rho activity and axonal outgrowth. Neuron, 24(3), 585-93. [PubMed:10595511] [WorldCat] [DOI] - ↑
Higuchi, H., Yamashita, T., Yoshikawa, H., & Tohyama, M. (2003).
PKA phosphorylates the p75 receptor and regulates its localization to lipid rafts. The EMBO journal, 22(8), 1790-800. [PubMed:12682012] [PMC] [WorldCat] [DOI] - ↑
Walsh, G.S., Krol, K.M., Crutcher, K.A., & Kawaja, M.D. (1999).
Enhanced neurotrophin-induced axon growth in myelinated portions of the CNS in mice lacking the p75 neurotrophin receptor. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(10), 4155-68. [PubMed:10234043] [PMC] [WorldCat] - ↑
Yamashita, T., & Tohyama, M. (2003).
The p75 receptor acts as a displacement factor that releases Rho from Rho-GDI. Nature neuroscience, 6(5), 461-7. [PubMed:12692556] [WorldCat] [DOI] - ↑
Lee, K.F., Li, E., Huber, L.J., Landis, S.C., Sharpe, A.H., Chao, M.V., & Jaenisch, R. (1992).
Targeted mutation of the gene encoding the low affinity NGF receptor p75 leads to deficits in the peripheral sensory nervous system. Cell, 69(5), 737-49. [PubMed:1317267] [WorldCat] [DOI] - ↑
von Schack, D., Casademunt, E., Schweigreiter, R., Meyer, M., Bibel, M., & Dechant, G. (2001).
Complete ablation of the neurotrophin receptor p75NTR causes defects both in the nervous and the vascular system. Nature neuroscience, 4(10), 977-8. [PubMed:11559852] [WorldCat] [DOI] - ↑
Nykjaer, A., Willnow, T.E., & Petersen, C.M. (2005).
p75NTR--live or let die. Current opinion in neurobiology, 15(1), 49-57. [PubMed:15721744] [WorldCat] [DOI] - ↑
Mufson, E.J., & Kordower, J.H. (1992).
Cortical neurons express nerve growth factor receptors in advanced age and Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America, 89(2), 569-73. [PubMed:1309947] [PMC] [WorldCat] [DOI] - ↑
Lowry, K.S., Murray, S.S., McLean, C.A., Talman, P., Mathers, S., Lopes, E.C., & Cheema, S.S. (2001).
A potential role for the p75 low-affinity neurotrophin receptor in spinal motor neuron degeneration in murine and human amyotrophic lateral sclerosis. Amyotrophic lateral sclerosis and other motor neuron disorders : official publication of the World Federation of Neurology, Research Group on Motor Neuron Diseases, 2(3), 127-34. [PubMed:11771768] [WorldCat]
(執筆者:藤田幸、山下俊英 担当編集委員:村上富士夫)