「SNAP-25」の版間の差分
細 →機能 |
細 →構造 |
||
| (2人の利用者による、間の8版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/coco 高橋 正身]</font><br> | <font size="+1">[http://researchmap.jp/coco 高橋 正身]</font><br> | ||
''北里大学医学部''<br> | ''北里大学医学部''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年1月29日 原稿完成日:2016年月日<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
| 10行目: | 10行目: | ||
{{box|text= | {{box|text= | ||
SNAP-25は脳や内分泌細胞に特異的に発現する206アミノ酸からなるタンパク質で、細胞膜に局在するt-SNAREタンパク質として細胞膜で起こる開口放出に不可欠な役割を果たしている。分子内に二つのSNAREモチーフを持ち、開口放出に不可欠なSNARE複合体を構成する4本のへリックスのうち、QbおよびQcの2本のへリックスを供出する。SNAP-25は開口放出による神経伝達物質や水溶性ホルモンの分泌に関わると共に、細胞膜へのタンパク質の組み込みや細胞膜の伸長などにも関与している。さらにイオンチャネルに結合し、その機能を調節する働きも持っている。SNAP-25の機能はリン酸化やパルミトイル化などの翻訳後修飾や、活性型Gタンパク質やシナプトタグミンなどの調節タンパク質の結合によって制御されている。SNAP-25の非翻訳領域の遺伝子変異と注意欠陥・多動性障害や統合失調症などとの関連が示されており、少なくとも一部はSNAP-25タンパク質の発現量の低下が原因である可能性が考えられる。さらに遺伝子改変マウスを用いた研究やヒト患者の解析から、てんかん発症との関わりも示されている。 | SNAP-25は脳や内分泌細胞に特異的に発現する206アミノ酸からなるタンパク質で、細胞膜に局在するt-SNAREタンパク質として細胞膜で起こる開口放出に不可欠な役割を果たしている。分子内に二つのSNAREモチーフを持ち、開口放出に不可欠なSNARE複合体を構成する4本のへリックスのうち、QbおよびQcの2本のへリックスを供出する。SNAP-25は開口放出による神経伝達物質や水溶性ホルモンの分泌に関わると共に、細胞膜へのタンパク質の組み込みや細胞膜の伸長などにも関与している。さらにイオンチャネルに結合し、その機能を調節する働きも持っている。SNAP-25の機能はリン酸化やパルミトイル化などの翻訳後修飾や、活性型Gタンパク質やシナプトタグミンなどの調節タンパク質の結合によって制御されている。SNAP-25の非翻訳領域の遺伝子変異と注意欠陥・多動性障害や統合失調症などとの関連が示されており、少なくとも一部はSNAP-25タンパク質の発現量の低下が原因である可能性が考えられる。さらに遺伝子改変マウスを用いた研究やヒト患者の解析から、てんかん発症との関わりも示されている。 | ||
}} | }} | ||
| 58行目: | 16行目: | ||
==イントロダクション== | ==イントロダクション== | ||
脳特異的に発現する遺伝子をスクリーニングする過程で、206アミノ酸からなり[[シナプス前膜]]に局在する25kDaのタンパク質として同定され、[[synaptosomal-associated protein 25]]と命名された<ref name=ref1><pubmed>2592413</pubmed></ref>。一方SNAP-25は新規に合成され速い[[軸索流]]で運ばれる主要なタンパク質としても同定されている<ref name=ref2><pubmed>1281490</pubmed></ref>。[[CHO細胞]] | 脳特異的に発現する遺伝子をスクリーニングする過程で、206アミノ酸からなり[[シナプス前膜]]に局在する25kDaのタンパク質として同定され、[[synaptosomal-associated protein 25]]と命名された<ref name=ref1><pubmed>2592413</pubmed></ref>。一方SNAP-25は新規に合成され速い[[軸索流]]で運ばれる主要なタンパク質としても同定されている<ref name=ref2><pubmed>1281490</pubmed></ref>。[[CHO細胞]]を用いて[[ゴルジ小胞]]輸送を研究していたRothmanらは、ゴルジ体の小胞輸送に必須なタンパク質である[[NSF]]/[[αSNAP]]複合体に結合するタンパク質としてSNAP-25および[[シンタキシン]]1、[[VAMP-2]]を脳から単離し[[SNAP receptors]] ([[SNAREs]]) と名付けた<ref name=ref3><pubmed>8455717</pubmed></ref>。X線解析の結果これらSNAREタンパク質はそれぞれSNAREモチーフと呼ばれる構造を持ち、SNARE複合体を形成することが示された<ref name=ref4><pubmed>9759724</pubmed></ref>。 | ||
SNAP-25がE型[[ボツリヌス毒素]]によって切断を受けるとSNARE複合体形成が阻害され[[開口放出]] | SNAP-25がE型[[ボツリヌス毒素]]によって切断を受けるとSNARE複合体形成が阻害され[[開口放出]]機能が阻害されることや<ref name=ref5><pubmed>15769746</pubmed></ref>、SNAP-25の[[ノックアウトマウス]]ではCa<sup>2+</sup>誘発性の神経伝達物質放出が見られないことなどから<ref name=ref6><pubmed>11753414</pubmed></ref>、SNAP-25はシンタキシン1やVAMP-2と同様に開口放出による神経伝達物質放出に必須なタンパク質であると結論されている。さらにSNAP-25は開口放出による細胞膜へのタンパク質の組み込みや細胞膜の伸展のほか、[[Caチャネル]]への直接結合を介したチャネル機能制御などにも関わっていると考えられている。 | ||
==サブファミリー== | ==サブファミリー== | ||
SNAP-25の翻訳領域は8つのエクソンから構成されるが、4億年前に起こった[[wikipedia:ja:硬骨魚|硬骨魚]]の出現初期にエクソン5の重複が起こり、SNAP-25aとSNAP-25bのスプライシングバリアントが作られた<ref name=ref7><pubmed>8112622</pubmed></ref>。SNAP-25のアミノ酸配列は良く保存されており、[[ヒト]]、[[マウス]]、[[ニワトリ]]では100%同一である。一方、[[wikipedia:ja:軟骨魚類|軟骨魚類]]である[[シビレエイ]](Torpedo)および[[wikipedia:ja:無脊椎動物|無脊椎動物]]である[[ショウジョウバエ]]のSNAP-25 はマウスのアミノ酸配列とそれぞれ81% および61% 同一である。SNAP-25の発現は神経系や[[内分泌]]細胞に特異的に見られるが<ref name=ref8><pubmed>21280044</pubmed></ref>、ユビキタスに発現するファミリー分子として[[SNAP-23]]が見出されている<ref name=ref9><pubmed>8663154</pubmed></ref>。 | SNAP-25の翻訳領域は8つのエクソンから構成されるが、4億年前に起こった[[wikipedia:ja:硬骨魚|硬骨魚]]の出現初期にエクソン5の重複が起こり、SNAP-25aとSNAP-25bのスプライシングバリアントが作られた<ref name=ref7><pubmed>8112622</pubmed></ref>。SNAP-25のアミノ酸配列は良く保存されており、[[ヒト]]、[[マウス]]、[[ニワトリ]]では100%同一である。一方、[[wikipedia:ja:軟骨魚類|軟骨魚類]]である[[シビレエイ]](Torpedo)および[[wikipedia:ja:無脊椎動物|無脊椎動物]]である[[ショウジョウバエ]]のSNAP-25 はマウスのアミノ酸配列とそれぞれ81% および61% 同一である。SNAP-25の発現は神経系や[[内分泌]]細胞に特異的に見られるが<ref name=ref8><pubmed>21280044</pubmed></ref>、ユビキタスに発現するファミリー分子として[[SNAP-23]]が見出されている<ref name=ref9><pubmed>8663154</pubmed></ref>。 | ||
これら3種類のアイソフォームはいずれも神経伝達物質放出を引き起こす機能を持っているが、SNAP-25bのみが[[シナプトタグミン1]]および[[シナプトタグミン2|2]]と結合してCa<sup>2+</sup>依存的に起こる同期した放出を引き起こすことができる<ref name=ref10><pubmed>12859899</pubmed></ref> <ref name=ref11><pubmed>17728451</pubmed></ref>。それに対してSNAP-23は[[シナプトタグミン7]] | これら3種類のアイソフォームはいずれも神経伝達物質放出を引き起こす機能を持っているが、SNAP-25bのみが[[シナプトタグミン1]]および[[シナプトタグミン2|2]]と結合してCa<sup>2+</sup>依存的に起こる同期した放出を引き起こすことができる<ref name=ref10><pubmed>12859899</pubmed></ref> <ref name=ref11><pubmed>17728451</pubmed></ref>。それに対してSNAP-23は[[シナプトタグミン7]]と結合し、持続的に起こる同期しない放出に関わることが示されている<ref name=ref12><pubmed>25422940</pubmed></ref>。SNAP-25aは進化の過程でSNAP-23とSNAP-25が分かれた後に作られている。SNAP-25aはSNAP-23と同様に同期した放出を引き起こすことはない点でSNAP-23と似ているが、脳においてSNAP-23とどのような機能的な違いを持っているかについては明らではない<ref name=ref8 />。 | ||
分子内に2つのSNAREモチーフを持つタンパク質として[[SNAP-29]]<ref name=ref13><pubmed>9852078</pubmed></ref>と[[SNAP-47]]<ref name=ref14><pubmed>16621800</pubmed></ref>が知られている。これらのタンパク質は[[パルミトイル化]]された[[システイン]]残基を持っていない点でSNAP-25やSNAP-23とは異なるが、細胞内小胞輸送に関わる可能性が示唆されている。 | 分子内に2つのSNAREモチーフを持つタンパク質として[[SNAP-29]]<ref name=ref13><pubmed>9852078</pubmed></ref>と[[SNAP-47]]<ref name=ref14><pubmed>16621800</pubmed></ref>が知られている。これらのタンパク質は[[パルミトイル化]]された[[システイン]]残基を持っていない点でSNAP-25やSNAP-23とは異なるが、細胞内小胞輸送に関わる可能性が示唆されている。 | ||
==構造== | ==構造== | ||
SNAP-25およびSNAP-23はN末側およびC末側の2か所にSNAREモチーフを持っている。VAMP- | SNAP-25およびSNAP-23はN末側およびC末側の2か所にSNAREモチーフを持っている。VAMP-2(シナプトブレビン)、シンタキシンと共にSNARE複合体を形成し、それに際してはQcおよびQbの2本のへリックスを供出する('''図1''')<ref name=ref4 /> <ref name=ref15><pubmed>16038056</pubmed></ref> <ref name=ref16><pubmed>16912714</pubmed></ref>。 | ||
その他、SNAP-25結合タンパク質として[[Snapin]]が同定されている。[[線虫]](''[[C. elegans]]'' )を用いた研究ではSnapinはSNAP-25に結合してSNARE複合体を安定化させる役割を持つと考えられているが<ref name=ref32><pubmed>23469084</pubmed></ref>、SNAP-25上の結合部位は特定されていない。 | |||
===パルミトイル化=== | ===パルミトイル化=== | ||
| 78行目: | 36行目: | ||
===リン酸化=== | ===リン酸化=== | ||
Ser187が[[プロテインキナーゼC]]([[PKC]])によってリン酸化されるとシンタキシンとの結合が強まり、Ca<sup>2+</sup>非依存的なシナプトタグミン1との結合が低下する<ref name=ref25><pubmed>8662851</pubmed></ref> <ref name=ref26><pubmed>17325194</pubmed></ref>。SNAP-25は[[cAMP依存性タンパク質キナーゼ]]([[PKA]] | Ser187が[[プロテインキナーゼC]]([[PKC]])によってリン酸化されるとシンタキシンとの結合が強まり、Ca<sup>2+</sup>非依存的なシナプトタグミン1との結合が低下する<ref name=ref25><pubmed>8662851</pubmed></ref> <ref name=ref26><pubmed>17325194</pubmed></ref>。SNAP-25は[[cAMP依存性タンパク質キナーゼ]]([[PKA]])によってもThr138がリン酸化されるが、この場合にはシンタキシンおよびシナプトタグミン1との結合はいずれも抑制される<ref name=ref26 />。[[セロトニン]]などの[[メタボリックレセプター]]が活性化されると、開口放出による神経伝達物質放出が抑制されることが知られている。活性化型[[Gタンパク質]]である[[Gβγ]]はSNAP-25と直接結合し、結合部位としてAsp99, Lys102, Arg198, Lys201を含む膜に近い部位と、Arg135、Arg136、Arg161、Arg142を含む2か所が同定され、セロトニンレセプターの活性化に伴う放出抑制にはC末端に近いArg198, Lys201へのGβγの結合が関与することが示されている<ref name=ref27><pubmed>22962332</pubmed></ref>。 | ||
===ボツリヌス毒素による分解=== | ===ボツリヌス毒素による分解=== | ||
| 89行目: | 47行目: | ||
SNAP-25はt-SNAREタンパク質として開口放出による[[神経伝達物質]]放出や水溶性[[ホルモン]]の分泌に不可欠な役割を果たしている<ref name=ref4 /> <ref name=ref15 /> <ref name=ref16 />。 | SNAP-25はt-SNAREタンパク質として開口放出による[[神経伝達物質]]放出や水溶性[[ホルモン]]の分泌に不可欠な役割を果たしている<ref name=ref4 /> <ref name=ref15 /> <ref name=ref16 />。 | ||
SNAREタンパク質による神経伝達物質放出はCa<sup>2+</sup>[[イオン]]によって誘発され、その場合のCa<sup>2+</sup>センサーとしてはシナプトタグミンが同定されている<ref name=ref28><pubmed>24183019</pubmed></ref>。シナプトタグミン1との結合部位としてAsp51, Glu52, Glu55<ref name=ref29><pubmed>16267273</pubmed></ref>およびAsp172, Asp179, Asp186, Asp193<ref name=ref30><pubmed>12062043</pubmed></ref>が同定されている。いずれも変異を加えると[[PC12細胞]]からの放出が抑制される。[[膜容量測定法|膜容量測定]]による時間分解能の良いアッセイではAsp51, Glu52, Glu55がCa<sup>2+</sup>依存性放出に必須でAsp172, Asp179, Asp186, Asp193はフュージョン誘発にあまり影響しないが、[[放出可能プール]](readily releasable pool)を少し減少させる ことが示されている<ref name=ref31><pubmed>24005294</pubmed></ref>。 | SNAREタンパク質による神経伝達物質放出はCa<sup>2+</sup>[[イオン]]によって誘発され、その場合のCa<sup>2+</sup>センサーとしてはシナプトタグミンが同定されている<ref name=ref28><pubmed>24183019</pubmed></ref>。シナプトタグミン1との結合部位としてAsp51, Glu52, Glu55<ref name=ref29><pubmed>16267273</pubmed></ref>およびAsp172, Asp179, Asp186, Asp193<ref name=ref30><pubmed>12062043</pubmed></ref>が同定されている。いずれも変異を加えると[[PC12細胞]]からの放出が抑制される。[[膜容量測定法|膜容量測定]]による時間分解能の良いアッセイではAsp51, Glu52, Glu55がCa<sup>2+</sup>依存性放出に必須でAsp172, Asp179, Asp186, Asp193はフュージョン誘発にあまり影響しないが、[[放出可能プール]](readily releasable pool)を少し減少させる ことが示されている<ref name=ref31><pubmed>24005294</pubmed></ref>。<u>編集部コメント:この段落は構造のところから移しました。</u> | ||
SNARE複合体形成に際しては、構成する4本のへリックスの中でQcおよびQbの2本のへリックスを供出する。SNAP-25がBoNT/Eで切断を受けると神経伝達物質放出が見られなくなることや<ref name=ref5 />、SNAP-25の[[KOマウス]]ではCa<sup>2+</sup>誘発性の神経伝達物質放出が見られないこと<ref name=ref6 />、SNAP-25とsyntaxinを組み込んだリポゾームをVAMP-2を組み込んだ[[リポゾーム]]を混ぜるとリポゾーム同士の[[膜融合]]が起こることなどから<ref name=ref33><pubmed>25997356</pubmed></ref>、SNAP-25は開口放出による神経伝達物質放出に必須なタンパク質であると結論されている。SNAP-25は内分泌細胞にも発現し、水溶性ホルモン分泌に不可欠な役割を果たしている。 | SNARE複合体形成に際しては、構成する4本のへリックスの中でQcおよびQbの2本のへリックスを供出する。SNAP-25がBoNT/Eで切断を受けると神経伝達物質放出が見られなくなることや<ref name=ref5 />、SNAP-25の[[KOマウス]]ではCa<sup>2+</sup>誘発性の神経伝達物質放出が見られないこと<ref name=ref6 />、SNAP-25とsyntaxinを組み込んだリポゾームをVAMP-2を組み込んだ[[リポゾーム]]を混ぜるとリポゾーム同士の[[膜融合]]が起こることなどから<ref name=ref33><pubmed>25997356</pubmed></ref>、SNAP-25は開口放出による神経伝達物質放出に必須なタンパク質であると結論されている。SNAP-25は内分泌細胞にも発現し、水溶性ホルモン分泌に不可欠な役割を果たしている。 | ||
開口放出は小胞内の内容物を放出する以外にも、小胞膜上のタンパク質を細胞膜に組み込んだり、細胞膜を伸長させたりする機能も持っている。SNAP-25は[[電位依存性カルシウムチャネル]]や[[アクアポリン]]などのチャネルタンパク質や[[NMDA型グルタミン酸|NMDA型]]および[[AMPA型グルタミン酸]] | 開口放出は小胞内の内容物を放出する以外にも、小胞膜上のタンパク質を細胞膜に組み込んだり、細胞膜を伸長させたりする機能も持っている。SNAP-25は[[電位依存性カルシウムチャネル]]や[[アクアポリン]]などのチャネルタンパク質や[[NMDA型グルタミン酸|NMDA型]]および[[AMPA型グルタミン酸]]レセプターなどの細胞膜への組み込みに関与していることが示されている<ref name=ref34><pubmed>11276228</pubmed></ref> <ref name=ref35><pubmed>11487629</pubmed></ref> <ref name=ref36><pubmed>17624753</pubmed></ref> <ref name=ref37><pubmed>18162553</pubmed></ref> <ref name=ref38><pubmed>19679075</pubmed></ref> <ref name=ref39><pubmed>20053906</pubmed></ref> <ref name=ref40><pubmed>20118925</pubmed></ref> <ref name=ref41><pubmed>25565955</pubmed></ref>。 | ||
さらにSNAP-25は[[成長円錐]]にも局在し、成長円錐の伸長に関わるほか<ref name=ref42><pubmed>19805073</pubmed></ref>、[[アダプタータンパク質]]である[[p140Cap]]と相互作用して[[樹状突起スパイン]]の形成にも関与することが示されている<ref name=ref43><pubmed>23868368</pubmed></ref>。しかしSNAP-25のノックアウトマウスでは、出生時に脳の構造に異常は認められないことから、これらの機能は出生後に起こる[[シナプス可塑性]]に関わっている可能性が高い。 | さらにSNAP-25は[[成長円錐]]にも局在し、成長円錐の伸長に関わるほか<ref name=ref42><pubmed>19805073</pubmed></ref>、[[アダプタータンパク質]]である[[p140Cap]]と相互作用して[[樹状突起スパイン]]の形成にも関与することが示されている<ref name=ref43><pubmed>23868368</pubmed></ref>。しかしSNAP-25のノックアウトマウスでは、出生時に脳の構造に異常は認められないことから、これらの機能は出生後に起こる[[シナプス可塑性]]に関わっている可能性が高い。 | ||
2016年2月1日 (月) 17:29時点における版
英語名:synaptosomal-associated protein 25
SNAP-25は脳や内分泌細胞に特異的に発現する206アミノ酸からなるタンパク質で、細胞膜に局在するt-SNAREタンパク質として細胞膜で起こる開口放出に不可欠な役割を果たしている。分子内に二つのSNAREモチーフを持ち、開口放出に不可欠なSNARE複合体を構成する4本のへリックスのうち、QbおよびQcの2本のへリックスを供出する。SNAP-25は開口放出による神経伝達物質や水溶性ホルモンの分泌に関わると共に、細胞膜へのタンパク質の組み込みや細胞膜の伸長などにも関与している。さらにイオンチャネルに結合し、その機能を調節する働きも持っている。SNAP-25の機能はリン酸化やパルミトイル化などの翻訳後修飾や、活性型Gタンパク質やシナプトタグミンなどの調節タンパク質の結合によって制御されている。SNAP-25の非翻訳領域の遺伝子変異と注意欠陥・多動性障害や統合失調症などとの関連が示されており、少なくとも一部はSNAP-25タンパク質の発現量の低下が原因である可能性が考えられる。さらに遺伝子改変マウスを用いた研究やヒト患者の解析から、てんかん発症との関わりも示されている。
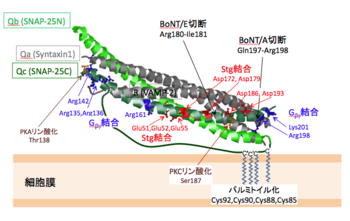
SNAP-25のN末側(Qb)およびC末側(Qc)のSNAREモチーフを緑色で、シンタキシン1およびVAMP-2のSNAREモチーフを灰色で示してある。各へリックスのN末端はすべて左側にある。
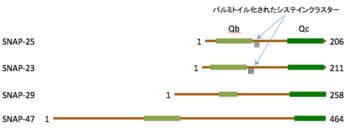
分子内に2つのSNAREモチーフを持っている。SNAP-25とSNAP-23は分子の中央付近にパルミトイル化されたシステインクラスターを持ち、細胞膜に係留されている。
イントロダクション
脳特異的に発現する遺伝子をスクリーニングする過程で、206アミノ酸からなりシナプス前膜に局在する25kDaのタンパク質として同定され、synaptosomal-associated protein 25と命名された[1]。一方SNAP-25は新規に合成され速い軸索流で運ばれる主要なタンパク質としても同定されている[2]。CHO細胞を用いてゴルジ小胞輸送を研究していたRothmanらは、ゴルジ体の小胞輸送に必須なタンパク質であるNSF/αSNAP複合体に結合するタンパク質としてSNAP-25およびシンタキシン1、VAMP-2を脳から単離しSNAP receptors (SNAREs) と名付けた[3]。X線解析の結果これらSNAREタンパク質はそれぞれSNAREモチーフと呼ばれる構造を持ち、SNARE複合体を形成することが示された[4]。
SNAP-25がE型ボツリヌス毒素によって切断を受けるとSNARE複合体形成が阻害され開口放出機能が阻害されることや[5]、SNAP-25のノックアウトマウスではCa2+誘発性の神経伝達物質放出が見られないことなどから[6]、SNAP-25はシンタキシン1やVAMP-2と同様に開口放出による神経伝達物質放出に必須なタンパク質であると結論されている。さらにSNAP-25は開口放出による細胞膜へのタンパク質の組み込みや細胞膜の伸展のほか、Caチャネルへの直接結合を介したチャネル機能制御などにも関わっていると考えられている。
サブファミリー
SNAP-25の翻訳領域は8つのエクソンから構成されるが、4億年前に起こった硬骨魚の出現初期にエクソン5の重複が起こり、SNAP-25aとSNAP-25bのスプライシングバリアントが作られた[7]。SNAP-25のアミノ酸配列は良く保存されており、ヒト、マウス、ニワトリでは100%同一である。一方、軟骨魚類であるシビレエイ(Torpedo)および無脊椎動物であるショウジョウバエのSNAP-25 はマウスのアミノ酸配列とそれぞれ81% および61% 同一である。SNAP-25の発現は神経系や内分泌細胞に特異的に見られるが[8]、ユビキタスに発現するファミリー分子としてSNAP-23が見出されている[9]。
これら3種類のアイソフォームはいずれも神経伝達物質放出を引き起こす機能を持っているが、SNAP-25bのみがシナプトタグミン1および2と結合してCa2+依存的に起こる同期した放出を引き起こすことができる[10] [11]。それに対してSNAP-23はシナプトタグミン7と結合し、持続的に起こる同期しない放出に関わることが示されている[12]。SNAP-25aは進化の過程でSNAP-23とSNAP-25が分かれた後に作られている。SNAP-25aはSNAP-23と同様に同期した放出を引き起こすことはない点でSNAP-23と似ているが、脳においてSNAP-23とどのような機能的な違いを持っているかについては明らではない[8]。
分子内に2つのSNAREモチーフを持つタンパク質としてSNAP-29[13]とSNAP-47[14]が知られている。これらのタンパク質はパルミトイル化されたシステイン残基を持っていない点でSNAP-25やSNAP-23とは異なるが、細胞内小胞輸送に関わる可能性が示唆されている。
構造
SNAP-25およびSNAP-23はN末側およびC末側の2か所にSNAREモチーフを持っている。VAMP-2(シナプトブレビン)、シンタキシンと共にSNARE複合体を形成し、それに際してはQcおよびQbの2本のへリックスを供出する(図1)[4] [15] [16]。
その他、SNAP-25結合タンパク質としてSnapinが同定されている。線虫(C. elegans )を用いた研究ではSnapinはSNAP-25に結合してSNARE複合体を安定化させる役割を持つと考えられているが[17]、SNAP-25上の結合部位は特定されていない。
パルミトイル化
シンタキシンやVAMP-2とは異なり細胞膜を貫通するへリックス構造は持っていないが、分子の中央部付近にパルミトイル化されたシステインクラスターを有しており、細胞膜に係留されている[2] [18] [19]。パルミトイル化はダイナミックに制御されており[20]、パルミトイル化にはDHHCファミリーS-パルミトイルアシル転移酵素遺伝子が、脱パルミトイル化にはタンパク質パルミトイルチオエステラーゼ1が関わっている[21]。
リン酸化
Ser187がプロテインキナーゼC(PKC)によってリン酸化されるとシンタキシンとの結合が強まり、Ca2+非依存的なシナプトタグミン1との結合が低下する[22] [23]。SNAP-25はcAMP依存性タンパク質キナーゼ(PKA)によってもThr138がリン酸化されるが、この場合にはシンタキシンおよびシナプトタグミン1との結合はいずれも抑制される[23]。セロトニンなどのメタボリックレセプターが活性化されると、開口放出による神経伝達物質放出が抑制されることが知られている。活性化型Gタンパク質であるGβγはSNAP-25と直接結合し、結合部位としてAsp99, Lys102, Arg198, Lys201を含む膜に近い部位と、Arg135、Arg136、Arg161、Arg142を含む2か所が同定され、セロトニンレセプターの活性化に伴う放出抑制にはC末端に近いArg198, Lys201へのGβγの結合が関与することが示されている[24]。
ボツリヌス毒素による分解
SNAP-25のC末端付近のGln197-Arg198、Arg180-Ile181およびArg198-Ala199間のペプチド結合がA型(BoNT/A)、E型(BoNT/E)およびC型ボツリヌス毒素(BoNT/C)によって特異的に切断される。マウスのSNAP-23はBoNT/AやBoNT/Eで切断されるがヒトのSNAP-23は切断されない[25]。SNAP-25がBoNT/Eで切断を受けると開口放出による神経伝達物質放出が抑制され、BoNT/AでC末が切断されると放出のCa2+依存性が変化する[26] [27]。これらのことからSNAP-25のC末端付近の構造はSNAP-25の機能にとって不可欠な役割を果たしていると考えられている。SNAP-25のC末端付近にあるArg198やLys201に変異を加えて正電荷を無くすと放出速度や放出頻度の低下が起こる[28]。
発現
SNAP-25は脳と内分泌細胞に発現するが[1]外分泌細胞での発現は確認されていない。それに対しSNAP-23は脳を含めユビキタスに発現している[9]。脳でのSNAP-25a、SNAP-25bおよびSNAP-23の局在は大きく異なっている。SNAP-25bは脳全体にわたってシナプスが豊富な部位に多く発現しているが、線維束にも見いだされている。それに対しSNAP-25aとSNAP-23は脳の特定の領域にかたよって発現している[8]。SNAP-23の発現量は発達に伴いほとんど変化しないが、SNAP-25bは生後数週間に発現量が大きく増加する。それに対してSNAP-25aは生後の発達期に一時的に発現が高まる[8]。SNAP-25は生後発達以降に重要な役割を果たしており、SNAP-25のノックアウトマウスは胎生期の発達には特に異常は認められていないが、出生直後に呼吸不全で死亡する[6]。
機能
SNAP-25はt-SNAREタンパク質として開口放出による神経伝達物質放出や水溶性ホルモンの分泌に不可欠な役割を果たしている[4] [15] [16]。
SNAREタンパク質による神経伝達物質放出はCa2+イオンによって誘発され、その場合のCa2+センサーとしてはシナプトタグミンが同定されている[29]。シナプトタグミン1との結合部位としてAsp51, Glu52, Glu55[30]およびAsp172, Asp179, Asp186, Asp193[31]が同定されている。いずれも変異を加えるとPC12細胞からの放出が抑制される。膜容量測定による時間分解能の良いアッセイではAsp51, Glu52, Glu55がCa2+依存性放出に必須でAsp172, Asp179, Asp186, Asp193はフュージョン誘発にあまり影響しないが、放出可能プール(readily releasable pool)を少し減少させる ことが示されている[32]。編集部コメント:この段落は構造のところから移しました。
SNARE複合体形成に際しては、構成する4本のへリックスの中でQcおよびQbの2本のへリックスを供出する。SNAP-25がBoNT/Eで切断を受けると神経伝達物質放出が見られなくなることや[5]、SNAP-25のKOマウスではCa2+誘発性の神経伝達物質放出が見られないこと[6]、SNAP-25とsyntaxinを組み込んだリポゾームをVAMP-2を組み込んだリポゾームを混ぜるとリポゾーム同士の膜融合が起こることなどから[33]、SNAP-25は開口放出による神経伝達物質放出に必須なタンパク質であると結論されている。SNAP-25は内分泌細胞にも発現し、水溶性ホルモン分泌に不可欠な役割を果たしている。
開口放出は小胞内の内容物を放出する以外にも、小胞膜上のタンパク質を細胞膜に組み込んだり、細胞膜を伸長させたりする機能も持っている。SNAP-25は電位依存性カルシウムチャネルやアクアポリンなどのチャネルタンパク質やNMDA型およびAMPA型グルタミン酸レセプターなどの細胞膜への組み込みに関与していることが示されている[34] [35] [36] [37] [38] [39] [40] [41]。
さらにSNAP-25は成長円錐にも局在し、成長円錐の伸長に関わるほか[42]、アダプタータンパク質であるp140Capと相互作用して樹状突起スパインの形成にも関与することが示されている[43]。しかしSNAP-25のノックアウトマウスでは、出生時に脳の構造に異常は認められないことから、これらの機能は出生後に起こるシナプス可塑性に関わっている可能性が高い。
SNAP-25はイオンチャネルの機能制御にも直接関わることも知られており、P/Q型、N型およびT型カルシウムチャネルなどに結合し[44]、不活性化の電位依存性をシフトさせたり[45] [46]カリウムチャネル機能の制御に関わることが示されている[47] [48] [49]。
疾患との関連
SNAP-25の3' 側および5’側の非翻訳領域の1塩基変異が、注意欠陥・多動性障害(ADHD)と関連があることが統計学的解析から示されている[50] [51] [52]。
SNAP-25を含む領域の染色体欠失を起こした自然発症のColobomaマウスはSNAP-25の発現が半減し多動性を示す[53]。しかしSNAP-25のノックアウトマウスのヘテロ接合体はSNAP-25の発現量が半減しているが多動は示さないことから[6]、多動性の発現はSNAP-25の発現低下のみに起因するものではないと考えられる。3' 側あるいは5’側の非翻訳領域の一塩基変異が線維筋痛症患者で見られる精神症状や[54]、ADHD患者などで見られる衝動性にも関連が見出されている[55]。さらに健常人の気質に関してもSNAP-25の一塩基多型との相関が見られる[56]。
非翻訳領域の変異の一部はSNAP-25の発現低下を引き起こして表現型を表している可能性がある[57]。統合失調症や躁病患者の脳では、前頭皮質や海馬の異なる部域でSNAP-25の発現低下が見られる[58] [59] [60]。脳血管性認知症の脳でSNAP-25の量が低下している[61]。自閉症患者の認知機能の低下にSNAP-25の発現低下が関係している[62]。
SNAP-25KOマウスのヘテロ接合体では、重篤ではないが脳波に異常発火が見られる[63]。SNAP-25bをSNAP-25aに置き換えたマウス[64]やリン酸化部位に変異を加えたマウスでは[65]SNAP-25の発現低下と機能低下が起こっているが、生後3週くらいからてんかん発作を多発するようになる。重篤な全身発作を多発するヒトの患者でVal48がPheに変異していることが見出されている[66]。いずれの場合も、てんかん発症がSNAP-25のどのような機能の異常に起因しているかは明らかではない。
関連項目
参考文献
- ↑ 1.0 1.1
Oyler, G.A., Higgins, G.A., Hart, R.A., Battenberg, E., Billingsley, M., Bloom, F.E., & Wilson, M.C. (1989).
The identification of a novel synaptosomal-associated protein, SNAP-25, differentially expressed by neuronal subpopulations. The Journal of cell biology, 109(6 Pt 1), 3039-52. [PubMed:2592413] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1
Hess, D.T., Slater, T.M., Wilson, M.C., & Skene, J.H. (1992).
The 25 kDa synaptosomal-associated protein SNAP-25 is the major methionine-rich polypeptide in rapid axonal transport and a major substrate for palmitoylation in adult CNS. The Journal of neuroscience : the official journal of the Society for Neuroscience, 12(12), 4634-41. [PubMed:1281490] [WorldCat] - ↑
Söllner, T., Whiteheart, S.W., Brunner, M., Erdjument-Bromage, H., Geromanos, S., Tempst, P., & Rothman, J.E. (1993).
SNAP receptors implicated in vesicle targeting and fusion. Nature, 362(6418), 318-24. [PubMed:8455717] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Sutton, R.B., Fasshauer, D., Jahn, R., & Brunger, A.T. (1998).
Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 A resolution. Nature, 395(6700), 347-53. [PubMed:9759724] [WorldCat] [DOI] - ↑ 5.0 5.1
Salaün, C., Gould, G.W., & Chamberlain, L.H. (2005).
Lipid raft association of SNARE proteins regulates exocytosis in PC12 cells. The Journal of biological chemistry, 280(20), 19449-53. [PubMed:15769746] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3
Washbourne, P., Thompson, P.M., Carta, M., Costa, E.T., Mathews, J.R., Lopez-Benditó, G., ..., & Wilson, M.C. (2002).
Genetic ablation of the t-SNARE SNAP-25 distinguishes mechanisms of neuroexocytosis. Nature neuroscience, 5(1), 19-26. [PubMed:11753414] [WorldCat] [DOI] - ↑
Bark, I.C., & Wilson, M.C. (1994).
Human cDNA clones encoding two different isoforms of the nerve terminal protein SNAP-25. Gene, 139(2), 291-2. [PubMed:8112622] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2 8.3
Yamamori, S., Itakura, M., Sugaya, D., Katsumata, O., Sakagami, H., & Takahashi, M. (2011).
Differential expression of SNAP-25 family proteins in the mouse brain. The Journal of comparative neurology, 519(5), 916-32. [PubMed:21280044] [WorldCat] [DOI] - ↑ 9.0 9.1
Ravichandran, V., Chawla, A., & Roche, P.A. (1996).
Identification of a novel syntaxin- and synaptobrevin/VAMP-binding protein, SNAP-23, expressed in non-neuronal tissues. The Journal of biological chemistry, 271(23), 13300-3. [PubMed:8663154] [WorldCat] [DOI] - ↑
Sørensen, J.B., Nagy, G., Varoqueaux, F., Nehring, R.B., Brose, N., Wilson, M.C., & Neher, E. (2003).
Differential control of the releasable vesicle pools by SNAP-25 splice variants and SNAP-23. Cell, 114(1), 75-86. [PubMed:12859899] [WorldCat] [DOI] - ↑
Delgado-Martínez, I., Nehring, R.B., & Sørensen, J.B. (2007).
Differential abilities of SNAP-25 homologs to support neuronal function. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(35), 9380-91. [PubMed:17728451] [PMC] [WorldCat] [DOI] - ↑
Weber, J.P., Toft-Bertelsen, T.L., Mohrmann, R., Delgado-Martinez, I., & Sørensen, J.B. (2014).
Synaptotagmin-7 is an asynchronous calcium sensor for synaptic transmission in neurons expressing SNAP-23. PloS one, 9(11), e114033. [PubMed:25422940] [PMC] [WorldCat] [DOI] - ↑
Steegmaier, M., Yang, B., Yoo, J.S., Huang, B., Shen, M., Yu, S., ..., & Scheller, R.H. (1998).
Three novel proteins of the syntaxin/SNAP-25 family. The Journal of biological chemistry, 273(51), 34171-9. [PubMed:9852078] [WorldCat] [DOI] - ↑
Holt, M., Varoqueaux, F., Wiederhold, K., Takamori, S., Urlaub, H., Fasshauer, D., & Jahn, R. (2006).
Identification of SNAP-47, a novel Qbc-SNARE with ubiquitous expression. The Journal of biological chemistry, 281(25), 17076-83. [PubMed:16621800] [WorldCat] [DOI] - ↑ 15.0 15.1
Hong, W. (2005).
SNAREs and traffic. Biochimica et biophysica acta, 1744(3), 493-517. [PubMed:16038056] [WorldCat] - ↑ 16.0 16.1
Jahn, R., & Scheller, R.H. (2006).
SNAREs--engines for membrane fusion. Nature reviews. Molecular cell biology, 7(9), 631-43. [PubMed:16912714] [WorldCat] [DOI] - ↑
Yu, S.C., Klosterman, S.M., Martin, A.A., Gracheva, E.O., & Richmond, J.E. (2013).
Differential roles for snapin and synaptotagmin in the synaptic vesicle cycle. PloS one, 8(2), e57842. [PubMed:23469084] [PMC] [WorldCat] [DOI] - ↑
Veit, M., Söllner, T.H., & Rothman, J.E. (1996).
Multiple palmitoylation of synaptotagmin and the t-SNARE SNAP-25. FEBS letters, 385(1-2), 119-23. [PubMed:8641455] [WorldCat] [DOI] - ↑
Vogel, K., & Roche, P.A. (1999).
SNAP-23 and SNAP-25 are palmitoylated in vivo. Biochemical and biophysical research communications, 258(2), 407-10. [PubMed:10329400] [WorldCat] [DOI] - ↑
Lane, S.R., & Liu, Y. (1997).
Characterization of the palmitoylation domain of SNAP-25. Journal of neurochemistry, 69(5), 1864-9. [PubMed:9349529] [WorldCat] [DOI] - ↑
Greaves, J., Prescott, G.R., Gorleku, O.A., & Chamberlain, L.H. (2010).
Regulation of SNAP-25 trafficking and function by palmitoylation. Biochemical Society transactions, 38(Pt 1), 163-6. [PubMed:20074052] [WorldCat] [DOI] - ↑
Shimazaki, Y., Nishiki, T., Omori, A., Sekiguchi, M., Kamata, Y., Kozaki, S., & Takahashi, M. (1996).
Phosphorylation of 25-kDa synaptosome-associated protein. Possible involvement in protein kinase C-mediated regulation of neurotransmitter release. The Journal of biological chemistry, 271(24), 14548-53. [PubMed:8662851] [WorldCat] [DOI] - ↑ 23.0 23.1
Yang, Y., Craig, T.J., Chen, X., Ciufo, L.F., Takahashi, M., Morgan, A., & Gillis, K.D. (2007).
Phosphomimetic mutation of Ser-187 of SNAP-25 increases both syntaxin binding and highly Ca2+-sensitive exocytosis. The Journal of general physiology, 129(3), 233-44. [PubMed:17325194] [PMC] [WorldCat] [DOI] - ↑
Wells, C.A., Zurawski, Z., Betke, K.M., Yim, Y.Y., Hyde, K., Rodriguez, S., ..., & Hamm, H.E. (2012).
Gβγ inhibits exocytosis via interaction with critical residues on soluble N-ethylmaleimide-sensitive factor attachment protein-25. Molecular pharmacology, 82(6), 1136-49. [PubMed:22962332] [PMC] [WorldCat] [DOI] - ↑
Vaidyanathan, V.V., Yoshino, K., Jahnz, M., Dörries, C., Bade, S., Nauenburg, S., ..., & Binz, T. (1999).
Proteolysis of SNAP-25 isoforms by botulinum neurotoxin types A, C, and E: domains and amino acid residues controlling the formation of enzyme-substrate complexes and cleavage. Journal of neurochemistry, 72(1), 327-37. [PubMed:9886085] [WorldCat] [DOI] - ↑
Capogna, M., McKinney, R.A., O'Connor, V., Gähwiler, B.H., & Thompson, S.M. (1997).
Ca2+ or Sr2+ partially rescues synaptic transmission in hippocampal cultures treated with botulinum toxin A and C, but not tetanus toxin. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(19), 7190-202. [PubMed:9295365] [WorldCat] - ↑
Sakaba, T., Stein, A., Jahn, R., & Neher, E. (2005).
Distinct kinetic changes in neurotransmitter release after SNARE protein cleavage. Science (New York, N.Y.), 309(5733), 491-4. [PubMed:16020741] [WorldCat] [DOI] - ↑
Fang, Q., Zhao, Y., Herbst, A.D., Kim, B.N., & Lindau, M. (2015).
Positively charged amino acids at the SNAP-25 C terminus determine fusion rates, fusion pore properties, and energetics of tight SNARE complex zippering. The Journal of neuroscience : the official journal of the Society for Neuroscience, 35(7), 3230-9. [PubMed:25698757] [PMC] [WorldCat] [DOI] - ↑
Südhof, T.C. (2013).
Neurotransmitter release: the last millisecond in the life of a synaptic vesicle. Neuron, 80(3), 675-90. [PubMed:24183019] [PMC] [WorldCat] [DOI] - ↑
Rickman, C., Jiménez, J.L., Graham, M.E., Archer, D.A., Soloviev, M., Burgoyne, R.D., & Davletov, B. (2006).
Conserved prefusion protein assembly in regulated exocytosis. Molecular biology of the cell, 17(1), 283-94. [PubMed:16267273] [PMC] [WorldCat] [DOI] - ↑
Zhang, X., Kim-Miller, M.J., Fukuda, M., Kowalchyk, J.A., & Martin, T.F. (2002).
Ca2+-dependent synaptotagmin binding to SNAP-25 is essential for Ca2+-triggered exocytosis. Neuron, 34(4), 599-611. [PubMed:12062043] [WorldCat] [DOI] - ↑
Mohrmann, R., de Wit, H., Connell, E., Pinheiro, P.S., Leese, C., Bruns, D., ..., & Sørensen, J.B. (2013).
Synaptotagmin interaction with SNAP-25 governs vesicle docking, priming, and fusion triggering. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(36), 14417-30. [PubMed:24005294] [PMC] [WorldCat] [DOI] - ↑
Kiessling, V., Liang, B., & Tamm, L.K. (2015).
Reconstituting SNARE-mediated membrane fusion at the single liposome level. Methods in cell biology, 128, 339-63. [PubMed:25997356] [PMC] [WorldCat] [DOI] - ↑
Lan, J.Y., Skeberdis, V.A., Jover, T., Grooms, S.Y., Lin, Y., Araneda, R.C., ..., & Zukin, R.S. (2001).
Protein kinase C modulates NMDA receptor trafficking and gating. Nature neuroscience, 4(4), 382-90. [PubMed:11276228] [WorldCat] [DOI] - ↑
Lan, J.Y., Skeberdis, V.A., Jover, T., Zheng, X., Bennett, M.V., & Zukin, R.S. (2001).
Activation of metabotropic glutamate receptor 1 accelerates NMDA receptor trafficking. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(16), 6058-68. [PubMed:11487629] [PMC] [WorldCat] - ↑
Jarvis, S.E., & Zamponi, G.W. (2007).
Trafficking and regulation of neuronal voltage-gated calcium channels. Current opinion in cell biology, 19(4), 474-82. [PubMed:17624753] [WorldCat] [DOI] - ↑
Pozzi, D., Condliffe, S., Bozzi, Y., Chikhladze, M., Grumelli, C., Proux-Gillardeaux, V., ..., & Matteoli, M. (2008).
Activity-dependent phosphorylation of Ser187 is required for SNAP-25-negative modulation of neuronal voltage-gated calcium channels. Proceedings of the National Academy of Sciences of the United States of America, 105(1), 323-8. [PubMed:18162553] [PMC] [WorldCat] [DOI] - ↑
Selak, S., Paternain, A.V., Aller, M.I., Aller, I.M., Picó, E., Rivera, R., & Lerma, J. (2009).
A role for SNAP25 in internalization of kainate receptors and synaptic plasticity. Neuron, 63(3), 357-71. [PubMed:19679075] [WorldCat] [DOI] - ↑
Lau, C.G., Takayasu, Y., Rodenas-Ruano, A., Paternain, A.V., Lerma, J., Bennett, M.V., & Zukin, R.S. (2010).
SNAP-25 is a target of protein kinase C phosphorylation critical to NMDA receptor trafficking. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(1), 242-54. [PubMed:20053906] [PMC] [WorldCat] [DOI] - ↑
Suh, Y.H., Terashima, A., Petralia, R.S., Wenthold, R.J., Isaac, J.T., Roche, K.W., & Roche, P.A. (2010).
A neuronal role for SNAP-23 in postsynaptic glutamate receptor trafficking. Nature neuroscience, 13(3), 338-43. [PubMed:20118925] [PMC] [WorldCat] [DOI] - ↑
Jurado, S. (2014).
The dendritic SNARE fusion machinery involved in AMPARs insertion during long-term potentiation. Frontiers in cellular neuroscience, 8, 407. [PubMed:25565955] [PMC] [WorldCat] [DOI] - ↑
Nozumi, M., Togano, T., Takahashi-Niki, K., Lu, J., Honda, A., Taoka, M., ..., & Igarashi, M. (2009).
Identification of functional marker proteins in the mammalian growth cone. Proceedings of the National Academy of Sciences of the United States of America, 106(40), 17211-6. [PubMed:19805073] [PMC] [WorldCat] [DOI] - ↑
Tomasoni, R., Repetto, D., Morini, R., Elia, C., Gardoni, F., Di Luca, M., ..., & Matteoli, M. (2013).
SNAP-25 regulates spine formation through postsynaptic binding to p140Cap. Nature communications, 4, 2136. [PubMed:23868368] [WorldCat] [DOI] - ↑
Weiss, N., Zamponi, G.W., & De Waard, M. (2012).
How do T-type calcium channels control low-threshold exocytosis? Communicative & integrative biology, 5(4), 377-80. [PubMed:23060963] [PMC] [WorldCat] [DOI] - ↑
Jarvis, S.E., & Zamponi, G.W. (2001).
Interactions between presynaptic Ca2+ channels, cytoplasmic messengers and proteins of the synaptic vesicle release complex. Trends in pharmacological sciences, 22(10), 519-25. [PubMed:11583809] [WorldCat] [DOI] - ↑
Jarvis, S.E., & Zamponi, G.W. (2005).
Masters or slaves? Vesicle release machinery and the regulation of presynaptic calcium channels. Cell calcium, 37(5), 483-8. [PubMed:15820397] [WorldCat] [DOI] - ↑
Ji, J., Salapatek, A.M., Lau, H., Wang, G., Gaisano, H.Y., & Diamant, N.E. (2002).
SNAP-25, a SNARE protein, inhibits two types of K channels in esophageal smooth muscle. Gastroenterology, 122(4), 994-1006. [PubMed:11910352] [WorldCat] [DOI] - ↑
He, Y., Kang, Y., Leung, Y.M., Xia, F., Gao, X., Xie, H., ..., & Tsushima, R.G. (2006).
Modulation of Kv2.1 channel gating and TEA sensitivity by distinct domains of SNAP-25. The Biochemical journal, 396(2), 363-9. [PubMed:16478442] [PMC] [WorldCat] [DOI] - ↑
He, Y., Elias, C.L., Huang, Y.C., Gao, X., Leung, Y.M., Kang, Y., ..., & Gaisano, H.Y. (2008).
Botulinum neurotoxin A and neurotoxin E cleavage products of synaptosome-associated protein of 25 kd exhibit distinct actions on pancreatic islet beta-cell Kv2.1 channel gating. Pancreas, 36(1), 10-7. [PubMed:18192874] [WorldCat] [DOI] - ↑
Faraone, S.V., & Khan, S.A. (2006).
Candidate gene studies of attention-deficit/hyperactivity disorder. The Journal of clinical psychiatry, 67 Suppl 8, 13-20. [PubMed:16961425] [WorldCat] - ↑
Zhang, H., Zhu, S., Zhu, Y., Chen, J., Zhang, G., & Chang, H. (2011).
An association study between SNAP-25 gene and attention-deficit hyperactivity disorder. European journal of paediatric neurology : EJPN : official journal of the European Paediatric Neurology Society, 15(1), 48-52. [PubMed:20599404] [WorldCat] [DOI] - ↑
Herken, H., Erdal, M.E., Kenar, A.N., Unal, G.A., Cakaloz, B., Ay, M.E., ..., & Sengül, C. (2014).
Association of SNAP-25 Gene Ddel and Mnll Polymorphisms with Adult Attention Deficit Hyperactivity Disorder. Psychiatry investigation, 11(4), 476-80. [PubMed:25395980] [PMC] [WorldCat] [DOI] - ↑
Wilson, M.C. (2000).
Coloboma mouse mutant as an animal model of hyperkinesis and attention deficit hyperactivity disorder. Neuroscience and biobehavioral reviews, 24(1), 51-7. [PubMed:10654661] [WorldCat] - ↑
Balkarli, A., Sengül, C., Tepeli, E., Balkarli, H., & Cobankara, V. (2014).
Synaptosomal-associated protein 25 (Snap-25) gene polymorphism frequency in fibromyalgia syndrome and relationship with clinical symptoms. BMC musculoskeletal disorders, 15, 191. [PubMed:24885975] [PMC] [WorldCat] [DOI] - ↑
Németh, N., Kovács-Nagy, R., Székely, A., Sasvári-Székely, M., & Rónai, Z. (2013).
Association of impulsivity and polymorphic microRNA-641 target sites in the SNAP-25 gene. PloS one, 8(12), e84207. [PubMed:24391914] [PMC] [WorldCat] [DOI] - ↑
Golimbet, V.E., Alfimova, M.V., Gritsenko, I.K., Lezheiko, T.V., Lavrushina, O.M., Abramova, L.I., ..., & Ebstein, R.P. (2010).
Association between a synaptosomal protein (SNAP-25) gene polymorphism and verbal memory and attention in patients with endogenous psychoses and mentally healthy subjects. Neuroscience and behavioral physiology, 40(4), 461-5. [PubMed:20333500] [WorldCat] [DOI] - ↑
Hawi, Z., Matthews, N., Wagner, J., Wallace, R.H., Butler, T.J., Vance, A., ..., & Bellgrove, M.A. (2013).
DNA variation in the SNAP25 gene confers risk to ADHD and is associated with reduced expression in prefrontal cortex. PloS one, 8(4), e60274. [PubMed:23593184] [PMC] [WorldCat] [DOI] - ↑
Thompson, P.M., Sower, A.C., & Perrone-Bizzozero, N.I. (1998).
Altered levels of the synaptosomal associated protein SNAP-25 in schizophrenia. Biological psychiatry, 43(4), 239-43. [PubMed:9513732] [WorldCat] [DOI] - ↑
Thompson, P.M., Egbufoama, S., & Vawter, M.P. (2003).
SNAP-25 reduction in the hippocampus of patients with schizophrenia. Progress in neuro-psychopharmacology & biological psychiatry, 27(3), 411-7. [PubMed:12691775] [WorldCat] [DOI] - ↑
Fatemi, S.H., Earle, J.A., Stary, J.M., Lee, S., & Sedgewick, J. (2001).
Altered levels of the synaptosomal associated protein SNAP-25 in hippocampus of subjects with mood disorders and schizophrenia. Neuroreport, 12(15), 3257-62. [PubMed:11711867] [WorldCat] [DOI] - ↑
Sinclair, L.I., Tayler, H.M., & Love, S. (2015).
Synaptic protein levels altered in vascular dementia. Neuropathology and applied neurobiology, 41(4), 533-43. [PubMed:25559750] [PMC] [WorldCat] [DOI] - ↑
Braida, D., Guerini, F.R., Ponzoni, L., Corradini, I., De Astis, S., Pattini, L., ..., & Sala, M. (2015).
Association between SNAP-25 gene polymorphisms and cognition in autism: functional consequences and potential therapeutic strategies. Translational psychiatry, 5, e500. [PubMed:25629685] [PMC] [WorldCat] [DOI] - ↑
Corradini, I., Donzelli, A., Antonucci, F., Welzl, H., Loos, M., Martucci, R., ..., & Matteoli, M. (2014).
Epileptiform activity and cognitive deficits in SNAP-25(+/-) mice are normalized by antiepileptic drugs. Cerebral cortex (New York, N.Y. : 1991), 24(2), 364-76. [PubMed:23064108] [WorldCat] [DOI] - ↑
Johansson, J.U., Ericsson, J., Janson, J., Beraki, S., Stanić, D., Mandic, S.A., ..., & Bark, C. (2008).
An ancient duplication of exon 5 in the Snap25 gene is required for complex neuronal development/function. PLoS genetics, 4(11), e1000278. [PubMed:19043548] [PMC] [WorldCat] [DOI] - ↑
Watanabe, S., Yamamori, S., Otsuka, S., Saito, M., Suzuki, E., Kataoka, M., ..., & Takahashi, M. (2015).
Epileptogenesis and epileptic maturation in phosphorylation site-specific SNAP-25 mutant mice. Epilepsy research, 115, 30-44. [PubMed:26220374] [WorldCat] [DOI] - ↑
Rohena, L., Neidich, J., Truitt Cho, M., Gonzalez, K.D., Tang, S., Devinsky, O., & Chung, W.K. (2013).
Mutation in SNAP25 as a novel genetic cause of epilepsy and intellectual disability. Rare diseases (Austin, Tex.), 1, e26314. [PubMed:25003006] [PMC] [WorldCat] [DOI]