「ブレビカン」の版間の差分
細 →構造 |
|||
| (同じ利用者による、間の3版が非表示) | |||
| 11行目: | 11行目: | ||
== ブレビカンとは == | == ブレビカンとは == | ||
1994年、Yamaguchiらと[[w:Susan Hockfield|Hockfield]]らのグループにより[[アグリカン]]ファミリーの4番目メンバーの神経系特異的[[コンドロイチン硫酸プロテオグリカン]]([[CSPG]])として発見された<ref name=Yamada1994><pubmed>8144512</pubmed></ref><ref name=Jaworski1994><pubmed>7512973</pubmed></ref>。さらに1995年、Gundelfingerらのグループは同じく分泌型ブレビカンに加え、[[GPIアンカー]]型のブレビカンをクローニングした<ref name=Seidenbecher1995><pubmed>7592978</pubmed></ref>。 | 1994年、Yamaguchiらと[[w:Susan Hockfield|Hockfield]]らのグループにより[[アグリカン]]ファミリーの4番目メンバーの神経系特異的[[コンドロイチン硫酸プロテオグリカン]]([[CSPG]])として発見された<ref name=Yamada1994><pubmed>8144512</pubmed></ref><ref name=Jaworski1994><pubmed>7512973</pubmed></ref> [1,2]。さらに1995年、Gundelfingerらのグループは同じく分泌型ブレビカンに加え、[[GPIアンカー]]型のブレビカンをクローニングした<ref name=Seidenbecher1995><pubmed>7592978</pubmed></ref>[3]。 | ||
ブレビカンは[[脳]]における多様な生理的および病理生理学的[[可塑性]]プロセスに関与する神経系プロテオグリカンである。神経細胞の表面に局在し、成熟した神経組織における[[ペリニューロナルネット]]や[[ペリシナプス]]、[[軸索初節]]、[[ランビエ絞輪]]などで、特定の種類の[[細胞外マトリクス]]の形成に寄与している。[[コンドロイチン硫酸]]鎖の結合度合いの変動、[[マトリックスメタロプロテアーゼ]]による限定的なプロテオリティック切断、[[選択的スプライシング]]、およびCa<sup>2+</sup>依存性の相互作用分子への結合を通じて、[[シナプス可塑性]]、[[グリオーマ]]の浸潤における調節因子として機能する。さらに、脳の老化および脳疾患との関連からバイオマーカーとして注目されつつある<ref name=Frischknecht2012><pubmed>22537913</pubmed></ref>。 | ブレビカンは[[脳]]における多様な生理的および病理生理学的[[可塑性]]プロセスに関与する神経系プロテオグリカンである。神経細胞の表面に局在し、成熟した神経組織における[[ペリニューロナルネット]]や[[ペリシナプス]]、[[軸索初節]]、[[ランビエ絞輪]]などで、特定の種類の[[細胞外マトリクス]]の形成に寄与している。[[コンドロイチン硫酸]]鎖の結合度合いの変動、[[マトリックスメタロプロテアーゼ]]による限定的なプロテオリティック切断、[[選択的スプライシング]]、およびCa<sup>2+</sup>依存性の相互作用分子への結合を通じて、[[シナプス可塑性]]、[[グリオーマ]]の浸潤における調節因子として機能する。さらに、脳の老化および脳疾患との関連からバイオマーカーとして注目されつつある<ref name=Frischknecht2012><pubmed>22537913</pubmed></ref>[5]。 | ||
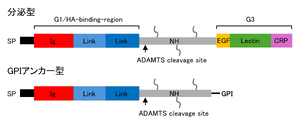
[[ファイル:Ohashi Brevican Fig1.png|サムネイル|'''図1. ブレビカンアイソフォームの構造'''<br>文献<ref name=Frischknecht2012 />より改変]] | [[ファイル:Ohashi Brevican Fig1.png|サムネイル|'''図1. ブレビカンアイソフォームの構造'''<br>文献<ref name=Frischknecht2012 />より改変]] | ||
== 構造 == | == 構造 == | ||
アグリカンファミリーの[[コアタンパク質]]は相同性の高いN末端[[G1ドメイン]]とC末端[[G3ドメイン]]とその間の非相同領域からなる<ref name=Frischknecht2012 /> [5]。G1ドメインは[[ヒアルロン酸]]結合能をもつ。非相同(NH)領域はファミリー分子間で長さが異なり、その領域には異なる数のコンドロイチン硫酸鎖が結合する。ブレビカンにはコンドロイチン硫酸鎖が結合する部位が潜在的に1-5か所あるとされるが、コンドロイチン硫酸鎖が結合していないブレビカンも検出されており、[[パートタイムプロテオグリカン]]と呼ばれる。さらに第8エクソンでスプライシングを受けずイントロン部分をリードスルーして転写され、結果として分泌型にない21[[アミノ酸]]残基が翻訳され、GPIアンカー型アイソフォームが形成される('''図1''') <ref name=Seidenbecher1995 /> [3]。GPIアンカー型アイソフォームはアグリカンファミリーの中でブレビカンにのみに存在する。非相同領域に[[マトリックスメタロプロテアーゼ]]の一種である[[A Disintegrin and Metalloproteinase with Thrombospondin motifs]] ([[ADAMTS]])による切断箇所があるので、両アイソフォームとも翻訳後のプロセシングを受けることがある。プロテオグリカンのタンパク質分解断片はプロテオグリカンそのものとは独立した生物活性を持つことがあり、matrikinsあるいはmatricryptinsと呼ばれる。最近ブレビカンの分解断片もbrevikineと呼ぶことが提唱されている<ref name=Mead2022><pubmed>35785985</pubmed></ref>。 | アグリカンファミリーの[[コアタンパク質]]は相同性の高いN末端[[G1ドメイン]]とC末端[[G3ドメイン]]とその間の非相同領域からなる<ref name=Frischknecht2012 /> [5]。G1ドメインは[[ヒアルロン酸]]結合能をもつ。非相同(NH)領域はファミリー分子間で長さが異なり、その領域には異なる数のコンドロイチン硫酸鎖が結合する。ブレビカンにはコンドロイチン硫酸鎖が結合する部位が潜在的に1-5か所あるとされるが、コンドロイチン硫酸鎖が結合していないブレビカンも検出されており、[[パートタイムプロテオグリカン]]と呼ばれる。さらに第8エクソンでスプライシングを受けずイントロン部分をリードスルーして転写され、結果として分泌型にない21[[アミノ酸]]残基が翻訳され、GPIアンカー型アイソフォームが形成される('''図1''') <ref name=Seidenbecher1995 /> [3]。GPIアンカー型アイソフォームはアグリカンファミリーの中でブレビカンにのみに存在する。非相同領域に[[マトリックスメタロプロテアーゼ]]の一種である[[A Disintegrin and Metalloproteinase with Thrombospondin motifs]] ([[ADAMTS]])による切断箇所があるので、両アイソフォームとも翻訳後のプロセシングを受けることがある。プロテオグリカンのタンパク質分解断片はプロテオグリカンそのものとは独立した生物活性を持つことがあり、matrikinsあるいはmatricryptinsと呼ばれる。最近ブレビカンの分解断片もbrevikineと呼ぶことが提唱されている<ref name=Mead2022><pubmed>35785985</pubmed></ref>[6]。 | ||
なお、G3ドメインの中に相同性の高いC型[[レクチン]]様サブドメインがあることからアグリカンファミリーは[[レクティカン]](lectican)ファミリーとも呼ばれる<ref name=Yamaguchi2000><pubmed>10766023</pubmed></ref>。 | なお、G3ドメインの中に相同性の高いC型[[レクチン]]様サブドメインがあることからアグリカンファミリーは[[レクティカン]](lectican)ファミリーとも呼ばれる<ref name=Yamaguchi2000><pubmed>10766023</pubmed></ref>[7]。 | ||
== 発現 == | == 発現 == | ||
ブレビカンの発現は脳特異的とされ、生後に発現増加がみられる。[[げっ歯類]]では生後1週目の発現量は少ないが、2週目以降[[臨界期]]の終了にかけて発現が増加し成体ではある程度の発現レベルが維持される。ブレビカンは[[ニューロン]]からも[[グリア細胞]]からも発現が認められる<ref name=Seidenbecher1998><pubmed>9751135</pubmed></ref><ref name=Gary2000><pubmed>11054543</pubmed></ref>。分泌型ブレビカンはペリニューロナルネットに代表されるように神経細胞周囲の[[細胞外マトリクス]]に組み込まれ、GPIアンカー型ブレビカンは細胞表面に直接結合する形をとる('''図2''')。GPIアンカー型特異的な[[抗体]]がないため、アイソフォームによる発現細胞の違いの検出はもっぱら[[in situ hybridization]] | ブレビカンの発現は脳特異的とされ、生後に発現増加がみられる。[[げっ歯類]]では生後1週目の発現量は少ないが、2週目以降[[臨界期]]の終了にかけて発現が増加し成体ではある程度の発現レベルが維持される。ブレビカンは[[ニューロン]]からも[[グリア細胞]]からも発現が認められる<ref name=Seidenbecher1998><pubmed>9751135</pubmed></ref><ref name=Gary2000><pubmed>11054543</pubmed></ref>[8, 9]。分泌型ブレビカンはペリニューロナルネットに代表されるように神経細胞周囲の[[細胞外マトリクス]]に組み込まれ、GPIアンカー型ブレビカンは細胞表面に直接結合する形をとる('''図2''')。GPIアンカー型特異的な[[抗体]]がないため、アイソフォームによる発現細胞の違いの検出はもっぱら[[in situ hybridization]]に依存している。しかしながら、近年ISHの感度が上がり、GPIアンカー型の発現の報告が目立ってきている<ref name=Favuzzi2017><pubmed>28712654</pubmed></ref><ref name=Hazlett2024><pubmed>38346480</pubmed></ref>[10,11]。ADAMTSメンバーの発現もin situ hybridizationにより調べられ、神経回路の形成に加え、細胞外マトリクスのリモデリングにおける役割が想定される<ref name=Levy2015><pubmed>25349050</pubmed></ref>[12]。 | ||
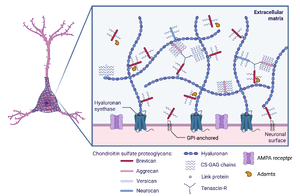
[[ファイル:Ohashi Brevican Fig2.png|サムネイル|'''図2. ペリニューロナルネットと分子構成'''<br>BioRenderを使用し作製。]] | [[ファイル:Ohashi Brevican Fig2.png|サムネイル|'''図2. ペリニューロナルネットと分子構成'''<br>BioRenderを使用し作製。]] | ||
== 機能 == | == 機能 == | ||
=== ペリニューロナルネット === | === ペリニューロナルネット === | ||
ブレビカンは、脳内で最も豊富なコンドロイチン硫酸プロテオグリカンの一つであり、ペリニューロナルネットの根本的な構成要素である('''図2''')<ref name=Fawcett2019><pubmed>31263252</pubmed></ref> | ブレビカンは、脳内で最も豊富なコンドロイチン硫酸プロテオグリカンの一つであり、ペリニューロナルネットの根本的な構成要素である('''図2''')<ref name=Fawcett2019><pubmed>31263252</pubmed></ref>[13]。ペリニューロナルネットには、細胞外マトリクス成分が濃縮されており、恒常的にシナプス可塑性を安定化させているという静的なイメージがあったが、Ricoらの研究によると、海馬のPVニューロンではブレビカンがカリウムチャネルの局在化とシナプスAMPA受容体のレベルを制御することでPVニューロンの性質を動的に調節し、その機能が空間的作業記憶と短期記憶に根本的に必要であることを報告した<ref name=Hazlett2024 /> [11]。2002年にFässlerらのグループがブレビカン欠損マウスを作製した<ref name=Brakebusch2002><pubmed>12370289</pubmed></ref>[4]。ブレビカン欠損マウスは、[[海馬]]の[[長期増強]]([[LTP]])の維持に著しい障害を示した。 | ||
脳内のペリニューロナルネットは場所により成分も異なっており、さらに詳細な調査が必要である。 | 脳内のペリニューロナルネットは場所により成分も異なっており、さらに詳細な調査が必要である。 | ||
=== 軸索被膜 === | === 軸索被膜 === | ||
ペリニューロナルネットとは異なり、軸索終末部を囲むようにコンドロイチン硫酸プロテオグリカンが局在し軸索被膜と呼ばれる。視床の軸索被膜はHAPLN4/Bral2により安定化されている<ref name=Cicanic2017><pubmed>28815777</pubmed></ref>。機能についてはまだ不明である。 | ペリニューロナルネットとは異なり、軸索終末部を囲むようにコンドロイチン硫酸プロテオグリカンが局在し軸索被膜と呼ばれる。視床の軸索被膜はHAPLN4/Bral2により安定化されている<ref name=Cicanic2017><pubmed>28815777</pubmed></ref>[14]。機能についてはまだ不明である。 | ||
=== 軸索初節 === | === 軸索初節 === | ||
軸索が細胞体から起始する部分である[[軸索初節]]は[[活動電位]]の発生部位として、[[電位依存性ナトリウムチャネル]]([[Nav]])が高密度に集積している。ブレビカンは軸索初節に局在し、その局在は[[ニューロファシン-186]] ([[NF-186]])に依存していることが分かった<ref name=Hedstrom2007><pubmed>17709431</pubmed></ref>。 | 軸索が細胞体から起始する部分である[[軸索初節]]は[[活動電位]]の発生部位として、[[電位依存性ナトリウムチャネル]]([[Nav]])が高密度に集積している。ブレビカンは軸索初節に局在し、その局在は[[ニューロファシン-186]] ([[NF-186]])に依存していることが分かった<ref name=Hedstrom2007><pubmed>17709431</pubmed></ref>[15]。 | ||
=== ランビエ絞輪 === | === ランビエ絞輪 === | ||
[[ランビエ絞輪]]は[[髄鞘]]が途切れている部分で、活動電位が[[跳躍伝導]]するために重要である。中枢ランビエ絞輪には電位依存性ナトリウムチャネルだけでなくニューロファシン-186や[[バーシカン]]やブレビカンなどのコンドロイチン硫酸プロテオグリカンが集積している<ref name=Bekku2010><pubmed>20181608</pubmed></ref>。コンドロイチン硫酸プロテオグリカンの集積には[[ヒアルロン酸プロテオグリカンリンクタンパク質2]] ([[HAPLN2]])/[[Brain link protein 1]] ([[Bral1]])が重要である。ブレビカンは直径の太い軸索のランビエ絞輪に発現しており、太い軸索での早い跳躍伝導と機能的に関連することが考えられる<ref name=Bekku2009><pubmed>19141078</pubmed></ref>。ランビエ絞輪に局在するコンドロイチン硫酸プロテオグリカンはニューロファシン-186を介して電位依存性ナトリウムチャネルのクラスタリングにも一部関与している<ref name=Susuki2013><pubmed>23664614</pubmed></ref>。 | [[ランビエ絞輪]]は[[髄鞘]]が途切れている部分で、活動電位が[[跳躍伝導]]するために重要である。中枢ランビエ絞輪には電位依存性ナトリウムチャネルだけでなくニューロファシン-186や[[バーシカン]]やブレビカンなどのコンドロイチン硫酸プロテオグリカンが集積している<ref name=Bekku2010><pubmed>20181608</pubmed></ref>[16]。コンドロイチン硫酸プロテオグリカンの集積には[[ヒアルロン酸プロテオグリカンリンクタンパク質2]] ([[HAPLN2]])/[[Brain link protein 1]] ([[Bral1]])が重要である。ブレビカンは直径の太い軸索のランビエ絞輪に発現しており、太い軸索での早い跳躍伝導と機能的に関連することが考えられる<ref name=Bekku2009><pubmed>19141078</pubmed></ref>[17]。ランビエ絞輪に局在するコンドロイチン硫酸プロテオグリカンはニューロファシン-186を介して電位依存性ナトリウムチャネルのクラスタリングにも一部関与している<ref name=Susuki2013><pubmed>23664614</pubmed></ref>[18]。 | ||
=== 髄鞘化 === | === 髄鞘化 === | ||
アストロサイトから分泌される分泌型ブレビカンが中枢神経の[[髄鞘化]]促進因子として注目されている<ref name=Seiler2023><pubmed>39092473</pubmed></ref>。 | アストロサイトから分泌される分泌型ブレビカンが中枢神経の[[髄鞘化]]促進因子として注目されている<ref name=Seiler2023><pubmed>39092473</pubmed></ref>[19]。 | ||
== 疾患とのかかわり == | == 疾患とのかかわり == | ||
=== グリオーマ === | === グリオーマ === | ||
ブレビカンは悪性度の高い[[グリオーマ]]の細胞外環境で発現上昇するプロテオグリカンとして発見された<ref name=Viapiano2008><pubmed>18398576</pubmed></ref>。注目すべきは低グリコシル化のブレビカンアイソフォームが多いことである。グリオーマの浸潤挙動は、組織特異的あるいは腫瘍特異的な細胞外タンパク質によって媒介されている可能性が示唆され、ブレビカン発現と[[ADAMTS4]]などによるブレビカン切断が腫瘍浸潤と関係があるとされている<ref name=Viapiano2008 />。また、正常脳でブレビカンのヒアルロン酸結合を安定化させる役目があるHAPLN4はグリオーマでは減少しており、これも侵襲性グリオーマの足場環境の変化として捉えられる<ref name=Sim2009><pubmed>19633295</pubmed></ref>。低グリコシル化ブレビカンを標的とする低分子ペプチド(BTP)をペプチドライブラリーから見つけ、in vivoでのグリオーマ腫瘍標的化実験が行われている<ref name=vonSpreckelsen2021><pubmed>33997269</pubmed></ref>。 | ブレビカンは悪性度の高い[[グリオーマ]]の細胞外環境で発現上昇するプロテオグリカンとして発見された<ref name=Viapiano2008><pubmed>18398576</pubmed></ref>[20]。注目すべきは低グリコシル化のブレビカンアイソフォームが多いことである。グリオーマの浸潤挙動は、組織特異的あるいは腫瘍特異的な細胞外タンパク質によって媒介されている可能性が示唆され、ブレビカン発現と[[ADAMTS4]]などによるブレビカン切断が腫瘍浸潤と関係があるとされている<ref name=Viapiano2008 /> (Viapianoら2008)。また、正常脳でブレビカンのヒアルロン酸結合を安定化させる役目があるHAPLN4はグリオーマでは減少しており、これも侵襲性グリオーマの足場環境の変化として捉えられる<ref name=Sim2009><pubmed>19633295</pubmed></ref>[21]。低グリコシル化ブレビカンを標的とする低分子ペプチド(BTP)をペプチドライブラリーから見つけ、in vivoでのグリオーマ腫瘍標的化実験が行われている<ref name=vonSpreckelsen2021><pubmed>33997269</pubmed></ref>[22]。 | ||
=== アルツハイマー病 === | === アルツハイマー病 === | ||
ヒトの死後脳研究で、アグリカンが主体のペリニューロナルネットとブレビカンに基づくシナプス周囲マトリックスの軸索被膜の変化と神経病理を比較した<ref name=Morawski2012><pubmed>22126211</pubmed></ref>。アミロイドプラーク部分においてペリニューロナルネットの損傷は見られず、ニューロンには[[神経原線維]]変化は見られなかった。これらの細胞外マトリクス機能には、神経細胞死を防ぐ保護的役割が含まれる可能性が示唆された。 | ヒトの死後脳研究で、アグリカンが主体のペリニューロナルネットとブレビカンに基づくシナプス周囲マトリックスの軸索被膜の変化と神経病理を比較した<ref name=Morawski2012><pubmed>22126211</pubmed></ref>[23]。アミロイドプラーク部分においてペリニューロナルネットの損傷は見られず、ニューロンには[[神経原線維]]変化は見られなかった。これらの細胞外マトリクス機能には、神経細胞死を防ぐ保護的役割が含まれる可能性が示唆された。 | ||
=== 老化バイオマーカー === | === 老化バイオマーカー === | ||
成体においては、ペリニューロナルネットの発現は比較的安定しており、シナプス可塑性を制限し、神経回路の安定性を維持することで、神経系の正常な機能を確保している。しかし、高齢期には、ペリニューロナルネット の恒常性バランスが崩れ、この崩れは脳領域特異性を示し、神経回路を安定させる機能障害を招き、最終的には認知機能障害や記憶障害を引き起こすと考えられる<ref name=Zhu2025><pubmed>40254145</pubmed></ref>。Liuらは多モダリティー脳画像データと[[血漿]][[プロテオーム]]データを統合し、脳の老化に伴う末梢プロテオームの変化を解析した<ref name=Liu2025><pubmed>39653801</pubmed></ref>。[[メンデルランダム化解析]]は、ブレビカンと脳老化を示す指標である脳年齢差(BAG)の因果関係を支持した。ブレビカンは脳年齢差(BAG)と最も大きな負の相関を示し、ブレビカンは、[[認知症]]、アルツハイマー病、および[[脳卒中]]のリスク低下と関連していた。ブレビカンの調節異常は、複数の[[大脳皮質]]および皮質下構造に影響を及ぼす。ブレビカンは脳の老化および関連する脳障害の候補として挙げられているが、その根本的なメカニズムについてはさらに調査が必要である。 | 成体においては、ペリニューロナルネットの発現は比較的安定しており、シナプス可塑性を制限し、神経回路の安定性を維持することで、神経系の正常な機能を確保している。しかし、高齢期には、ペリニューロナルネット の恒常性バランスが崩れ、この崩れは脳領域特異性を示し、神経回路を安定させる機能障害を招き、最終的には認知機能障害や記憶障害を引き起こすと考えられる<ref name=Zhu2025><pubmed>40254145</pubmed></ref>[24]。Liuらは多モダリティー脳画像データと[[血漿]][[プロテオーム]]データを統合し、脳の老化に伴う末梢プロテオームの変化を解析した<ref name=Liu2025><pubmed>39653801</pubmed></ref>[25]。[[メンデルランダム化解析]]は、ブレビカンと脳老化を示す指標である脳年齢差(BAG)の因果関係を支持した。ブレビカンは脳年齢差(BAG)と最も大きな負の相関を示し、ブレビカンは、[[認知症]]、アルツハイマー病、および[[脳卒中]]のリスク低下と関連していた。ブレビカンの調節異常は、複数の[[大脳皮質]]および皮質下構造に影響を及ぼす。ブレビカンは脳の老化および関連する脳障害の候補として挙げられているが、その根本的なメカニズムについてはさらに調査が必要である。 | ||
=== 薬物依存 === | === 薬物依存 === | ||
[[薬物依存]]は、[[内側前頭前野]]([[mPFC]])その他さまざまな脳領域におけるペリニューロナルネットの分布と構成に変化を引き起こす。薬物依存症の治療の成功は、禁断期間中の高い再発率によって妨げられている。[[ヘロイン]]の自己投与後に長期禁断状態を経験した[[ラット]]の内側前頭前野の[[シナプス]]分画の定量的プロテオミクス解析から、ブレビカンなどのペリニューロナルネットの成分の顕著な減少が示された<ref name=VanDenOever2010><pubmed>20592718</pubmed></ref>。内側前頭前野の[[GABA]]作動性介在ニューロンのペリニューロナルネットの分解・減少が禁断期間中の薬物探索行動への再発を高める新たな神経適応メカニズムと考えられる。最近、ニューロンを取り囲む細胞外マトリクス構造であるペリニューロナルネットが、[[学習]]、[[記憶]]、そして依存行動の調節因子として注目されている。ペリニューロナルネットはニューロンに構造的な支持を与えるだけでなく、[[メタロプロテアーゼ]]によって経験依存的に動的にリモデリングされる<ref name=Lasek2018><pubmed>29289347</pubmed></ref>。 | [[薬物依存]]は、[[内側前頭前野]]([[mPFC]])その他さまざまな脳領域におけるペリニューロナルネットの分布と構成に変化を引き起こす。薬物依存症の治療の成功は、禁断期間中の高い再発率によって妨げられている。[[ヘロイン]]の自己投与後に長期禁断状態を経験した[[ラット]]の内側前頭前野の[[シナプス]]分画の定量的プロテオミクス解析から、ブレビカンなどのペリニューロナルネットの成分の顕著な減少が示された<ref name=VanDenOever2010><pubmed>20592718</pubmed></ref>[26]。内側前頭前野の[[GABA]]作動性介在ニューロンのペリニューロナルネットの分解・減少が禁断期間中の薬物探索行動への再発を高める新たな神経適応メカニズムと考えられる。最近、ニューロンを取り囲む細胞外マトリクス構造であるペリニューロナルネットが、[[学習]]、[[記憶]]、そして依存行動の調節因子として注目されている。ペリニューロナルネットはニューロンに構造的な支持を与えるだけでなく、[[メタロプロテアーゼ]]によって経験依存的に動的にリモデリングされる<ref name=Lasek2018><pubmed>29289347</pubmed></ref>[27]。 | ||
=== 発作性転倒症候群 === | === 発作性転倒症候群 === | ||
[[wj:キャバリア・キング・チャールズ・スパニエル|キャバリア・キング・チャールズ・スパニエル]]犬にみられる[[発作性転倒症候群]]の原因遺伝子が[[ゲノムワイド関連解析]]を用いて第7染色体に同定され、ブレビカン遺伝子の15.7 kbの欠失と関連していることが判明した<ref name=Gill2012><pubmed>21821125</pubmed></ref>。米国での既往歴のない同犬種の大規模な集団を対象にした広範な検査では、保因動物が極めて一般的であることが判明した(12.9% | [[wj:キャバリア・キング・チャールズ・スパニエル|キャバリア・キング・チャールズ・スパニエル]]犬にみられる[[発作性転倒症候群]]の原因遺伝子が[[ゲノムワイド関連解析]]を用いて第7染色体に同定され、ブレビカン遺伝子の15.7 kbの欠失と関連していることが判明した<ref name=Gill2012><pubmed>21821125</pubmed></ref>[28]。米国での既往歴のない同犬種の大規模な集団を対象にした広範な検査では、保因動物が極めて一般的であることが判明した(12.9%)。遺伝子変異を有する動物の数を最小限に抑えることを目的とした選択的交配プログラムの実施を可能にする。なお、ヒトでは同様の疾患でのブレビカン変異報告はない。 | ||
== 関連項目 == | == 関連項目 == | ||
2025年7月4日 (金) 09:11時点における版
大橋 俊孝
岡山大学 医歯薬学総合研究科
DOI:10.14931/bsd.11101 原稿受付日:2025年6月30日 原稿完成日:2025年7月1日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
同義語:brevican
英略語:BCAN
神経系に特異的に発現するコンドロイチン硫酸プロテオグリカンで、脳の細胞外マトリクス構造であるペリニューロナルネット(PNN)や軸索初節、ランビエ絞輪、シナプス周囲などに局在し、神経の可塑性や回路の安定性に重要な役割を果たす。分泌型とGPIアンカー型の2種類のアイソフォームがあり、発現や機能は発達段階や細胞種によって異なる。加齢や神経疾患(アルツハイマー病、グリオーマなど)に関与し、薬物依存や行動制御にも関係することから、近年では脳の可塑性や老化のバイオマーカーとしても注目されている。
ブレビカンとは
1994年、YamaguchiらとHockfieldらのグループによりアグリカンファミリーの4番目メンバーの神経系特異的コンドロイチン硫酸プロテオグリカン(CSPG)として発見された[1][2] [1,2]。さらに1995年、Gundelfingerらのグループは同じく分泌型ブレビカンに加え、GPIアンカー型のブレビカンをクローニングした[3][3]。
ブレビカンは脳における多様な生理的および病理生理学的可塑性プロセスに関与する神経系プロテオグリカンである。神経細胞の表面に局在し、成熟した神経組織におけるペリニューロナルネットやペリシナプス、軸索初節、ランビエ絞輪などで、特定の種類の細胞外マトリクスの形成に寄与している。コンドロイチン硫酸鎖の結合度合いの変動、マトリックスメタロプロテアーゼによる限定的なプロテオリティック切断、選択的スプライシング、およびCa2+依存性の相互作用分子への結合を通じて、シナプス可塑性、グリオーマの浸潤における調節因子として機能する。さらに、脳の老化および脳疾患との関連からバイオマーカーとして注目されつつある[4][5]。
文献[4]より改変
構造
アグリカンファミリーのコアタンパク質は相同性の高いN末端G1ドメインとC末端G3ドメインとその間の非相同領域からなる[4] [5]。G1ドメインはヒアルロン酸結合能をもつ。非相同(NH)領域はファミリー分子間で長さが異なり、その領域には異なる数のコンドロイチン硫酸鎖が結合する。ブレビカンにはコンドロイチン硫酸鎖が結合する部位が潜在的に1-5か所あるとされるが、コンドロイチン硫酸鎖が結合していないブレビカンも検出されており、パートタイムプロテオグリカンと呼ばれる。さらに第8エクソンでスプライシングを受けずイントロン部分をリードスルーして転写され、結果として分泌型にない21アミノ酸残基が翻訳され、GPIアンカー型アイソフォームが形成される(図1) [3] [3]。GPIアンカー型アイソフォームはアグリカンファミリーの中でブレビカンにのみに存在する。非相同領域にマトリックスメタロプロテアーゼの一種であるA Disintegrin and Metalloproteinase with Thrombospondin motifs (ADAMTS)による切断箇所があるので、両アイソフォームとも翻訳後のプロセシングを受けることがある。プロテオグリカンのタンパク質分解断片はプロテオグリカンそのものとは独立した生物活性を持つことがあり、matrikinsあるいはmatricryptinsと呼ばれる。最近ブレビカンの分解断片もbrevikineと呼ぶことが提唱されている[5][6]。
なお、G3ドメインの中に相同性の高いC型レクチン様サブドメインがあることからアグリカンファミリーはレクティカン(lectican)ファミリーとも呼ばれる[6][7]。
発現
ブレビカンの発現は脳特異的とされ、生後に発現増加がみられる。げっ歯類では生後1週目の発現量は少ないが、2週目以降臨界期の終了にかけて発現が増加し成体ではある程度の発現レベルが維持される。ブレビカンはニューロンからもグリア細胞からも発現が認められる[7][8][8, 9]。分泌型ブレビカンはペリニューロナルネットに代表されるように神経細胞周囲の細胞外マトリクスに組み込まれ、GPIアンカー型ブレビカンは細胞表面に直接結合する形をとる(図2)。GPIアンカー型特異的な抗体がないため、アイソフォームによる発現細胞の違いの検出はもっぱらin situ hybridizationに依存している。しかしながら、近年ISHの感度が上がり、GPIアンカー型の発現の報告が目立ってきている[9][10][10,11]。ADAMTSメンバーの発現もin situ hybridizationにより調べられ、神経回路の形成に加え、細胞外マトリクスのリモデリングにおける役割が想定される[11][12]。
BioRenderを使用し作製。
機能
ペリニューロナルネット
ブレビカンは、脳内で最も豊富なコンドロイチン硫酸プロテオグリカンの一つであり、ペリニューロナルネットの根本的な構成要素である(図2)[12][13]。ペリニューロナルネットには、細胞外マトリクス成分が濃縮されており、恒常的にシナプス可塑性を安定化させているという静的なイメージがあったが、Ricoらの研究によると、海馬のPVニューロンではブレビカンがカリウムチャネルの局在化とシナプスAMPA受容体のレベルを制御することでPVニューロンの性質を動的に調節し、その機能が空間的作業記憶と短期記憶に根本的に必要であることを報告した[10] [11]。2002年にFässlerらのグループがブレビカン欠損マウスを作製した[13][4]。ブレビカン欠損マウスは、海馬の長期増強(LTP)の維持に著しい障害を示した。
脳内のペリニューロナルネットは場所により成分も異なっており、さらに詳細な調査が必要である。
軸索被膜
ペリニューロナルネットとは異なり、軸索終末部を囲むようにコンドロイチン硫酸プロテオグリカンが局在し軸索被膜と呼ばれる。視床の軸索被膜はHAPLN4/Bral2により安定化されている[14][14]。機能についてはまだ不明である。
軸索初節
軸索が細胞体から起始する部分である軸索初節は活動電位の発生部位として、電位依存性ナトリウムチャネル(Nav)が高密度に集積している。ブレビカンは軸索初節に局在し、その局在はニューロファシン-186 (NF-186)に依存していることが分かった[15][15]。
ランビエ絞輪
ランビエ絞輪は髄鞘が途切れている部分で、活動電位が跳躍伝導するために重要である。中枢ランビエ絞輪には電位依存性ナトリウムチャネルだけでなくニューロファシン-186やバーシカンやブレビカンなどのコンドロイチン硫酸プロテオグリカンが集積している[16][16]。コンドロイチン硫酸プロテオグリカンの集積にはヒアルロン酸プロテオグリカンリンクタンパク質2 (HAPLN2)/Brain link protein 1 (Bral1)が重要である。ブレビカンは直径の太い軸索のランビエ絞輪に発現しており、太い軸索での早い跳躍伝導と機能的に関連することが考えられる[17][17]。ランビエ絞輪に局在するコンドロイチン硫酸プロテオグリカンはニューロファシン-186を介して電位依存性ナトリウムチャネルのクラスタリングにも一部関与している[18][18]。
髄鞘化
アストロサイトから分泌される分泌型ブレビカンが中枢神経の髄鞘化促進因子として注目されている[19][19]。
疾患とのかかわり
グリオーマ
ブレビカンは悪性度の高いグリオーマの細胞外環境で発現上昇するプロテオグリカンとして発見された[20][20]。注目すべきは低グリコシル化のブレビカンアイソフォームが多いことである。グリオーマの浸潤挙動は、組織特異的あるいは腫瘍特異的な細胞外タンパク質によって媒介されている可能性が示唆され、ブレビカン発現とADAMTS4などによるブレビカン切断が腫瘍浸潤と関係があるとされている[20] (Viapianoら2008)。また、正常脳でブレビカンのヒアルロン酸結合を安定化させる役目があるHAPLN4はグリオーマでは減少しており、これも侵襲性グリオーマの足場環境の変化として捉えられる[21][21]。低グリコシル化ブレビカンを標的とする低分子ペプチド(BTP)をペプチドライブラリーから見つけ、in vivoでのグリオーマ腫瘍標的化実験が行われている[22][22]。
アルツハイマー病
ヒトの死後脳研究で、アグリカンが主体のペリニューロナルネットとブレビカンに基づくシナプス周囲マトリックスの軸索被膜の変化と神経病理を比較した[23][23]。アミロイドプラーク部分においてペリニューロナルネットの損傷は見られず、ニューロンには神経原線維変化は見られなかった。これらの細胞外マトリクス機能には、神経細胞死を防ぐ保護的役割が含まれる可能性が示唆された。
老化バイオマーカー
成体においては、ペリニューロナルネットの発現は比較的安定しており、シナプス可塑性を制限し、神経回路の安定性を維持することで、神経系の正常な機能を確保している。しかし、高齢期には、ペリニューロナルネット の恒常性バランスが崩れ、この崩れは脳領域特異性を示し、神経回路を安定させる機能障害を招き、最終的には認知機能障害や記憶障害を引き起こすと考えられる[24][24]。Liuらは多モダリティー脳画像データと血漿プロテオームデータを統合し、脳の老化に伴う末梢プロテオームの変化を解析した[25][25]。メンデルランダム化解析は、ブレビカンと脳老化を示す指標である脳年齢差(BAG)の因果関係を支持した。ブレビカンは脳年齢差(BAG)と最も大きな負の相関を示し、ブレビカンは、認知症、アルツハイマー病、および脳卒中のリスク低下と関連していた。ブレビカンの調節異常は、複数の大脳皮質および皮質下構造に影響を及ぼす。ブレビカンは脳の老化および関連する脳障害の候補として挙げられているが、その根本的なメカニズムについてはさらに調査が必要である。
薬物依存
薬物依存は、内側前頭前野(mPFC)その他さまざまな脳領域におけるペリニューロナルネットの分布と構成に変化を引き起こす。薬物依存症の治療の成功は、禁断期間中の高い再発率によって妨げられている。ヘロインの自己投与後に長期禁断状態を経験したラットの内側前頭前野のシナプス分画の定量的プロテオミクス解析から、ブレビカンなどのペリニューロナルネットの成分の顕著な減少が示された[26][26]。内側前頭前野のGABA作動性介在ニューロンのペリニューロナルネットの分解・減少が禁断期間中の薬物探索行動への再発を高める新たな神経適応メカニズムと考えられる。最近、ニューロンを取り囲む細胞外マトリクス構造であるペリニューロナルネットが、学習、記憶、そして依存行動の調節因子として注目されている。ペリニューロナルネットはニューロンに構造的な支持を与えるだけでなく、メタロプロテアーゼによって経験依存的に動的にリモデリングされる[27][27]。
発作性転倒症候群
キャバリア・キング・チャールズ・スパニエル犬にみられる発作性転倒症候群の原因遺伝子がゲノムワイド関連解析を用いて第7染色体に同定され、ブレビカン遺伝子の15.7 kbの欠失と関連していることが判明した[28][28]。米国での既往歴のない同犬種の大規模な集団を対象にした広範な検査では、保因動物が極めて一般的であることが判明した(12.9%)。遺伝子変異を有する動物の数を最小限に抑えることを目的とした選択的交配プログラムの実施を可能にする。なお、ヒトでは同様の疾患でのブレビカン変異報告はない。
関連項目
参考文献
- ↑
Yamada, H., Watanabe, K., Shimonaka, M., & Yamaguchi, Y. (1994).
Molecular cloning of brevican, a novel brain proteoglycan of the aggrecan/versican family. The Journal of biological chemistry, 269(13), 10119-26. [PubMed:8144512] [WorldCat] - ↑
Jaworski, D.M., Kelly, G.M., & Hockfield, S. (1994).
BEHAB, a new member of the proteoglycan tandem repeat family of hyaluronan-binding proteins that is restricted to the brain. The Journal of cell biology, 125(2), 495-509. [PubMed:7512973] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Seidenbecher, C.I., Richter, K., Rauch, U., Fässler, R., Garner, C.C., & Gundelfinger, E.D. (1995).
Brevican, a chondroitin sulfate proteoglycan of rat brain, occurs as secreted and cell surface glycosylphosphatidylinositol-anchored isoforms. The Journal of biological chemistry, 270(45), 27206-12. [PubMed:7592978] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Frischknecht, R., & Seidenbecher, C.I. (2012).
Brevican: a key proteoglycan in the perisynaptic extracellular matrix of the brain. The international journal of biochemistry & cell biology, 44(7), 1051-4. [PubMed:22537913] [WorldCat] [DOI] - ↑
Mead, T.J., Bhutada, S., Martin, D.R., & Apte, S.S. (2022).
Proteolysis: a key post-translational modification regulating proteoglycans. American journal of physiology. Cell physiology, 323(3), C651-C665. [PubMed:35785985] [PMC] [WorldCat] [DOI] - ↑
Yamaguchi, Y. (2000).
Lecticans: organizers of the brain extracellular matrix. Cellular and molecular life sciences : CMLS, 57(2), 276-89. [PubMed:10766023] [PMC] [WorldCat] [DOI] - ↑
Seidenbecher, C.I., Gundelfinger, E.D., Böckers, T.M., Trotter, J., & Kreutz, M.R. (1998).
Transcripts for secreted and GPI-anchored brevican are differentially distributed in rat brain. The European journal of neuroscience, 10(5), 1621-30. [PubMed:9751135] [WorldCat] [DOI] - ↑
Gary, S.C., Zerillo, C.A., Chiang, V.L., Gaw, J.U., Gray, G., & Hockfield, S. (2000).
cDNA cloning, chromosomal localization, and expression analysis of human BEHAB/brevican, a brain specific proteoglycan regulated during cortical development and in glioma. Gene, 256(1-2), 139-47. [PubMed:11054543] [WorldCat] [DOI] - ↑
Favuzzi, E., Marques-Smith, A., Deogracias, R., Winterflood, C.M., Sánchez-Aguilera, A., Mantoan, L., ..., & Rico, B. (2017).
Activity-Dependent Gating of Parvalbumin Interneuron Function by the Perineuronal Net Protein Brevican. Neuron, 95(3), 639-655.e10. [PubMed:28712654] [WorldCat] [DOI] - ↑ 10.0 10.1
Hazlett, M.F., Hall, V.L., Patel, E., Halvorsen, A., Calakos, N., & West, A.E. (2024).
The Perineuronal Net Protein Brevican Acts in Nucleus Accumbens Parvalbumin-Expressing Interneurons of Adult Mice to Regulate Excitatory Synaptic Inputs and Motivated Behaviors. Biological psychiatry, 96(9), 694-707. [PubMed:38346480] [PMC] [WorldCat] [DOI] - ↑
Levy, C., Brooks, J.M., Chen, J., Su, J., & Fox, M.A. (2015).
Cell-specific and developmental expression of lectican-cleaving proteases in mouse hippocampus and neocortex. The Journal of comparative neurology, 523(4), 629-48. [PubMed:25349050] [PMC] [WorldCat] [DOI] - ↑
Fawcett, J.W., Oohashi, T., & Pizzorusso, T. (2019).
The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature reviews. Neuroscience, 20(8), 451-465. [PubMed:31263252] [WorldCat] [DOI] - ↑
Brakebusch, C., Seidenbecher, C.I., Asztely, F., Rauch, U., Matthies, H., Meyer, H., ..., & Fässler, R. (2002).
Brevican-deficient mice display impaired hippocampal CA1 long-term potentiation but show no obvious deficits in learning and memory. Molecular and cellular biology, 22(21), 7417-27. [PubMed:12370289] [PMC] [WorldCat] [DOI] - ↑
Cicanic, M., Edamatsu, M., Bekku, Y., Vorisek, I., Oohashi, T., & Vargova, L. (2018).
A deficiency of the link protein Bral2 affects the size of the extracellular space in the thalamus of aged mice. Journal of neuroscience research, 96(2), 313-327. [PubMed:28815777] [WorldCat] [DOI] - ↑
Hedstrom, K.L., Xu, X., Ogawa, Y., Frischknecht, R., Seidenbecher, C.I., Shrager, P., & Rasband, M.N. (2007).
Neurofascin assembles a specialized extracellular matrix at the axon initial segment. The Journal of cell biology, 178(5), 875-86. [PubMed:17709431] [PMC] [WorldCat] [DOI] - ↑
Bekku, Y., Vargová, L., Goto, Y., Vorísek, I., Dmytrenko, L., Narasaki, M., ..., & Oohashi, T. (2010).
Bral1: its role in diffusion barrier formation and conduction velocity in the CNS. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(8), 3113-23. [PubMed:20181608] [PMC] [WorldCat] [DOI] - ↑
Bekku, Y., Rauch, U., Ninomiya, Y., & Oohashi, T. (2009).
Brevican distinctively assembles extracellular components at the large diameter nodes of Ranvier in the CNS. Journal of neurochemistry, 108(5), 1266-76. [PubMed:19141078] [WorldCat] [DOI] - ↑
Susuki, K., Chang, K.J., Zollinger, D.R., Liu, Y., Ogawa, Y., Eshed-Eisenbach, Y., ..., & Rasband, M.N. (2013).
Three mechanisms assemble central nervous system nodes of Ranvier. Neuron, 78(3), 469-82. [PubMed:23664614] [PMC] [WorldCat] [DOI] - ↑
Seiler, S., Rudolf, F., Gomes, F.R., Pavlovic, A., Nebel, J., Seidenbecher, C.I., & Foo, L.C. (2024).
Astrocyte-derived factors regulate CNS myelination. Glia, 72(11), 2038-2060. [PubMed:39092473] [WorldCat] [DOI] - ↑ 20.0 20.1
Viapiano, M.S., Hockfield, S., & Matthews, R.T. (2008).
BEHAB/brevican requires ADAMTS-mediated proteolytic cleavage to promote glioma invasion. Journal of neuro-oncology, 88(3), 261-72. [PubMed:18398576] [PMC] [WorldCat] [DOI] - ↑
Sim, H., Hu, B., & Viapiano, M.S. (2009).
Reduced expression of the hyaluronan and proteoglycan link proteins in malignant gliomas. The Journal of biological chemistry, 284(39), 26547-56. [PubMed:19633295] [PMC] [WorldCat] [DOI] - ↑
von Spreckelsen, N., Fadzen, C.M., Hartrampf, N., Ghotmi, Y., Wolfe, J.M., Dubey, S., ..., & Cho, C.F. (2021).
Targeting glioblastoma using a novel peptide specific to a deglycosylated isoform of brevican. Advanced therapeutics, 4(4). [PubMed:33997269] [PMC] [WorldCat] [DOI] - ↑
Morawski, M., Brückner, G., Jäger, C., Seeger, G., Matthews, R.T., & Arendt, T. (2012).
Involvement of perineuronal and perisynaptic extracellular matrix in Alzheimer's disease neuropathology. Brain pathology (Zurich, Switzerland), 22(4), 547-61. [PubMed:22126211] [PMC] [WorldCat] [DOI] - ↑
Zhu, K., Fu, Y., Zhao, Y., Niu, B., & Lu, H. (2025).
Perineuronal nets: Role in normal brain physiology and aging, and pathology of various diseases. Ageing research reviews, 108, 102756. [PubMed:40254145] [WorldCat] [DOI] - ↑
Liu, W.S., You, J., Chen, S.D., Zhang, Y., Feng, J.F., Xu, Y.M., ..., & Cheng, W. (2025).
Plasma proteomics identify biomarkers and undulating changes of brain aging. Nature aging, 5(1), 99-112. [PubMed:39653801] [WorldCat] [DOI] - ↑
Van den Oever, M.C., Lubbers, B.R., Goriounova, N.A., Li, K.W., Van der Schors, R.C., Loos, M., ..., & Spijker, S. (2010).
Extracellular matrix plasticity and GABAergic inhibition of prefrontal cortex pyramidal cells facilitates relapse to heroin seeking. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 35(10), 2120-33. [PubMed:20592718] [PMC] [WorldCat] [DOI] - ↑
Lasek, A.W., Chen, H., & Chen, W.Y. (2018).
Releasing Addiction Memories Trapped in Perineuronal Nets. Trends in genetics : TIG, 34(3), 197-208. [PubMed:29289347] [PMC] [WorldCat] [DOI] - ↑
Gill, J.L., Tsai, K.L., Krey, C., Noorai, R.E., Vanbellinghen, J.F., Garosi, L.S., ..., & Harvey, R.J. (2012).
A canine BCAN microdeletion associated with episodic falling syndrome. Neurobiology of disease, 45(1), 130-6. [PubMed:21821125] [PMC] [WorldCat] [DOI]