蓋板
岡 雄一郎、佐藤 真
大阪大学医学系研究科 解剖学講座(神経機能形態学)/大阪大学医学系研究科 連合小児発達学研究科 こころの発達神経科学講座(分子生物遺伝学)
DOI:10.14931/bsd.3242 原稿受付日:2013年3月27日 原稿完成日:2013年9月2日 一部改訂:2021年6月29日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:roof plate
蓋板は、脊椎動物における神経発生の過程で神経板が閉じて形成される神経管の背側正中領域であり、骨形成因子などのシグナル分子を分泌する形成中心として、中枢神経系の背側のパターン形成において重要な働きを持つ。蓋板は終脳から脊髄まで脳の前後軸に沿ってどの部位にも存在するが、特に脊髄の背側部においてその形成機構が良く解析されている。第3脳室、第4脳室では蓋板上に血管が入り、蓋板由来の細胞とともに脈絡叢を形成する。
蓋板の構造
神経管の両側では上衣層(胚芽層:ependymal layer)、外套層(mantle layer、後の脊髄灰白質)、縁帯(marginal layer、後の脊髄白質)の3層構造をとっているが、蓋板(および底板)では細胞分裂が少なく、神経細胞が生じないので外套層が形成されない。上衣層と上衣細胞の突起から成る辺縁層は形成され、辺縁層は後に交連性の神経軸索の通路となるので、場所によっては厚く肥大する(特に底板の場合に顕著)。蓋板の細胞は神経管背側の湾曲部を構成するため、特徴的な鋭角三角形のような形態を示す。
蓋板形成の流れ
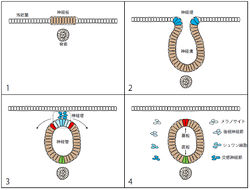
脊椎動物の初期発生における神経胚の時期には、外胚葉背側部に形成された神経板が陥入して神経溝(neural groove)となると、神経板と表皮外胚葉の境界部に神経堤(neural crest)が形成される。神経溝は次第に円筒状になり、最終的には背側部が融合して管が閉じて神経管を形成する。この時、神経堤は表皮と神経管の間の部分を占めるが、神経堤には神経管の背側部からもしばらく細胞が供給される。神経管背側部からの神経堤細胞の離脱が終わった時点で、神経管背側正中領域は蓋板となる(図)。
神経管背側正中領域から産生される神経堤細胞と蓋板細胞の前駆細胞は形態的にも分子的にも区別することができないため、共通の前駆細胞から産生されると考えられている。ただし、Krispinらはニワトリ体幹部神経管の細胞系譜を追跡し、将来、腹側の構造(交感神経節)を形成する細胞は神経管内の背側にあって最初に神経管を離脱し、反対に、背側に分布するメラノサイトとなる細胞は神経管内で腹側に分布して次第に背側に移動し最後に神経管を離脱することを明らかにした。蓋板細胞の前駆細胞は神経管内のメラノサイト前駆細胞より腹側に分布し、神経堤細胞が順次離脱していくのに伴って次第に背側に移動し、メラノサイト前駆細胞が離脱した後に背側正中領域を占めるとされている[1]。
蓋板形成の分子機構
初期の神経板は背側の性質を持っているが、脊索から分泌された腹側化シグナルSonic hedgehog (SHH)が作用して腹側が決定され、さらに表皮外胚葉から、のちには蓋板から背側化シグナルが分泌されることで背側領域ではSHHの作用が相殺されて背側が決定される。この背側の分化を誘導するシグナル分子には表皮外胚葉から分泌される因子と、神経管内で発現する内在性の因子がある。
分泌因子
分泌因子としては骨形成因子(bone morphogenetic protein,BMP)が主要な役割を果たしており、BMP4とBMP7はニワトリ胚の蓋板の形成時期に表皮外胚葉で一過的に発現する。これらを未分化なニワトリ神経板尾側部の培養液に加えると蓋板の細胞が誘導される。この誘導はnogginやfollistatinなどのBMPシグナルの特異的な阻害剤を用いて阻害することができる[2]。BMP4、BMP7、BMP阻害剤、あるいは活性型BMP受容体(caBMPR1A)などをニワトリHH (Hamburger-Hamilton stage)10期の神経板尾側部に電気穿孔法(electroporation)で導入する実験によりBMPシグナルは蓋板の発生に必要かつ十分であることが示されている[3][4]。
wingless-related mouse mammary tumour virus integration site(WNT)ファミリーのいくつかの分子はニワトリ及びマウスの表皮外胚葉や蓋板形成期の背側正中領域に発現している。HH10期のニワトリ神経板でWNTシグナルを抑えても蓋板の形成は阻害されなかった[3]。表皮外胚葉からのWNTシグナルが蓋板の誘導に必要かどうかはまだわからない。
ビタミンA欠乏条件下のウズラの神経管では腹側化が優勢であり、BMP4やWnt1、Msx2などの蓋板のマーカー遺伝子の発現領域が減少していた[5]。また、レチノイン酸合成酵素Raldh2(aldh1a2)遺伝子の第1イントロン内には四足脊椎動物で保存された配列があり、Raldh2の脊髄背側部における発現を制御するエンハンサー領域であることが示されている[6]。これらの研究はレチノイン酸シグナルが蓋板を含む神経管背側部の形成に何らかの役割を果たしていることを示唆している。
内在性因子
内在性因子としては、LIMホメオドメインを持つ転写因子LHX1Aが知られている。LHX1Aは蓋板の前駆細胞および分化した蓋板の細胞に特異的に発現している。Lhx1a遺伝子に変異を持つDreherマウスでは吻側の蓋板が形成されない[7]。ニワトリ脊髄や未分化な神経管吻側部のexplantにLMX1Aを異所性に発現させると蓋板関連分子の発現が誘導される[3]。LMX1Aの発現誘導にはBMPシグナルが必要かつ十分であることが示されている[3]。逆に、LMX1AがないとBMP4は蓋板を誘導できないので、LMX1AはBMPシグナルのメディエーターである[3]。異所性に発現したLMX1Aが蓋板を誘導できる領域は異所性に発現したBMPが誘導できる領域と比べて小さいので、BMPの下流にはLMX1A以外の経路もあると考えられる[3][4]。
LMX1BはオルソログであるLMX1Aと同様にニワトリの蓋板の前駆細胞や分化した蓋板細胞に発現し、過剰発現させると機能的な蓋板を誘導する[8]。また、LMX1Aの上流で機能し、異所性に発現させるとLMX1Aの発現を誘導する。マウスではLMX1Bは蓋板で発現しておらず、蓋板の誘導はLMX1Aのみに依存するが、Dreherマウスにおける蓋板形成異常はLMX1Bの過剰発現で部分的に回復するので、機能的には重複があると考えられる。ただし、LMX1BにLMX1Aと似た蓋板誘導能があるのか、LMX1Aとは異なる蓋板誘導経路を活性化しているのかは弁別できない。
BMPシグナルのターゲットであるMSXファミリーはマウスではMsx1、Msx2およびMsx3の3つの遺伝子から成り、すべて初期の脊髄背側に発現している。発生が進むにつれ、Msx1とMsx2は背側正中領域に限局するようになり、Msx3は神経管の背側1/3で蓋板を除く領域に発現する。マウスMsx1をニワトリ脊髄に発現させるといくつかの蓋板マーカーの発現を誘導できる[4]。
蓋板依存的な中枢神経系背側のパターン形成
脊髄
脊髄背側の運命決定
分化した蓋板は形成中心(organizing center)としてシグナル分子を分泌し、脊髄背側の神経細胞の分化を誘導する。
蓋板が脊髄背側の神経の運命決定に関わっていることを示す最初の知見は、未分化な神経板に蓋板を移植するとdI1とdI3という背側の介在神経細胞(dorsal interneuron)が誘導されるという発見であった[2]。その後、蓋板に特異的なgrowth differentiation factor 7 (Gdf7)遺伝子のプロモータを利用してジフテリアトキシン (DTA)を発現させるGdf7-DTAマウスを用いて蓋板を欠失させると、最も背側のdI1-3は誘導されず、これを補うように腹側のdI4-6が余計に誘導されること、また、dI1-3の前駆細胞が失われたことによってではなく、蓋板からのシグナルが発信されないことによってdI1-3が誘導されないことがわかり、背側の介在神経細胞はデフォルトではdI4-6になるが、蓋板に近い領域では蓋板からのシグナルがそれを抑制してdI1-3に方向付けることが明らかになった[9]。
一方、dreherマウスでは蓋板の欠失だけでなくdI1の減少も認められた。Lmx1aは蓋板でのみ発現しているので、これは蓋板からのnon-autonomousなシグナルが働いていることを示唆している[7][10]。このnon-autonomousな蓋板のシグナルの存在は、ニワトリ神経板でLmx1aやLmx1bを発現させて異所性に蓋板をつくると、その場所ではdI2-6の代わりにdI1がnon-autonomousに誘導されることからも示された[3][8]。
蓋板からの背側化シグナルの分子実体は主にBMPとWNTである。
BMP
LiemらはBMPファミリーの分子はdI1とdI3を誘導できることをニワトリ神経板のexplantを用いて示した[11][2]。その後、Timmerらがマウス神経管に活性化BMPレセプターを発現させる実験により、BMPシグナルの強度依存的にdI1-3を誘導することを示した。BMPシグナルが強い(高BMP濃度の)領域ではdI1が、逆にシグナルが低い領域ではdI3がより優勢に誘導される[12]。このBMPの局所的な濃度勾配は、BMPとヘパラン硫酸プロテオグリカン(heparan sulfate proteoglycans, HSPG)との相互作用によって形成される。N末端付近の塩基性アミノ酸に富むHSPGとの結合に重要な領域の5残基を欠失させたBMP4を神経管背側部に強制発現させると、野生型のBMP4を発現させた場合と比較してより広い範囲で背側化認められた[13]。ただし、個々のBMPタンパク質はそれぞれに特有の役割を果たしている。例えばBMPファミリーの関連因子で蓋板特異的に発現するGDF7をノックアウトするとdI1の一部の細胞のみが欠失する[14]。また、蓋板特異的に発現するBMP4はdI1の誘導に必要であるがdI2-5には必要ないのに対し、より広い神経管背側部に発現するBMP7はdI1, 3, 5の誘導に必要である[15]。
WNT
蓋板を含む神経管の背側部で発現するWnt1やWnt3aも背側のパターニングに関与している。Wnt1/Wnt3aのダブルノックアウトマウスでは蓋板の形成は正常であるが、dI1-3が激減する[16]。反対に、WNTシグナルの下流に当たるβ-カテニンの活性を上げると背側(Pax7陽性)から中央部(Pax6陽性)の神経前駆細胞が増加して、Nkx6.1、Olig2、Nkx2.2などを発現する腹側の前駆細胞が減少する。それに伴って、背側の介在神経細胞が多く誘導され、腹側の神経細胞は失われる[17][18]。また、Dreherマウスでは蓋板からのBMPシグナルが放出されないにもかかわらず、ある程度のdI1-3が誘導されるのは、残存しているWNTシグナルによるものだと考えられる[10]。
Lbx1
BMPとWNT以外で脊髄背側部のパターニングに関与すると考えられている分子としては、Lbx1が挙げられる。Lbx1のノックアウトマウスでは蓋板の形成は正常で、dI1-3も誘導されるが、dI4あるいはdI5が誘導されるべき領域でdI2あるいはdI3が誘導される[19][20]。
吻側中枢神経系
蓋板の形成や背側のパターン形成における蓋板の役割は、脊髄以外の中枢神経系では脊髄の場合ほどには詳しく解析されていないが、吻側の中枢神経系の背側のパターン形成に蓋板シグナルが重要であることを示す研究が複数報告されている。
後脳領域
後脳(hindbrain)の最前部である菱脳分節(rhombomere)1の背側からは小脳が形成され、特に小脳顆粒細胞(granule cells)は菱脳唇(rhombic lip)から誘導される最も背側の神経細胞である。マウス後脳の蓋板ではGdf7やBmp6/7が発現しており、これらのBMPシグナルは小脳顆粒細胞の特異化プログラムをスタートさせるのに十分であることが、explantを用いた実験で示されている[21]。ただし、これらのBMP分子は蓋板だけでなく隣接した非神経性の外胚葉にも発現しているので、本当に蓋板シグナルによって顆粒細胞が誘導されるのかどうかははっきりしない。一方、Lmx1aは蓋板に発現しており、蓋板の形成に必要である。Dreherマウスは将来小脳になる領域と隣接する蓋板が著しく小さくなっており、成体では正中領域の虫部の大半が失われて小脳が矮小化している[22][7]。
菱脳分節1背側部からはまた、青斑核のノルアドレナリン作動性ニューロンが分化する。青斑核ニューロンはMash1陽性の脳室帯で産生され、ホメオドメイン転写因子であるPhox2a、Phox2bを発現して最終的な分布領域である橋の背側部に移動する。ニワトリで中脳後脳境界部にnogginを加えてBMPシグナルを阻害するとPhox2陽性のニューロンが完全に失われるか、あるいは背側にずれる[23]。
間脳領域
マウスの吻側中枢神経系の蓋板ではBMPシグナルのエフェクターであるMsx1が発現しており、そのノックアウトマウスは間脳の蓋板を特異的に欠失している。その結果、正中の両側でPax6/7やLim1の発現が抑制され、交連下器官の形成不全が起きて胎生期水頭症になる[24]。また、En1を間脳の背側正中部で異所性に発現するトランスジェニックマウスでは蓋板、ひいては交連下器官ができず、また後交連も形成されない。これらのマウス系統ではどちらも、間脳背側の最前部にできる松果体の形成が不全である[25]。また、ゼブラフィッシュにおいても正常な背側正中部の形成とnodalのシグナルが松果体の正確なパターニングに必要である[26][27]。
終脳領域
終脳領域では蓋板を含む背側正中領域は陥入して2つの大脳半球の間に潜り込む。蓋板は後に脈略叢およびcortical hemとなる。Gdf7-DTAマウスで終脳の蓋板を破壊すると、脈略叢とcortical hemの細胞が劇的に減少するだけでなく、隣接する皮質領域も低形成となり、Lhx2の発現が低下する。すなわち、脈略叢とcortical hemはLhx2発現領域のパターニングに重要である。
蓋板とそれに由来する脈略叢とcortical hemにはBMPやWNTのシグナル分子が発現している。BMPシグナルの終脳背側のパターニングへの関与を示すデータとしては、外来性のBMPがニワトリ前脳のパターニングに異常を引き起こすこと[28]、Bmp5/Bmp7のダブルノックアウトマウスやBMPシグナルのアンタゴニストであるChordinあるいはNogginを投与したマウスにおいて前脳の低形成あるは形成異常が認められること[29][30]などがある。また、Foxg1-Creマウスを用いてBMPレセプターBmpr1aを終脳特異的に欠失させると、脈略叢が特異的に失われた[31]。一方、nestinエンハンサーを用いて活性型のBmpr1aを強制発現させると終脳の翼板(神経管の背側半分)がすべて脈略叢になった[32]。これらの結果は、終脳においてはBMPシグナルは広い領域に濃度依存的に作用するのではなく、正中領域のパターニングのみに必要であることを示唆している。
ニワトリ神経板の吻側部あるいは全胚に様々な濃度のWntやWntシグナルのアンタゴニストであるfrizzled receptor 8タンパク質の可溶性フラグメントを添加すると、腹側性の細胞運命を抑え、Pax6やNgn2の発現など、終脳の初期の背側性の性質を誘導する[33]。その後、WntシグナルとFgfシグナルが共存することによって終脳背側に決定されたEmx1陽性の細胞が誘導される。Fgfシグナルは背側正中領域の細胞の産生にも重要である[34][35]。正中領域が決定された後、Wnt3aはcortical hemに発現する。Wnt3aノックアウトマウスではcortical hemの隣から分化する海馬が完全に欠失する[36]。
交連性神経の軸索誘導
蓋板は腹側の交連性神経の軸索に対して反発性のシグナルを分泌している。また、背側の交連性神経の軸側に対しても、その走行を制御していると考えられている。
蓋板から分泌されるBmp7は、dI1の軸索に対してchemoattractantとして作用し、腹側に伸びるよう方向性を与えている[37]。別のBMP分子であるGdf7はBmp7とヘテロダイマーを形成してBmp7の作用を増強している[38]。また、このBMPシグナルはLimk1(Lim domain kinase 1)を介して交連神経の軸索伸長速度を調節している[39]。
ニワトリ間脳後部の蓋板から形成される交連下器官(Subcommissural organ, SCO)の外側部はSCO-spondinという糖タンパク質を分泌している。SCO-spondinには後交連の軸索を束にする活性があると考えられ、実際、SCO-spondin陽性部の上部では後交連の軸索は束となって走行している[40]。
関連項目
参考文献
- ↑
Krispin, S., Nitzan, E., Kassem, Y., & Kalcheim, C. (2010).
Evidence for a dynamic spatiotemporal fate map and early fate restrictions of premigratory avian neural crest. Development (Cambridge, England), 137(4), 585-95. [PubMed:20110324] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Liem, K.F., Tremml, G., & Jessell, T.M. (1997).
A role for the roof plate and its resident TGFbeta-related proteins in neuronal patterning in the dorsal spinal cord. Cell, 91(1), 127-38. [PubMed:9335341] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3 3.4 3.5 3.6
Chizhikov, V.V., & Millen, K.J. (2004).
Control of roof plate formation by Lmx1a in the developing spinal cord. Development (Cambridge, England), 131(11), 2693-705. [PubMed:15148302] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Liu, Y., Helms, A.W., & Johnson, J.E. (2004).
Distinct activities of Msx1 and Msx3 in dorsal neural tube development. Development (Cambridge, England), 131(5), 1017-28. [PubMed:14973289] [WorldCat] [DOI] - ↑
Wilson, L., Gale, E., Chambers, D., & Maden, M. (2004).
Retinoic acid and the control of dorsoventral patterning in the avian spinal cord. Developmental biology, 269(2), 433-46. [PubMed:15110711] [WorldCat] [DOI] - ↑
Castillo, H.A., Cravo, R.M., Azambuja, A.P., Simões-Costa, M.S., Sura-Trueba, S., Gonzalez, J., ..., & Xavier-Neto, J. (2010).
Insights into the organization of dorsal spinal cord pathways from an evolutionarily conserved raldh2 intronic enhancer. Development (Cambridge, England), 137(3), 507-18. [PubMed:20081195] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Millonig, J.H., Millen, K.J., & Hatten, M.E. (2000).
The mouse Dreher gene Lmx1a controls formation of the roof plate in the vertebrate CNS. Nature, 403(6771), 764-9. [PubMed:10693804] [WorldCat] [DOI] - ↑ 8.0 8.1
Chizhikov, V.V., & Millen, K.J. (2004).
Control of roof plate development and signaling by Lmx1b in the caudal vertebrate CNS. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(25), 5694-703. [PubMed:15215291] [PMC] [WorldCat] [DOI] - ↑
Lee, K.J., Dietrich, P., & Jessell, T.M. (2000).
Genetic ablation reveals that the roof plate is essential for dorsal interneuron specification. Nature, 403(6771), 734-40. [PubMed:10693795] [WorldCat] [DOI] - ↑ 10.0 10.1
Millen, K.J., Millonig, J.H., & Hatten, M.E. (2004).
Roof plate and dorsal spinal cord dl1 interneuron development in the dreher mutant mouse. Developmental biology, 270(2), 382-92. [PubMed:15183721] [WorldCat] [DOI] - ↑
Liem, K.F., Tremml, G., Roelink, H., & Jessell, T.M. (1995).
Dorsal differentiation of neural plate cells induced by BMP-mediated signals from epidermal ectoderm. Cell, 82(6), 969-79. [PubMed:7553857] [WorldCat] [DOI] - ↑
Timmer, J.R., Wang, C., & Niswander, L. (2002).
BMP signaling patterns the dorsal and intermediate neural tube via regulation of homeobox and helix-loop-helix transcription factors. Development (Cambridge, England), 129(10), 2459-72. [PubMed:11973277] [WorldCat] - ↑
Hu, Q., Ueno, N., & Behringer, R.R. (2004).
Restriction of BMP4 activity domains in the developing neural tube of the mouse embryo. EMBO reports, 5(7), 734-9. [PubMed:15218525] [PMC] [WorldCat] [DOI] - ↑
Lee, K.J., Mendelsohn, M., & Jessell, T.M. (1998).
Neuronal patterning by BMPs: a requirement for GDF7 in the generation of a discrete class of commissural interneurons in the mouse spinal cord. Genes & development, 12(21), 3394-407. [PubMed:9808626] [PMC] [WorldCat] [DOI] - ↑
Le Dréau, G., Garcia-Campmany, L., Rabadán, M.A., Ferronha, T., Tozer, S., Briscoe, J., & Martí, E. (2012).
Canonical BMP7 activity is required for the generation of discrete neuronal populations in the dorsal spinal cord. Development (Cambridge, England), 139(2), 259-68. [PubMed:22159578] [PMC] [WorldCat] [DOI] - ↑
Muroyama, Y., Fujihara, M., Ikeya, M., Kondoh, H., & Takada, S. (2002).
Wnt signaling plays an essential role in neuronal specification of the dorsal spinal cord. Genes & development, 16(5), 548-53. [PubMed:11877374] [PMC] [WorldCat] [DOI] - ↑
Alvarez-Medina, R., Cayuso, J., Okubo, T., Takada, S., & Martí, E. (2008).
Wnt canonical pathway restricts graded Shh/Gli patterning activity through the regulation of Gli3 expression. Development (Cambridge, England), 135(2), 237-47. [PubMed:18057099] [WorldCat] [DOI] - ↑
Yu, W., McDonnell, K., Taketo, M.M., & Bai, C.B. (2008).
Wnt signaling determines ventral spinal cord cell fates in a time-dependent manner. Development (Cambridge, England), 135(22), 3687-96. [PubMed:18927156] [WorldCat] [DOI] - ↑
Gross, M.K., Dottori, M., & Goulding, M. (2002).
Lbx1 specifies somatosensory association interneurons in the dorsal spinal cord. Neuron, 34(4), 535-49. [PubMed:12062038] [WorldCat] [DOI] - ↑
Müller, T., Brohmann, H., Pierani, A., Heppenstall, P.A., Lewin, G.R., Jessell, T.M., & Birchmeier, C. (2002).
The homeodomain factor lbx1 distinguishes two major programs of neuronal differentiation in the dorsal spinal cord. Neuron, 34(4), 551-62. [PubMed:12062039] [WorldCat] [DOI] - ↑
Alder, J., Lee, K.J., Jessell, T.M., & Hatten, M.E. (1999).
Generation of cerebellar granule neurons in vivo by transplantation of BMP-treated neural progenitor cells. Nature neuroscience, 2(6), 535-40. [PubMed:10448218] [WorldCat] [DOI] - ↑
Manzanares, M., Trainor, P.A., Ariza-McNaughton, L., Nonchev, S., & Krumlauf, R. (2000).
Dorsal patterning defects in the hindbrain, roof plate and skeleton in the dreher (dr(J)) mouse mutant. Mechanisms of development, 94(1-2), 147-56. [PubMed:10842066] [WorldCat] [DOI] - ↑
Vogel-Höpker, A., & Rohrer, H. (2002).
The specification of noradrenergic locus coeruleus (LC) neurones depends on bone morphogenetic proteins (BMPs). Development (Cambridge, England), 129(4), 983-91. [PubMed:11861481] [WorldCat] - ↑
Bach, A., Lallemand, Y., Nicola, M.A., Ramos, C., Mathis, L., Maufras, M., & Robert, B. (2003).
Msx1 is required for dorsal diencephalon patterning. Development (Cambridge, England), 130(17), 4025-36. [PubMed:12874124] [WorldCat] [DOI] - ↑
Louvi, A., & Wassef, M. (2000).
Ectopic engrailed 1 expression in the dorsal midline causes cell death, abnormal differentiation of circumventricular organs and errors in axonal pathfinding. Development (Cambridge, England), 127(18), 4061-71. [PubMed:10952903] [WorldCat] - ↑
Concha, M.L., Burdine, R.D., Russell, C., Schier, A.F., & Wilson, S.W. (2000).
A nodal signaling pathway regulates the laterality of neuroanatomical asymmetries in the zebrafish forebrain. Neuron, 28(2), 399-409. [PubMed:11144351] [WorldCat] [DOI] - ↑
Liang, J.O., Etheridge, A., Hantsoo, L., Rubinstein, A.L., Nowak, S.J., Izpisúa Belmonte, J.C., & Halpern, M.E. (2000).
Asymmetric nodal signaling in the zebrafish diencephalon positions the pineal organ. Development (Cambridge, England), 127(23), 5101-12. [PubMed:11060236] [WorldCat] - ↑
Golden, J.A., Bracilovic, A., McFadden, K.A., Beesley, J.S., Rubenstein, J.L., & Grinspan, J.B. (1999).
Ectopic bone morphogenetic proteins 5 and 4 in the chicken forebrain lead to cyclopia and holoprosencephaly. Proceedings of the National Academy of Sciences of the United States of America, 96(5), 2439-44. [PubMed:10051661] [PMC] [WorldCat] [DOI] - ↑
Solloway, M.J., & Robertson, E.J. (1999).
Early embryonic lethality in Bmp5;Bmp7 double mutant mice suggests functional redundancy within the 60A subgroup. Development (Cambridge, England), 126(8), 1753-68. [PubMed:10079236] [WorldCat] - ↑
Bachiller, D., Klingensmith, J., Kemp, C., Belo, J.A., Anderson, R.M., May, S.R., ..., & De Robertis, E.M. (2000).
The organizer factors Chordin and Noggin are required for mouse forebrain development. Nature, 403(6770), 658-61. [PubMed:10688202] [WorldCat] [DOI] - ↑
Hébert, J.M., Mishina, Y., & McConnell, S.K. (2002).
BMP signaling is required locally to pattern the dorsal telencephalic midline. Neuron, 35(6), 1029-41. [PubMed:12354394] [WorldCat] [DOI] - ↑
Panchision, D.M., Pickel, J.M., Studer, L., Lee, S.H., Turner, P.A., Hazel, T.G., & McKay, R.D. (2001).
Sequential actions of BMP receptors control neural precursor cell production and fate. Genes & development, 15(16), 2094-110. [PubMed:11511541] [PMC] [WorldCat] [DOI] - ↑
Gunhaga, L., Marklund, M., Sjödal, M., Hsieh, J.C., Jessell, T.M., & Edlund, T. (2003).
Specification of dorsal telencephalic character by sequential Wnt and FGF signaling. Nature neuroscience, 6(7), 701-7. [PubMed:12766771] [WorldCat] [DOI] - ↑
Crossley, P.H., Martinez, S., Ohkubo, Y., & Rubenstein, J.L. (2001).
Coordinate expression of Fgf8, Otx2, Bmp4, and Shh in the rostral prosencephalon during development of the telencephalic and optic vesicles. Neuroscience, 108(2), 183-206. [PubMed:11734354] [WorldCat] [DOI] - ↑
Storm, E.E., Rubenstein, J.L., & Martin, G.R. (2003).
Dosage of Fgf8 determines whether cell survival is positively or negatively regulated in the developing forebrain. Proceedings of the National Academy of Sciences of the United States of America, 100(4), 1757-62. [PubMed:12574514] [PMC] [WorldCat] [DOI] - ↑
Lee, S.M., Tole, S., Grove, E., & McMahon, A.P. (2000).
A local Wnt-3a signal is required for development of the mammalian hippocampus. Development (Cambridge, England), 127(3), 457-67. [PubMed:10631167] [WorldCat] - ↑
Augsburger, A., Schuchardt, A., Hoskins, S., Dodd, J., & Butler, S. (1999).
BMPs as mediators of roof plate repulsion of commissural neurons. Neuron, 24(1), 127-41. [PubMed:10677032] [WorldCat] [DOI] - ↑
Butler, S.J., & Dodd, J. (2003).
A role for BMP heterodimers in roof plate-mediated repulsion of commissural axons. Neuron, 38(3), 389-401. [PubMed:12741987] [WorldCat] [DOI] - ↑
Phan, K.D., Hazen, V.M., Frendo, M., Jia, Z., & Butler, S.J. (2010).
The bone morphogenetic protein roof plate chemorepellent regulates the rate of commissural axonal growth. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(46), 15430-40. [PubMed:21084599] [PMC] [WorldCat] [DOI] - ↑
Stanic, K., Montecinos, H., & Caprile, T. (2010).
Subdivisions of chick diencephalic roof plate: implication in the formation of the posterior commissure. Developmental dynamics : an official publication of the American Association of Anatomists, 239(10), 2584-93. [PubMed:20730872] [WorldCat] [DOI]