底板
原 聡史、白崎 竜一
大阪大学大学院生命機能研究科
DOI:10.14931/bsd.6921 原稿受付日:2016年2月17日 原稿完成日:2016年7月24日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:floor plate 英略語:FP 独:Bodenplatte 仏:plaque du plancher
底板とは脊髄尾部から吻側の中脳にかけて、神経管の腹側正中部に形成されるグリア細胞から成る組織である。脊椎動物の発生期において、中枢神経系のパターン形成に関わる分泌因子や接着因子を発現することで、脊髄の運動ニューロンに代表される神経管腹側で生まれる神経細胞の分化誘導、底板で正中交差を形成する交連ニューロンの軸索ガイダンス、さらには小脳前核神経細胞などの底板付近での細胞移動に重要な役割を果たしている。
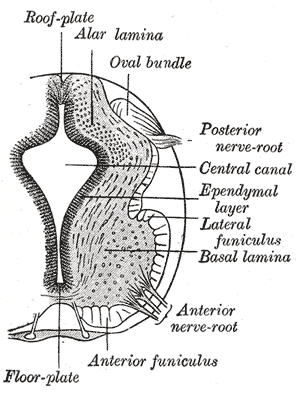
発生期ヒト脊髄の断面を示す。Grayによる。
発生
底板は神経系の発生初期に、神経管の腹側正中部に形成されるグリア細胞由来の組織である[1]。神経生物学の黎明期から、Kingsburyらによって底板は神経系の発生分化に重要な役割を果たしている可能性が指摘されてきた[2]。
そして近年、分子細胞生物学の技術的な進展を受けて底板の性質が徐々に明らかにされてきた。1990年、DoddとJessellらのグループはニワトリ胚を用いた実験で、異所的に新たに移植された脊索によって神経管背側や側方部に異所的な底板が分化誘導されること、また底板形成前に脊索を除去することで底板の形成が阻害されることを示した[3]。これらの結果から、脊索に発現される何らかの分泌因子が底板の分化誘導に重要であることが示唆された。
その後ショウジョウバエのパターン形成遺伝子hh(ヘッジホッグ)の脊椎動物相同遺伝子が3つ報告され、その内の1つであるshhがコードするタンパク質SHH(ソニック・ヘッジホッグ)が、脊索から分泌されて底板の発生分化に不可欠な分子であることが明らかにされた[4] [5]。
また、ノックアウトマウスなどの変異マウスの解析から、Shhシグナルによる底板の発生分化に際してはその下流で、7回膜貫通型タンパク質Smoothened(Smo)やジンクフィンガー型転写調節因子Gli2の神経管腹側正中部での発現が必須であることが報告された[6] [7] [8]。
またフォークヘッド型転写調節因子Foxa2が底板細胞の発生初期に特異的に発現し、その分化に寄与している[9]。Foxa2は当初、底板の分子マーカーとして用いられていたが、近年、神経管腹側で底板と接するV3型ニューロンも次第にFoxa2を発現するようになることが明らかとなり、底板の発生分化を解析する上ではホメオボックス型転写調節因子Arxが、より厳密な意味での底板特異的な分子マーカーとして用いられる[10]。
一方で、ゼブラフィッシュにおいては底板の分化に果たすShhの役割は限定的であり、同じく脊索から分泌されるTGF-βスーパーファミリータンパク質Nodalが底板の分化に不可欠である[11]。
機能
神経管腹側細胞への分化誘導
底板の主な機能の一つはShhの分泌源として、腹側から背側にわたりShhの濃度勾配を形成することで、モルフォゲン(morphogen)として作用することにある。特に神経管の腹側で発生分化する細胞に対して決定的な作用を及ぼし、脊索および底板から分泌されるShhが形成する濃度勾配の中での特定の濃度によって異なるクラスのニューロンが誘導されると考えられている。
その代表的な例としては運動ニューロンが知られ、底板由来Shhの作用機序の理解が分子レベルにおいて最も進んでいる。その先駆的な研究の例としては、ニワトリ胚を用いての底板の異所的な移植実験による運動ニューロンの分化誘導[12]、底板の組織片培養によるin vitroでの運動ニューロン分化誘導能の直接的な検出[13] [14]、底板由来Shhの濃度依存的な運動ニューロンへの運命決定機構やその発現抑制が運動ニューロンの消失を引き起こすことを示した一連の研究が挙げられる[15] [16]。
底板に端を発するShhの分子カスケードではまず、神経前駆細胞の時期において底板からの距離に応じて形成される固有のShh濃度の作用により、ホメオドメイン型転写調節因子とbHLH型転写調節因子の特異的な組み合わせ発現が促される[17]。その後、それぞれの神経前駆細胞のクラスに付与された固有の遺伝プログラム(転写調節因子コード)が、最終細胞分裂後の個々の神経細胞のクラス特異的な運命決定に関わり、その分子カスケードの最終段階として、軸索投射先を規定する軸索ガイダンスプログラムや樹状突起形態などを制御する分子プログラムの発現が引き起こされる[18]。尚、神経前駆細胞の運命決定過程において中心的な役割を担っている底板由来のShhは、
その後に交連ニューロン軸索の底板へのガイダンスにも関与していることが報告されているが、そこでは運命決定の時とは異なるシグナル伝達カスケードが軸索成長円錐内で活性化していることが示されている[19] [20]。
軸索ガイダンス
脊椎動物の発生期において、最終細胞分裂後の神経細胞に対する底板の重要な役割としては、神経回路形成時における軸索ガイダンスが挙げられる[21]。特に、底板で正中交差を形成する交連ニューロン軸索における役割は、軸索ガイダンス研究の重要なモデルの一つとして、この研究領域を歴史的にも牽引してきている[22] [23]。
1988年、コロンビア大学のJessell研究室にてポスドクであったTessier-LavigneとDodd研究室のPlaczekは、ラット胎仔を用いた脊髄組織片の共培養を3次元コラーゲンゲルアッセイにより行い、正中交差形成時期の底板細胞が何らかの分子を分泌することで、脊髄交連ニューロンの軸索を特異的に誘引することを見出した[24] [25]。その後、カリフォルニア大学サンフランシスコ校にて、Tessier-Lavigneを中心とするグループはその底板由来の誘引活性の正体として、ネトリン-1を同定するに至った[26] [27]。
また、ネトリン-1は底板のすべての吻尾軸レベル(脊髄尾側から中脳吻側までの領域)において発現していたことから、底板由来のネトリン-1による腹側正中部への軸索誘引作用は脊髄にとどまらず、より吻側の脳においても誘引作用を受けている軸索群が存在している可能性が考えられた[26]。実際、後脳の底板で正中交差を行う小脳核ニューロンの軸索[28]や、中脳の底板で正中交差を行う視蓋脊髄路投射の軸索[29]においても、底板由来のネトリン-1による誘引作用が報告された。
一方で、底板は交連ニューロン軸索にとっては対側の最終標的細胞に投射する途中における中間標的としても重要な役割を果たし、正中交差後の交連ニューロンの軸索挙動を規定している[30]。特に、交連ニューロン軸索と底板細胞との相互作用は、ネトリン-1により誘引されて底板に到達した交連ニューロン軸索に対してネトリン-1に対する応答性を失わせ、さらには底板に発現する反発分子であるスリットやセマフォリンへの応答性を正中交差後に獲得させることが報告された[31] [32]。
このような軸索応答性の制御により、交連ニューロン軸索をネトリン-1の分泌源である底板に留めずに、さらには一度、底板で正中交差を形成した軸索に対しては再び正中交差が起こらないようにしていると考えられている。さらに近年、底板での軸索応答性の変化に関わる交連ニューロン側の責任分子の一つとして、ロボ3(ロボ3.1とロボ3.2)が同定され、底板に発現している何らかの分子(2016年1月現在、未同定)が正中交差時の交連ニューロン軸索に作用することで、ロボ3の交連ニューロンにおける発現のオン・オフを制御していることが示されている[33] [34]。
また、交連ニューロン軸索と底板細胞との相互作用が、軸索成長円錐内での局所的なタンパク質翻訳を引き起こし、その結果が正中交差後の軸索においてEphレセプターの発現増大に関与しているとする可能性も指摘されている[35]。
一方で、底板は腹側正中部から離れる方向に伸長していく軸索群に対しては反発活性を示すことが組織培養片を用いたin vitroの系で報告されている[36] [37] [38]。尚、底板による軸索ガイダンス全般においては、底板細胞に発現している誘引分子と反発分子が分泌性か膜結合接着性かにより、その作用効果や及ぼされる作動距離が異なる。以下では、底板に発現している主要な軸索ガイダンス分子の機能について概説する。
分泌性因子
ネトリン
Tessier-Lavigneらによる脊髄背側組織と底板組織の3次元コラーゲンゲル内での共培養実験の結果、底板から分泌されるタンパク質性の分子が交連ニューロンの軸索伸長促進、および距離依存的な誘引に関わっていることが示唆された[24] [25]。この分泌因子は後に単離され、ネトリン-1と命名された[26] [27]。ネトリン-1は、ショウジョウバエからヒトに至るまで、構造的にも機能的にも保存された分子であり、それぞれの動物種においては発生期中枢神経系の正中部細胞に発現されるようになるという特徴をもつ[39]。尚、交連ニューロンの軸索は腹側正中部の底板へ伸長する過程では、ネトリン-1の受容体の1つであるDCCを発現していることが知られている[40]。また、底板から分泌されるネトリン-1が、実際に脊髄内で、腹側から背側にかけて濃度勾配を形成して存在していることが示されている[41]。一方で、交連ニューロンの軸索伸長方向とは逆で、底板から離れる背側方向に伸長していく後脳の滑車神経の軸索に対しては、反発作用を示すことがin vitroの3次元コラーゲンゲルアッセイにおいて報告されている[36]。尚、ネトリン-1ノックアウトマウスの表現型解析においては、交連ニューロン軸索の底板への伸長過程は影響を受けていたが、滑車神経の軸索ガイダンスには異常が認められなかった[42] [43]。
スリット
底板から分泌されているガイダンス分子の中で、ネトリン以外で反発作用をもつ分子として最初に同定された[44] [45]。その受容体であるロボ1やロボ2を発現する軸索に作用することで反発活性を示す[45]。底板から離れる方向に伸長していく脊髄や後脳の運動ニューロンの軸索は、スリットの受容体であるロボ1を発現しており、スリットにより反発作用を受けることが報告されている[44] [46]。交連ニューロンの軸索は、正中交差前は底板由来のスリットに対して反発作用を示さないが、正中交差後はスリットへの応答性を獲得することで反発作用を受けるようになる[32]。これにより、交連ニューロン軸索が正中交差後に、再び正中交差を行ってしまうようなガイダンスエラーを防いでいると考えられている。
また、この一連の過程の分子レベルでの解明が進んでおり、ロボ3.1の交連ニューロン軸索における発現が鍵を握っていることが知られる。すなわち、正中交差前では、交連ニューロンの軸索はロボ3.1とロボ1を共発現しており、このロボ3.1がロボ1の機能を内在的に抑制することで底板由来のスリットからの反発を防いでいる。一方で、正中交差後では、ロボ3.1の発現が軸索から消失するためにロボ1の抑制状態が解除され、その結果として、底板由来のスリットが正中交差後の交連ニューロン軸索を反発できるようになる。これら一連の分子カスケードは、ロボ3のノックアウトマウスを用いたin vivo ならびにin vitroの詳細な解析により示された[33] [47]。
Wnt
脊髄交連ニューロンの軸索が正中交差後に方向転換して吻側へ伸長していく際には、底板由来の分泌性タンパク質Wntが吻尾軸方向への軸索ガイダンスに重要な役割を果たしている。特に、底板でのWnt4の発現(論文発表データとしてはタンパク質レベルではなく、mRNAの発現レベル)は、脊髄から後脳にわたり、尾側で少なく吻側ほど多くなっていることが報告されており、Wnt4タンパク質が底板近傍で吻尾軸方向にそって濃度勾配を形成していると推測されている。
さらに、コラーゲンゲルを用いた組織片共培養により、Wnt4タンパク質がWntの受容体であるFrizzled3を発現した正中交差後の軸索に対して誘引作用を引き起こすことが示された[48]。これらの結果から、脊髄交連ニューロンの軸索は、正中交差後に底板近傍のWnt4タンパク質の濃度勾配を感知することで、よりWnt濃度の高い吻側へ伸長していると考えられている。
セマフォリン
セマフォリン3クラスのSema3Bはスリットと同様に底板から分泌されており、正中交差後の脊髄交連ニューロンの軸索に対して反発作用を及ぼすことで、底板への再侵入(再交差)を防いでいると考えられている[32]。またこの時、同じく底板から分泌されているグリア細胞株由来神経栄養因子 (glial cell line derived neurotrophic factor, GDNF)が、交連ニューロンに発現しているプレキシン-A1のカルパインによる分解作用を抑制することで、正中交差後の軸索膜上でのプレキシン-A1のタンパク質発現を安定化させていることが報告された[49]。これにより、底板由来のSema3Bがニューロピリン-2とプレキシン-A1の受容体複合体を介して、正中交差後の軸索に対して反発作用を及ぼしていると考えられている。
接着性因子
NrCAM
ニワトリ胚を用いた実験により、底板に発現している接着分子NrCAMは脊髄交連ニューロンの軸索に発現するAxonin-1と結合することで、底板細胞に発現する反発分子からの反発作用を受けるのを防ぎ、それにより軸索が底板に侵入して正中交差が可能になることが示唆されている[50]。また、NrCAMはGDNFと共同して交連ニューロン軸索内でのカルパインの活性を抑制することでPlexin-A1の分解を妨げ、その結果として正中交差後の軸索が底板由来のSema3Bに対して応答性を獲得する、すなわち反発作用を受けるようになることが示されている[51]。
エフリン
膜貫通型エフリンクラスのエフリン-B3が底板に発現していることが知られている[52]。ノックアウトマウスの解析により、脊髄交連ニューロンに発現するEphB受容体とエフリン-B3による順行性のシグナル伝達が、正常な軸索正中交差に必要であることが報告されている[53]。
細胞移動
神経細胞は発達の過程で、生まれた場所から正しく機能するための場所へと移動する。このような細胞移動の過程においても、底板由来のガイダンス分子が重要な役割を果たしている。後脳背側の菱脳唇で生まれる下オリーブ核ニューロンに代表される小脳前核ニューロンは発達に伴い腹側の底板に向かって細胞移動を行うが、この腹側への細胞移動に底板から分泌されるネトリン-1が誘引的に作用していることが示されている[54]。
また、下オリーブ核ニューロンの細胞体はロボ1とロボ2を発現することで底板由来のスリットによる反発作用を受けることが知られ、この反発作用により下オリーブ核ニューロンの細胞体が底板を越えて対側へ移動することが妨げられていると考えられている[55]。
一方で、オリゴデンドロサイトは底板近傍で生まれた後に、底板から離れる方向に細胞移動を行うことが知られているが、この細胞移動に底板由来のネトリン-1の反発作用が関与していることが報告されている[56]。
関連項目
参考文献
- ↑
Placzek, M., & Briscoe, J. (2005).
The floor plate: multiple cells, multiple signals. Nature reviews. Neuroscience, 6(3), 230-40. [PubMed:15738958] [WorldCat] [DOI] - ↑ Kingsbury BF.
The developmental significance of the floor-plate of the brain and spinal cord.
J. Comp. Neurol.: 1930, 50(1);177-207. - ↑
Placzek, M., Tessier-Lavigne, M., Yamada, T., Jessell, T., & Dodd, J. (1990).
Mesodermal control of neural cell identity: floor plate induction by the notochord. Science (New York, N.Y.), 250(4983), 985-8. [PubMed:2237443] [WorldCat] [DOI] - ↑
Roelink, H., Augsburger, A., Heemskerk, J., Korzh, V., Norlin, S., Ruiz i Altaba, A., ..., & Jessell, T.M. (1994).
Floor plate and motor neuron induction by vhh-1, a vertebrate homolog of hedgehog expressed by the notochord. Cell, 76(4), 761-75. [PubMed:8124714] [WorldCat] [DOI] - ↑
Chiang, C., Litingtung, Y., Lee, E., Young, K.E., Corden, J.L., Westphal, H., & Beachy, P.A. (1996).
Cyclopia and defective axial patterning in mice lacking Sonic hedgehog gene function. Nature, 383(6599), 407-13. [PubMed:8837770] [WorldCat] [DOI] - ↑
Wijgerde, M., McMahon, J.A., Rule, M., & McMahon, A.P. (2002).
A direct requirement for Hedgehog signaling for normal specification of all ventral progenitor domains in the presumptive mammalian spinal cord. Genes & development, 16(22), 2849-64. [PubMed:12435628] [PMC] [WorldCat] [DOI] - ↑
Ding, Q., Motoyama, J., Gasca, S., Mo, R., Sasaki, H., Rossant, J., & Hui, C.C. (1998).
Diminished Sonic hedgehog signaling and lack of floor plate differentiation in Gli2 mutant mice. Development (Cambridge, England), 125(14), 2533-43. [PubMed:9636069] [WorldCat] - ↑
Matise, M.P., Epstein, D.J., Park, H.L., Platt, K.A., & Joyner, A.L. (1998).
Gli2 is required for induction of floor plate and adjacent cells, but not most ventral neurons in the mouse central nervous system. Development (Cambridge, England), 125(15), 2759-70. [PubMed:9655799] [WorldCat] - ↑
Sasaki, H., & Hogan, B.L. (1994).
HNF-3 beta as a regulator of floor plate development. Cell, 76(1), 103-15. [PubMed:8287471] [WorldCat] [DOI] - ↑
Ribes, V., Balaskas, N., Sasai, N., Cruz, C., Dessaud, E., Cayuso, J., ..., & Briscoe, J. (2010).
Distinct Sonic Hedgehog signaling dynamics specify floor plate and ventral neuronal progenitors in the vertebrate neural tube. Genes & development, 24(11), 1186-200. [PubMed:20516201] [PMC] [WorldCat] [DOI] - ↑
Strähle, U., Lam, C.S., Ertzer, R., & Rastegar, S. (2004).
Vertebrate floor-plate specification: variations on common themes. Trends in genetics : TIG, 20(3), 155-62. [PubMed:15036809] [WorldCat] [DOI] - ↑
Yamada, T., Placzek, M., Tanaka, H., Dodd, J., & Jessell, T.M. (1991).
Control of cell pattern in the developing nervous system: polarizing activity of the floor plate and notochord. Cell, 64(3), 635-47. [PubMed:1991324] [WorldCat] [DOI] - ↑
Ericson, J., Thor, S., Edlund, T., Jessell, T.M., & Yamada, T. (1992).
Early stages of motor neuron differentiation revealed by expression of homeobox gene Islet-1. Science (New York, N.Y.), 256(5063), 1555-60. [PubMed:1350865] [WorldCat] [DOI] - ↑
Yamada, T., Pfaff, S.L., Edlund, T., & Jessell, T.M. (1993).
Control of cell pattern in the neural tube: motor neuron induction by diffusible factors from notochord and floor plate. Cell, 73(4), 673-86. [PubMed:8500163] [WorldCat] [DOI] - ↑
Roelink, H., Porter, J.A., Chiang, C., Tanabe, Y., Chang, D.T., Beachy, P.A., & Jessell, T.M. (1995).
Floor plate and motor neuron induction by different concentrations of the amino-terminal cleavage product of sonic hedgehog autoproteolysis. Cell, 81(3), 445-55. [PubMed:7736596] [WorldCat] [DOI] - ↑
Ericson, J., Morton, S., Kawakami, A., Roelink, H., & Jessell, T.M. (1996).
Two critical periods of Sonic Hedgehog signaling required for the specification of motor neuron identity. Cell, 87(4), 661-73. [PubMed:8929535] [WorldCat] [DOI] - ↑
Jessell, T.M. (2000).
Neuronal specification in the spinal cord: inductive signals and transcriptional codes. Nature reviews. Genetics, 1(1), 20-9. [PubMed:11262869] [WorldCat] [DOI] - ↑
Shirasaki, R., & Pfaff, S.L. (2002).
Transcriptional codes and the control of neuronal identity. Annual review of neuroscience, 25, 251-81. [PubMed:12052910] [WorldCat] [DOI] - ↑
Charron, F., Stein, E., Jeong, J., McMahon, A.P., & Tessier-Lavigne, M. (2003).
The morphogen sonic hedgehog is an axonal chemoattractant that collaborates with netrin-1 in midline axon guidance. Cell, 113(1), 11-23. [PubMed:12679031] [WorldCat] [DOI] - ↑
Yam, P.T., Langlois, S.D., Morin, S., & Charron, F. (2009).
Sonic hedgehog guides axons through a noncanonical, Src-family-kinase-dependent signaling pathway. Neuron, 62(3), 349-62. [PubMed:19447091] [WorldCat] [DOI] - ↑
Colamarino, S.A., & Tessier-Lavigne, M. (1995).
The role of the floor plate in axon guidance. Annual review of neuroscience, 18, 497-529. [PubMed:7605072] [WorldCat] [DOI] - ↑
Tessier-Lavigne, M., & Goodman, C.S. (1996).
The molecular biology of axon guidance. Science (New York, N.Y.), 274(5290), 1123-33. [PubMed:8895455] [WorldCat] [DOI] - ↑
Dickson, B.J. (2002).
Molecular mechanisms of axon guidance. Science (New York, N.Y.), 298(5600), 1959-64. [PubMed:12471249] [WorldCat] [DOI] - ↑ 24.0 24.1
Tessier-Lavigne, M., Placzek, M., Lumsden, A.G., Dodd, J., & Jessell, T.M. (1988).
Chemotropic guidance of developing axons in the mammalian central nervous system. Nature, 336(6201), 775-8. [PubMed:3205306] [WorldCat] [DOI] - ↑ 25.0 25.1
Placzek, M., Tessier-Lavigne, M., Jessell, T., & Dodd, J. (1990).
Orientation of commissural axons in vitro in response to a floor plate-derived chemoattractant. Development (Cambridge, England), 110(1), 19-30. [PubMed:2081459] [WorldCat] - ↑ 26.0 26.1 26.2
Kennedy, T.E., Serafini, T., de la Torre, J.R., & Tessier-Lavigne, M. (1994).
Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell, 78(3), 425-35. [PubMed:8062385] [WorldCat] [DOI] - ↑ 27.0 27.1
Serafini, T., Kennedy, T.E., Galko, M.J., Mirzayan, C., Jessell, T.M., & Tessier-Lavigne, M. (1994).
The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell, 78(3), 409-24. [PubMed:8062384] [WorldCat] [DOI] - ↑
Shirasaki, R., Tamada, A., Katsumata, R., & Murakami, F. (1995).
Guidance of cerebellofugal axons in the rat embryo: directed growth toward the floor plate and subsequent elongation along the longitudinal axis. Neuron, 14(5), 961-72. [PubMed:7748563] [WorldCat] [DOI] - ↑
Shirasaki, R., Mirzayan, C., Tessier-Lavigne, M., & Murakami, F. (1996).
Guidance of circumferentially growing axons by netrin-dependent and -independent floor plate chemotropism in the vertebrate brain. Neuron, 17(6), 1079-88. [PubMed:8982157] [WorldCat] [DOI] - ↑
Dickson, B.J., & Zou, Y. (2010).
Navigating intermediate targets: the nervous system midline. Cold Spring Harbor perspectives in biology, 2(8), a002055. [PubMed:20534708] [PMC] [WorldCat] [DOI] - ↑
Shirasaki, R., Katsumata, R., & Murakami, F. (1998).
Change in chemoattractant responsiveness of developing axons at an intermediate target. Science (New York, N.Y.), 279(5347), 105-7. [PubMed:9417018] [WorldCat] [DOI] - ↑ 32.0 32.1 32.2
Zou, Y., Stoeckli, E., Chen, H., & Tessier-Lavigne, M. (2000).
Squeezing axons out of the gray matter: a role for slit and semaphorin proteins from midline and ventral spinal cord. Cell, 102(3), 363-75. [PubMed:10975526] [WorldCat] [DOI] - ↑ 33.0 33.1
Sabatier, C., Plump, A.S., Le Ma, Brose, K., Tamada, A., Murakami, F., ..., & Tessier-Lavigne, M. (2004).
The divergent Robo family protein rig-1/Robo3 is a negative regulator of slit responsiveness required for midline crossing by commissural axons. Cell, 117(2), 157-69. [PubMed:15084255] [WorldCat] [DOI] - ↑
Colak, D., Ji, S.J., Porse, B.T., & Jaffrey, S.R. (2013).
Regulation of axon guidance by compartmentalized nonsense-mediated mRNA decay. Cell, 153(6), 1252-65. [PubMed:23746841] [PMC] [WorldCat] [DOI] - ↑
Brittis, P.A., Lu, Q., & Flanagan, J.G. (2002).
Axonal protein synthesis provides a mechanism for localized regulation at an intermediate target. Cell, 110(2), 223-35. [PubMed:12150930] [WorldCat] [DOI] - ↑ 36.0 36.1
Colamarino, S.A., & Tessier-Lavigne, M. (1995).
The axonal chemoattractant netrin-1 is also a chemorepellent for trochlear motor axons. Cell, 81(4), 621-9. [PubMed:7758116] [WorldCat] [DOI] - ↑
Guthrie, S., & Pini, A. (1995).
Chemorepulsion of developing motor axons by the floor plate. Neuron, 14(6), 1117-30. [PubMed:7541631] [WorldCat] [DOI] - ↑
Tamada, A., Shirasaki, R., & Murakami, F. (1995).
Floor plate chemoattracts crossed axons and chemorepels uncrossed axons in the vertebrate brain. Neuron, 14(5), 1083-93. [PubMed:7748556] [WorldCat] [DOI] - ↑
Evans, T.A., & Bashaw, G.J. (2010).
Axon guidance at the midline: of mice and flies. Current opinion in neurobiology, 20(1), 79-85. [PubMed:20074930] [PMC] [WorldCat] [DOI] - ↑
Williams, T.W., Lyons, J.M., & Braude, A.I. (1977).
In vitro lysis of target cells by rat polymorphonuclear leukocytes isolated from acute pyelonephritic exudates. Journal of immunology (Baltimore, Md. : 1950), 119(2), 671-4. [PubMed:886190] [WorldCat] - ↑
Kennedy, T.E., Wang, H., Marshall, W., & Tessier-Lavigne, M. (2006).
Axon guidance by diffusible chemoattractants: a gradient of netrin protein in the developing spinal cord. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(34), 8866-74. [PubMed:16928876] [PMC] [WorldCat] [DOI] - ↑
Serafini, T., Colamarino, S.A., Leonardo, E.D., Wang, H., Beddington, R., Skarnes, W.C., & Tessier-Lavigne, M. (1996).
Netrin-1 is required for commissural axon guidance in the developing vertebrate nervous system. Cell, 87(6), 1001-14. [PubMed:8978605] [WorldCat] [DOI] - ↑
Bin, J.M., Han, D., Lai Wing Sun, K., Croteau, L.P., Dumontier, E., Cloutier, J.F., ..., & Kennedy, T.E. (2015).
Complete Loss of Netrin-1 Results in Embryonic Lethality and Severe Axon Guidance Defects without Increased Neural Cell Death. Cell reports, 12(7), 1099-106. [PubMed:26257176] [WorldCat] [DOI] - ↑ 44.0 44.1
Brose, K., Bland, K.S., Wang, K.H., Arnott, D., Henzel, W., Goodman, C.S., ..., & Kidd, T. (1999).
Slit proteins bind Robo receptors and have an evolutionarily conserved role in repulsive axon guidance. Cell, 96(6), 795-806. [PubMed:10102268] [WorldCat] [DOI] - ↑ 45.0 45.1
Dickson, B.J., & Gilestro, G.F. (2006).
Regulation of commissural axon pathfinding by slit and its Robo receptors. Annual review of cell and developmental biology, 22, 651-75. [PubMed:17029581] [WorldCat] [DOI] - ↑
Hammond, R., Vivancos, V., Naeem, A., Chilton, J., Mambetisaeva, E., Mambitisaeva, E., ..., & Guthrie, S. (2005).
Slit-mediated repulsion is a key regulator of motor axon pathfinding in the hindbrain. Development (Cambridge, England), 132(20), 4483-95. [PubMed:16162649] [WorldCat] [DOI] - ↑
Chen, Z., Gore, B.B., Long, H., Ma, L., & Tessier-Lavigne, M. (2008).
Alternative splicing of the Robo3 axon guidance receptor governs the midline switch from attraction to repulsion. Neuron, 58(3), 325-32. [PubMed:18466743] [WorldCat] [DOI] - ↑
Lyuksyutova, A.I., Lu, C.C., Milanesio, N., King, L.A., Guo, N., Wang, Y., ..., & Zou, Y. (2003).
Anterior-posterior guidance of commissural axons by Wnt-frizzled signaling. Science (New York, N.Y.), 302(5652), 1984-8. [PubMed:14671310] [WorldCat] [DOI] - ↑
Charoy, C., Nawabi, H., Reynaud, F., Derrington, E., Bozon, M., Wright, K., ..., & Castellani, V. (2012).
gdnf activates midline repulsion by Semaphorin3B via NCAM during commissural axon guidance. Neuron, 75(6), 1051-66. [PubMed:22998873] [WorldCat] [DOI] - ↑
Stoeckli, E.T., Sonderegger, P., Pollerberg, G.E., & Landmesser, L.T. (1997).
Interference with axonin-1 and NrCAM interactions unmasks a floor-plate activity inhibitory for commissural axons. Neuron, 18(2), 209-21. [PubMed:9052792] [WorldCat] [DOI] - ↑
Nawabi, H., Briançon-Marjollet, A., Clark, C., Sanyas, I., Takamatsu, H., Okuno, T., ..., & Castellani, V. (2010).
A midline switch of receptor processing regulates commissural axon guidance in vertebrates. Genes & development, 24(4), 396-410. [PubMed:20159958] [PMC] [WorldCat] [DOI] - ↑
Imondi, R., Wideman, C., & Kaprielian, Z. (2000).
Complementary expression of transmembrane ephrins and their receptors in the mouse spinal cord: a possible role in constraining the orientation of longitudinally projecting axons. Development (Cambridge, England), 127(7), 1397-410. [PubMed:10704386] [WorldCat] - ↑
Kadison, S.R., Mäkinen, T., Klein, R., Henkemeyer, M., & Kaprielian, Z. (2006).
EphB receptors and ephrin-B3 regulate axon guidance at the ventral midline of the embryonic mouse spinal cord. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(35), 8909-14. [PubMed:16943546] [PMC] [WorldCat] [DOI] - ↑
Bloch-Gallego, E., Ezan, F., Tessier-Lavigne, M., & Sotelo, C. (1999).
Floor plate and netrin-1 are involved in the migration and survival of inferior olivary neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(11), 4407-20. [PubMed:10341242] [PMC] [WorldCat] - ↑
Di Meglio, T., Nguyen-Ba-Charvet, K.T., Tessier-Lavigne, M., Sotelo, C., & Chédotal, A. (2008).
Molecular mechanisms controlling midline crossing by precerebellar neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(25), 6285-94. [PubMed:18562598] [PMC] [WorldCat] [DOI] - ↑
Jarjour, A.A., Manitt, C., Moore, S.W., Thompson, K.M., Yuh, S.J., & Kennedy, T.E. (2003).
Netrin-1 is a chemorepellent for oligodendrocyte precursor cells in the embryonic spinal cord. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(9), 3735-44. [PubMed:12736344] [PMC] [WorldCat]