蝸牛
久場 博司
名古屋大学 大学院医学系研究科
DOI:10.14931/bsd.696 原稿受付日:2012年2月24日 原稿完成日:2012年8月16日
担当編集委員:藤田 一郎(大阪大学 大学院生命機能研究科)
英語名 : cochlea 独:Hörschnecke 仏:cochlée
側頭骨錐体内にある内耳の聴覚器官。渦巻き状の管で,その名は形状がカタツムリに似ていることに由来する。内部に膜迷路と呼ばれる構造をもつ。膜迷路はリンパ液で満たされ,基底部で中耳の耳小骨と連なることにより,音の振動はリンパ液を介して膜迷路内にある基底膜(basilar membrane)を振動させる。基底膜の振動はさらに,基底膜上にあるコルチ器官(organ of Corti)の有毛細胞と呼ばれる感覚器細胞の感覚毛を揺らし,その結果,音の振動が細胞の電気信号へと変換される。蝸牛では音の周波数が基底膜上での位置として表される。これは,音の周波数に応じて,基底膜上での振動しやすい位置が異なることによる.鳥類では,これに加えて有毛細胞の電気的性質が関わることも知られている[1]。周波数成分毎に受容された聴覚信号は,蝸牛神経(cochlear nerve)を介して中枢へと伝えられる[2]。
構造
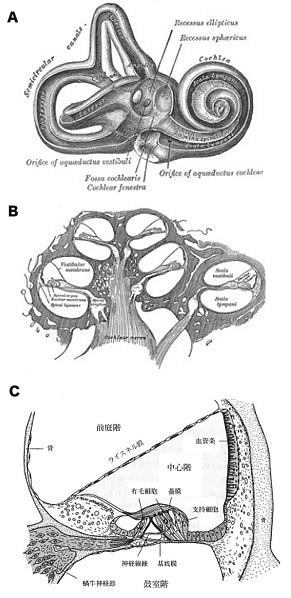
A,B ヒトの内耳「Gray's Anatomy」から転載。C 蝸牛管の断面「古河太郎:現代の生理学、第2版、1987、p254 図IV-6 蝸牛管の断面」から許可を得て転載
蝸牛は蝸牛軸を中心に2¾回転するらせん状の管構造で,引き延ばすとヒトでは約35mmの長さになる。骨により形成された骨迷路と,その内部の膜迷路からなる。膜迷路は3層に仕切られ,上層から前庭階(scala vestibuli),中心階(scala media),鼓室階(scala tympani)と呼ばれる。前庭階と中心階はライスネル膜で仕切られ,中心階と鼓室階はコルチ器官をのせた基底膜で仕切られている。前庭階と鼓室階は外リンパ液で満たされ,中心階は内リンパ液で満たされている。外リンパ液は通常の細胞外液と類似のイオン組成をもつのに対して,内リンパ液は高K+,低Na+,低Ca2+濃度のイオン組成をもち,これは中心階の外側壁を構成する上皮組織である血管条により生成される。また,前庭階と鼓室階は蝸牛基底部でそれぞれ卵円窓(別名,前庭窓)と正円窓の2枚の膜構造により中耳腔と隔てられ,蝸牛頂部にある蝸牛孔で互いに交通している。卵円窓には耳小骨(アブミ骨)が付着し,耳小骨の振動が膜迷路へと伝えられる。
進行波
耳小骨から卵円窓へ伝えられた音の振動は,外リンパ液を介して前庭階,蝸牛孔,皷室階へと伝わり,正円窓を振動させる。この結果,基底膜に振動が生じる。この基底膜の振動は波として蝸牛の基底部から頂部に向かって進む。これを進行波という。基底膜の振動エネルギーは高い周波数のものほど早く減衰する。さらに,基底膜は蝸牛の頂部ほど幅広く柔軟なため,固有振動数が低くなる。このため,進行波の振幅が最大となる基底膜上での位置は音の周波数に応じて異なり,高い周波数では蝸牛の基底部,低い周波数では頂部となる。すなわち,蝸牛では基底膜が最も振動しやすい周波数(特徴周波数)が卵円窓からの距離の関数として決まり,このことが聴覚における周波数弁別の基礎となる。このような特徴周波数の部位局在(周波数局在構造:tonotopic organization)は,大脳皮質の聴覚野にいたる聴覚伝導路の各部位で再現されている。
死体の蝸牛を用いたvon Bekesyの実験では,基底膜の周波数応答特性は生体に比べてはるかに劣る。これは,基底膜の振動特性が生体では非線形性を示すことによる。すなわち,基底膜の振動は特徴周波数領域で増幅され,より大きく振動する。このことは,生体の基底膜では何らかの能動的なしくみが働いていることを示唆する。近年,この能動的な因子として,外有毛細胞のもつ伸縮特性が注目されている[3]。
コルチ器官
コルチ器官は基底膜上にあり,有毛細胞と複数の支持細胞からなる。有毛細胞には内有毛細胞と外有毛細胞の2種類があり,それぞれ蝸牛の内側に1列と外側に3列の細胞群として基底膜の全長にわたって並んでいる。有毛細胞の頂部には感覚毛が生えている。コルチ器官の場合,感覚毛は長さの異なる100本以上の不動毛からなり,内側から外側に向けて,背の低いものから高いものが規則正しく配列している。最長の不動毛の外側には,動毛の原器である1つの基底小体が存在する。感覚毛の上部は蓋膜により覆われている。蓋膜は中心階の内側壁から伸びており,基底膜の振動を感覚毛に伝える作用をもつ。すなわち,基底膜が振動すると蓋膜と基底膜との間に内外側方向へのずれを生じ,感覚毛に機械刺激が加わる。この際,外有毛細胞の感覚毛は蓋膜に付着しているため蓋膜の動きにより直接的に刺激されるのに対して,内有毛細胞の感覚毛は蓋膜との付着をもたず,内リンパ液を介して間接的に刺激される。感覚毛が外側へ屈曲すると,有毛細胞に脱分極性の受容器電位が生じる。
有毛細胞の線維連絡
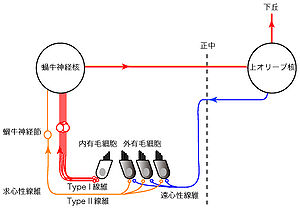
有毛細胞は,蝸牛軸に分布する蝸牛神経節(ラセン神経節)細胞からの一次求心性神経線維とシナプスを形成する。求心性神経線維は蝸牛神経節の中枢側で蝸牛神経を形成し,脳幹の蝸牛神経核へと入力する。1つの内有毛細胞は10〜30本の有髄の求心性神経線維(Type-I線維)とシナプス結合するのに対して,外有毛細胞では1本の無髄の求心性線維(Type-II線維)が枝分かれをして複数(10〜20個)の外有毛細胞を支配する。このため,聴覚信号の伝達には内有毛細胞が特に重要な働きをしている。一方,外有毛細胞は主に遠心性神経線維からの投射を受けており,後述のように基底膜振動の増幅に関わることが知られている。この遠心性神経線維は主に脳幹の上オリーブ核に起源をもつ。
受容器電位
基底膜の振動特性によって個々の周波数成分に分解された音波は,有毛細胞の働きにより電気信号に変換される。これは,有毛細胞の頂部にある感覚毛への機械刺激が,この部位に存在するイオンチャネル(機械受容器チャネル)を開閉し,受容器電流を発生することによる。感覚毛は内リンパ液に接しているため,受容器電流は主にK+の細胞内への移動により生じる。この機械受容器チャネルの分子的な実体は明らかでないが,TRP (transient receptor potential) チャネルの可能性が強く示唆されている。一方,有毛細胞の感覚毛の先端にはtip linkと呼ばれるひも状の構造が知られており,この構造が感覚毛への機械刺激を機械受容器チャネルに伝えると考えられている[4]。受容器電流による有毛細胞の脱分極(受容器電位)は,さらに[[電位依存性Ca2+チャネル]]を活性化することでシナプス小胞からの神経伝達物質放出を生じ,この結果,聴覚信号が求心性神経線維へと伝えられる。この神経伝達物質は主にグルタミン酸である。
外有毛細胞による振動増幅機構
外有毛細胞は膜電位に応じて細胞長が動的に変化する性質をもち,細胞長は脱分極で短縮,過分極で伸展する。この外有毛細胞の伸縮機構は非常に速い応答特性(20 kHz以上)をもち,特徴周波数領域の基底膜の振動を増幅することで,聴覚受容の感度と周波数選択性を向上させると考えられている。この外有毛細胞は頂部で周囲の支持細胞と強固に結合している。このため,外有毛細胞の伸縮は,蓋膜とコルチ器官の距離を変化させるのではなく,コルチ器官自体にゆがみを生じると考えられる。この外有毛細胞の伸縮にはPrestinというモータータンパク質が関わる。Prestin遺伝子のノックアウトマウスでは,外有毛細胞の伸縮特性が失われ,聴覚感度も40-60 dB低下する。このタンパク質は外有毛細胞の側壁膜に多く分布し,細胞骨格と結びつくことで細胞長を変化させると考えられている[5]。
内リンパ腔電位
上述のように,中心階は内リンパ液に満たされている。内リンパ液はK+濃度が高く,これはNa+-K+ ATPaseとNa+-K+-Cl-共輸送機構の働きを介して血管条の辺縁細胞からK+が分泌されることにより形成される。さらに,中心階は前庭階や皷室階に対して約80 mVほど高い電位を持っている。この電位は内リンパ腔電位と呼ばれ,Na+-K+ ATPaseの働きにより血管条の基底細胞および中間細胞で形成される。この内リンパ腔電位は受容器電流の駆動電圧を大きくすることにより,聴覚受容の感度を高める働きがある。有毛細胞の受容器電流はK+によって担われており,その平衡電位は0 mVである。有毛細胞の膜電位は-60 mV程度であることから,受容器電流の駆動電圧は140 mVとなる。一方,平衡感覚に関わる前庭器官では内リンパ腔電位が0 mVであることから,受容器電流の駆動電圧は60 mVとなる。
蝸牛マイクロホン電位
音刺激により内耳および内耳周辺では刺激音を忠実に再現する蝸牛マイクロホン電位が記録される。この電位は音圧に比例して増大し,音刺激に対して特別な閾値や潜時を示さない。蝸牛器官で記録されるマイクロホン電位は有毛細胞の頂部で極性が変化する。現在では,このマイクロホン電位は受容器電流により生じるものであり,数の上で多い外有毛細胞の活動に起因すると考えられている。また,この外有毛細胞の活動は鼓膜の外から音としても記録することができ,耳音響放射と呼ばれ,新生児の内耳機能検査にも利用されている。
関連項目
参考文献
- ↑
Mann, Z.F., & Kelley, M.W. (2011).
Development of tonotopy in the auditory periphery. Hearing research, 276(1-2), 2-15. [PubMed:21276841] [WorldCat] [DOI] - ↑ 小澤瀞司,福田康一郎 編
標準生理学 第7版
医学書院: 2009 - ↑
Nobili, R., Mammano, F., & Ashmore, J. (1998).
How well do we understand the cochlea? Trends in neurosciences, 21(4), 159-67. [PubMed:9554726] [WorldCat] [DOI] - ↑
Kazmierczak, P., & Müller, U. (2012).
Sensing sound: molecules that orchestrate mechanotransduction by hair cells. Trends in neurosciences, 35(4), 220-9. [PubMed:22177415] [PMC] [WorldCat] [DOI] - ↑
Dallos, P. (2008).
Cochlear amplification, outer hair cells and prestin. Current opinion in neurobiology, 18(4), 370-6. [PubMed:18809494] [PMC] [WorldCat] [DOI]