アクアポリン
三須 建郎、青木 正志
東北大学大学院 神経内科
DOI:10.14931/bsd.6490 原稿受付日:2015年9月24日 原稿完成日:2015年10月28日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
アクアポリンは、水分子を特異的に通す膜タンパク質であり、生体内の水分子の移動を介して尿の再吸収や濃縮現象、脳脊髄液等の体液産生と分泌、皮膚の保湿など、あらゆる水の動きに密接に関わっている。哺乳類には13種類のサブファミリーが存在する。中枢神経系においては、アクアポリン1(AQP1)が主に脈絡叢に発現して髄液産生に深く関わり、またアクアポリン4(AQP4)は血管周囲や軟膜下のアストロサイト足突起に強く発現し、血管から脳実質、髄液腔に至る水の恒常的な輸送に関わっている。遺伝子欠損マウスを用いた検討により、脳梗塞、脳腫瘍、脳外傷、髄膜炎等の脳浮腫を呈する疾患において、特に早期に生じる細胞性浮腫に対してAQP4欠損が病態抑制的に働くこと、また血管性浮腫に対してはAQP4欠損が病態を促進する可能性が示唆されており、実際に脳浮腫を治療する上ではそれらの動態を理解することが欠かせない。近年、自己免疫性疾患の1つである視神経脊髄炎(NMO、別名Devic病)において、抗AQP4抗体が病原性のある自己抗体として中枢神経系のアストロサイトを標的とする疾患であることが明らかとなった。
| Aquaporin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
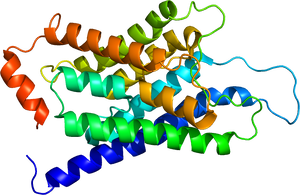
アクアポリン1の結晶構造。PDB 1j4nより。 | |||||||||
| Identifiers | |||||||||
| Symbol | Aquaporin | ||||||||
| Pfam | PF00230 | ||||||||
| InterPro | IPR000425 | ||||||||
| PROSITE | PDOC00193 | ||||||||
| SCOP | 1fx8 | ||||||||
| SUPERFAMILY | 1fx8 | ||||||||
| TCDB | 1.A.8 | ||||||||
| |||||||||
アクアポリンとは
動物や植物などの種を超えて個体の70%が水であると言われるほど、水は生命にとって必要不可欠なものであり、宇宙船は当然のように生命の痕跡として水を探す旅をすることになる。古くから細胞レベルでの水の細胞膜移動や制御・保持機構が生命維持の根幹の1つと考えらえており、我々は飲水から排水(尿)まで常に水に余念がなく水に関わる病気も多い。
1988年、米国ジョンズ・ホプキンス大学のPeter Agre教授の研究グループは、ヒトの赤血球から単離した28kDaの細胞膜タンパク質が種を超えてラット腎臓や赤血球にも発現する新しいタンパク質(CHIP28)であることを報告した[1]。その後、そのタンパク質を阻害することで細胞の水の透過性が抑制される事、水銀によってその効果が制御できることから、選択的に水を通す水チャンネルであることが報告され、後にアクアポリン(水の穴)(Aquaporin: AQP)と呼ばれるようになった[2]。赤血球が、細い毛細血管レベルまで形態を自在に変えて循環することが出来るのは、AQP(AQP1)による水移動による形態変化が深く関わっている。AQPは、ほぼ全ての生命体に発現し細胞内外の浸透圧勾配によって水を特異的に移動させる他、尿細管における尿再吸収や唾液腺等でのホルモン分泌等の体内外のあらゆるダイナミックな水移動に関わるとともに、近年は麻酔薬や様々な薬剤の作用機序に関わる可能性が示唆される等、多くの生命維持に不可欠なタンパク質であることが解ってきている[3]。多くの功績により、2003年Peter Agreはノーベル化学賞を受賞している。
中枢神経系には、主にAQP1、AQP4、AQP9が発現することが知られ、特にAQP4は最も発現量が多いとされ、主にアストロサイトに発現して生理学的には脳内外の水輸送や細胞接着、代謝、情報伝達等に関わることから、「脳のアクアポリン」とも言われている[4]。近年、脳浮腫の制御機構や脳独自の水代謝機構が明らかにされたほか、AQP4を標的とする抗AQP4抗体による自己免疫疾患が発見されるなど、脳における水の理解は進んでいる。
中枢神経系においては、頭蓋骨や脊柱管という限られた空間で保護されている反面、そこに起こる浮腫によって神経予後に重大な影響を与えることとなるため、水を制御することは最も大きな課題の1つとも言える。本稿においてはアクアポリンの最近の知見を中心に概説する。
基本的構造
図1A、1B. アクアポリンは基本構造として膜6回型タンパク質であり、そのループA,C,Eは細胞外に、リープB, Dを細胞内に局在している。そのうち、ループBとループE内にはNPAモチーフと呼ばれる構造を有しており、立体構造をなした際には細胞膜内にて互いに向き合うように小孔(2.8Å)を呈し、主に水分子を特異的に通すことができる。
図C.図はAQP1の構造をサイドから見た像であり、Cys領域と言われる局在を示している。この領域には水銀などが結合することで水分子の移動が制限される事が知られている。
図D. アクアポリンは基本的に四量体を形成しており、図のように上から見ると四色に色塗りされた構造が結合し、それぞれの水チャネルが形成されている。(図C、Dは慶応大学薬理学 安井正人先生よりご供与頂く)
AQPは、250~350個程度のアミノ酸残基から構成され分子量は約28k~30kDa前後である。AQPの分子構造はN末端とC末端は細胞内に位置し、6回膜貫通型であるため5つのループを形成し、3つの細胞外ドメイン(ループA、C、E)と2つの細胞内ドメイン(ループB、D)を有する(図1A)。ループBとループEには、アスパラギン-プロリン-アラニンが配列するNPAモチーフと呼ばれる脂質二重膜に入りこむ特殊構造が存在し、細胞膜上で立体構造を呈するとそれぞれのNPAモチーフが顔を合わせるように近接し小さな水の通路を形成する(図1B)。ちょうど砂時計のように水分子(2.8Å)を一つ一つ通すことのできる小孔(直径2.8Å)を形成しており、それより大きなイオン分子等が透過できない構造になっている。また、小孔にはアルギニン制限領域を有する狭い疎水性溶質に対する壁が存在し、プロトン分子や他の陽イオンを阻害する領域も存在している。また、NPAモチーフの近傍にはAQP1等では水銀が結合するCys(AQP1ではCys 189、AQP4ではCys 178)領域が存在し、水銀が結合することにより水分子が通過できなくなる事が知られている(図1C)[5]。
AQPは、基本的には四量体を形成して細胞膜に発現しており(図1D)、更に集合することにより直行格子状配列(orthogonal arrays of particles:OAP)を採ることが知られている[6]。電子顕微鏡を用いた凍結割断法により、1970年代からアストロサイトの細胞膜上や他組織に格子状構造があること[7][8]、脳室周囲器官やてんかんモデル等の神経病態において格子状構造が増減することは古くから知られていたが[8] [9]、Peter Agreらによって1993年にアクアポリンが発見され、この特異な細胞膜タンパク質の正体がアクアポリンであることが判明した[2]。1970年代に電顕像で見られた格子状構造は、正に脳室周囲器官に豊富に発現するAQPや神経病態で反応性に増加したアストロサイトに発現するAQP4を見ていたとものと考えられる。
サブファミリー
哺乳動物においては、現在AQP0からAQP12までの13種類のAQPサブファミリーが知られており、水分子を選択的に通すものと、グリセロール等かなり選択性が緩いアクアグリセロポリンに大別される(表1)。
さらに、AQPにはそれぞれアイソフォームが存在する。例えば、AQP4には古典的な2種類のアイソフォームがあり、AQP4の本来の転写開始領域である1番目のメチオニンよりなる長いM1(323アミノ酸)と、23番目のメチオニンから翻訳される短いM23(301アミノ酸)が存在する。それぞれ同様の水チャネル機能を有しているが、M23はM1と比較して四量体同士が接着して大きな格子状配列を呈する能力が優れていることが報告されている。すなわち、四量体でもM23のみであれば格子状配列がより大きく形成されるのに対して、M1とM23のヘテロ四量体では格子状配列の形成がより小さくなり、M1のホモ四量体では基本的に格子状構造を取らずに細胞膜上に別々に存在すると考えられている[10]。
格子状配列を形成する際には、初めからM23によってのみ形成が開始されることが知られており、逆にN末端にM1が存在することによって格子状配列の形成は抑制されることが知られている。これはN末端のパルミトイル基が深く関わっており、13番と17番のシステイン残基を変異させることにより、M1による抑制効果は失われOAPの形成が促される[10]。
この細胞膜上でのOAPの形成の有無は、後述する近年明らかとなってきた視神経脊髄炎(NMO)の病態においても、M23に対する抗体がより病態に深く関わっていることが解ってきている。
発現
中枢神経系においては、当初より主にAQP1、AQP4、AQP9等が発現することが知られているが、特に圧倒的にAQP4の発現が優位であることが知られている。
AQP1
AQP発見の発端となったAQP1は全身を巡る赤血球や血管内皮に広く発現が知られているが、中枢神経系においては血管内皮には発現せずに、特に齧歯類では脈絡叢に選択的に発現しており、髄液産生に重要な役割を担っていることが知られている[11]。AQP1は、脳血管内皮の培養系や悪性脳腫瘍において発現することが報告されているが、アストロサイトとの共培養系では発現が低下することから、血管内皮とアストロサイト足突起の相互作用により低下することが示唆されている[12]。
AQP1は定常状態ではラットでは脈絡叢や脊髄後索の一部に発現するのみであるが、ヒト脳においては大脳白質や脊髄にも広範に発現することが報告されており、種による違いがあるものと推察される[13] [14]。脳外傷モデルにおいては、病的状態になって発現してきて水輸送に関わる事が報告されている[12]。
AQP4
AQP4は脳に特に豊富に発現し、AQP1とは異なり水銀非感受性の異なる分子として同定され、AgreとVerkmanのグループがそれぞれ1994年に単離し報告したタンパク質である[15] [16]。AQP4は、髄腔に接する上衣細胞や血液脳関門を構成するアストロサイト足突起に発現していることが明らかとなり[17]、また、脳室周囲器官と呼ばれる髄腔に接する視床下部や下垂体、脈絡叢周囲などに豊富に発現し、脳内ホルモンの分泌や髄液産生にも積極的に関与していることが示唆されている[15]。
AQP9
AQP9は、脳や肝臓、白血球にも発現することが知られ、水だけではなく尿素やグリセロール等広く透過することが知られ、アクアグリセロポリンの1つである。近年、視神経に発現しており病態に関与することが報告されている[18]。
その他のサブタイプ
ラットのアストロサイト培養系の検討では、AQP1、AQP2、AQP3、AQP4、AQP5、AQP8、 AQP9、AQP11、AQP12と、従来考えられているより多くのAQPが中枢神経系に発現することが報告されている[19] [20]。これらのAQPの中枢神経系における機能は少しずつ解ってくると期待されるが、前述したAQP1に見るように培養系ではmRNAレベルで確認されても細胞膜上に確認されない事もあり、また血管内皮とアストロサイト足突起の共存下で発現量が増減するものなど、その特性の違いが個々のAQPで異なることが想定される。
| アクアポリン | 分布臓器 | ヒト病態 | AQP欠損マウス |
| AQP0 | 水晶体 | 白内障 | 白内障 |
| AQP1 | 腎、赤血球、血管、角膜、脈絡叢、肺、心、肝 | 尿濃縮低下 | |
| AQP2 | 腎、精巣 | 腎性尿崩症 | 腎性尿崩症 |
| AQP3 | 腎、大腸、皮膚 | 皮膚乾燥、尿濃縮力低下 | |
| AQP4 | 脳、網膜、骨格筋、肺、胃、内耳、腎 | 視神経脊髄炎 | 尿濃縮力低下、視覚異常、聴力障害、脳浮腫 軽減、憎悪 |
| AQP5 | 涙腺、唾液腺、角膜、肺 | シェーグレン症候群 | 唾液腺分泌低下 |
| AQP6 | 腎 | ||
| AQP7 | 脂肪組織、腎、精巣 | グリセリン代謝異常 | グリセリン代謝異常、内臓肥満 |
| AQP8 | 精巣、肝、膵、脳 | 精巣肥大 | |
| AQP9 | 肝、精巣、脳、白血球 | グリセリン代謝異常 | |
| AQP10 | 小腸 | ||
| AQP11 | 腎 | 多発性嚢胞腎 | |
| AQP12 | 膵 |
機能
分子機能
AQPは細胞内外での浸透圧の違いにより双方向性に効率的、選択的かつ迅速に水分子を移動させることができる構造になっている。そのため、イオン分子やプロトン分子の移動に伴う細胞内外のイオン環境の変化を伴うことなく水の移動を行う。
通常は、AQP4は細胞膜上ではα-ジストログリカンやシントロフィンなどの膜タンパク質と共存している。筋ジストロフィーの原因遺伝子の1つであるα-ジストログリカン欠損マウスや細胞外マトリックスのアンカータンパク質であるシントロフィン欠損マウスではAQP4の発現も抑制されることが報告されており、これらの細胞膜タンパク質がAQP4の発現を制御していることが示唆されている。また、AQP4はカリウムチャネル(Kir4.1)とも近接して存在することが報告されている[21]。カリウムは神経活動において放出される神経毒の1つであるが、シントロフィン欠損によりカリウム代謝が鈍化することが知られており、水移動とカリウム代謝には密接な関係があることが示唆されている。このAQP4に近接するKir4.1が、従来から視神経脊髄炎との異同が問題となってきた多発性硬化症(MS)の自己抗体の標的抗原であることがLancetに報告され注目されたが、その後の追試では確定的な結論には至っていない。
細胞機能
AQP1
AQP1は主に脈絡叢に発現して髄液産生に関わる事が知られている[11]。
AQP4
主にAQP4欠損マウスにおけるアストロサイト機能の検討から、アストロサイトの遊走機能に関わることや、アストロサイトの足突起先端に発現するAQP4は互いに接着能を有すること、などが報告されている[4] [22] [23]。神経疾患の病態においては、AQP4は活性化したアストロサイトの膜上に豊富に発現し、神経病理学的には反応性アストロサイトにおいて密集する無数の足突起を可視化することができ、神経病態における水輸送や代謝を中心としたアストロサイトの重要性は明らかである[24]。
AQP4欠損マウスでは、通常状態は特に脳圧亢進などは起こらず僅かに脳の水分量が増加する程度の変化しか来さない。一部では正常圧水頭症と同様の変化を来すことが報告されている。一方、脳圧亢進状態や脳虚血などでは後述するように脳浮腫の程度に明らかな差があることが報告されている(表1)。
近年、AQP4自体がアストロサイト足突起に発現するAQP4分子同士による細胞接着に関わっていると報告されてきたが[23]、それを担うのは主に格子状構造に関連するM23であることが報告されている[25]。一方、M1-AQP4はより動的であり、膜状ないし葉状仮足と呼ばれる足突起の発現に関与し、細胞の移動と接着に関与しているという。
また、AQPは脳の代謝においても重要な役割を担うと考えられている。脳は古くから免疫学的特権部位として、脳だけは全身臓器に走る血管のような並走するリンパ組織を持たないと考えられ、ミクログリア等の独自の免疫システムは神経免疫学分野の大きなテーマでもある。これは、トレーサーを用いた研究において血管側ないし髄腔側から脳実質に入り込めない特権領域があることから考えられた概念である。今まで脳における代謝は主にアストロサイトが担うと考えられてきており、代表的なグルタミン酸などもEAAT2等のトランスポーターを介している。Virchow-Robin腔は、基本的には脳脊髄液と接し、脳実質側からアストロサイト足突起のアプローチを受け、AQP4を介して水や物質の移動に深く関わっている[26]。
近年、髄液の流れから脳特有の代謝機構についてもアクアポリン4欠損マウスによる検討から様々な知見が得られている。大小様々なトレーサーを髄腔に投与すると、髄液の流れによって脳室側から脳実質へと入り込み傍静脈性に実質外へ流出することが解ったが、AQP4欠損マウスによってその流れが約70%抑えられることが解った。さらに、脳実質内に打ち込んだ水溶性アミロイドβが徐々に減衰していく現象において、AQP4欠損によって抑制される事が示された[27]。このことから、AQP4を介したアストロサイトによる積極的な水輸送システムが、脳内における様々な分子の代謝に関わる事が示唆されている。この脳独自のシステムは、様々なトランスポーターが果す代謝とも独立したシステムとして、glymphatic system(脳リンパないしグリア-リンパ組織)と呼ばれている。このシステムでは、睡眠中には覚醒中の比較で60%も増大することで劇的に水を入れ替えことが報告され、よく眠ることが脳の老廃物を代謝することに繋がるとして注目されている[28]。このシステムは、加齢とともに機能が低下することが報告されており、アミロイドβの代謝機能が低下することが、認知機能低下につながると報告されている[29]。
疾患との関わり
近年、アストロサイトによる水輸送の本幹となるタンパク質として、主にAQP4欠損マウスを用いた病態研究により、脳浮腫や脳腫瘍等の分野で注目され報告がなされている。また、変性疾患や精神疾患等、多種多様な神経疾患で水に注目されるようになり、また脳からの代謝経路としての「水」が注目されている。一方で、AQP4欠損マウスの検討では、実際にはAQP4自体の欠損による病態変化であるのか、共発現する他のタンパク質の変化が関わるのか結論の出ていない問題も多い。また、実際にヒトの疾患におけるAQP4の検討は少なく、未だにAQP4を標的とした治療がどこまで可能であるかは議論の余地が残されている。近年、AQP4は19世紀から存在し多発性硬化症との異同が議論されてきた視神経脊髄炎(別名デビック病)における標的抗原であることが明らかとなり、AQP4が中枢神経系で果たす役割が精力的に研究されており、その理解が高まっている。
脳浮腫
脳浮腫は、脳梗塞や脳出血、脳腫瘍、脳炎や、虚血性や肝性、腎性の多くの代謝性脳症などで見られ、生命予後に直結する重大な病態である。アストロサイトや脳神経細胞の著しい膨張を中心とした病理を呈し、主に血管の破綻を伴わない細胞浮腫を特徴とする細胞性浮腫と、主に血液能関門の破綻を伴う血管性浮腫に分類されている。進行すると脳ヘルニアを来たし死に至る。
近年のAQPの発見により、脳浮腫の病態にAQP4が密接に関わっていることが示唆されており、特にAQP4欠損は細胞性浮腫の軽減に効果がある反面、血管性浮腫を増悪させるジレンマが有る事が示唆されている。これらの研究では、血中が相対的に低浸透圧になることで水がAQP4を介して神経系へと流れやすく細胞傷害性浮腫を来すと考えられているなど、全身と神経系の水バランスが影響している。また、血液脳関門(BBB)の破綻を呈する脳腫瘍、脳膿瘍、てんかんなどのモデルにおいては、AQP4欠損によって脳浮腫が増悪することが報告されている。これは、BBBの破綻があるため血管性浮腫を呈し、水はAQP4を介さずに細胞外に浮腫を増すことにより、AQP4による排液が出来ないことが却って悪化を招くためと考えられている。
脳梗塞によるヒト脳でのAQP4の発現の検討では、AQP4の発現は虚血巣より末端で強く発現しており、特にアストロサイトの足突起に発現し、軟膜や軟膜下の発現も虚血巣近傍でより強く発現しており、AQP4の発現が浮腫に関連していると報告されている[30]。
また、AQP4欠損マウスの検討で、一割弱に重度の閉塞性の水頭症を来したとする検討がなされている[31]。一方、交通性水頭症モデルにおいて、脳室周囲のAQP4と髄液量に相関を示したとの報告もあり、いずれにせよAQP4と脳内髄液産生の関連が注目されている。
Verkmanらのグループで作成されたAQP4欠損マウスにおける脳浮腫の検討においては、急性水中毒における検討では、欠損マウスで有意に組織内水分量および足突起の腫脹が軽減することが示されている。また、中大脳動脈閉塞モデルにおいて、24時間後の大脳半球の面積を検討した検討においては、35%の脳浮腫軽減効果を認めている。この結果から、AQP4を抑制することが新たな脳浮腫を来す疾患の治療法に繋がると考えられた[32]。
一方、同じグループが作成したモデルにおいて、凍結創モデルによる血管性浮腫モデルにおいてAQP4欠損マウスは著明な増悪を示し、脳圧が2倍程度上昇し浮腫が悪化することが示された。メラノーマ移植による脳腫瘍モデルにおいて、AQP4欠損マウスにおいては、やはり2倍程度の脳圧亢進状態を呈し、神経症状の増悪を示したと報告されている[33]。そのため、病変局所におけるAQP4の発現亢進が血管性浮腫の軽減に効果があると報告されている。
脳腫瘍
ヒトの悪性脳腫瘍周囲においては、AQP4は著明に発現亢進することが報告されているが、腫瘍周囲の細胞外浮腫は軽減することから、腫瘍から脳実質への水輸送は制限されていると考えられている[33]。血管周囲グリア境界膜に発現するAQP4や血液脳関門を構成するOccludin等の密着結合の制御によって脳腫瘍による脳浮腫が増悪すると推察されている[34]。一方、数種類の脳腫瘍に対する免疫組織染色による検討において、中枢神経系に発現するAQP1、AQP4、AQP9の発現を検討した報告では、異常なAQP1の発現亢進がグリオーマや上衣腫に認められ、特に高分化癌では傍腫瘍性の発現であるが、低分化癌では細胞内染色パターンを示した[35]。AQP1の発現は、高分化癌とよく相関し、傍腫瘍性に生じる血管性浮腫に応じてAQP1が発現していることを示唆している[35]。このように脈絡叢に局在すると言われるAQP1が脳実質内で発現し、脳浮腫に関連することが示唆されている。
脊髄外傷
胸髄T6レベルでの圧迫性脊髄症モデルにおいて、AQP4欠損マウスにおいては外傷後2日における運動障害度が有意に改善される事が報告されている(Basso運動スコアで4.9対1.3)。さらに、体性感覚誘発電位においても、AQP4欠損マウスで6.4μV非欠損マウスで1.7と、AQP4欠損マウスで障害が軽度であった。これらの結果から、運動・感覚神経の改善効果が明らかであり、AQP4が主要な静脈性浮腫の原因と考えられた。脊髄外傷において、AQP4を抑制することが有力な治療標的と考えられている[36]。
認知症
神経変性疾患の多くが脳に貯留する蓄積タンパク質が原因であることから様々な疾患で水が注目されている。アルツハイマー型認知症においては、ヒト患者の検討からAQP1が高発現していること、アミロイドタンパク質と共発現しており、AQP1とアミロイドβと分子的相互作用により、NPAモチーフに影響を起こしうると報告している[37]。動物実験の検討においても、アミロイドβはAQP4欠損マウスにおいて、その代謝が抑制される事が報告され、水が毒性タンパク質の代謝に重要であることが示唆されている[27]。
視神経脊髄炎とアクアポリン4抗体
脊髄では、血管中心性に補体(赤)の沈着を認めており、周囲のアクアポリン4(緑)の染色性が血管中心性に低下ないし消失している。血管周囲性に炎症とアストロサイト傷害があり、同部位では脱髄が比較的軽いことから、アストロサイト一次性の病態であることが示唆されている。
視神経脊髄炎(Neuromyelitis optica; NMO)は、視神経と脊髄を病変の主座とする炎症性疾患であり、多発性硬化症(MS)の亜型と考えられてきた[38]。2004年に視神経脊髄炎に極めて特異性の高い抗体(NMO-IgG)が発見され、2005年にその対応抗原がAQP4であることが報告された[39]。視神経脊髄炎の早期炎症性病変においては、補体であるC9neoの沈着する血管周囲でAQP4は欠落し、同部位ではアストロサイトの脱落も確認され脱髄に先行してアストロサイトが障害される病態である事を明らかとなっている[40](図2)。また、視神経脊髄炎患者血清から抽出したヒトIgGをラットに投与すると、特にヒトIgGや補体が沈着する血管周囲でAQP4やアストロサイトの脱落が見られ、実際に生体内で補体介在性(CDC)ないし抗体介在性(ADCC)に病原性を有する抗体であることが明らかとなっている[14]、一方で発症と同時に始まると思われる修復機転(グリオーシス)においてもAQP4は細胞移動や接着といった多様な機能でその病態に強く関わっていると考えられる[24]。
視神経脊髄炎の病態は、初めに血管中心性に病変を来すことが特徴と考えられている(図2)。これは、血中にある抗AQP4抗体は、まずは炎症等をきっかけに血管周囲から神経系へ漏れ出し、血管周囲のアストロサイト足突起に反応して病変が血管中心性に進行すると推察されるためである[40] [41]。病態が血管中心性であり血管性浮腫を来すことが特徴の1つと考えられているが、組織の広範なアストロサイトの脱落や広範な脱落や壊死を呈するなど、細胞傷害性浮腫が先行する脳虚血などとの共通点も多い[40] [42]。
前述した細胞膜上でAQP4の格子状構造を呈するM23アイソフォームに対する自己抗体が、従来考えられたM1-AQP4抗体より血清抗体価が非常に高く親和性が高い事[43]、M23-AQP4抗体によって補体介在性アストロサイトパチーが起きやすく疾患促進的に働くことが報告されている[44]。これは、脂質ラフト構造が元来補体活性を来しやすいこと、抗体自体の結合能が高いこと等も関与している。また、このAQP4抗体は、細胞膜上でAQP4四量体を立体的かつ架橋的に認識している可能性が示唆されている[45]。本来のAQP4機能の中核の一つである水輸送機能をAQP4抗体が抑えるかどうかは賛否両論があるが、水輸送には関わらないという立場の論文がやや多い[46]。AQP4の細胞膜上における特異な局在や機能の理解が進むとともに、視神経脊髄炎がその本質的な部分に関わる事が判明しており、その病態の理解も飛躍的な進歩を遂げている。
その他
AQP2の遺伝子異常によって尿濃縮力が低下し、遺伝性の尿崩症を発症することが初めて報告された[47] [48]。また、AQP0のE134GやT138R点変異が先天性白内障の原因であることが報告されている[49]。さらにシェーグレン症候群の患者では唾液腺でのAQP5の発現が低下していると報告されている[50]。その他、数々のAQP欠損マウスの検討により様々な病態にAQPが関与することが示唆されている
おわりに
脳におけるアクアポリンの研究は、主にAQP4によって発展してきたのは言うまでもないが、これまで知られた以上に脳におけるアクアポリンの関与は重大で水輸送が認知機能や睡眠など、広く精神活動にも関わりうることが報告されてきており、脳の水の理解はAQP4のみに留まらず様々な領域で研究の拡がりを見せており、さらなる発展が期待されている。
参考文献
- ↑
Denker, B.M., Smith, B.L., Kuhajda, F.P., & Agre, P. (1988).
Identification, purification, and partial characterization of a novel Mr 28,000 integral membrane protein from erythrocytes and renal tubules. The Journal of biological chemistry, 263(30), 15634-42. [PubMed:3049610] [WorldCat] - ↑ 2.0 2.1
Preston, G.M., Carroll, T.P., Guggino, W.B., & Agre, P. (1992).
Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 protein. Science (New York, N.Y.), 256(5055), 385-7. [PubMed:1373524] [WorldCat] [DOI] - ↑
Agre, P., & Nielsen, S. (1996).
The aquaporin family of water channels in kidney. Nephrologie, 17(7), 409-15. [PubMed:8987045] [WorldCat] - ↑ 4.0 4.1
Papadopoulos, M.C., & Verkman, A.S. (2013).
Aquaporin water channels in the nervous system. Nature reviews. Neuroscience, 14(4), 265-77. [PubMed:23481483] [PMC] [WorldCat] [DOI] - ↑
Yukutake, Y., & Yasui, M. (2010).
Regulation of water permeability through aquaporin-4. Neuroscience, 168(4), 885-91. [PubMed:19850109] [WorldCat] [DOI] - ↑
Engel, A., Fujiyoshi, Y., & Agre, P. (2000).
The importance of aquaporin water channel protein structures. The EMBO journal, 19(5), 800-6. [PubMed:10698922] [PMC] [WorldCat] [DOI] - ↑
Landis, D.M., & Reese, T.S. (1974).
Arrays of particles in freeze-fractured astrocytic membranes. The Journal of cell biology, 60(1), 316-20. [PubMed:4809245] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1
Hatton, J.D., & Ellisman, M.H. (1981).
The distribution of orthogonal arrays and their relationship to intercellular junctions in neuroglia of the freeze-fractured hypothalamo-neurohypophysial system. Cell and tissue research, 215(2), 309-23. [PubMed:7214478] [WorldCat] [DOI] - ↑
Hatton, J.D., & Ellisman, M.H. (1984).
Orthogonal arrays are redistributed in the membranes of astroglia from alumina-induced epileptic foci. Epilepsia, 25(2), 145-51. [PubMed:6705745] [WorldCat] [DOI] - ↑ 10.0 10.1
Suzuki, H., Nishikawa, K., Hiroaki, Y., & Fujiyoshi, Y. (2008).
Formation of aquaporin-4 arrays is inhibited by palmitoylation of N-terminal cysteine residues. Biochimica et biophysica acta, 1778(4), 1181-9. [PubMed:18179769] [WorldCat] [DOI] - ↑ 11.0 11.1
Oshio, K., Watanabe, H., Song, Y., Verkman, A.S., & Manley, G.T. (2005).
Reduced cerebrospinal fluid production and intracranial pressure in mice lacking choroid plexus water channel Aquaporin-1. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 19(1), 76-8. [PubMed:15533949] [WorldCat] [DOI] - ↑ 12.0 12.1
McCoy, E., & Sontheimer, H. (2010).
MAPK induces AQP1 expression in astrocytes following injury. Glia, 58(2), 209-17. [PubMed:19610096] [PMC] [WorldCat] [DOI] - ↑
Satoh, J., Tabunoki, H., Yamamura, T., Arima, K., & Konno, H. (2007).
Human astrocytes express aquaporin-1 and aquaporin-4 in vitro and in vivo. Neuropathology : official journal of the Japanese Society of Neuropathology, 27(3), 245-56. [PubMed:17645239] [WorldCat] - ↑ 14.0 14.1
Misu, T., Höftberger, R., Fujihara, K., Wimmer, I., Takai, Y., Nishiyama, S., ..., & Lassmann, H. (2013).
Presence of six different lesion types suggests diverse mechanisms of tissue injury in neuromyelitis optica. Acta neuropathologica, 125(6), 815-27. [PubMed:23579868] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1
Jung, J.S., Bhat, R.V., Preston, G.M., Guggino, W.B., Baraban, J.M., & Agre, P. (1994).
Molecular characterization of an aquaporin cDNA from brain: candidate osmoreceptor and regulator of water balance. Proceedings of the National Academy of Sciences of the United States of America, 91(26), 13052-6. [PubMed:7528931] [PMC] [WorldCat] [DOI] - ↑
Hasegawa, H., Ma, T., Skach, W., Matthay, M.A., & Verkman, A.S. (1994).
Molecular cloning of a mercurial-insensitive water channel expressed in selected water-transporting tissues. The Journal of biological chemistry, 269(8), 5497-500. [PubMed:7509789] [WorldCat] - ↑
Nielsen, S., Nagelhus, E.A., Amiry-Moghaddam, M., Bourque, C., Agre, P., & Ottersen, O.P. (1997).
Specialized membrane domains for water transport in glial cells: high-resolution immunogold cytochemistry of aquaporin-4 in rat brain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(1), 171-80. [PubMed:8987746] [WorldCat] - ↑
Mizokami, J., Kanamori, A., Negi, A., & Nakamura, M. (2011).
A preliminary study of reduced expression of aquaporin-9 in the optic nerve of primate and human eyes with glaucoma. Current eye research, 36(11), 1064-7. [PubMed:21919596] [WorldCat] [DOI] - ↑
Albertini, R., & Bianchi, R. (2010).
Aquaporins and glia. Current neuropharmacology, 8(2), 84-91. [PubMed:21119878] [PMC] [WorldCat] [DOI] - ↑
Yamamoto, N., Yoneda, K., Asai, K., Sobue, K., Tada, T., Fujita, Y., ..., & Kato, T. (2001).
Alterations in the expression of the AQP family in cultured rat astrocytes during hypoxia and reoxygenation. Brain research. Molecular brain research, 90(1), 26-38. [PubMed:11376853] [WorldCat] [DOI] - ↑
Puwarawuttipanit, W., Bragg, A.D., Frydenlund, D.S., Mylonakou, M.N., Nagelhus, E.A., Peters, M.F., ..., & Amiry-Moghaddam, M. (2006).
Differential effect of alpha-syntrophin knockout on aquaporin-4 and Kir4.1 expression in retinal macroglial cells in mice. Neuroscience, 137(1), 165-75. [PubMed:16257493] [WorldCat] [DOI] - ↑
Saadoun, S., Papadopoulos, M.C., Watanabe, H., Yan, D., Manley, G.T., & Verkman, A.S. (2005).
Involvement of aquaporin-4 in astroglial cell migration and glial scar formation. Journal of cell science, 118(Pt 24), 5691-8. [PubMed:16303850] [WorldCat] [DOI] - ↑ 23.0 23.1
Hiroaki, Y., Tani, K., Kamegawa, A., Gyobu, N., Nishikawa, K., Suzuki, H., ..., & Fujiyoshi, Y. (2006).
Implications of the aquaporin-4 structure on array formation and cell adhesion. Journal of molecular biology, 355(4), 628-39. [PubMed:16325200] [WorldCat] [DOI] - ↑ 24.0 24.1
Ikeshima-Kataoka, H., Abe, Y., & Yasui, M. (2015).
Aquaporin 4-dependent expression of glial fibrillary acidic protein and tenascin-C in activated astrocytes in stab wound mouse brain and in primary culture. Journal of neuroscience research, 93(1), 121-9. [PubMed:25174305] [WorldCat] [DOI] - ↑
Smith, A.J., Jin, B.J., Ratelade, J., & Verkman, A.S. (2014).
Aggregation state determines the localization and function of M1- and M23-aquaporin-4 in astrocytes. The Journal of cell biology, 204(4), 559-73. [PubMed:24515349] [PMC] [WorldCat] [DOI] - ↑
Nakada, T. (2014).
Virchow-Robin space and aquaporin-4: new insights on an old friend. Croatian medical journal, 55(4), 328-36. [PubMed:25165047] [PMC] [WorldCat] [DOI] - ↑ 27.0 27.1
Iliff, J.J., Wang, M., Liao, Y., Plogg, B.A., Peng, W., Gundersen, G.A., ..., & Nedergaard, M. (2012).
A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β. Science translational medicine, 4(147), 147ra111. [PubMed:22896675] [PMC] [WorldCat] [DOI] - ↑
Nedergaard, M. (2013).
Neuroscience. Garbage truck of the brain. Science (New York, N.Y.), 340(6140), 1529-30. [PubMed:23812703] [PMC] [WorldCat] [DOI] - ↑
Kress, B.T., Iliff, J.J., Xia, M., Wang, M., Wei, H.S., Zeppenfeld, D., ..., & Nedergaard, M. (2014).
Impairment of paravascular clearance pathways in the aging brain. Annals of neurology, 76(6), 845-61. [PubMed:25204284] [PMC] [WorldCat] [DOI] - ↑
Aoki, K., Uchihara, T., Tsuchiya, K., Nakamura, A., Ikeda, K., & Wakayama, Y. (2003).
Enhanced expression of aquaporin 4 in human brain with infarction. Acta neuropathologica, 106(2), 121-4. [PubMed:12715185] [WorldCat] [DOI] - ↑
Feng, X., Papadopoulos, M.C., Liu, J., Li, L., Zhang, D., Zhang, H., ..., & Ma, T. (2009).
Sporadic obstructive hydrocephalus in Aqp4 null mice. Journal of neuroscience research, 87(5), 1150-5. [PubMed:18951529] [PMC] [WorldCat] [DOI] - ↑
Manley, G.T., Fujimura, M., Ma, T., Noshita, N., Filiz, F., Bollen, A.W., ..., & Verkman, A.S. (2000).
Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke. Nature medicine, 6(2), 159-63. [PubMed:10655103] [WorldCat] [DOI] - ↑ 33.0 33.1
Papadopoulos, M.C., Manley, G.T., Krishna, S., & Verkman, A.S. (2004).
Aquaporin-4 facilitates reabsorption of excess fluid in vasogenic brain edema. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 18(11), 1291-3. [PubMed:15208268] [WorldCat] [DOI] - ↑
Papadopoulos, M.C., Saadoun, S., Binder, D.K., Manley, G.T., Krishna, S., & Verkman, A.S. (2004).
Molecular mechanisms of brain tumor edema. Neuroscience, 129(4), 1011-20. [PubMed:15561416] [WorldCat] [DOI] - ↑ 35.0 35.1
Deb, P., Pal, S., Dutta, V., Boruah, D., Chandran, V.M., & Bhatoe, H.S. (2013).
Correlation of expression pattern of aquaporin-1 in primary central nervous system tumors with tumor type, grade, proliferation, microvessel density, contrast-enhancement and perilesional edema. Journal of cancer research and therapeutics, 8(4), 571-7. [PubMed:23361277] [WorldCat] [DOI] - ↑
Saadoun, S., Bell, B.A., Verkman, A.S., & Papadopoulos, M.C. (2008).
Greatly improved neurological outcome after spinal cord compression injury in AQP4-deficient mice. Brain : a journal of neurology, 131(Pt 4), 1087-98. [PubMed:18267965] [WorldCat] [DOI] - ↑
Misawa, T., Arima, K., Mizusawa, H., & Satoh, J. (2008).
Close association of water channel AQP1 with amyloid-beta deposition in Alzheimer disease brains. Acta neuropathologica, 116(3), 247-60. [PubMed:18509662] [PMC] [WorldCat] [DOI] - ↑ Kuroiwa, Y.
Neuromyelitis optica (Devic's disease, Devic's syndrome). Demyelinating diseases.
Handbook of Clinical Neurology, 1985. 3(47): p. 397-417. - ↑
Lennon, V.A., Kryzer, T.J., Pittock, S.J., Verkman, A.S., & Hinson, S.R. (2005).
IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel. The Journal of experimental medicine, 202(4), 473-7. [PubMed:16087714] [PMC] [WorldCat] [DOI] - ↑ 40.0 40.1 40.2
Misu, T., Fujihara, K., Kakita, A., Konno, H., Nakamura, M., Watanabe, S., ..., & Itoyama, Y. (2007).
Loss of aquaporin 4 in lesions of neuromyelitis optica: distinction from multiple sclerosis. Brain : a journal of neurology, 130(Pt 5), 1224-34. [PubMed:17405762] [WorldCat] [DOI] - ↑
Bradl, M., Misu, T., Takahashi, T., Watanabe, M., Mader, S., Reindl, M., ..., & Lassmann, H. (2009).
Neuromyelitis optica: pathogenicity of patient immunoglobulin in vivo. Annals of neurology, 66(5), 630-43. [PubMed:19937948] [WorldCat] [DOI] - ↑
Takano, R., Misu, T., Takahashi, T., Izumiyama, M., Fujihara, K., & Itoyama, Y. (2008).
A prominent elevation of glial fibrillary acidic protein in the cerebrospinal fluid during relapse in neuromyelitis optica. The Tohoku journal of experimental medicine, 215(1), 55-9. [PubMed:18509235] [WorldCat] [DOI] - ↑
Rossi, A., Pisani, F., Nicchia, G.P., Svelto, M., & Frigeri, A. (2010).
Evidences for a leaky scanning mechanism for the synthesis of the shorter M23 protein isoform of aquaporin-4: implication in orthogonal array formation and neuromyelitis optica antibody interaction. The Journal of biological chemistry, 285(7), 4562-9. [PubMed:20007705] [PMC] [WorldCat] [DOI] - ↑
Sato, D.K., Nakashima, I., Takahashi, T., Misu, T., Waters, P., Kuroda, H., ..., & Aoki, M. (2013).
Aquaporin-4 antibody-positive cases beyond current diagnostic criteria for NMO spectrum disorders. Neurology, 80(24), 2210-6. [PubMed:23677744] [WorldCat] [DOI] - ↑
Pisani, F., Mola, M.G., Simone, L., Rosito, S., Alberga, D., Mangiatordi, G.F., ..., & Nicchia, G.P. (2014).
Identification of a point mutation impairing the binding between aquaporin-4 and neuromyelitis optica autoantibodies. The Journal of biological chemistry, 289(44), 30578-89. [PubMed:25239624] [PMC] [WorldCat] [DOI] - ↑
Rossi, A., Ratelade, J., Papadopoulos, M.C., Bennett, J.L., & Verkman, A.S. (2012).
Neuromyelitis optica IgG does not alter aquaporin-4 water permeability, plasma membrane M1/M23 isoform content, or supramolecular assembly. Glia, 60(12), 2027-39. [PubMed:22987455] [PMC] [WorldCat] [DOI] - ↑
Sasaki, S., Fushimi, K., Saito, H., Saito, F., Uchida, S., Ishibashi, K., ..., & Nakajima, K. (1994).
Cloning, characterization, and chromosomal mapping of human aquaporin of collecting duct. The Journal of clinical investigation, 93(3), 1250-6. [PubMed:7510718] [PMC] [WorldCat] [DOI] - ↑
Deen, P.M., Verdijk, M.A., Knoers, N.V., Wieringa, B., Monnens, L.A., van Os, C.H., & van Oost, B.A. (1994).
Requirement of human renal water channel aquaporin-2 for vasopressin-dependent concentration of urine. Science (New York, N.Y.), 264(5155), 92-5. [PubMed:8140421] [WorldCat] [DOI] - ↑
Francis, P., Chung, J.J., Yasui, M., Berry, V., Moore, A., Wyatt, M.K., ..., & Agre, P. (2000).
Functional impairment of lens aquaporin in two families with dominantly inherited cataracts. Human molecular genetics, 9(15), 2329-34. [PubMed:11001937] [WorldCat] [DOI] - ↑
Tsubota, K., Hirai, S., King, L.S., Agre, P., & Ishida, N. (2001).
Defective cellular trafficking of lacrimal gland aquaporin-5 in Sjögren's syndrome. Lancet (London, England), 357(9257), 688-9. [PubMed:11247557] [WorldCat] [DOI]