「シナプス後肥厚」の版間の差分
細編集の要約なし |
細 →生化学的性質 |
||
| (2人の利用者による、間の28版が非表示) | |||
| 1行目: | 1行目: | ||
< | [[ファイル:Spine EM.png|thumb|right|'''電子顕微鏡によるPSD画像'''<br>この例は穿孔PSDである。矢頭間:PSD、S:樹状突起棘、AT:軸索終止、a:星状膠細胞、矢印:小胞体、スケールバー:200 nm。ヒト大脳皮質。SpacekとHarrisによる。許可を得て転載。]] | ||
< | 英:postsynaptic density 英略称:PSD、独:postsynaptische Dichte 仏:densité post-synaptique<br> | ||
'' | シナプス後肥厚(シナプス後肥厚部ともいう)とは[[シナプス]]膜直下、細胞質側に存在する多数の[[蛋白質]]の複合体である。当初、[[電子顕微鏡]]によるシナプスの観察から、シナプス直下のみ電子線を通しにくく、細胞膜が肥厚してみれるからこのように名付けられた。シナプス膜直下に有ることから、シナプスの構造や機能に密接な関わりがあることが推定され、多くの研究がなされてきた。[[wikipedea:ja:生化学|生化学]]的に単離する事も可能で、シナプスの構造蛋白質、調節蛋白質など数百種類に及ぶ分子を含む事が判っている。 | ||
[[Image:PSD_3D_reconstruction.jpg|thumb|right|'''樹状突起(D)、樹状突起棘とPSD(赤)の立体再構築'''<br>T - 細型棘、 M - 茸状棘と穿孔シナプス(ラット、海馬)SpacekとHarrisによる。許可を得て転載。]] | |||
[[ファイル:PSD EM.png|thumb|right|'''電子顕微鏡による精製したPSD画像'''<br>スケールバー:100 nm。LismanとReeseによる<ref name=petersen_j_neurosci><pubmed>14657186</pubmed></ref>。]] | |||
</ | == 電子顕微鏡像 == | ||
Palayは、シナプスを電子顕微鏡で観察する事で、シナプスの直下の膜が他の部分に比べて電子密度が高い事に気づいた<ref><pubmed>13357542</pubmed></ref>。その後、この構造はAkertらによりpostsynaptic density(PSD)と名付けられた<ref><pubmed>4186645</pubmed></ref>。シナプスの膜直下に有ることから、シナプスの構造や機能に密接な関わりがあることが容易に推定され、多くの研究がなされてきた。 | |||
GrayはPSDがシナプスの後部にのみ認められる非対称シナプス(Gray I型シナプス)に加え、シナプス前部にも認められる対称シナプス(Gray II型シナプス)が有ることを見いだした<ref><pubmed>13829103</pubmed></ref>。I型シナプスは円形の[[シナプス顆粒]]を持つのに対し、II型は楕円形のシナプス顆粒を持つ。現在では、I型シナプスが、[[グルタミン酸]]性[[興奮性シナプス]]、II型シナプスが[[GABA性]][[抑制性シナプス]]であるとされており、電子顕微鏡的に観察されたシナプスの機能を推定する手がかりとなっている。 | |||
[[海馬]][[CA1]][[錐体細胞]]の場合では、PSDの面積0.05-0.3 µm<sup>2</sup>、厚さ20 nm程度である。また、場合によってはシナプス直下で連続した構造ではなく、切れ目が有りそのようなPSDは穿孔PSD(perforated PSD)と呼ばれている<ref><pubmed> 1613552 </pubmed></ref>。そのようなPSDは茸状(mushroom)[[樹状突起棘]]に形成された一般に大きなシナプスに認められるが、穿孔をなす成因と生理学的意義はよく判っていない。しかし、一般にPSDが大きなシナプスは、シナプス前終末も大きく、ドックしているシナプス顆粒の数も多いため、より効率の良いシナプス伝達に関与していると思われる。 | |||
ReeseらはPSDを[[電子顕微鏡断層撮影]]で観察し、PSD中に様々な形状の蛋白質粒子を見いだし分類した上、それぞれを既知のPSD分子種に当てはめている<ref><pubmed> 18326622 </pubmed></ref>。 | |||
== 生化学的性質 == | |||
de RobertisらはPSDが[[wikipedia:ja:界面活性剤|界面活性剤]]に耐性があることを利用し、PSDを生化学的に単離することに成功した。今日では、Siekevitzらによる界面活性剤に[[wikipedia:Sucrose_gradient_centrifugation|非連続蔗糖密度勾配遠心法]]を組み合わせた方法がよく用いられている<ref name=Carlin_J_Cell_Biol><pubmed>7410481</pubmed></ref>。単離したPSDの電子顕微鏡像は組織中のPSDと大きさや形状がよく似ており、直径が平均360 nm(面積で0.1 µm<sup>2</sup>)、分子量が1.10±0.36 GDaであった<ref><pubmed>16061821</pubmed></ref>。走査型電子顕微鏡観察では、不定形の網目状の構造が認められおり、その構造がPSDを形作る構成基盤である可能性がある<ref name=petersen_j_neurosci><pubmed>14657186</pubmed></ref>。 | |||
これにより、PSDを構成する分子を同定することも可能となった。 順により強い界面活性剤処理を行うことにより、PSD I、II、IIIとしてPSDに強固に結合している分子を分別していくことも可能である。 ただし、標品には通常シナプス後部にはあまり存在しない分子(例えば[[塩基性ミエリン蛋白質]])も混入することも知られており、取れてきた標品の中に含まれている分子が本当にPSD由来であるかは、別に[[免疫染色]]などで確認する必要が有る。 | |||
[[ファイル:PSD_proteins2.png|thumb|right|'''PSD蛋白質'''<ref name=sheng_ann_rev_biochem><pubmed> 17243894 </pubmed></ref><ref name=peng_mol_cell_proteomics><pubmed>15020595</pubmed></ref>]] | |||
Kennedyらは、PSD分画に再現性よく多く認められる約45kDの蛋白質が、[[Ca2+/calmodulin依存性タンパク質キナーゼ|Ca<sup>2+</sup>/calmodulin依存性タンパク質キナーゼ]](CaMKII)αである事を見いだした<ref><pubmed> 6580651 </pubmed></ref>。この量は他の蛋白質と比べても多いが、CaMKIIはサンプル調整時の[[虚血]]によりPSDに移行することが知られており<ref><pubmed> 7931307 </pubmed></ref>、それによる影響で過大評価されている可能性があるが、それでもなお最も多い蛋白質の一つであることには間違えがない。CaMKIIは他の情報伝達分子に比べ、数十倍以上多く、これはCaMKIIが単に情報伝達分子であるだけではなく、PSDに於ける構造因子であることも示唆する。実際に岡本らはCaMKIIβがアクチンを束化する活性があることを見いだしている<ref><pubmed> 17404223 </pubmed></ref>。 | |||
また、Kennedyらは、PSD III分画に濃縮され、堅固にPSDを構成している蛋白質として、PSD-95を同定した<ref><pubmed> 1419001 </pubmed></ref>。PSD-95は後に、[[NMDA型グルタミン酸受容体]]のカルボキシル末端に結合し、NMDA型グルタミン酸受容体のシナプスへの局在を規定している蛋白質として再同定された。その後の研究により、PSD-95は様々なシナプス蛋白に結合する事が示され、[[足場蛋白]]の典型例として知られている。 | |||
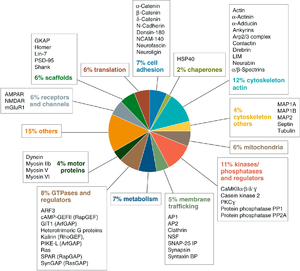
一方で、[[wikipedia:ja:ゲノム計画|ゲノム計画]]の完成、[[質量分析計]]技術の進歩により、PSDに存在する蛋白質を網羅的に解析する事も出来る様になった<ref name=peng_mol_cell_proteomics><pubmed>15020595</pubmed></ref><ref><pubmed> 15169875 </pubmed></ref><ref><pubmed> 15572359 </pubmed></ref>。その構成要素はシナプス伝達に関与する分子([[受容体]]など)のほか、細胞内[[情報伝達分子]]([[蛋白質リン酸化酵素]]、[[小分子GTP結合蛋白質]]など)、[[細胞骨格]]系分子([[アクチン]]、[[スペクトリン]]など)、足場蛋白質(PSD-95、[[Shank]]、[[Homer]]など)、[[細胞接着分子]]([[カドヘリン]]、[[ニューロリギン]]など)が見いだされている。 | |||
{| | {| style="float:left" width="200" border="1" cellpadding="1" cellspacing="1" | ||
|+ align=bottom |'''1個のPSDあたりに存在する蛋白質分子数'''<br>*PSD-95、[[SAP97]]、[[SAP102]]、[[PSD-93]]を含めた[[MAGUKs]]全体 | |||
|+ align=bottom |''' | |||
|- | |- | ||
! scope="col" | | ! scope="col" | | ||
| 63行目: | 56行目: | ||
| N.D. | | N.D. | ||
|- | |- | ||
! scope="row" | [[ | ! scope="row" | [[NR1]]/[[NR2A]]/[[NR2B]] | ||
| 20 | | 20 | ||
| N.D. | | N.D. | ||
| 75行目: | 68行目: | ||
| * | | * | ||
|- | |- | ||
! scope="row" | [[ | ! scope="row" | [[SAPAP1-4]]/[[GKAP]] | ||
| 150 | | 150 | ||
| 171 | | 171 | ||
|- | |- | ||
! scope="row" | ! scope="row" | Shank1/2/3 | ||
| 150 | | 150 | ||
| 310 | | 310 | ||
|} | |}[[ファイル:PSD_proteins.png|thumb|right|'''PSD画分のSDS-PAGE像'''<br>Major 51000はCaMKIIである事が後に判明する。Siekevitzらによる<ref name=Carlin_J_Cell_Biol><pubmed>7410481</pubmed></ref>。]] | ||
[[ファイル: | |||
Shengらは一個のPSDの[[wikipedia:ja:分子量|分子量]]とその要素の構成比から、一個のPSDの中にある分子の数を推定した<ref name=sheng_ann_rev_biochem><pubmed> 17243894 </pubmed></ref><ref><pubmed>16507876</pubmed></ref>。それによると多い蛋白質で数百個の単位で存在することが判った。 この数値は、杉山らが独立に[[GFP]]融合蛋白質、[[免疫染色]]と[[蛍光]]標準ビーズを組み合わせた実験から得られた数字と驚くほど一致している<ref name=sugiyama_nature_method><pubmed> 16118638 </pubmed></ref>。また、電気生理学的解析によっても一つのシナプスに存在する受容体数は数十から数百個であり、妥当な数字である。 | |||
これらのPSD分子は、蛋白質[[ドメイン]]間相互作用により、お互い結合し合っている。どの蛋白質が、PSDの最も中心に存在するかは判っていないが、一つの候補としてHomerとShankがある。この両者を精製し、混合することにより、PSDと同様な、網目状構造が再構築できるのに加え、そこにアダプター蛋白質であるGKAPを加えると組み込まれる<ref><pubmed> 19345194 </pubmed></ref>。GKAPはさらにPSD-95を介しシナプス膜表面の[[グルタミン酸受容体]]に結合するので、ShankとHomerを基盤としてその他の蛋白質が次々に結合していくことで、PSDが形成されている可能性がある。実際にPSDとShankをニューロンに過剰発現することによりPSDが大きくなることが知られている<ref><pubmed> 11498055 </pubmed></ref>。 | |||
[[免疫電子顕微鏡]]による観察からは、様々なPSD蛋白質が膜直下から鉛直方向に層構造を作っていること、また、シナプス中心から水平方向に周辺部に向かっても蛋白質それぞれの分布をしていることが知られている<ref><pubmed> 11160391 </pubmed></ref>。 | |||
[[免疫電子顕微鏡]] | |||
== 分子構造のダイナミクス == | == 分子構造のダイナミクス == | ||
[[ファイル:GFP-PSD-95.png|thumb|right|'''GFP-PSD-95の経時観察'''<br> | [[ファイル:GFP-PSD-95.png|thumb|right|'''GFP-PSD-95の経時観察'''<br>画像は1時間毎。岡部らによる<ref name=okabe_nature_neurosci><pubmed> 10461219 </pubmed></ref>。]] | ||
岡部らはPSDのコア蛋白質であるPSD-95をGFP融合蛋白とし、神経細胞に導入した上で、経時観察を行った。それによると、PSDは常に形態的に変化していることが判った。さらに、一個のPSDに存在するPSD-95-GFPの蛍光を褪色させて、その回復を測定する方法([[光褪色後蛍光回復法]]、FRAP)によりPSD-95のturnoverを観察した<ref name=okabe_nature_neurosci><pubmed> 10461219 </pubmed></ref>。その結果、PSDに存在するPSD-95は早いturnoverを示す成分(数十分の単位)と1時間程度の観察ではほとんどturnoverが認められない2つの成分が有ることが判った。様々な蛋白質についてさらに検討を加えた所、蛋白質によってアクチンのように殆どの分子が数分以内に入れ替わる分子もある一方で、PSD-95のように遅い分子も有ることが判った<ref><pubmed> 16855097 </pubmed></ref>。同じ蛋白質で早い成分と遅い成分が有るとき、それらがPSDでいかに配置されているかは興味深い問題であるが、これもまだ明らかにされていない。PSDの蛋白質は[[樹状突起]]から供給されるのに加え、隣りのシナプスからも供給される。 | |||
分子のturnoverの速度を規定しているのは、その蛋白質の分子量と形状により影響される[[wikipedia:ja:拡散|拡散]]速度に加え、結合部位の存在や[[蛋白質修飾]]などが深く関わっているものと考えられる。また、この移行が、拡散による能動的な過程か、あるいは[[モーター蛋白質]]を利用した受動的過程は判っていないが、おそらく両者が有るものと考えられる。また、この時に多くのPSD構成要素が予め複合体を形成しつつ既存のPSDに付け加わって行くのか、それとも個々の蛋白質が付け加わった時に始めて複合体になるかはまだ判っていない。 | |||
神経活動依存的な[[AMPA型グルタミン酸受容体]]のシナプスへの移行が[[シナプス可塑性]]の主要な機構であり<ref><pubmed> 10364548 </pubmed></ref>、その裏打ち構造であるPSDがいかに変化するかはシナプス可塑性の分子機構を理解するのに重要である。神経活動依存的なシナプスへの移行はCaMKIIで初めて見いだされ<ref><pubmed> 10102820 </pubmed></ref>、これはCa<sup>2+</sup>/ | 神経活動依存的な[[AMPA型グルタミン酸受容体]]のシナプスへの移行が[[シナプス可塑性]]の主要な機構であり<ref><pubmed> 10364548 </pubmed></ref>、その裏打ち構造であるPSDがいかに変化するかはシナプス可塑性の分子機構を理解するのに重要である。神経活動依存的なシナプスへの移行はCaMKIIで初めて見いだされ<ref><pubmed> 10102820 </pubmed></ref>、これはCa<sup>2+</sup>/カルモジュリンによる蛋白質リン酸化酵素活性の活性化による。しかし、数百に及ぶPSD構成要素がいかにシナプス可塑性で変化していくかの全体像はまだ得られていない。 | ||
==将来展望== | ==将来展望== | ||
当初、PSDの観察に用いられてきた電子顕微鏡は、生組織に用いることが出来ないと言う大きな欠点が有った。一方で、光学顕微鏡は生組織を観察できるが、[[wikipedia:ja:分解能|分解能]]に限度が有り、PSDの詳しい構造はみることが出来ない。最近、[[超高解像度顕微鏡]]と呼ばれる技術が開発され、100 | 当初、PSDの観察に用いられてきた電子顕微鏡は、生組織に用いることが出来ないと言う大きな欠点が有った。一方で、光学顕微鏡は生組織を観察できるが、[[wikipedia:ja:分解能|分解能]]に限度が有り、PSDの詳しい構造はみることが出来ない。最近、[[超高解像度顕微鏡]]と呼ばれる技術が開発され、100 nm以下の分解能で構造を観察することが出来るようになりつつ有る<ref><pubmed> 21889466</pubmed></ref>。まだ、光[[wikipedia:Photobleach|褪色]]などの問題を抱えるが、将来的には生細胞でのPSD動態観察に応用可能であると期待される。 | ||
== 参考文献 == | == 参考文献 == | ||
| 119行目: | 98行目: | ||
<references /> | <references /> | ||
(執筆者:林 康紀、担当編集委員:) | |||
<keywords content="postsynaptic density, PSD" /> | <keywords content="postsynaptic density, PSD" /> | ||
2012年1月7日 (土) 17:42時点における版
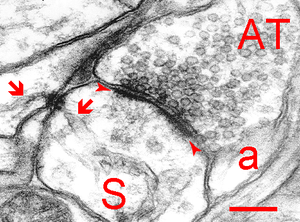
この例は穿孔PSDである。矢頭間:PSD、S:樹状突起棘、AT:軸索終止、a:星状膠細胞、矢印:小胞体、スケールバー:200 nm。ヒト大脳皮質。SpacekとHarrisによる。許可を得て転載。
英:postsynaptic density 英略称:PSD、独:postsynaptische Dichte 仏:densité post-synaptique
シナプス後肥厚(シナプス後肥厚部ともいう)とはシナプス膜直下、細胞質側に存在する多数の蛋白質の複合体である。当初、電子顕微鏡によるシナプスの観察から、シナプス直下のみ電子線を通しにくく、細胞膜が肥厚してみれるからこのように名付けられた。シナプス膜直下に有ることから、シナプスの構造や機能に密接な関わりがあることが推定され、多くの研究がなされてきた。生化学的に単離する事も可能で、シナプスの構造蛋白質、調節蛋白質など数百種類に及ぶ分子を含む事が判っている。
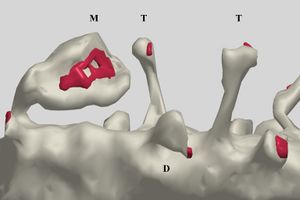
T - 細型棘、 M - 茸状棘と穿孔シナプス(ラット、海馬)SpacekとHarrisによる。許可を得て転載。
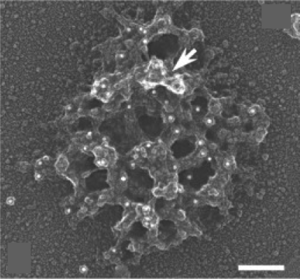
スケールバー:100 nm。LismanとReeseによる[1]。
電子顕微鏡像
Palayは、シナプスを電子顕微鏡で観察する事で、シナプスの直下の膜が他の部分に比べて電子密度が高い事に気づいた[2]。その後、この構造はAkertらによりpostsynaptic density(PSD)と名付けられた[3]。シナプスの膜直下に有ることから、シナプスの構造や機能に密接な関わりがあることが容易に推定され、多くの研究がなされてきた。
GrayはPSDがシナプスの後部にのみ認められる非対称シナプス(Gray I型シナプス)に加え、シナプス前部にも認められる対称シナプス(Gray II型シナプス)が有ることを見いだした[4]。I型シナプスは円形のシナプス顆粒を持つのに対し、II型は楕円形のシナプス顆粒を持つ。現在では、I型シナプスが、グルタミン酸性興奮性シナプス、II型シナプスがGABA性抑制性シナプスであるとされており、電子顕微鏡的に観察されたシナプスの機能を推定する手がかりとなっている。
海馬CA1錐体細胞の場合では、PSDの面積0.05-0.3 µm2、厚さ20 nm程度である。また、場合によってはシナプス直下で連続した構造ではなく、切れ目が有りそのようなPSDは穿孔PSD(perforated PSD)と呼ばれている[5]。そのようなPSDは茸状(mushroom)樹状突起棘に形成された一般に大きなシナプスに認められるが、穿孔をなす成因と生理学的意義はよく判っていない。しかし、一般にPSDが大きなシナプスは、シナプス前終末も大きく、ドックしているシナプス顆粒の数も多いため、より効率の良いシナプス伝達に関与していると思われる。
ReeseらはPSDを電子顕微鏡断層撮影で観察し、PSD中に様々な形状の蛋白質粒子を見いだし分類した上、それぞれを既知のPSD分子種に当てはめている[6]。
生化学的性質
de RobertisらはPSDが界面活性剤に耐性があることを利用し、PSDを生化学的に単離することに成功した。今日では、Siekevitzらによる界面活性剤に非連続蔗糖密度勾配遠心法を組み合わせた方法がよく用いられている[7]。単離したPSDの電子顕微鏡像は組織中のPSDと大きさや形状がよく似ており、直径が平均360 nm(面積で0.1 µm2)、分子量が1.10±0.36 GDaであった[8]。走査型電子顕微鏡観察では、不定形の網目状の構造が認められおり、その構造がPSDを形作る構成基盤である可能性がある[1]。
これにより、PSDを構成する分子を同定することも可能となった。 順により強い界面活性剤処理を行うことにより、PSD I、II、IIIとしてPSDに強固に結合している分子を分別していくことも可能である。 ただし、標品には通常シナプス後部にはあまり存在しない分子(例えば塩基性ミエリン蛋白質)も混入することも知られており、取れてきた標品の中に含まれている分子が本当にPSD由来であるかは、別に免疫染色などで確認する必要が有る。
Kennedyらは、PSD分画に再現性よく多く認められる約45kDの蛋白質が、Ca2+/calmodulin依存性タンパク質キナーゼ(CaMKII)αである事を見いだした[11]。この量は他の蛋白質と比べても多いが、CaMKIIはサンプル調整時の虚血によりPSDに移行することが知られており[12]、それによる影響で過大評価されている可能性があるが、それでもなお最も多い蛋白質の一つであることには間違えがない。CaMKIIは他の情報伝達分子に比べ、数十倍以上多く、これはCaMKIIが単に情報伝達分子であるだけではなく、PSDに於ける構造因子であることも示唆する。実際に岡本らはCaMKIIβがアクチンを束化する活性があることを見いだしている[13]。
また、Kennedyらは、PSD III分画に濃縮され、堅固にPSDを構成している蛋白質として、PSD-95を同定した[14]。PSD-95は後に、NMDA型グルタミン酸受容体のカルボキシル末端に結合し、NMDA型グルタミン酸受容体のシナプスへの局在を規定している蛋白質として再同定された。その後の研究により、PSD-95は様々なシナプス蛋白に結合する事が示され、足場蛋白の典型例として知られている。
一方で、ゲノム計画の完成、質量分析計技術の進歩により、PSDに存在する蛋白質を網羅的に解析する事も出来る様になった[10][15][16]。その構成要素はシナプス伝達に関与する分子(受容体など)のほか、細胞内情報伝達分子(蛋白質リン酸化酵素、小分子GTP結合蛋白質など)、細胞骨格系分子(アクチン、スペクトリンなど)、足場蛋白質(PSD-95、Shank、Homerなど)、細胞接着分子(カドヘリン、ニューロリギンなど)が見いだされている。
| Shengら[9] | 杉山ら[17] | |
|---|---|---|
| AKAP79/150 | 20 | N.D. |
| CaMKIIα/β | 5600 | N.D. |
| GluR1/2/3 | 60 | N.D. |
| Homer1/2/3 | 60 | 343 |
| IRSp53 | 80 | N.D. |
| mGluR1/5 | 20 | N.D. |
| NR1/NR2A/NR2B | 20 | N.D. |
| PSD-95 | 300 | 273* |
| SAP97 | 10 | * |
| SAPAP1-4/GKAP | 150 | 171 |
| Shank1/2/3 | 150 | 310 |
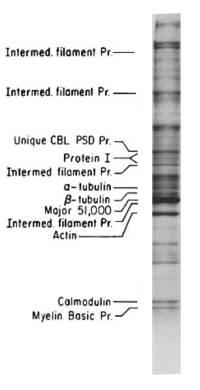
Major 51000はCaMKIIである事が後に判明する。Siekevitzらによる[7]。
Shengらは一個のPSDの分子量とその要素の構成比から、一個のPSDの中にある分子の数を推定した[9][18]。それによると多い蛋白質で数百個の単位で存在することが判った。 この数値は、杉山らが独立にGFP融合蛋白質、免疫染色と蛍光標準ビーズを組み合わせた実験から得られた数字と驚くほど一致している[17]。また、電気生理学的解析によっても一つのシナプスに存在する受容体数は数十から数百個であり、妥当な数字である。
これらのPSD分子は、蛋白質ドメイン間相互作用により、お互い結合し合っている。どの蛋白質が、PSDの最も中心に存在するかは判っていないが、一つの候補としてHomerとShankがある。この両者を精製し、混合することにより、PSDと同様な、網目状構造が再構築できるのに加え、そこにアダプター蛋白質であるGKAPを加えると組み込まれる[19]。GKAPはさらにPSD-95を介しシナプス膜表面のグルタミン酸受容体に結合するので、ShankとHomerを基盤としてその他の蛋白質が次々に結合していくことで、PSDが形成されている可能性がある。実際にPSDとShankをニューロンに過剰発現することによりPSDが大きくなることが知られている[20]。
免疫電子顕微鏡による観察からは、様々なPSD蛋白質が膜直下から鉛直方向に層構造を作っていること、また、シナプス中心から水平方向に周辺部に向かっても蛋白質それぞれの分布をしていることが知られている[21]。
分子構造のダイナミクス
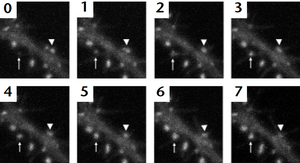
画像は1時間毎。岡部らによる[22]。
岡部らはPSDのコア蛋白質であるPSD-95をGFP融合蛋白とし、神経細胞に導入した上で、経時観察を行った。それによると、PSDは常に形態的に変化していることが判った。さらに、一個のPSDに存在するPSD-95-GFPの蛍光を褪色させて、その回復を測定する方法(光褪色後蛍光回復法、FRAP)によりPSD-95のturnoverを観察した[22]。その結果、PSDに存在するPSD-95は早いturnoverを示す成分(数十分の単位)と1時間程度の観察ではほとんどturnoverが認められない2つの成分が有ることが判った。様々な蛋白質についてさらに検討を加えた所、蛋白質によってアクチンのように殆どの分子が数分以内に入れ替わる分子もある一方で、PSD-95のように遅い分子も有ることが判った[23]。同じ蛋白質で早い成分と遅い成分が有るとき、それらがPSDでいかに配置されているかは興味深い問題であるが、これもまだ明らかにされていない。PSDの蛋白質は樹状突起から供給されるのに加え、隣りのシナプスからも供給される。
分子のturnoverの速度を規定しているのは、その蛋白質の分子量と形状により影響される拡散速度に加え、結合部位の存在や蛋白質修飾などが深く関わっているものと考えられる。また、この移行が、拡散による能動的な過程か、あるいはモーター蛋白質を利用した受動的過程は判っていないが、おそらく両者が有るものと考えられる。また、この時に多くのPSD構成要素が予め複合体を形成しつつ既存のPSDに付け加わって行くのか、それとも個々の蛋白質が付け加わった時に始めて複合体になるかはまだ判っていない。
神経活動依存的なAMPA型グルタミン酸受容体のシナプスへの移行がシナプス可塑性の主要な機構であり[24]、その裏打ち構造であるPSDがいかに変化するかはシナプス可塑性の分子機構を理解するのに重要である。神経活動依存的なシナプスへの移行はCaMKIIで初めて見いだされ[25]、これはCa2+/カルモジュリンによる蛋白質リン酸化酵素活性の活性化による。しかし、数百に及ぶPSD構成要素がいかにシナプス可塑性で変化していくかの全体像はまだ得られていない。
将来展望
当初、PSDの観察に用いられてきた電子顕微鏡は、生組織に用いることが出来ないと言う大きな欠点が有った。一方で、光学顕微鏡は生組織を観察できるが、分解能に限度が有り、PSDの詳しい構造はみることが出来ない。最近、超高解像度顕微鏡と呼ばれる技術が開発され、100 nm以下の分解能で構造を観察することが出来るようになりつつ有る[26]。まだ、光褪色などの問題を抱えるが、将来的には生細胞でのPSD動態観察に応用可能であると期待される。
参考文献
- ↑ 1.0 1.1
Petersen, J.D., Chen, X., Vinade, L., Dosemeci, A., Lisman, J.E., & Reese, T.S. (2003).
Distribution of postsynaptic density (PSD)-95 and Ca2+/calmodulin-dependent protein kinase II at the PSD. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(35), 11270-8. [PubMed:14657186] [PMC] [WorldCat] - ↑
PALAY, S.L. (1956).
Synapses in the central nervous system. The Journal of biophysical and biochemical cytology, 2(4 Suppl), 193-202. [PubMed:13357542] [PMC] [WorldCat] [DOI] - ↑
Akert, K., Moor, H., Pfenninger, K., & Sandri, C. (1969).
Contributions of new impregnation methods and freeze etching to the problems of synaptic fine structure. Progress in brain research, 31, 223-40. [PubMed:4186645] [WorldCat] [DOI] - ↑
GRAY, E.G. (1959).
Axo-somatic and axo-dendritic synapses of the cerebral cortex: an electron microscope study. Journal of anatomy, 93, 420-33. [PubMed:13829103] [PMC] [WorldCat] - ↑
Harris, K.M., Jensen, F.E., & Tsao, B. (1992).
Three-dimensional structure of dendritic spines and synapses in rat hippocampus (CA1) at postnatal day 15 and adult ages: implications for the maturation of synaptic physiology and long-term potentiation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 12(7), 2685-705. [PubMed:1613552] [WorldCat] - ↑
Chen, X., Winters, C., Azzam, R., Li, X., Galbraith, J.A., Leapman, R.D., & Reese, T.S. (2008).
Organization of the core structure of the postsynaptic density. Proceedings of the National Academy of Sciences of the United States of America, 105(11), 4453-8. [PubMed:18326622] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1
Carlin, R.K., Grab, D.J., Cohen, R.S., & Siekevitz, P. (1980).
Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. The Journal of cell biology, 86(3), 831-45. [PubMed:7410481] [PMC] [WorldCat] [DOI] - ↑
Chen, X., Vinade, L., Leapman, R.D., Petersen, J.D., Nakagawa, T., Phillips, T.M., ..., & Reese, T.S. (2005).
Mass of the postsynaptic density and enumeration of three key molecules. Proceedings of the National Academy of Sciences of the United States of America, 102(32), 11551-6. [PubMed:16061821] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2
Sheng, M., & Hoogenraad, C.C. (2007).
The postsynaptic architecture of excitatory synapses: a more quantitative view. Annual review of biochemistry, 76, 823-47. [PubMed:17243894] [WorldCat] [DOI] - ↑ 10.0 10.1
Peng, J., Kim, M.J., Cheng, D., Duong, D.M., Gygi, S.P., & Sheng, M. (2004).
Semiquantitative proteomic analysis of rat forebrain postsynaptic density fractions by mass spectrometry. The Journal of biological chemistry, 279(20), 21003-11. [PubMed:15020595] [WorldCat] [DOI] - ↑
Kennedy, M.B., Bennett, M.K., & Erondu, N.E. (1983).
Biochemical and immunochemical evidence that the "major postsynaptic density protein" is a subunit of a calmodulin-dependent protein kinase. Proceedings of the National Academy of Sciences of the United States of America, 80(23), 7357-61. [PubMed:6580651] [PMC] [WorldCat] [DOI] - ↑
Suzuki, T., Okumura-Noji, K., Tanaka, R., & Tada, T. (1994).
Rapid translocation of cytosolic Ca2+/calmodulin-dependent protein kinase II into postsynaptic density after decapitation. Journal of neurochemistry, 63(4), 1529-37. [PubMed:7931307] [WorldCat] [DOI] - ↑
Okamoto, K., Narayanan, R., Lee, S.H., Murata, K., & Hayashi, Y. (2007).
The role of CaMKII as an F-actin-bundling protein crucial for maintenance of dendritic spine structure. Proceedings of the National Academy of Sciences of the United States of America, 104(15), 6418-23. [PubMed:17404223] [PMC] [WorldCat] [DOI] - ↑
Cho, K.O., Hunt, C.A., & Kennedy, M.B. (1992).
The rat brain postsynaptic density fraction contains a homolog of the Drosophila discs-large tumor suppressor protein. Neuron, 9(5), 929-42. [PubMed:1419001] [WorldCat] [DOI] - ↑
Jordan, B.A., Fernholz, B.D., Boussac, M., Xu, C., Grigorean, G., Ziff, E.B., & Neubert, T.A. (2004).
Identification and verification of novel rodent postsynaptic density proteins. Molecular & cellular proteomics : MCP, 3(9), 857-71. [PubMed:15169875] [WorldCat] [DOI] - ↑
Collins, M.O., Yu, L., Coba, M.P., Husi, H., Campuzano, I., Blackstock, W.P., ..., & Grant, S.G. (2005).
Proteomic analysis of in vivo phosphorylated synaptic proteins. The Journal of biological chemistry, 280(7), 5972-82. [PubMed:15572359] [WorldCat] [DOI] - ↑ 17.0 17.1
Sugiyama, Y., Kawabata, I., Sobue, K., & Okabe, S. (2005).
Determination of absolute protein numbers in single synapses by a GFP-based calibration technique. Nature methods, 2(9), 677-84. [PubMed:16118638] [WorldCat] [DOI] - ↑
Cheng, D., Hoogenraad, C.C., Rush, J., Ramm, E., Schlager, M.A., Duong, D.M., ..., & Peng, J. (2006).
Relative and absolute quantification of postsynaptic density proteome isolated from rat forebrain and cerebellum. Molecular & cellular proteomics : MCP, 5(6), 1158-70. [PubMed:16507876] [WorldCat] [DOI] - ↑
Hayashi, M.K., Tang, C., Verpelli, C., Narayanan, R., Stearns, M.H., Xu, R.M., ..., & Hayashi, Y. (2009).
The postsynaptic density proteins Homer and Shank form a polymeric network structure. Cell, 137(1), 159-71. [PubMed:19345194] [PMC] [WorldCat] [DOI] - ↑
Sala, C., Piëch, V., Wilson, N.R., Passafaro, M., Liu, G., & Sheng, M. (2001).
Regulation of dendritic spine morphology and synaptic function by Shank and Homer. Neuron, 31(1), 115-30. [PubMed:11498055] [WorldCat] [DOI] - ↑
Valtschanoff, J.G., & Weinberg, R.J. (2001).
Laminar organization of the NMDA receptor complex within the postsynaptic density. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(4), 1211-7. [PubMed:11160391] [PMC] [WorldCat] - ↑ 22.0 22.1
Okabe, S., Kim, H.D., Miwa, A., Kuriu, T., & Okado, H. (1999).
Continual remodeling of postsynaptic density and its regulation by synaptic activity. Nature neuroscience, 2(9), 804-11. [PubMed:10461219] [WorldCat] [DOI] - ↑
Kuriu, T., Inoue, A., Bito, H., Sobue, K., & Okabe, S. (2006).
Differential control of postsynaptic density scaffolds via actin-dependent and -independent mechanisms. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(29), 7693-706. [PubMed:16855097] [PMC] [WorldCat] [DOI] - ↑
Shi, S.H., Hayashi, Y., Petralia, R.S., Zaman, S.H., Wenthold, R.J., Svoboda, K., & Malinow, R. (1999).
Rapid spine delivery and redistribution of AMPA receptors after synaptic NMDA receptor activation. Science (New York, N.Y.), 284(5421), 1811-6. [PubMed:10364548] [WorldCat] [DOI] - ↑
Shen, K., & Meyer, T. (1999).
Dynamic control of CaMKII translocation and localization in hippocampal neurons by NMDA receptor stimulation. Science (New York, N.Y.), 284(5411), 162-6. [PubMed:10102820] [WorldCat] [DOI] - ↑
Urban, N.T., Willig, K.I., Hell, S.W., & Nägerl, U.V. (2011).
STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysical journal, 101(5), 1277-84. [PubMed:21889466] [PMC] [WorldCat] [DOI]
(執筆者:林 康紀、担当編集委員:)