「セロトニン神経系」の版間の差分
細 →摂食行動 |
細編集の要約なし |
||
| (3人の利用者による、間の20版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:Serotonergic system | |||
[[セロトニン]]を含有し、[[伝達物質]]として用いる神経細胞群とその標的細胞の受容体からなる神経系。セロトニン神経の細胞体はそのほとんどが[[脳幹]]の[[縫線核]]にあるが、神経線維は[[中枢神経]]系全体に分布しており、様々な中枢機能の調節に関与する。縫線核外にもセロトニン神経の細胞体は存在し、縫線核にはセロトニン作動性神経以外の神経細胞も存在する<ref name="ref1"><pubmed>16157378</pubmed></ref>。また、[[グルタミン酸]]や[[GABA]]など他の伝達物質がセロトニン神経に含まれる、又は伝達物質として用いられることも示唆されている<ref><pubmed>18615128</pubmed></ref>。背側縫線核と[[上中心核]]のセロトニン神経は[[前脳]]に投射し、[[橋縫線核]]からは主に[[小脳]]に、[[大縫線核]]、[[不確縫線核]]、[[淡蒼縫線核]]からは脳幹内及び[[脊髄]]に投射する。 | |||
== | == セロトニン神経系の情報伝達 == | ||
[[Image:5ht fig3.jpg|frame|right|グルタミン酸作動性シナプスなどとは異なり、セロトニンによる情報伝達部位は明確なシナプス構造を形成しない場合が多い。セロトニンは放出部位から比較的離れた部位にある受容体に作用して、標的細胞の興奮性や他の伝達物質の放出を調節し、自己受容体を介してセロトニン神経自身を抑制する。]] | |||
[[ | セロトニンが標的細胞に対して及ぼす効果は受容体の種類に依存し、主に[[シナプス伝達]]の修飾や比較的遅い[[膜電位]]変化による興奮性の調節を担う(セロトニンの項目参照)。セロトニン神経自身にもセロトニン受容体が発現しており([[自己受容体]])、主にセロトニン[[5-HT<sub>1A</sub>受容体]]による抑制性の調節を受ける。神経細胞間の速い信号伝達は通常シナプスと呼ばれる神経細胞同士が近接した特殊な構造で行われるが、大脳皮質や海馬に投射するセロトニン神経線維の[[バリコシティ]](小胞を含む膨らみで伝達物質放出部位と考えられている構造)はその大多数が明確なシナプス構造を形成していない<ref name="ref1" />。縫線核内にセロトニン神経線維の側枝と考えられる軸索の終末や、セロトニン神経の樹状突起にシナプス小胞様の構造が存在するが、このような縫線核内の[[軸索終末]]などの中にも明確なシナプス構造を形成しないものがある。また、5-HT<sub>1A</sub>受容体や5-HT<sub>2A</sub>受容体がシナプス外、又はバリコシティと離れた部位に発現していることも報告されている。従って、セロトニン作動性の神経情報伝達は通常のシナプス伝達とは異なり、セロトニンが比較的離れた場所にある受容体まで拡散して作用する[[拡散性伝達]](volume transmission)が主と考えられる<ref name="ref1" />。 | ||
== | == セロトニン神経系によって調節される中枢神経機能 == | ||
==== 体温調節 | ==== 体温調節 ==== | ||
5-HT<sub>1A</sub>、5-HT<sub>3</sub>、5-HT<sub>7</sub>受容体の[[アゴニスト]]の投与によって体温低下が生じる<ref><pubmed>21884711</pubmed></ref>。セロトニン神経の活動を急性かつ特異的に低下させることができる遺伝子改変マウスでは、セロトニン神経の活動低下に伴って体温が低下する<ref><pubmed>21798952</pubmed></ref>。一方で、セロトニン合成酵素を欠損したマウスやセロトニン神経が障害された遺伝子改変[[マウス]]では、通常の室温であれば正常な体温が保たれているが、低温暴露の際の体温低下が野生型マウスに比べて大きい又は持続する。従って、セロトニン神経は環境変化の情報を熱産生系に伝える中継点に位置すると考えられる<ref><pubmed>20133432</pubmed></ref>。 | |||
==== 摂食行動 ==== | |||
[[摂食行動]]の調節には[[視床下部]]の[[外側核]]、[[腹内側核]]、[[弓状核]]、[[室傍核]]が重要な役割を果たし、視床下部に投射するセロトニン作動性神経は摂食行動に対して抑制的に作用する。薬理学的解析によって5-HT<sub>1B</sub>受容体と5-HT<sub>2C</sub>受容体の関与が示されており、さらに5-HT<sub>2C</sub>受容体欠損マウスでは[[過食]]と[[肥満]]が生じる<ref name="ref2"><pubmed>21040622</pubmed></ref>。5-HT<sub>2C</sub>は弓状核の[[プロオピオメラノコルチン]](POMC)ニューロンの活動性を上昇させることによって摂食を抑制することが示唆されており、5-HT<sub>2C</sub>受容体欠損マウスにおける異常はPOMCニューロン特異的に5-HT<sub>2C</sub>受容体を発現させることよってレスキューできる<ref><pubmed>19038216</pubmed></ref>。5-HT<sub>1B</sub>受容体はPOMCニューロンに対して抑制的もしくは拮抗的に働くニューロンの活動を低下させることによって摂食を抑制することが示唆されている<ref name="ref2" />。 | |||
==== 睡眠 ==== | |||
5-HT<sub>1A</sub>、5-HT<sub>1B</sub>、5-HT<sub>2A/2C</sub>、5-HT<sub>3</sub>、5-HT<sub>6</sub>、5-HT<sub>7</sub>受容体アゴニストの全身、又は脳室内投与は共通して[[覚醒]]を促進し、[[REM睡眠]]を抑制する。5-HT<sub>1A</sub>、5-HT<sub>1B</sub>受容体欠損マウスではREM睡眠の促進が生じ、アゴニスト投与の効果と矛盾しない。しかし、5-HT<sub>2A</sub>、5-HT<sub>2C</sub>受容体欠損マウスでは覚醒が促進され、5-HT<sub>7</sub>受容体欠損マウスではREM睡眠が抑制される<ref><pubmed>21459634</pubmed></ref>。 | |||
==== 睡眠 | |||
5-HT<sub>1A</sub>、5-HT<sub>1B</sub>、5-HT<sub>2A/2C</sub>、5-HT<sub>3</sub> | |||
==== 痛覚 ==== | |||
末梢においてセロトニンは[[一次知覚神経]]に作用して[[痛覚]]に対して促進的な役割を果たす<ref name="ref3"><pubmed>21808193</pubmed></ref>。下降性に脊髄に投射するセロトニン作動性神経には痛みの制御に関与するものがあり、特に大縫線核からの投射が重要と考えられている。セロトニン神経毒などを用いた初期の実験結果から、下降性のセロトニン神経は痛みを抑制することが示されたが、後に痛みの促進にも関与することが報告された<ref name="ref3" /> <ref><pubmed>16539862</pubmed></ref>。抑制的に作用するか促進的に作用するかは神経系の状態に依存し、神経損傷時には5-HT<sub>3</sub>受容体を介した促進系の亢進が生じることが示唆されている<ref name="ref3" />。 | 末梢においてセロトニンは[[一次知覚神経]]に作用して[[痛覚]]に対して促進的な役割を果たす<ref name="ref3"><pubmed>21808193</pubmed></ref>。下降性に脊髄に投射するセロトニン作動性神経には痛みの制御に関与するものがあり、特に大縫線核からの投射が重要と考えられている。セロトニン神経毒などを用いた初期の実験結果から、下降性のセロトニン神経は痛みを抑制することが示されたが、後に痛みの促進にも関与することが報告された<ref name="ref3" /> <ref><pubmed>16539862</pubmed></ref>。抑制的に作用するか促進的に作用するかは神経系の状態に依存し、神経損傷時には5-HT<sub>3</sub>受容体を介した促進系の亢進が生じることが示唆されている<ref name="ref3" />。 | ||
==== 性行動 | ==== 性行動 ==== | ||
一般にセロトニン機能低下は[[性行動]]を促進し、セロトニン機能亢進は性行動を抑制する<ref name="ref5"><pubmed>21374021</pubmed></ref> <ref name="ref4"><pubmed>22206901</pubmed></ref>。オスラットにセロトニントランスポーター阻害薬である[[選択的セロトニン再取込阻害薬]](selective serotonin reuptake inhibitor、SSRI)を慢性投与すると[[射精]]の遅延が生じる。ヒトでもSSRIの使用によって射精の遅延等の性機能異常が生じる。5-HT<sub>1A</sub>受容体は性行動に促進的に、5-HT<sub>1B</sub>受容体は抑制的に働いており、SSRIと同時に5-HT<sub>1A</sub>受容体のアンタゴニストを投与すると性行動が完全に抑制される<ref name="ref5" />。メスでは5-HT<sub>1A</sub>受容体が性行動に対して抑制的に働いており、視床下部の腹内側核に5-HT<sub>1A</sub>受容体アゴニストを投与すると[[ロードシス]](発情期のメスが示す姿勢反射)を抑制する<ref><pubmed>11011068</pubmed></ref>。 | 一般にセロトニン機能低下は[[性行動]]を促進し、セロトニン機能亢進は性行動を抑制する<ref name="ref5"><pubmed>21374021</pubmed></ref> <ref name="ref4"><pubmed>22206901</pubmed></ref>。オスラットにセロトニントランスポーター阻害薬である[[選択的セロトニン再取込阻害薬]](selective serotonin reuptake inhibitor、SSRI)を慢性投与すると[[射精]]の遅延が生じる。ヒトでもSSRIの使用によって射精の遅延等の性機能異常が生じる。5-HT<sub>1A</sub>受容体は性行動に促進的に、5-HT<sub>1B</sub>受容体は抑制的に働いており、SSRIと同時に5-HT<sub>1A</sub>受容体のアンタゴニストを投与すると性行動が完全に抑制される<ref name="ref5" />。メスでは5-HT<sub>1A</sub>受容体が性行動に対して抑制的に働いており、視床下部の腹内側核に5-HT<sub>1A</sub>受容体アゴニストを投与すると[[ロードシス]](発情期のメスが示す姿勢反射)を抑制する<ref><pubmed>11011068</pubmed></ref>。 | ||
==== 攻撃性 | ==== 攻撃性 ==== | ||
セロトニン枯渇実験などの結果に基づき、従来はセロトニンが[[攻撃性]]を抑制することが定説となっていた。しかし、セロトニンが攻撃性に及ぼす影響は、用いられる動物モデルなどに依存し、促進的に働く場合もあることが示されている<ref name="ref4" /> <ref name="ref6"><pubmed>15817750</pubmed></ref> <ref name="ref7"><pubmed>20938650</pubmed></ref>。ヒトでもSSRIが攻撃性に対して抑制的、促進的、どちらにも働き得ることが報告されている<ref><pubmed>19404614</pubmed></ref>。攻撃性に対するセロトニンの影響は、攻撃の特性(trait)か攻撃の状態(state)に関するものか、あるいは能動的攻撃か反応的攻撃かなどによって異なることが示唆されている<ref name="ref4" /> <ref name="ref6" />。実験動物において5-HT<sub>1A</sub>、5-HT<sub>1B</sub>受容体アゴニストの全身投与や視床下部、[[中脳水道周囲灰白質]]に対する局所投与は攻撃性に対して抑制的に作用する。5-HT<sub>1A</sub>アゴニストの全身投与は沈静などの非特異的な効果を伴うのに対し、5-HT<sub>1B</sub>アゴニストは特異的に攻撃性を抑制する。また、5-HT<sub>1B</sub>受容体欠損マウスでは攻撃性が上昇している<ref name="ref6" /> <ref name="ref7" />。セロトニン、[[ノルアドレナリン]]の代謝酵素MAO<sub>A</sub>(monoamine oxidase A)を欠損したマウスでは、脳のセロトニン含量の増加と攻撃性の亢進が生じている。攻撃性の変化は5-HT<sub>2A</sub>受容体のアンタゴニストで抑制できるため、この場合5-HT<sub>2A</sub>受容体が攻撃性に対して促進的に働いていると考えられる<ref><pubmed>18258310</pubmed></ref>。 | |||
セロトニン枯渇実験などの結果に基づき、従来はセロトニンが[[攻撃性]] | |||
==== 情動 ==== | |||
うつ病や不安障害の治療にセロトニントランスポーターや代謝酵素の阻害薬が用いられるため<ref name="ref8"><pubmed>12551730</pubmed></ref>、情動の調節にセロトニン神経系が関与すると考えられている。うつ病から回復した患者の血中トリプトファン(セロトニンの前駆物質)濃度を低下させると抑うつ症状が表れるため、うつ病もしくはその治療によってセロトニン神経系の機能が変化すると考えられる<ref name="ref9"><pubmed>18585794</pubmed></ref>。うつ病患者ではセロトニンによる神経内分泌制御機能の低下や5-HT<sub>1A</sub>受容体のリガンド結合が低下しているが、これらの変化はうつ症状が無くなった後も持続するので、うつ状態と直接関係しているとは考え難い<ref name="ref9" />。また、一般にセロトニン系の薬物の治療効果が発現するまでには数週間かかり、トリプトファンレベルを変化させても健常者では[[気分]]の変化は生じないため、単純にセロトニンレベルの増減で気分が変化するのではない<ref name="ref9" />。健常者においてトリプトファンレベルを変化させると恐怖や幸福の表情の認識が変化する<ref><pubmed>17363069</pubmed></ref>。実験動物において薬物によってセロトニン神経機能を障害すると不安様行動が低下する<ref><pubmed>3275471</pubmed></ref>。セロトニン神経に対して抑制的に働く5-HT<sub>1A</sub>自己受容体を特異的に欠損させたマウスでは不安様行動が増加する<ref><pubmed>21508226</pubmed></ref>。セロトニン神経の障害やセロトニン含量の低下を生じさせた遺伝子改変マウスでは、ほとんどの例で不安様行動が低下するが、うつ様行動については一致した結果が得られていない<ref name="ref10"><pubmed>21945798</pubmed></ref>。セロトニントランスポーターを欠損させたマウスでは脳内のセロトニンレベルが上昇し、不安様行動が増加する。ヒトのセロトニントランスポーター遺伝子の[[プロモーター]]領域には繰り返し配列の長さが異なる多型が存在し、短い型(S型)は長い型よりセロトニントランスポーターの発現量が少ない。S型は不安の性格特性に関連し、ストレスを受けた際のうつ病発症のリスクが高い。さらに、S型を持つヒトの脳では[[情動]]に関与する[[扁桃体]]の反応性が高まっている<ref><pubmed>16530463</pubmed></ref>。 | |||
== | ==== 学習・記憶 ==== | ||
セロトニン神経の障害やセロトニン含量の低下を生じさせた遺伝子改変マウスでは、多くの場合恐怖条件付けが亢進している<ref name="ref10" />。5-HT<sub>1A</sub>受容体欠損マウスでは海馬依存性の空間学習課題などに障害が見られるが<ref name="ref11"><pubmed>19086256</pubmed></ref>、5-HT<sub>1A</sub>アゴニストを海馬に投与しても[[空間学習]]の遂行が悪くなる<ref><pubmed>9142756</pubmed></ref>。一方で、縫線核に5-HT<sub>1A</sub>アゴニストを投与すると作業記憶課題の遂行が良くなることなどから、5-HT<sub>1A</sub>の自己受容体とそれ以外とでは認知機能に対して逆の作用を持ち、自己受容体の活性化によるセロトニン神経の活動低下が記憶課題の遂行を改善することが示唆されている<ref name="ref11" />。5-HT<sub>4</sub>受容体のアゴニスト投与によって複数の記憶課題において改善が見られ、アンタゴニスト投与によって受動的回避学習の成績が低下するため、この受容体の活性化は概ね記憶課題を改善する方向に働く。逆に5-HT<sub>6</sub>受容体の場合はアンタゴニストの投与によって、空間学習課題などの遂行が改善する<ref name="ref11" />。 | |||
== セロトニン神経系に作用する薬物 == | |||
==== 向精神薬 ==== | |||
SSRI、三環系抗うつ薬、セロトニン・ノルアドレナリン再取込阻害薬はいずれも抗うつ作用を持ち、セロトニントランスポーターを阻害する。三環系抗うつ薬はノルアドレナリン再取込阻害薬も持ち、セロトニントランスポーターに対する親和性が低いものもある。セロトニン、ノルアドレナリンの代謝酵素MAO<sub>A</sub>の阻害薬も抗うつ作用を持つ。このように、セロトニンの再取込や代謝酵素の阻害によって、シナプスや細胞外のセロトニン濃度を上昇させる、又はセロトニン含量を増やす薬物が抗うつ薬として用いられている。また、SSRIは抗不安薬としても広く用いられている<ref name="ref8" />。情動調節におけるセロトニンの役割には不明な点が多く、セロトニン濃度上昇が抗うつ作用や抗不安作用に結びつくメカニズムも不明である。これらの薬物の治療効果の発現には一般に数週間を要するため、セロトニン濃度上昇そのものではなく、2次的な変化が治療効果を担うと考えられている。統合失調症や躁状態の治療に用いられる抗精神病薬は様々な伝達物質受容体に対する遮断作用を持ち、セロトニン受容体に対する遮断作用も強い。特に非定型抗精神病薬(新規抗精神病薬)に属するセロトニン・ドーパミンアンタゴニストは5-HT<sub>2A</sub>受容体に対する遮断作用が強いが、抗精神病作用との関連は明らかではない<ref><pubmed>18772032</pubmed></ref>。 | |||
コカイン、アンフェタミン、MDMA(3,4-methylenedioxymethamphetamine)などの精神刺激薬は細胞膜のモノアミントランスポーターを標的とする。一般にこれらの薬物には依存性があり、実験動物では自己投与の条件付けが成立する。コカインは再取込阻害薬であり、アンフェタミン類はトランスポーターの逆輸送によってモノアミンの放出を起こす。ドーパミントランスポーターに対する作用が行動に及ぼす影響において重要とされており、セロトニントランスポーターに対する作用の強さは自己投与における効力と負の相関を示す<ref><pubmed>17825265</pubmed></ref>。幻覚薬にはセロトニン受容体に対してアゴニスト作用を持つものがあり、メスカリンなどのフェニルアルキルアミン系薬とシロシビンやLSD(lysergic acid diethylamide)などのインドールアミン系薬がある。フェニルアルキルアミン系薬は比較的5-HT<sub>2</sub>ファミリーの受容体に対する親和性が高い。インドールアミン系薬は5-HT<sub>1A</sub>受容体に対する親和性が高く、セロトニン神経の活動を抑制する。いずれも複数のセロトニン受容体に作用するが、幻覚誘発作用は5-HT<sub>2A</sub>受容体に依存すると考えられている<ref><pubmed>21256140</pubmed></ref>。しかし、必ずしも全ての5-HT<sub>2A</sub>受容体アゴニストが幻覚誘発作用を持つのではなく、幻覚誘発作用を持つものと持たないものでは下流のシグナル経路が異なることが示唆されている<ref><pubmed>207171</pubmed></ref>。 | |||
==== 偏頭痛治療薬 ==== | |||
偏頭痛の治療薬として用いられるトリプタン系の薬物は5-HT<sub>1B</sub>、5-HT<sub>1D</sub>受容体のアゴニストで、特に5-HT<sub>1D</sub>に高い親和性を持つ。トリプタン系薬の中には5-HT<sub>1F</sub>受容体に対して比較的高い親和性を持つものもあり、5-HT<sub>1F</sub>アゴニストが治療効果を持つことも示唆されている<ref name="ref12"><pubmed>20430316</pubmed></ref>。偏頭痛における痛みは頭蓋内外の血管に分布する三叉神経の活動が関与すると考えられている。5-HT<sub>1B</sub>受容体は血管平滑筋に存在し、活性化によって血管収縮を引き起こす。5-HT<sub>1D</sub>、5-HT<sub>1F</sub>受容体は三叉神経に発現しており、活性化によって過分極と炎症誘発性ペプチド類の放出抑制を引き起こして鎮痛効果を発揮すると考えられている<ref name="ref12" /> <ref><pubmed>21459461</pubmed></ref>。 | |||
==== 制吐薬 | ==== 制吐薬 ==== | ||
嘔吐反射において重要な役割を果たす延髄最後野の化学受容器引金帯と消化管に分布する求心性迷走神経の末端に5-HT<sub>3</sub>受容体が多く発現している。5-HT<sub>3</sub>受容体のアンタゴニストは制吐薬として、特に癌化学療法に伴う嘔気、嘔吐の軽減に用いられる。延髄最後野では血液脳関門の透過性が比較的高く血中の化学物質が直接達し得るが、化学療法に伴う嘔吐の抑制は主に迷走神経末端の5-HT<sub>3</sub>受容体遮断によるものと考えられている<ref><pubmed>18525044</pubmed></ref>。 | |||
== セロトニン症候群 == | == セロトニン症候群 == | ||
セロトニン系に作用する薬物の過剰投与、相互作用によって、セロトニン神経系の活動性の亢進によって生じる。自律神経症状、精神症状、神経筋症状が生じるが、全ての患者でこれら全てが表れるのではない。診断基準となる症状として、焦燥、混乱、軽躁、発汗、下痢、発熱、震え、反射亢進、協調運動障害、ミオクローヌス、眼振、振戦がある。重篤な場合には強直間代発作、多臓器不全、播種性血管内凝固、横紋筋融解、昏睡、死に至る場合もある<ref><pubmed>20433130</pubmed></ref>。<br> | |||
<references /> | |||
(執筆者:小林克典、担当編集委員:林康紀) | |||
2012年2月15日 (水) 16:14時点における版
英語名:Serotonergic system
セロトニンを含有し、伝達物質として用いる神経細胞群とその標的細胞の受容体からなる神経系。セロトニン神経の細胞体はそのほとんどが脳幹の縫線核にあるが、神経線維は中枢神経系全体に分布しており、様々な中枢機能の調節に関与する。縫線核外にもセロトニン神経の細胞体は存在し、縫線核にはセロトニン作動性神経以外の神経細胞も存在する[1]。また、グルタミン酸やGABAなど他の伝達物質がセロトニン神経に含まれる、又は伝達物質として用いられることも示唆されている[2]。背側縫線核と上中心核のセロトニン神経は前脳に投射し、橋縫線核からは主に小脳に、大縫線核、不確縫線核、淡蒼縫線核からは脳幹内及び脊髄に投射する。
セロトニン神経系の情報伝達
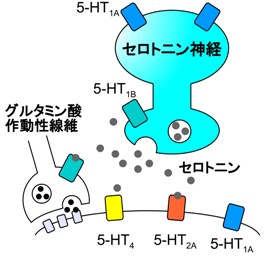
セロトニンが標的細胞に対して及ぼす効果は受容体の種類に依存し、主にシナプス伝達の修飾や比較的遅い膜電位変化による興奮性の調節を担う(セロトニンの項目参照)。セロトニン神経自身にもセロトニン受容体が発現しており(自己受容体)、主にセロトニン[[5-HT1A受容体]]による抑制性の調節を受ける。神経細胞間の速い信号伝達は通常シナプスと呼ばれる神経細胞同士が近接した特殊な構造で行われるが、大脳皮質や海馬に投射するセロトニン神経線維のバリコシティ(小胞を含む膨らみで伝達物質放出部位と考えられている構造)はその大多数が明確なシナプス構造を形成していない[1]。縫線核内にセロトニン神経線維の側枝と考えられる軸索の終末や、セロトニン神経の樹状突起にシナプス小胞様の構造が存在するが、このような縫線核内の軸索終末などの中にも明確なシナプス構造を形成しないものがある。また、5-HT1A受容体や5-HT2A受容体がシナプス外、又はバリコシティと離れた部位に発現していることも報告されている。従って、セロトニン作動性の神経情報伝達は通常のシナプス伝達とは異なり、セロトニンが比較的離れた場所にある受容体まで拡散して作用する拡散性伝達(volume transmission)が主と考えられる[1]。
セロトニン神経系によって調節される中枢神経機能
体温調節
5-HT1A、5-HT3、5-HT7受容体のアゴニストの投与によって体温低下が生じる[3]。セロトニン神経の活動を急性かつ特異的に低下させることができる遺伝子改変マウスでは、セロトニン神経の活動低下に伴って体温が低下する[4]。一方で、セロトニン合成酵素を欠損したマウスやセロトニン神経が障害された遺伝子改変マウスでは、通常の室温であれば正常な体温が保たれているが、低温暴露の際の体温低下が野生型マウスに比べて大きい又は持続する。従って、セロトニン神経は環境変化の情報を熱産生系に伝える中継点に位置すると考えられる[5]。
摂食行動
摂食行動の調節には視床下部の外側核、腹内側核、弓状核、室傍核が重要な役割を果たし、視床下部に投射するセロトニン作動性神経は摂食行動に対して抑制的に作用する。薬理学的解析によって5-HT1B受容体と5-HT2C受容体の関与が示されており、さらに5-HT2C受容体欠損マウスでは過食と肥満が生じる[6]。5-HT2Cは弓状核のプロオピオメラノコルチン(POMC)ニューロンの活動性を上昇させることによって摂食を抑制することが示唆されており、5-HT2C受容体欠損マウスにおける異常はPOMCニューロン特異的に5-HT2C受容体を発現させることよってレスキューできる[7]。5-HT1B受容体はPOMCニューロンに対して抑制的もしくは拮抗的に働くニューロンの活動を低下させることによって摂食を抑制することが示唆されている[6]。
睡眠
5-HT1A、5-HT1B、5-HT2A/2C、5-HT3、5-HT6、5-HT7受容体アゴニストの全身、又は脳室内投与は共通して覚醒を促進し、REM睡眠を抑制する。5-HT1A、5-HT1B受容体欠損マウスではREM睡眠の促進が生じ、アゴニスト投与の効果と矛盾しない。しかし、5-HT2A、5-HT2C受容体欠損マウスでは覚醒が促進され、5-HT7受容体欠損マウスではREM睡眠が抑制される[8]。
痛覚
末梢においてセロトニンは一次知覚神経に作用して痛覚に対して促進的な役割を果たす[9]。下降性に脊髄に投射するセロトニン作動性神経には痛みの制御に関与するものがあり、特に大縫線核からの投射が重要と考えられている。セロトニン神経毒などを用いた初期の実験結果から、下降性のセロトニン神経は痛みを抑制することが示されたが、後に痛みの促進にも関与することが報告された[9] [10]。抑制的に作用するか促進的に作用するかは神経系の状態に依存し、神経損傷時には5-HT3受容体を介した促進系の亢進が生じることが示唆されている[9]。
性行動
一般にセロトニン機能低下は性行動を促進し、セロトニン機能亢進は性行動を抑制する[11] [12]。オスラットにセロトニントランスポーター阻害薬である選択的セロトニン再取込阻害薬(selective serotonin reuptake inhibitor、SSRI)を慢性投与すると射精の遅延が生じる。ヒトでもSSRIの使用によって射精の遅延等の性機能異常が生じる。5-HT1A受容体は性行動に促進的に、5-HT1B受容体は抑制的に働いており、SSRIと同時に5-HT1A受容体のアンタゴニストを投与すると性行動が完全に抑制される[11]。メスでは5-HT1A受容体が性行動に対して抑制的に働いており、視床下部の腹内側核に5-HT1A受容体アゴニストを投与するとロードシス(発情期のメスが示す姿勢反射)を抑制する[13]。
攻撃性
セロトニン枯渇実験などの結果に基づき、従来はセロトニンが攻撃性を抑制することが定説となっていた。しかし、セロトニンが攻撃性に及ぼす影響は、用いられる動物モデルなどに依存し、促進的に働く場合もあることが示されている[12] [14] [15]。ヒトでもSSRIが攻撃性に対して抑制的、促進的、どちらにも働き得ることが報告されている[16]。攻撃性に対するセロトニンの影響は、攻撃の特性(trait)か攻撃の状態(state)に関するものか、あるいは能動的攻撃か反応的攻撃かなどによって異なることが示唆されている[12] [14]。実験動物において5-HT1A、5-HT1B受容体アゴニストの全身投与や視床下部、中脳水道周囲灰白質に対する局所投与は攻撃性に対して抑制的に作用する。5-HT1Aアゴニストの全身投与は沈静などの非特異的な効果を伴うのに対し、5-HT1Bアゴニストは特異的に攻撃性を抑制する。また、5-HT1B受容体欠損マウスでは攻撃性が上昇している[14] [15]。セロトニン、ノルアドレナリンの代謝酵素MAOA(monoamine oxidase A)を欠損したマウスでは、脳のセロトニン含量の増加と攻撃性の亢進が生じている。攻撃性の変化は5-HT2A受容体のアンタゴニストで抑制できるため、この場合5-HT2A受容体が攻撃性に対して促進的に働いていると考えられる[17]。
情動
うつ病や不安障害の治療にセロトニントランスポーターや代謝酵素の阻害薬が用いられるため[18]、情動の調節にセロトニン神経系が関与すると考えられている。うつ病から回復した患者の血中トリプトファン(セロトニンの前駆物質)濃度を低下させると抑うつ症状が表れるため、うつ病もしくはその治療によってセロトニン神経系の機能が変化すると考えられる[19]。うつ病患者ではセロトニンによる神経内分泌制御機能の低下や5-HT1A受容体のリガンド結合が低下しているが、これらの変化はうつ症状が無くなった後も持続するので、うつ状態と直接関係しているとは考え難い[19]。また、一般にセロトニン系の薬物の治療効果が発現するまでには数週間かかり、トリプトファンレベルを変化させても健常者では気分の変化は生じないため、単純にセロトニンレベルの増減で気分が変化するのではない[19]。健常者においてトリプトファンレベルを変化させると恐怖や幸福の表情の認識が変化する[20]。実験動物において薬物によってセロトニン神経機能を障害すると不安様行動が低下する[21]。セロトニン神経に対して抑制的に働く5-HT1A自己受容体を特異的に欠損させたマウスでは不安様行動が増加する[22]。セロトニン神経の障害やセロトニン含量の低下を生じさせた遺伝子改変マウスでは、ほとんどの例で不安様行動が低下するが、うつ様行動については一致した結果が得られていない[23]。セロトニントランスポーターを欠損させたマウスでは脳内のセロトニンレベルが上昇し、不安様行動が増加する。ヒトのセロトニントランスポーター遺伝子のプロモーター領域には繰り返し配列の長さが異なる多型が存在し、短い型(S型)は長い型よりセロトニントランスポーターの発現量が少ない。S型は不安の性格特性に関連し、ストレスを受けた際のうつ病発症のリスクが高い。さらに、S型を持つヒトの脳では情動に関与する扁桃体の反応性が高まっている[24]。
学習・記憶
セロトニン神経の障害やセロトニン含量の低下を生じさせた遺伝子改変マウスでは、多くの場合恐怖条件付けが亢進している[23]。5-HT1A受容体欠損マウスでは海馬依存性の空間学習課題などに障害が見られるが[25]、5-HT1Aアゴニストを海馬に投与しても空間学習の遂行が悪くなる[26]。一方で、縫線核に5-HT1Aアゴニストを投与すると作業記憶課題の遂行が良くなることなどから、5-HT1Aの自己受容体とそれ以外とでは認知機能に対して逆の作用を持ち、自己受容体の活性化によるセロトニン神経の活動低下が記憶課題の遂行を改善することが示唆されている[25]。5-HT4受容体のアゴニスト投与によって複数の記憶課題において改善が見られ、アンタゴニスト投与によって受動的回避学習の成績が低下するため、この受容体の活性化は概ね記憶課題を改善する方向に働く。逆に5-HT6受容体の場合はアンタゴニストの投与によって、空間学習課題などの遂行が改善する[25]。
セロトニン神経系に作用する薬物
向精神薬
SSRI、三環系抗うつ薬、セロトニン・ノルアドレナリン再取込阻害薬はいずれも抗うつ作用を持ち、セロトニントランスポーターを阻害する。三環系抗うつ薬はノルアドレナリン再取込阻害薬も持ち、セロトニントランスポーターに対する親和性が低いものもある。セロトニン、ノルアドレナリンの代謝酵素MAOAの阻害薬も抗うつ作用を持つ。このように、セロトニンの再取込や代謝酵素の阻害によって、シナプスや細胞外のセロトニン濃度を上昇させる、又はセロトニン含量を増やす薬物が抗うつ薬として用いられている。また、SSRIは抗不安薬としても広く用いられている[18]。情動調節におけるセロトニンの役割には不明な点が多く、セロトニン濃度上昇が抗うつ作用や抗不安作用に結びつくメカニズムも不明である。これらの薬物の治療効果の発現には一般に数週間を要するため、セロトニン濃度上昇そのものではなく、2次的な変化が治療効果を担うと考えられている。統合失調症や躁状態の治療に用いられる抗精神病薬は様々な伝達物質受容体に対する遮断作用を持ち、セロトニン受容体に対する遮断作用も強い。特に非定型抗精神病薬(新規抗精神病薬)に属するセロトニン・ドーパミンアンタゴニストは5-HT2A受容体に対する遮断作用が強いが、抗精神病作用との関連は明らかではない[27]。
コカイン、アンフェタミン、MDMA(3,4-methylenedioxymethamphetamine)などの精神刺激薬は細胞膜のモノアミントランスポーターを標的とする。一般にこれらの薬物には依存性があり、実験動物では自己投与の条件付けが成立する。コカインは再取込阻害薬であり、アンフェタミン類はトランスポーターの逆輸送によってモノアミンの放出を起こす。ドーパミントランスポーターに対する作用が行動に及ぼす影響において重要とされており、セロトニントランスポーターに対する作用の強さは自己投与における効力と負の相関を示す[28]。幻覚薬にはセロトニン受容体に対してアゴニスト作用を持つものがあり、メスカリンなどのフェニルアルキルアミン系薬とシロシビンやLSD(lysergic acid diethylamide)などのインドールアミン系薬がある。フェニルアルキルアミン系薬は比較的5-HT2ファミリーの受容体に対する親和性が高い。インドールアミン系薬は5-HT1A受容体に対する親和性が高く、セロトニン神経の活動を抑制する。いずれも複数のセロトニン受容体に作用するが、幻覚誘発作用は5-HT2A受容体に依存すると考えられている[29]。しかし、必ずしも全ての5-HT2A受容体アゴニストが幻覚誘発作用を持つのではなく、幻覚誘発作用を持つものと持たないものでは下流のシグナル経路が異なることが示唆されている[30]。
偏頭痛治療薬
偏頭痛の治療薬として用いられるトリプタン系の薬物は5-HT1B、5-HT1D受容体のアゴニストで、特に5-HT1Dに高い親和性を持つ。トリプタン系薬の中には5-HT1F受容体に対して比較的高い親和性を持つものもあり、5-HT1Fアゴニストが治療効果を持つことも示唆されている[31]。偏頭痛における痛みは頭蓋内外の血管に分布する三叉神経の活動が関与すると考えられている。5-HT1B受容体は血管平滑筋に存在し、活性化によって血管収縮を引き起こす。5-HT1D、5-HT1F受容体は三叉神経に発現しており、活性化によって過分極と炎症誘発性ペプチド類の放出抑制を引き起こして鎮痛効果を発揮すると考えられている[31] [32]。
制吐薬
嘔吐反射において重要な役割を果たす延髄最後野の化学受容器引金帯と消化管に分布する求心性迷走神経の末端に5-HT3受容体が多く発現している。5-HT3受容体のアンタゴニストは制吐薬として、特に癌化学療法に伴う嘔気、嘔吐の軽減に用いられる。延髄最後野では血液脳関門の透過性が比較的高く血中の化学物質が直接達し得るが、化学療法に伴う嘔吐の抑制は主に迷走神経末端の5-HT3受容体遮断によるものと考えられている[33]。
セロトニン症候群
セロトニン系に作用する薬物の過剰投与、相互作用によって、セロトニン神経系の活動性の亢進によって生じる。自律神経症状、精神症状、神経筋症状が生じるが、全ての患者でこれら全てが表れるのではない。診断基準となる症状として、焦燥、混乱、軽躁、発汗、下痢、発熱、震え、反射亢進、協調運動障害、ミオクローヌス、眼振、振戦がある。重篤な場合には強直間代発作、多臓器不全、播種性血管内凝固、横紋筋融解、昏睡、死に至る場合もある[34]。
- ↑ 1.0 1.1 1.2
Hensler, J.G. (2006).
Serotonergic modulation of the limbic system. Neuroscience and biobehavioral reviews, 30(2), 203-14. [PubMed:16157378] [WorldCat] [DOI] - ↑
Ciranna, L. (2006).
Serotonin as a modulator of glutamate- and GABA-mediated neurotransmission: implications in physiological functions and in pathology. Current neuropharmacology, 4(2), 101-14. [PubMed:18615128] [PMC] [WorldCat] - ↑
Naumenko, V.S., Kondaurova, E.M., & Popova, N.K. (2011).
On the role of brain 5-HT7 receptor in the mechanism of hypothermia: comparison with hypothermia mediated via 5-HT1A and 5-HT3 receptor. Neuropharmacology, 61(8), 1360-5. [PubMed:21884711] [WorldCat] [DOI] - ↑
Ray, R.S., Corcoran, A.E., Brust, R.D., Kim, J.C., Richerson, G.B., Nattie, E., & Dymecki, S.M. (2011).
Impaired respiratory and body temperature control upon acute serotonergic neuron inhibition. Science (New York, N.Y.), 333(6042), 637-42. [PubMed:21798952] [PMC] [WorldCat] [DOI] - ↑
Hodges, M.R., & Richerson, G.B. (2010).
The role of medullary serotonin (5-HT) neurons in respiratory control: contributions to eupneic ventilation, CO2 chemoreception, and thermoregulation. Journal of applied physiology (Bethesda, Md. : 1985), 108(5), 1425-32. [PubMed:20133432] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Magalhães, C.P., de Freitas, M.F., Nogueira, M.I., Campina, R.C., Takase, L.F., de Souza, S.L., & de Castro, R.M. (2010).
Modulatory role of serotonin on feeding behavior. Nutritional neuroscience, 13(6), 246-55. [PubMed:21040622] [WorldCat] [DOI] - ↑
Xu, Y., Jones, J.E., Kohno, D., Williams, K.W., Lee, C.E., Choi, M.J., ..., & Elmquist, J.K. (2008).
5-HT2CRs expressed by pro-opiomelanocortin neurons regulate energy homeostasis. Neuron, 60(4), 582-9. [PubMed:19038216] [PMC] [WorldCat] [DOI] - ↑
Monti, J.M. (2011).
Serotonin control of sleep-wake behavior. Sleep medicine reviews, 15(4), 269-81. [PubMed:21459634] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2
Bardin, L. (2011).
The complex role of serotonin and 5-HT receptors in chronic pain. Behavioural pharmacology, 22(5-6), 390-404. [PubMed:21808193] [WorldCat] [DOI] - ↑
Sommer, C. (2006).
Is serotonin hyperalgesic or analgesic? Current pain and headache reports, 10(2), 101-6. [PubMed:16539862] [WorldCat] - ↑ 11.0 11.1
Olivier, B., Chan, J.S., Snoeren, E.M., Olivier, J.D., Veening, J.G., Vinkers, C.H., ..., & Oosting, R.S. (2011).
Differences in sexual behaviour in male and female rodents: role of serotonin. Current topics in behavioral neurosciences, 8, 15-36. [PubMed:21374021] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2
Kiser, D., Steemers, B., Branchi, I., & Homberg, J.R. (2012).
The reciprocal interaction between serotonin and social behaviour. Neuroscience and biobehavioral reviews, 36(2), 786-98. [PubMed:22206901] [WorldCat] [DOI] - ↑
Uphouse, L. (2000).
Female gonadal hormones, serotonin, and sexual receptivity. Brain research. Brain research reviews, 33(2-3), 242-57. [PubMed:11011068] - ↑ 14.0 14.1 14.2
Olivier, B. (2004).
Serotonin and aggression. Annals of the New York Academy of Sciences, 1036, 382-92. [PubMed:15817750] [WorldCat] [DOI] - ↑ 15.0 15.1
Takahashi, A., Quadros, I.M., de Almeida, R.M., & Miczek, K.A. (2011).
Brain serotonin receptors and transporters: initiation vs. termination of escalated aggression. Psychopharmacology, 213(2-3), 183-212. [PubMed:20938650] [PMC] [WorldCat] [DOI] - ↑
Carrillo, M., Ricci, L.A., Coppersmith, G.A., & Melloni, R.H. (2009).
The effect of increased serotonergic neurotransmission on aggression: a critical meta-analytical review of preclinical studies. Psychopharmacology, 205(3), 349-68. [PubMed:19404614] [WorldCat] [DOI] - ↑
Buckholtz, J.W., & Meyer-Lindenberg, A. (2008).
MAOA and the neurogenetic architecture of human aggression. Trends in neurosciences, 31(3), 120-9. [PubMed:18258310] [WorldCat] [DOI] - ↑ 18.0 18.1
Vaswani, M., Linda, F.K., & Ramesh, S. (2003).
Role of selective serotonin reuptake inhibitors in psychiatric disorders: a comprehensive review. Progress in neuro-psychopharmacology & biological psychiatry, 27(1), 85-102. [PubMed:12551730] [WorldCat] [DOI] - ↑ 19.0 19.1 19.2
Cowen, P.J. (2008).
Serotonin and depression: pathophysiological mechanism or marketing myth? Trends in pharmacological sciences, 29(9), 433-6. [PubMed:18585794] [WorldCat] [DOI] - ↑
Merens, W., Willem Van der Does, A.J., & Spinhoven, P. (2007).
The effects of serotonin manipulations on emotional information processing and mood. Journal of affective disorders, 103(1-3), 43-62. [PubMed:17363069] [WorldCat] [DOI] - ↑
Kahn, R.S., van Praag, H.M., Wetzler, S., Asnis, G.M., & Barr, G. (1988).
Serotonin and anxiety revisited. Biological psychiatry, 23(2), 189-208. [PubMed:3275471] [WorldCat] [DOI] - ↑
Richardson-Jones, J.W., Craige, C.P., Nguyen, T.H., Kung, H.F., Gardier, A.M., Dranovsky, A., ..., & Leonardo, E.D. (2011).
Serotonin-1A autoreceptors are necessary and sufficient for the normal formation of circuits underlying innate anxiety. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(16), 6008-18. [PubMed:21508226] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Fernandez, S.P., & Gaspar, P. (2012).
Investigating anxiety and depressive-like phenotypes in genetic mouse models of serotonin depletion. Neuropharmacology, 62(1), 144-54. [PubMed:21945798] [WorldCat] [DOI] - ↑
Hariri, A.R., & Holmes, A. (2006).
Genetics of emotional regulation: the role of the serotonin transporter in neural function. Trends in cognitive sciences, 10(4), 182-91. [PubMed:16530463] [WorldCat] [DOI] - ↑ 25.0 25.1 25.2
King, M.V., Marsden, C.A., & Fone, K.C. (2008).
A role for the 5-HT(1A), 5-HT4 and 5-HT6 receptors in learning and memory. Trends in pharmacological sciences, 29(9), 482-92. [PubMed:19086256] [WorldCat] [DOI] - ↑
Buhot, M.C. (1997).
Serotonin receptors in cognitive behaviors. Current opinion in neurobiology, 7(2), 243-54. [PubMed:9142756] [WorldCat] [DOI] - ↑
Richtand, N.M., Welge, J.A., Logue, A.D., Keck, P.E., Strakowski, S.M., & McNamara, R.K. (2008).
Role of serotonin and dopamine receptor binding in antipsychotic efficacy. Progress in brain research, 172, 155-75. [PubMed:18772032] [WorldCat] [DOI] - ↑
Howell, L.L., & Kimmel, H.L. (2008).
Monoamine transporters and psychostimulant addiction. Biochemical pharmacology, 75(1), 196-217. [PubMed:17825265] [WorldCat] [DOI] - ↑
Halberstadt, A.L., & Geyer, M.A. (2011).
Multiple receptors contribute to the behavioral effects of indoleamine hallucinogens. Neuropharmacology, 61(3), 364-81. [PubMed:21256140] [PMC] [WorldCat] [DOI] - ↑
Mayevsky, A., & Bar-Sagie, D. (1977).
The interrelation between CBF, energy metabolism and ECoG in a new awake brain model. Advances in experimental medicine and biology, 94, 761-7. [PubMed:207171] [WorldCat] [DOI] - ↑ 31.0 31.1
Neeb, L., Meents, J., & Reuter, U. (2010).
5-HT(1F) Receptor agonists: a new treatment option for migraine attacks? Neurotherapeutics : the journal of the American Society for Experimental NeuroTherapeutics, 7(2), 176-82. [PubMed:20430316] [PMC] [WorldCat] [DOI] - ↑
Olesen, J., & Ashina, M. (2011).
Emerging migraine treatments and drug targets. Trends in pharmacological sciences, 32(6), 352-9. [PubMed:21459461] [WorldCat] [DOI] - ↑
Hesketh, P.J. (2008).
Chemotherapy-induced nausea and vomiting. The New England journal of medicine, 358(23), 2482-94. [PubMed:18525044] [WorldCat] [DOI] - ↑
Ables, A.Z., & Nagubilli, R. (2010).
Prevention, recognition, and management of serotonin syndrome. American family physician, 81(9), 1139-42. [PubMed:20433130] [WorldCat]
(執筆者:小林克典、担当編集委員:林康紀)