「ウイルスベクター」の版間の差分
細編集の要約なし |
Junko kurahashi (トーク | 投稿記録) 細編集の要約なし |
||
| (2人の利用者による、間の22版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[https://researchmap.jp/hirokazuhirai 平井宏和]</font><br> | <font size="+1">[https://researchmap.jp/hirokazuhirai 平井宏和]</font><br> | ||
''群馬大学 医学系研究科''<br> | ''群馬大学 医学系研究科''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2018年3月27日 原稿完成日:<br> | ||
担当編集委員:[https://researchmap.jp/ | 担当編集委員:[https://researchmap.jp/okanolab 岡野栄之](慶應義塾大学 医学部)<br> | ||
</div> | </div> | ||
英語名:viral | 英語名:viral vector | ||
{{box|text= | {{box|text= 細胞に吸着したウイルスは、自らのゲノムを細胞内に送り込み、細胞がもつ転写翻訳機構を利用してゲノムを複製し増殖する。遺伝子操作により、複製および増殖能を欠損させたウイルスに外来遺伝子を組み込み、効率的に目的の遺伝子を細胞へ導入し発現させる能力のみを利用したものをウイルスベクターという。細胞への遺伝子導入効率は、エレクトロポレーションやリン酸カルシウム法などの物理化学的な導入法よりはるかに優れており、遺伝子導入が困難な生体ニューロンへの遺伝子発現実験や遺伝子治療に広く使用されている。}} | ||
== | == ウイルスベクター作製の概要 == | ||
複製等に関与する非構造タンパク質をコードしている領域および、[[カプシド]]などの構造タンパク質をコードしている領域を欠損し、代わりに目的の遺伝子を挿入したウイルス[[プラスミド]]と、非構造タンパク質と構造タンパク質を供給するプラスミド(さらにウイルスによっては別に必要となる遺伝子を供給するプラスミド)を、[[HEK293細胞]]や[[NIH3T3細胞]]などの[[培養細胞]]に同時に導入し、細胞内でウイルス粒子を産生させる。産生されたウイルスはウイルスプラスミドに組み込んだ目的遺伝子をもつが、非構造タンパク質および構造タンパク質をコードする遺伝子を欠損するため、細胞に吸着・侵入して目的の遺伝子を発現するが、複製・増殖能はない。 | |||
複製等に関与する非構造タンパク質をコードしている領域および、[[カプシド]]などの構造タンパク質をコードしている領域を欠損し、代わりに目的の遺伝子を挿入したウイルス[[プラスミド]]と、非構造タンパク質と構造タンパク質を供給するプラスミド(さらにウイルスによっては別に必要となる遺伝子を供給するプラスミド)を、[[HEK293細胞]]や[[NIH3T3細胞]]などの[[培養細胞]] | |||
== 種類 == | == 種類 == | ||
| 19行目: | 16行目: | ||
{| class="wikitable" | {| class="wikitable" | ||
|+ | |+ 表1.ベクターとして利用される代表的なウイルス | ||
! 種類 !! アデノウイルス !! シンドビスウイルス、セムリキ森林ウイルス | ! 種類 !! アデノウイルス !! シンドビスウイルス、セムリキ森林ウイルス !! レトロウイルス !! レンチウイルス !! 狂犬病ウイルス !! センダイウイルス !! アデノ随伴ウイルス | ||
|- | |- | ||
| 分類 || アデノウイルス科、マストアデノウイルス属 || トガウイルス科、アフファウイルス属 || | | 分類 || アデノウイルス科、マストアデノウイルス属 || トガウイルス科、アフファウイルス属 || レトロウイルス科、オンコウイルス亜科 || レトロウイルス科、レンチウイルス亜科 || ラブドウイルス科、リッサウイルス属 || パラミクソウイルス科、レスピロウイルス属(マウスパラインフルエンザ1型ウイルス) || パルボウイルス科、ディペンドウイルス属 | ||
|- | |- | ||
| 疾患 || カゼ症候群 || 関節炎、発疹、発熱 | | 疾患 || カゼ症候群 || 関節炎、発疹、発熱 || マウス白血病 || AIDS || 狂犬病 || マウス肺炎 || 病原性なし | ||
|- | |- | ||
| 核酸 || 2本鎖DNA || 1本鎖RNA +鎖 | | 核酸 || 2本鎖DNA || 1本鎖RNA +鎖 || 1本鎖RNA +鎖 || 1本鎖RNA +鎖 || 1本鎖RNA -鎖 || 1本鎖RNA -鎖 || 1本鎖DNA | ||
|- | |- | ||
| 形態 | | 形態 || 正20面体カプシド || 正20面体カプシド || 正20面体 || 正20面体 || 円筒形 || 多形らせんヌクレオカプシド || 正20面体カプシド | ||
|- | |- | ||
| 大きさ(nm) || 70-90 || 約70 | | 大きさ(nm) || 70-90 || 約70 || 80-100 || 80-100 || 180(長)、75(径) || 150-250 || 18-26 | ||
|- | |- | ||
| | | エンベロープ || なし || あり || あり || あり || あり || あり || なし | ||
|} | |} | ||
{| class="wikitable" | {| class="wikitable" | ||
|+ | |+ 表2.遺伝子導入に使用されるウイルスベクターの性質 | ||
! 由来 !! | ! 由来 !! 細胞障害性 !! 発現期間 !! 神経細胞への感染 !! 物理的封じ込め !! 搭載可能 | ||
|- | |- | ||
| | | アデノウイルス || 有 || ~2ヶ月 || グリア細胞好性 || P2 || 8~30 kb | ||
|- | |- | ||
| | | シンドビスウイルス || 有(強い) || ~2日 || ニューロン好性 || P2 || | ||
|- | |- | ||
| | | センダイウイルス || ほぼ無し || ~2ヶ月 || 好性なし || P2 || 4.5 kb | ||
|- | |- | ||
| | | レトロウイルス || ほぼ無し || 数年以上 || 分裂細胞のみ、ニューロン発現なし || P2 || 8 kb | ||
|- | |- | ||
| | | レンチウイルス || ほぼ無し || 数年以上 || ニューロン/グリア || P2 || 8 kb | ||
|- | |||
| アデノ随伴ウイルス || ほぼ無し || 数年以上 || ニューロン/グリア || P1(普通の実験室) || 4.7 kb | |||
|} | |} | ||
=== アデノウイルスベクター === | === アデノウイルスベクター === | ||
小児に感冒を引き起こす[[ヒト]][[アデノウイルス]] 5型が主に利用されている。ウイルス[[ゲノム]]([[DNA]])は核移行するがホストゲノムに組み込まれずに[[転写]]・[[翻訳]]される。アデノウイルスの増殖にはE1AとE1B領域が必須であるが、これらを発現させたい外来遺伝子と置換し、さらに増殖には不必要なE3領域も欠損させている<ref>'''斎藤 泉'''<br>次世代アデノウイルスベクターの開発状況と展望<br>ウイルス: 47:231-8: | 小児に感冒を引き起こす[[ヒト]][[アデノウイルス]] 5型が主に利用されている。ウイルス[[ゲノム]]([[DNA]])は核移行するがホストゲノムに組み込まれずに[[転写]]・[[翻訳]]される。アデノウイルスの増殖にはE1AとE1B領域が必須であるが、これらを発現させたい外来遺伝子と置換し、さらに増殖には不必要なE3領域も欠損させている<ref>'''斎藤 泉'''<br>次世代アデノウイルスベクターの開発状況と展望<br>ウイルス: 47:231-8:1997 doi 10.2222/jsv.47.231</ref>。パッケージングされる部分を残して全て外来遺伝子に置換したウイルスプラスミドを、E1AとE1Bを持続発現しているHEK293細胞に導入することでウイルス粒子が産生され、細胞外に放出される。産生されたウイルス粒子はE1A遺伝子機能をもたないので複製できず非増殖型である。 | ||
アデノウイルスベクターは[[ニューロン]]や静止期の[[アストロサイト]]を含むさまざまな細胞に感染し、きわめて効率的に外来遺伝子を発現する。細胞障害性や[[免疫原性]]をもつことが欠点であるが、逆にこの点を利用して脳腫瘍に対する遺伝子治療ベクターとして利用されている。遺伝子発現は一過性で感染から2ヶ月以内に消失する。 | アデノウイルスベクターは[[ニューロン]]や静止期の[[アストロサイト]]を含むさまざまな細胞に感染し、きわめて効率的に外来遺伝子を発現する。細胞障害性や[[免疫原性]]をもつことが欠点であるが、逆にこの点を利用して脳腫瘍に対する遺伝子治療ベクターとして利用されている。遺伝子発現は一過性で感染から2ヶ月以内に消失する。 | ||
| 73行目: | 67行目: | ||
感染によりウイルスゲノム(一本鎖RNA)が細胞内に入り、同時に送り込まれた逆転写酵素により二本鎖DNAへと変えられる('''図1'''参照)。二本鎖DNAは核に送られて[[染色体]]に組み込まれ、細胞の転写発現機構を使って外来遺伝子を発現する。ただし、核膜があると核内に入ることができないため、核膜が消失する分裂期の細胞でしか組み込みは行われない。すなわちレトロウイルスベクターは最終分裂を終えたニューロンへの遺伝子発現には使えないが、この性質を利用し、成熟動物の[[神経幹細胞]]選択的に遺伝子発現させる目的で使用されることがある。 | 感染によりウイルスゲノム(一本鎖RNA)が細胞内に入り、同時に送り込まれた逆転写酵素により二本鎖DNAへと変えられる('''図1'''参照)。二本鎖DNAは核に送られて[[染色体]]に組み込まれ、細胞の転写発現機構を使って外来遺伝子を発現する。ただし、核膜があると核内に入ることができないため、核膜が消失する分裂期の細胞でしか組み込みは行われない。すなわちレトロウイルスベクターは最終分裂を終えたニューロンへの遺伝子発現には使えないが、この性質を利用し、成熟動物の[[神経幹細胞]]選択的に遺伝子発現させる目的で使用されることがある。 | ||
=== レンチウイルスベクター === | === レンチウイルスベクター === | ||
レトロウイルス科に属するヒトあるいは[[サル]][[免疫不全]]ウイルス由来のベクターで、レトロウイルスと類似の方法で作成される。野生型のレンチウイルスは[[wj:CD4|CD4]]陽性リンパ球にしか感染能がないが、エンベロープの[[糖タンパク質]]を[[wj:水疱性口内炎ウイルス|水疱性口内炎ウイルス]](VSV)由来のものに変えることで、ニューロンを含むさまざまな細胞種に感染することが可能となる。レンチウイルスベクターは非分裂細胞でも核膜孔を通過して染色体に逆転写した二本鎖DNAを組み込むことができるため、非分裂細胞であるニューロンや静止期のアストロサイトにも外来遺伝子を発現させることができる。 | レトロウイルス科に属するヒトあるいは[[サル]][[免疫不全]]ウイルス由来のベクターで、レトロウイルスと類似の方法で作成される。野生型のレンチウイルスは[[wj:CD4|CD4]]陽性リンパ球にしか感染能がないが、エンベロープの[[糖タンパク質]]を[[wj:水疱性口内炎ウイルス|水疱性口内炎ウイルス]](VSV)由来のものに変えることで、ニューロンを含むさまざまな細胞種に感染することが可能となる。レンチウイルスベクターは非分裂細胞でも核膜孔を通過して染色体に逆転写した二本鎖DNAを組み込むことができるため、非分裂細胞であるニューロンや静止期のアストロサイトにも外来遺伝子を発現させることができる。 | ||
=== 狂犬病ウイルスベクター === | === 狂犬病ウイルスベクター === | ||
| 90行目: | 80行目: | ||
センダイウイルスベクターはニューロンを含む非分裂細胞にも外来遺伝子発現が可能で、発現能も高い。感染後、ウイルスゲノムはホストの染色体に組み込まれずRNAの状態で細胞質に留まるため、挿入変異や染色体の構造変化の恐れがなく、機能性、安全性の両面で優れたベクターである。生体にベクター投与後2〜4日目に外来遺伝子の発現量が最大となり、数週間発現が持続する。 | センダイウイルスベクターはニューロンを含む非分裂細胞にも外来遺伝子発現が可能で、発現能も高い。感染後、ウイルスゲノムはホストの染色体に組み込まれずRNAの状態で細胞質に留まるため、挿入変異や染色体の構造変化の恐れがなく、機能性、安全性の両面で優れたベクターである。生体にベクター投与後2〜4日目に外来遺伝子の発現量が最大となり、数週間発現が持続する。 | ||
=== アデノ随伴ウイルスベクター === | === アデノ随伴ウイルスベクター === | ||
アデノ随伴ウイルスは、ラテン語で「小さい」を意味する“parvus”を語源とするパルボウイルス科のウイルスで、粒子径は18 – 26nmとDNAウイルスの中ではもっとも小さい。単独感染では増殖能はなく、アデノウイルスと同時に感染して初めて増殖が可能となる。病原性はないと考えられている。ウイルスゲノムは4.7kbの線状一本鎖DNAで、両端に逆位反復配列(Inverted Terminal Repeat : ITR) | アデノ随伴ウイルスは、ラテン語で「小さい」を意味する“parvus”を語源とするパルボウイルス科のウイルスで、粒子径は18 – 26nmとDNAウイルスの中ではもっとも小さい。単独感染では増殖能はなく、アデノウイルスと同時に感染して初めて増殖が可能となる。病原性はないと考えられている。ウイルスゲノムは4.7kbの線状一本鎖DNAで、両端に逆位反復配列(Inverted Terminal Repeat : ITR)と呼ばれるT字型のヘアピン構造が存在し、ゲノム複製はこの部分の折り返しにより、他のプライマー非依存的に開始する。ゲノムにはRepとCapという2つの遺伝子が存在する。Repはウイルスゲノムの複製や転写を担う非構造タンパク質を、Capは3種類の構造タンパク質(カプシドタンパク質)をコードしている。 | ||
アデノ随伴ウイルスには多くの血清型が知られており、主に細胞表面受容体の違いにより特定の組織や細胞種への指向性を示す。最もよく研究されている2型の受容体[[はへパラン硫酸プロテオグリカン]]であり<ref><pubmed>944504</pubmed></ref>、[[線維芽細胞増殖因子受容体1]]([[FGFR1]])<ref><pubmed>944504</pubmed></ref>や[[αVβ5インテグリン]]<ref><pubmed>9883843 </pubmed></ref>も共受容体として働き、ウイルスの結合と取り込みを促進することが示唆されている。アデノ随伴ウイルス4型と5型はシアル酸に結合すること<ref><pubmed>11435568</pubmed></ref>、またPDGF受容体が5型の受容体であることが報告されている<ref><pubmed>14502277 </pubmed></ref>。適切な血清型由来のベクターを用いることで、任意の臓器の特定細胞種を標的とした効率的な遺伝子発現が期待できる。 | |||
==== アデノ随伴ウイルスベクター粒子の作製法 ==== | ==== アデノ随伴ウイルスベクター粒子の作製法 ==== | ||
| 104行目: | 90行目: | ||
ITR間の[[Rep]]、[[Cap]]の2つの遺伝子を取り除き、そのスペースにプロモーターと目的の遺伝子を挿入したベクタープラスミドを作製する('''図2''')。Rep、Cap(ウイルス複製やカプシド形成に必要なタンパク質)は別のプラスミドで供給する。またアデノウイルスのヘルパー作用としてE1A、E1B、E2A、VA、E4遺伝子が必要となるが、このうちE1AとE1BはHEK293細胞(E1AとE1Bでトランスフォームしている)から、残りのE2A、E4、VAはヘルパープラスミドとして供給する。これら3つのプラスミドでHEK293細胞をトランスフェクションすると、Rep、Cap遺伝子はもたずITR間の外来遺伝子のみをもつウイルス粒子が産生される。粒子は核内に存在するため細胞を凍結融解し、[[wj:塩化セシウム|塩化セシウム]]を用いた密度勾配超遠心法を用いて精製する。 | ITR間の[[Rep]]、[[Cap]]の2つの遺伝子を取り除き、そのスペースにプロモーターと目的の遺伝子を挿入したベクタープラスミドを作製する('''図2''')。Rep、Cap(ウイルス複製やカプシド形成に必要なタンパク質)は別のプラスミドで供給する。またアデノウイルスのヘルパー作用としてE1A、E1B、E2A、VA、E4遺伝子が必要となるが、このうちE1AとE1BはHEK293細胞(E1AとE1Bでトランスフォームしている)から、残りのE2A、E4、VAはヘルパープラスミドとして供給する。これら3つのプラスミドでHEK293細胞をトランスフェクションすると、Rep、Cap遺伝子はもたずITR間の外来遺伝子のみをもつウイルス粒子が産生される。粒子は核内に存在するため細胞を凍結融解し、[[wj:塩化セシウム|塩化セシウム]]を用いた密度勾配超遠心法を用いて精製する。 | ||
==参考文献== | ==参考文献== | ||
<references/> | <references/> | ||
2018年4月18日 (水) 21:49時点における版
英語名:viral vector
細胞に吸着したウイルスは、自らのゲノムを細胞内に送り込み、細胞がもつ転写翻訳機構を利用してゲノムを複製し増殖する。遺伝子操作により、複製および増殖能を欠損させたウイルスに外来遺伝子を組み込み、効率的に目的の遺伝子を細胞へ導入し発現させる能力のみを利用したものをウイルスベクターという。細胞への遺伝子導入効率は、エレクトロポレーションやリン酸カルシウム法などの物理化学的な導入法よりはるかに優れており、遺伝子導入が困難な生体ニューロンへの遺伝子発現実験や遺伝子治療に広く使用されている。
ウイルスベクター作製の概要
複製等に関与する非構造タンパク質をコードしている領域および、カプシドなどの構造タンパク質をコードしている領域を欠損し、代わりに目的の遺伝子を挿入したウイルスプラスミドと、非構造タンパク質と構造タンパク質を供給するプラスミド(さらにウイルスによっては別に必要となる遺伝子を供給するプラスミド)を、HEK293細胞やNIH3T3細胞などの培養細胞に同時に導入し、細胞内でウイルス粒子を産生させる。産生されたウイルスはウイルスプラスミドに組み込んだ目的遺伝子をもつが、非構造タンパク質および構造タンパク質をコードする遺伝子を欠損するため、細胞に吸着・侵入して目的の遺伝子を発現するが、複製・増殖能はない。
種類
表1に示すようにさまざまなウイルスがベクターとして用いられており、多くは由来となったウイルスの性質をある程度保持している。それぞれのウイルスベクターの性質について表2にまとめた。
| 種類 | アデノウイルス | シンドビスウイルス、セムリキ森林ウイルス | レトロウイルス | レンチウイルス | 狂犬病ウイルス | センダイウイルス | アデノ随伴ウイルス |
|---|---|---|---|---|---|---|---|
| 分類 | アデノウイルス科、マストアデノウイルス属 | トガウイルス科、アフファウイルス属 | レトロウイルス科、オンコウイルス亜科 | レトロウイルス科、レンチウイルス亜科 | ラブドウイルス科、リッサウイルス属 | パラミクソウイルス科、レスピロウイルス属(マウスパラインフルエンザ1型ウイルス) | パルボウイルス科、ディペンドウイルス属 |
| 疾患 | カゼ症候群 | 関節炎、発疹、発熱 | マウス白血病 | AIDS | 狂犬病 | マウス肺炎 | 病原性なし |
| 核酸 | 2本鎖DNA | 1本鎖RNA +鎖 | 1本鎖RNA +鎖 | 1本鎖RNA +鎖 | 1本鎖RNA -鎖 | 1本鎖RNA -鎖 | 1本鎖DNA |
| 形態 | 正20面体カプシド | 正20面体カプシド | 正20面体 | 正20面体 | 円筒形 | 多形らせんヌクレオカプシド | 正20面体カプシド |
| 大きさ(nm) | 70-90 | 約70 | 80-100 | 80-100 | 180(長)、75(径) | 150-250 | 18-26 |
| エンベロープ | なし | あり | あり | あり | あり | あり | なし |
| 由来 | 細胞障害性 | 発現期間 | 神経細胞への感染 | 物理的封じ込め | 搭載可能 |
|---|---|---|---|---|---|
| アデノウイルス | 有 | ~2ヶ月 | グリア細胞好性 | P2 | 8~30 kb |
| シンドビスウイルス | 有(強い) | ~2日 | ニューロン好性 | P2 | |
| センダイウイルス | ほぼ無し | ~2ヶ月 | 好性なし | P2 | 4.5 kb |
| レトロウイルス | ほぼ無し | 数年以上 | 分裂細胞のみ、ニューロン発現なし | P2 | 8 kb |
| レンチウイルス | ほぼ無し | 数年以上 | ニューロン/グリア | P2 | 8 kb |
| アデノ随伴ウイルス | ほぼ無し | 数年以上 | ニューロン/グリア | P1(普通の実験室) | 4.7 kb |
アデノウイルスベクター
小児に感冒を引き起こすヒトアデノウイルス 5型が主に利用されている。ウイルスゲノム(DNA)は核移行するがホストゲノムに組み込まれずに転写・翻訳される。アデノウイルスの増殖にはE1AとE1B領域が必須であるが、これらを発現させたい外来遺伝子と置換し、さらに増殖には不必要なE3領域も欠損させている[1]。パッケージングされる部分を残して全て外来遺伝子に置換したウイルスプラスミドを、E1AとE1Bを持続発現しているHEK293細胞に導入することでウイルス粒子が産生され、細胞外に放出される。産生されたウイルス粒子はE1A遺伝子機能をもたないので複製できず非増殖型である。
アデノウイルスベクターはニューロンや静止期のアストロサイトを含むさまざまな細胞に感染し、きわめて効率的に外来遺伝子を発現する。細胞障害性や免疫原性をもつことが欠点であるが、逆にこの点を利用して脳腫瘍に対する遺伝子治療ベクターとして利用されている。遺伝子発現は一過性で感染から2ヶ月以内に消失する。
アデノウイルスベクターの発現可能遺伝子サイズはおよそ8 kbであるが、ウイルスゲノムのほぼ全長を外来遺伝子と置換できるヘルパー依存性アデノウイルスベクター(gutlessとも呼ばれる)が開発されており、最長37 kbの外来遺伝子の挿入が可能である[2]。ヘルパー依存性アデノウイルスベクターはウイルス由来のタンパク質がほとんど産生されないため、免疫原性が低い利点がある。
シンドビスウイルス/セムリキ森林ウイルスベクター
シンドビスウイルス、セムリキ森林ウイルスはアルファウイルス属に分類されるエンベロープをもつRNAウイルスで、DNAの中間体を経ることなく細胞質で増殖する[3]。脊椎動物および無脊椎動物のさまざまな細胞に感染し、増殖性が非常に高い[4]。シンドビスウイルスのレセプターは多くの生物種で広く保存されているラミニン受容体[5]やNatural resistance-associated macrophage protein (NRAMP)[6] が報告されている。受容体に結合したウイルスは、クラスリン依存性エンドサイトーシスにより細胞内に侵入する[7]。セムリキ森林ウイルスは中枢神経系ではニューロンとオリゴデンドロサイトに感染する。
シンドビスウイルス、セムリキ森林ウイルスとも細胞毒性が問題となる。ウイルスの増殖により幼若ニューロンではアポトーシスが、成熟ニューロンではネクローシスが誘導される[8]。ウイルス感染による細胞毒性を低減させる目的で非構造遺伝子領域に変異を導入したベクターが開発されている。ベクターは内在性プロモーターを含むすべての非構造遺伝子を保持し、構造タンパク質の遺伝子領域が外来遺伝子に置換される。ウイルス粒子は、インビトロで転写された(自己増殖能をもつ)レプリコンRNAとヘルパーRNAを培養細胞にトランスフェクションすることで得られる[9][10]。
レトロウイルスベクター
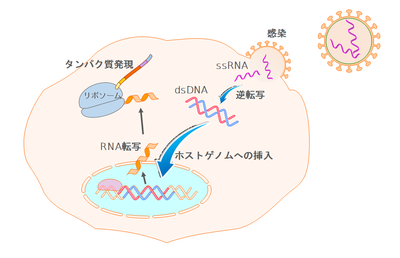
マウス白血病ウイルス由来で、ウイルスゲノムからウイルスタンパク質をコードするgag、pol、envが除去され、その代わりに発現させたい外来遺伝子が組み込まれる。ウイルス産生に用いられるウイルスプラスミドは、二つのLTRで挟まれた外来遺伝子とパッケージング配列のみをもつ。このウイルスプラスミドを、gag、pol、envがコードするウイルスタンパク質を発現するパッケージング細胞に導入することでウイルス粒子が産生される。産生されたウイルスはgag、pol、env遺伝子をもたないため、細胞に感染し外来遺伝子を発現するが、ウイルス粒子は産生しない。
感染によりウイルスゲノム(一本鎖RNA)が細胞内に入り、同時に送り込まれた逆転写酵素により二本鎖DNAへと変えられる(図1参照)。二本鎖DNAは核に送られて染色体に組み込まれ、細胞の転写発現機構を使って外来遺伝子を発現する。ただし、核膜があると核内に入ることができないため、核膜が消失する分裂期の細胞でしか組み込みは行われない。すなわちレトロウイルスベクターは最終分裂を終えたニューロンへの遺伝子発現には使えないが、この性質を利用し、成熟動物の神経幹細胞選択的に遺伝子発現させる目的で使用されることがある。
レンチウイルスベクター
レトロウイルス科に属するヒトあるいはサル免疫不全ウイルス由来のベクターで、レトロウイルスと類似の方法で作成される。野生型のレンチウイルスはCD4陽性リンパ球にしか感染能がないが、エンベロープの糖タンパク質を水疱性口内炎ウイルス(VSV)由来のものに変えることで、ニューロンを含むさまざまな細胞種に感染することが可能となる。レンチウイルスベクターは非分裂細胞でも核膜孔を通過して染色体に逆転写した二本鎖DNAを組み込むことができるため、非分裂細胞であるニューロンや静止期のアストロサイトにも外来遺伝子を発現させることができる。
狂犬病ウイルスベクター
狂犬病ウイルスは弾丸のような形をした神経向性ウイルスで、感染獣による咬傷から侵入する。感染局所の筋肉や結合組織中で増殖したのち、運動ニューロンから脊髄、脳へとシナプスを越えて逆行性に軸索を上行する。ウイルスのエンベロープに存在する糖タンパク質スパイク(Gタンパク質)が結合するニューロン特異的なレセプターとしてp75NTR (p75 neurotropin receptor)、NCAM (neuron adhesion molecule)やニコチン性アセチルコリン受容体が考えられている[11]。狂犬病ウイルスはニューロンを逆行性、かつ経シナプス性に伝達するため、経ニューロン性トレーサーとして利用される技術が開発されている[12]。
センダイウイルスベクター
センダイウイルスはHemagglutinating Virus of Japan (HVJ)、マウスパラインフルエンザ1型とも呼ばれるマイナス鎖RNAウイルスで、1950年代前半に日本で初めて分離された。マウスに肺炎を引き起こすウイルスでヒトへの病原性は報告されていない。
最初に作出されたベクターは、増殖に必須な膜融合タンパク質(F)遺伝子が欠失しており自立増殖できない。ヌクレオカプシドタンパク質(N)遺伝子の上流に外来遺伝子(合計で約5kbまでの遺伝子が複数挿入可能)を挿入したプラスミドと、マイナス鎖RNAの合成と複製に必要な遺伝子群を培養細胞に導入することでFタンパク質欠失型ウイルス粒子が産生される[13]。こうして得られたFタンパク質欠失型ウイルス粒子を、Fタンパク質を発現するヘルパー細胞株に感染させることで、ベクターがさらに増幅される。
センダイウイルスベクターはニューロンを含む非分裂細胞にも外来遺伝子発現が可能で、発現能も高い。感染後、ウイルスゲノムはホストの染色体に組み込まれずRNAの状態で細胞質に留まるため、挿入変異や染色体の構造変化の恐れがなく、機能性、安全性の両面で優れたベクターである。生体にベクター投与後2〜4日目に外来遺伝子の発現量が最大となり、数週間発現が持続する。
アデノ随伴ウイルスベクター
アデノ随伴ウイルスは、ラテン語で「小さい」を意味する“parvus”を語源とするパルボウイルス科のウイルスで、粒子径は18 – 26nmとDNAウイルスの中ではもっとも小さい。単独感染では増殖能はなく、アデノウイルスと同時に感染して初めて増殖が可能となる。病原性はないと考えられている。ウイルスゲノムは4.7kbの線状一本鎖DNAで、両端に逆位反復配列(Inverted Terminal Repeat : ITR)と呼ばれるT字型のヘアピン構造が存在し、ゲノム複製はこの部分の折り返しにより、他のプライマー非依存的に開始する。ゲノムにはRepとCapという2つの遺伝子が存在する。Repはウイルスゲノムの複製や転写を担う非構造タンパク質を、Capは3種類の構造タンパク質(カプシドタンパク質)をコードしている。
アデノ随伴ウイルスには多くの血清型が知られており、主に細胞表面受容体の違いにより特定の組織や細胞種への指向性を示す。最もよく研究されている2型の受容体はへパラン硫酸プロテオグリカンであり[14]、線維芽細胞増殖因子受容体1(FGFR1)[15]やαVβ5インテグリン[16]も共受容体として働き、ウイルスの結合と取り込みを促進することが示唆されている。アデノ随伴ウイルス4型と5型はシアル酸に結合すること[17]、またPDGF受容体が5型の受容体であることが報告されている[18]。適切な血清型由来のベクターを用いることで、任意の臓器の特定細胞種を標的とした効率的な遺伝子発現が期待できる。
アデノ随伴ウイルスベクター粒子の作製法
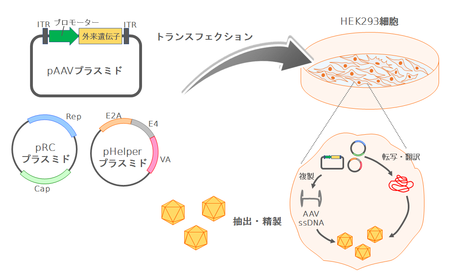
ITR間のRep、Capの2つの遺伝子を取り除き、そのスペースにプロモーターと目的の遺伝子を挿入したベクタープラスミドを作製する(図2)。Rep、Cap(ウイルス複製やカプシド形成に必要なタンパク質)は別のプラスミドで供給する。またアデノウイルスのヘルパー作用としてE1A、E1B、E2A、VA、E4遺伝子が必要となるが、このうちE1AとE1BはHEK293細胞(E1AとE1Bでトランスフォームしている)から、残りのE2A、E4、VAはヘルパープラスミドとして供給する。これら3つのプラスミドでHEK293細胞をトランスフェクションすると、Rep、Cap遺伝子はもたずITR間の外来遺伝子のみをもつウイルス粒子が産生される。粒子は核内に存在するため細胞を凍結融解し、塩化セシウムを用いた密度勾配超遠心法を用いて精製する。
参考文献
- ↑ 斎藤 泉
次世代アデノウイルスベクターの開発状況と展望
ウイルス: 47:231-8:1997 doi 10.2222/jsv.47.231 - ↑
Rosewell, A., Vetrini, F., & Ng, P. (2011).
Helper-Dependent Adenoviral Vectors. Journal of genetic syndromes & gene therapy, Suppl 5. [PubMed:24533227] [PMC] [WorldCat] - ↑
Rhême, C., Ehrengruber, M.U., & Grandgirard, D. (2005).
Alphaviral cytotoxicity and its implication in vector development. Experimental physiology, 90(1), 45-52. [PubMed:15542620] [WorldCat] [DOI] - ↑
Strauss, J.H., & Strauss, E.G. (1994).
The alphaviruses: gene expression, replication, and evolution. Microbiological reviews, 58(3), 491-562. [PubMed:7968923] [PMC] [WorldCat] - ↑
Wang, K.S., Kuhn, R.J., Strauss, E.G., Ou, S., & Strauss, J.H. (1992).
High-affinity laminin receptor is a receptor for Sindbis virus in mammalian cells. Journal of virology, 66(8), 4992-5001. [PubMed:1385835] [PMC] [WorldCat] - ↑
Rose, P.P., Hanna, S.L., Spiridigliozzi, A., Wannissorn, N., Beiting, D.P., Ross, S.R., ..., & Cherry, S. (2011).
Natural resistance-associated macrophage protein is a cellular receptor for sindbis virus in both insect and mammalian hosts. Cell host & microbe, 10(2), 97-104. [PubMed:21843867] [PMC] [WorldCat] [DOI] - ↑
DeTulleo, L., & Kirchhausen, T. (1998).
The clathrin endocytic pathway in viral infection. The EMBO journal, 17(16), 4585-93. [PubMed:9707418] [PMC] [WorldCat] [DOI] - ↑
Glasgow, G.M., McGee, M.M., Sheahan, B.J., & Atkins, G.J. (1997).
Death mechanisms in cultured cells infected by Semliki Forest virus. The Journal of general virology, 78 ( Pt 7), 1559-63. [PubMed:9225029] [WorldCat] [DOI] - ↑
Bredenbeek, P.J., Frolov, I., Rice, C.M., & Schlesinger, S. (1993).
Sindbis virus expression vectors: packaging of RNA replicons by using defective helper RNAs. Journal of virology, 67(11), 6439-46. [PubMed:8411346] [PMC] [WorldCat] - ↑
Liljeström, P., & Garoff, H. (1991).
A new generation of animal cell expression vectors based on the Semliki Forest virus replicon. Bio/technology (Nature Publishing Company), 9(12), 1356-61. [PubMed:1370252] [WorldCat] - ↑
Finke, S., & Conzelmann, K.K. (2005).
Replication strategies of rabies virus. Virus research, 111(2), 120-31. [PubMed:15885837] [WorldCat] [DOI] - ↑
Kelly, R.M., & Strick, P.L. (2000).
Rabies as a transneuronal tracer of circuits in the central nervous system. Journal of neuroscience methods, 103(1), 63-71. [PubMed:11074096] [WorldCat] [DOI] - ↑ 飯田 章
センダイウイルスベクター:ベクター開発と医療・バイオ分野への応用
ウイルス: 57:29-36: 2007 doi 10.2222/jsv.57.29 - ↑
Christl, G. (1976).
[Therapy using Cor-Vel dragées in perimeter of digitalization]. Zur Therapie mit Cor-Vel Dragées im Vorfeld der Digitalisierung ZFA. Zeitschrift fur Allgemeinmedizin, 52(6), 324-7. [PubMed:944504] [WorldCat] - ↑
Christl, G. (1976).
[Therapy using Cor-Vel dragées in perimeter of digitalization]. Zur Therapie mit Cor-Vel Dragées im Vorfeld der Digitalisierung ZFA. Zeitschrift fur Allgemeinmedizin, 52(6), 324-7. [PubMed:944504] [WorldCat] - ↑
Summerford, C., Bartlett, J.S., & Samulski, R.J. (1999).
AlphaVbeta5 integrin: a co-receptor for adeno-associated virus type 2 infection. Nature medicine, 5(1), 78-82. [PubMed:9883843] [WorldCat] [DOI] - ↑
Kaludov, N., Brown, K.E., Walters, R.W., Zabner, J., & Chiorini, J.A. (2001).
Adeno-associated virus serotype 4 (AAV4) and AAV5 both require sialic acid binding for hemagglutination and efficient transduction but differ in sialic acid linkage specificity. Journal of virology, 75(15), 6884-93. [PubMed:11435568] [PMC] [WorldCat] [DOI] - ↑
Di Pasquale, G., Davidson, B.L., Stein, C.S., Martins, I., Scudiero, D., Monks, A., & Chiorini, J.A. (2003).
Identification of PDGFR as a receptor for AAV-5 transduction. Nature medicine, 9(10), 1306-12. [PubMed:14502277] [WorldCat] [DOI]