「進行性核上性麻痺」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の1版が非表示) | |||
| 3行目: | 3行目: | ||
''国立病院機構東名古屋病院脳神経内科''<br> | ''国立病院機構東名古屋病院脳神経内科''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2020年12月28日 原稿完成日:2020年12月21日<br> | ||
担当編集委員:[http://researchmap.jp/read0141446/ 漆谷 真](滋賀医科大学 脳神経内科)<br> | 担当編集委員:[http://researchmap.jp/read0141446/ 漆谷 真](滋賀医科大学 脳神経内科)<br> | ||
</div> | </div> | ||
| 10行目: | 10行目: | ||
英略称:PSP | 英略称:PSP | ||
{{box|text= 進行性核上性麻痺 は、パーキンソニズムを呈する神経変性疾患で非定型パーキンソニズムに位置付けられる。病理学的には、基底核や脳幹部被蓋、小脳、前頭葉などの神経細胞内やグリア細胞内に異常リン酸化タウタンパク質が蓄積し、タウオパチーに分類される。臨床像は垂直性核上性注視麻痺、早期からの姿勢保持障害を主徴とするリチャードソン症候群のほか、近年多様な臨床病型が示されている。パーキンソニズムを呈するが、パーキンソン病よりも進行が速く、対症療法やリハビリ・ケアが治療の中心である。 近年病態抑止療法が開発されつつあり、早期に正しく診断するため、診断に有用なバイオマーカーの開発が求められる。}} | {{box|text= 進行性核上性麻痺 は、パーキンソニズムを呈する神経変性疾患で非定型パーキンソニズムに位置付けられる。病理学的には、基底核や脳幹部被蓋、小脳、前頭葉などの神経細胞内やグリア細胞内に異常リン酸化タウタンパク質が蓄積し、タウオパチーに分類される。臨床像は垂直性核上性注視麻痺、早期からの姿勢保持障害を主徴とするリチャードソン症候群のほか、近年多様な臨床病型が示されている。パーキンソニズムを呈するが、パーキンソン病よりも進行が速く、対症療法やリハビリ・ケアが治療の中心である。 近年病態抑止療法が開発されつつあり、早期に正しく診断するため、診断に有用なバイオマーカーの開発が求められる。}} | ||
== 歴史 == | == 歴史 == | ||
進行性核上性麻痺は、Richardsonらが1963年にアメリカ神経学会において6例の臨床病理学的所見を報告し、翌1964年Annals of Neurology誌に9例をまとめ、報告した<ref name=Steele1964><pubmed>14107684</pubmed></ref> 。1996年にthe National Institute of Neurological Disorders and Stroke and the Society for PSP (NINDS-SPSP)による国際的な臨床診断基準が発表され<ref name=Litvan8710059><pubmed>8710059</pubmed></ref> 、その臨床的特徴は[[垂直性注視麻痺]]および発症早期の転倒を伴う[[姿勢保持障害]]とされ、現在では[[リチャードソン症候群]]と呼ばれる。2005年にPSP第2の臨床病型として[[PSP-parkinsonism]]<ref name=Williams2005><pubmed>15788542</pubmed></ref> が、また2007年に[[pure akinesia with gait freezing]]<ref name=Williams2007><pubmed>17712855</pubmed></ref> が報告された後も多様な臨床病型の報告が相次ぎ、2017年に発表されたMovement disorder societyによる診断基準(以下MDS基準と略す)では、リチャードソン症候群以外に7つの臨床病型が提唱されている<ref name=Höglinger2017><pubmed>28467028</pubmed></ref> 。 | 進行性核上性麻痺は、Richardsonらが1963年にアメリカ神経学会において6例の臨床病理学的所見を報告し、翌1964年Annals of Neurology誌に9例をまとめ、報告した<ref name=Steele1964><pubmed>14107684</pubmed></ref> 。1996年にthe National Institute of Neurological Disorders and Stroke and the Society for PSP (NINDS-SPSP)による国際的な臨床診断基準が発表され<ref name=Litvan8710059><pubmed>8710059</pubmed></ref> 、その臨床的特徴は[[垂直性注視麻痺]]および発症早期の転倒を伴う[[姿勢保持障害]]とされ、現在では[[リチャードソン症候群]]と呼ばれる。2005年にPSP第2の臨床病型として[[PSP-parkinsonism]]<ref name=Williams2005><pubmed>15788542</pubmed></ref> が、また2007年に[[pure akinesia with gait freezing]]<ref name=Williams2007><pubmed>17712855</pubmed></ref> が報告された後も多様な臨床病型の報告が相次ぎ、2017年に発表されたMovement disorder societyによる診断基準(以下MDS基準と略す)では、リチャードソン症候群以外に7つの臨床病型が提唱されている<ref name=Höglinger2017><pubmed>28467028</pubmed></ref> 。 | ||
2020年12月30日 (水) 21:41時点における版
饗場郁子
国立病院機構東名古屋病院脳神経内科
DOI:10.14931/bsd.9641 原稿受付日:2020年12月28日 原稿完成日:2020年12月21日
担当編集委員:漆谷 真(滋賀医科大学 脳神経内科)
英:progressive supranucelar palsy 独:progressive supranukleäre Blickparese 仏:paralysie supranucléaire progressive
英略称:PSP
進行性核上性麻痺 は、パーキンソニズムを呈する神経変性疾患で非定型パーキンソニズムに位置付けられる。病理学的には、基底核や脳幹部被蓋、小脳、前頭葉などの神経細胞内やグリア細胞内に異常リン酸化タウタンパク質が蓄積し、タウオパチーに分類される。臨床像は垂直性核上性注視麻痺、早期からの姿勢保持障害を主徴とするリチャードソン症候群のほか、近年多様な臨床病型が示されている。パーキンソニズムを呈するが、パーキンソン病よりも進行が速く、対症療法やリハビリ・ケアが治療の中心である。 近年病態抑止療法が開発されつつあり、早期に正しく診断するため、診断に有用なバイオマーカーの開発が求められる。
歴史
進行性核上性麻痺は、Richardsonらが1963年にアメリカ神経学会において6例の臨床病理学的所見を報告し、翌1964年Annals of Neurology誌に9例をまとめ、報告した[1] 。1996年にthe National Institute of Neurological Disorders and Stroke and the Society for PSP (NINDS-SPSP)による国際的な臨床診断基準が発表され[2] 、その臨床的特徴は垂直性注視麻痺および発症早期の転倒を伴う姿勢保持障害とされ、現在ではリチャードソン症候群と呼ばれる。2005年にPSP第2の臨床病型としてPSP-parkinsonism[3] が、また2007年にpure akinesia with gait freezing[4] が報告された後も多様な臨床病型の報告が相次ぎ、2017年に発表されたMovement disorder societyによる診断基準(以下MDS基準と略す)では、リチャードソン症候群以外に7つの臨床病型が提唱されている[5] 。
病態
病理所見
肉眼的には脳幹部被蓋、淡蒼球、視床下核、小脳歯状核などが萎縮し、組織学的に上記部位の神経細胞脱落及びグリオーシスを示す[1] 。これらの部位を含み広範に神経細胞、グリア細胞、neuropilに異常にリン酸化したタウタンパク質が蓄積する[6][7] 。タウタンパク質はヒトでは微小管結合領域が3つのリピート(3R)タウと4つのリピート(4R)タウが存在するが、PSPでは4Rタウが優位に蓄積する。タウタンパク質は神経細胞内では神経原線維変化 neurofibrillary tangle (NFT)という形態で蓄積し(図1)、アストロサイトでは細胞体近位部に房状に蓄積するため房付き星状細胞(tufted astrocyte)と呼ばれ、PSPに特異的な病理所見とされる[8] (図2)。またサルコシル不溶性の脳抽出物のタウ分子量はPSPでは33kDa、 PSPとの鑑別が問題となる大脳皮質基底核変性症 corticobasal degeneration(CBD)では37kDaであり、生化学的にも大脳皮質基底核変性症と区別されている[9] 。
わが国の70剖検例の報告によれば、PSPの病理学的な病変分布は大きく3群に分かれ、典型的な分布は73%、淡蒼球、視床下核、黒質に限局したタウ病変を認める群は18%、大脳皮質に左右差を伴うタウ病理を認める群が9%とされ、各々臨床像との関連が示唆されている[7] 。
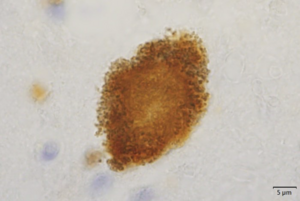
RD4免疫染色。吉田眞理先生(愛知医科大学)提供
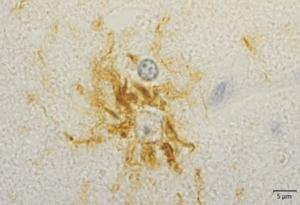
大脳皮質、被殻や尾状核、脳幹部被蓋などに出現する。RD4免疫染色。吉田眞理先生(愛知医科大学)提供
異常タウタンパク質の伝播
4Rタウが優位に蓄積するタウオパチーの動物モデルでは4Rタウが細胞外に伝搬することが明らかになっており、マウスの脳内にPSPの患者脳から抽出した異常タウタンパク質を接種すると、接種部位から離れた部位において疾患特徴的なタウ病理が確認されている[10] 。
病因
遺伝子
欧米のゲノムワイド関連解析 Genome-wide association study (GWAS)の結果、孤発性PSPの疾患感受性遺伝子として、PSP脳に蓄積するタウをコードするmicrotubule-associated protein tau (MAPT)遺伝子に加え、STX6、 EIF2A3K、MOBPが同定された[11] 。またtripartite motif-containing protein 11 (TRIM11)はPSPの臨床像修飾因子であることが報告されている[12] 。さらに家族性パーキンソン病の原因遺伝子の一つであるleucine rich-repeat kinase 2 (LRRK2)の変異がPSPの生存に関連するというグローバルなGWASの結果が示された[13] 。わが国においてはまだGWASは行われていない。
タウタンパク質は微小管結合タンパク質で、第17番染色体に存在する遺伝子MAPTから選択的スプライシングにより生成される。MAPTはH1/H2ハプロ多型に分類され、H1ハプロタイプがPSPのリスクである[14] 。この2つのハプロタイプは、遺伝子が局所で逆方向となっているのに加え、複数のSNPがのっている。日本人はPSPかどうかにかかわらずH1ハプロ多型であり、PSP発症のリスクが高い集団であると言える。わが国における有病率が欧米に比し高いこととの関連性が示唆される[15]。また、本疾患は孤発性の疾患であるが、家族性のPSPも報告されている[16] 。
環境
20世紀に、繊維染色となめし工業がさかんであった北フランスにおいて、2015年にPSPのクラスターが報告された[17] 。重金属による土壌汚染が明らかになっており、クロムとニッケルがタウの蓄積および細胞死に寄与している可能性が示唆されている[18] 。
症候
典型例は、垂直性核上性注視麻痺と初期からの姿勢保持障害を特徴とし、原著の著者名からリチャードソン症候群と呼ばれる。
眼球運動障害
疾患名の核上性麻痺とは、核上性注視麻痺のことを指す。また「核上性」の意味は「核以下が保たれている」という意味で、頭位変換眼球反射(頚部を他動的に前後屈させると眼球は上転あるいは下転する)で確認できる[1] 。垂直性注視麻痺の中では上方注視麻痺は下方注視麻痺に先行するが、上方注視麻痺は加齢により障害されるため、下方注視麻痺がPSPの特徴である[2][19] 。水平性注視麻痺は垂直性注視麻痺に遅れて出現し、最終的に全く動かなくなる。眼球運動障害は本疾患の特徴であるが、初期には存在せず、発症2〜3年経ってから現れる場合が多い[19] 。
姿勢保持障害/転倒
眼球運動障害に比べ、姿勢保持障害は初期から出現する。他のパーキンソニズムを呈する疾患と異なり、転倒の出現が早期であることは、PSPに特異的であり、診断基準にも発症早期の転倒が含まれている[20][5] 。また、バランスを失った際、手で防御する反応が出にくいため他疾患に比べ上半身(顔面・肋骨・脊椎)の外傷が多い[21] 。
パーキンソニズム
強剛・無動などパーキンソニズムが出現する。強剛は四肢よりも頸部や体幹に優位で[1][19] 「体軸性強剛」と呼ばれる。ただし初期には四肢には強剛はないことも少なくない。振戦や左右差はパーキンソン病と比較して少ないとされている[19] が実際には、稀ではない。
認知機能障害
初期には全般性の認知機能は保たれ、Mini-Mental State Examinaton (MMSE)や改訂 長谷川式簡易知能評価スケール (HDS-R)のスコアは正常で、前頭葉機能を反映するFrontal Assesment Battery (FAB) スコアのみ低下している場合が多い。把握反射や視性探索反応、模倣行動などの前頭葉徴候は比較的早期より出現する[19] 。PSPでは前頭葉に神経原線維変化などタウ病変が出現することが、認知症の主因であるとされている[22] 。一方アルツハイマー病やレヴィー小体型認知症と異なり、時間や場所などの見当識は保たれる場合が多い。状況判断や危険に対する認知力が低下するため、転倒や窒息などの合併症が生じる。進行とともに発動性が低下し、無動・無言の傾向が強くなる。
診断
診断基準
米国国立神経疾患・脳卒中研究所(NINDS)基準はリチャードソン症候群の基準であり、特異度は高いもののリチャードソン症候群以外の臨床病型が合致せず、感度が高くない基準であった[2] 。2017年に発表されたMovement disorder societyによる診断基準(以下MDS基準と略す)には、PSP-parkinsonism(PSP-P)、PSP-corticobasal syndrome(PSP-CBS)のほか、PSP with progressive gait freezing(PSP-PGF)、PSP with predominant frontal presentation(PSP-F)、PSP with predominant ocular motor dysfunction(PSP-OM)、PSP with predominant speech/language disorder(PSP-SL)、PSP with predominant postural instability(PSP-PI)の全部で8つの臨床病型が含まれ[5] 、各々の病型に対する病理所見が示された[23] 。他に主にわが国から報告されている臨床病型として、小脳性運動失調が先行し、初期に脊髄小脳変性症と診断されうるPSP with predominant cerebellar ataxia(PSP-C)がある[24][25] 。
MDS基準ではリチャードソン症候群の特徴である眼球運動障害、姿勢保持障害のほか、無動、認知機能障害の4つの機能ドメインを組み合わせて8つの臨床病型を決定する。各機能ドメインの症候は診断の確からしさにより3段階に分けられている(MDS基準の和訳)。これらの主要臨床症候についてはtutorial videoが作成されたので、ぜひ参照されたい[26] 。また診断の確実性により確実例(病理診断例、 Definite PSP)、ほぼ確実例(Probable) PSP、疑い例(Possible) PSPに加え示唆例(suggesitive of PSP)が加えられた[5] 。示唆例は病態修飾療法を見据え、早期に正しく診断するための病型として位置づけられている。実際の症例でこの基準を適応すると複数の病型に該当することが多いため、Multiple allocation extinction rule を適用し病型を絞ることが提案されている[27] 。
MDS基準は2019年に病理診断例において感度・特異度が報告され、probable PSPは特異度は86%と高いが感度は47%と低く、一方suggestive of PSPは感度は88%と高いものの特異度は40%と低いことが報告されている[28] 。
検査
形態画像
脳MRIでは、脳幹特に中脳被蓋部の萎縮、第3脳室の拡大、前頭葉の萎縮などを特徴とする(図3)[29][30] 。決め手となるのは、MRIの正中矢状断像における中脳被蓋部の萎縮で、中脳被蓋の最も吻側がハチドリの嘴様に見えることから‘humming bird appearance’と呼ばれている。また小脳歯状核遠心系の障害を反映し、上小脳脚の萎縮を認める。これらPSPの特徴的な所見は初期に認めないことも多い点、また臨床病型によっては進行期においても認めない場合がある点に留意する[30] 。
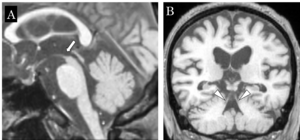
81歳男性 発症3年4か月時 全経過4年の病理診断例
A:正中矢状断像にて中脳被蓋吻側が萎縮し、‘humming bird appearance’を呈する(矢印)
B: 冠状断像にて上小脳脚の萎縮(矢頭)を認める
機能画像
脳血流SPECT上、前頭葉の血流低下がみられる。ドーパミントランスポーター(DAT)SPECTでは、初期から取り込み低下を認める場合が多い[29] 。123I-メタヨードベンジルグアニジン(MIBG)心筋シンチフラフィーでは心筋への取り込みは正常であるがLewy小体病を合併すると低下するので注意する[31] 。
認知機能検査
前頭葉性の遂行機能障害がみられ、Frontal Assessment Battery (FAB) 語彙の流暢性(長谷川式テストの‘野菜の名前’の項目)など前頭葉機能を反映するテストスコアの低下がみられる。
タウと関連する検査
脳に蓄積したタウタンパク質をとらえる診断法として、Tau PETとReal-time quaking-induced conversion (RT-QuIC) assayが挙げられる。
Tau PET
蓄積したタウタンパク質を可視化する方法で、タウオパチーであるという疾患の質的な診断および病変分布が確認でき[32] 、種類も増えている。
RT-QuIC assay
PSP特有の微量の異常4リピートタウタンパク質(シード)を増幅する方法で、PSP剖検例の脳脊髄液で4リピートタウシードが報告されている[33] 。
鑑別診断
最終臨床診断がPSPであった症例の中で病理診断がPSPは8割弱であり、non-PSPの約3分の2は大脳皮質基底核変性症corticobasal degeneration(CBD)、 多系統萎縮症multiple system atrophy(MSA)、 レヴィー小体病Lewy body disease(LBD)である[34][35] 。それ以外にも多様な疾患が含まれる。Non-PSPの中ではαシヌクレオパチーである多系統萎縮症とレヴィー小体病を除外することが重要である。MDS基準の中ではPSP mimicsを除外するために、必須除外基準が設けられており[5] 、それらの項目が鑑別診断上重要である。
多系統萎縮症
パーキンソニズム、自律神経障害、小脳性運動失調が3大神経症候で、PSPと共通の所見は「レボドパの効果が乏しい」、「自律神経障害の中の排尿障害」、「筋トーヌス低下、slurred speech(不明瞭発語)、不安定歩行など小脳性運動失調に関連する症候」である。PSPとの鑑別点は起立性低血圧の存在であり、「起立3分後に収縮期30mmHg以上、拡張期15mmHg以上の起立性低血圧」はMDS基準の必須除外項目に含まれている[5] (MDS基準の和訳)。また、画像所見としては多系統萎縮症ではMRIにおいて橋のクロスサインや被殻のslit signなど特徴的な所見が認められる。
レヴィー小体病
認知症、パーキンソニズムはPSPと共通である。 MDS基準ではレヴィー小体病を除外するために「起立性低血圧」、「幻視ないし覚醒度の変容」が必須除外基準に含まれている[5] 。またPSPの中でレヴィー小体病と最も鑑別が難しいのはパーキンソニズムを主徴とするPSP-Pであるが、病理診断例における後方視的検討によれば、「進行期の薬剤誘発性ジスキネジア」、「進行期の自律神経障害」、「全経過を通じた幻視」は陽性的中率99%でパーキンソン病を示唆したとされている[36] 。
上記2疾患はαシヌクレオパチーであるが、「起立性低血圧の欠如」はPSPをαシヌクレオパチーから区別するための最も強い自律神経系所見であることが病理診断例において報告されている[37] 。
大脳皮質基底核変性症
大脳皮質基底核変性症(corticobasal syndrome)はPSPとの鑑別が最も難しい疾患であり、現時点で診断基準の必須除外基準の中に大脳皮質基底核変性症を除外するための項目は設けられていない[5] 。病理診断された大脳皮質基底核変性症の中で、生前の臨床診断大脳皮質基底核変性症は37%に過ぎず、2番目に多い生前診断はPSP23%であるとされている[38] 。一方大脳皮質基底核変性症の典型的な臨床像である大脳皮質基底核症候群の背景病理は大脳皮質基底核変性症は半数以下で、PSPも2割弱含まれる[39] 。大脳皮質基底核変性症ではレヴィー小体型認知症 Dementia with Lewy bodies(DLB)、PSP、アルツハイマー病などに比べてMRI上大脳萎縮の進行が速いという画像上の所見が知られている[40] が、現時点でリチャードソン症候群の中で大脳皮質基底核変性症を除外することは極めて難しい。
疫学
わが国における有病率は、1999年は人口10万あたり5.82人で欧米と同等であったが[41] 、2010年では17.9人と増加が報告され[15] 、欧米に比べ高くなっている。平均60歳代で発症し、男性に多い[19][42][43] 。平均罹病期間は5〜9年という報告が多い[19][42][43] 。 臨床病型によって経過は異なり、PSP-PあるいはPSP-PGFは進行が緩徐で罹病年数が長い[3][4] 。また、発症1年以内に嚥下障害が出現すると生命予後が不良である[43] 。
治療
現時点では有効な病態抑止治療は確立されておらず、対症療法が中心である。
非薬物療法
初期から頚部・体幹のストレッチ運動、バランス訓練などのリハビリテーションを併用する。嚥下障害に対しては、嚥下リハビリとともに摂食方法の指導、適切な食材を検討し、嚥下障害が高度になってきたら、嚥下性肺炎予防のため口腔ケアを行い、低栄養にならないよう胃瘻あるいは経鼻経管栄養を考慮する。
薬物療法
パーキンソニズムに対し、レボドパ合剤をはじめ、抗パーキンソン病薬を使用するが、パーキンソン病のような効果は得られない場合がほとんどである。抗うつ薬である塩酸アミトリプチリン、コハク酸タンドスピロンが奏功する場合もある。坑コリン薬であるトリヘキシフェニジル(アーテン®)は無動あるいはすくみ足に有効な場合が多いが、量が多いと突発的な行動が増えるので少量から開始し、症状の変化を確認しながら増量する。 わが国において医師主導治験が行われている(UMIN000036522)。一方、コリンエステラーゼ阻害薬であるドネペジルはランダム化比較試験 randomized controlled trial (RCT)の結果、認知機能においては中等度の改善が見られたものの運動機能を悪化させたため、PSPでは使用を薦められないとされている[44] 。
病態抑止療法
現在MAPT遺伝子発現調節(アンチセンスオリゴ、スプライシング調整)、タウタンパク質翻訳後調節(タウのリン酸化、アセチル化、N-アセチルグルコサミン(GlcNAc)修飾、ユビキチンプロテアソームシステムとオートファジーによる分解、微小管安定化)、およびタウの伝搬抑制(抗タウ抗体、ミクログリアによって媒介されるタウ増殖の阻害)が開発中である[45] 。この中で、わが国では3つのヒト化IgG4モノクローナル抗体であるABBV-8E12(AbbVie)およびBIIB092(Biogen)の試験が終了し、いずれも安全性が確認されたが有効性は示されなかった[46] 。
参考文献
- ↑ 1.0 1.1 1.2 1.3
STEELE, J.C., RICHARDSON, J.C., & OLSZEWSKI, J. (1964).
PROGRESSIVE SUPRANUCLEAR PALSY. A HETEROGENEOUS DEGENERATION INVOLVING THE BRAIN STEM, BASAL GANGLIA AND CEREBELLUM WITH VERTICAL GAZE AND PSEUDOBULBAR PALSY, NUCHAL DYSTONIA AND DEMENTIA. Archives of neurology, 10, 333-59. [PubMed:14107684] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Litvan, I., Agid, Y., Calne, D., Campbell, G., Dubois, B., Duvoisin, R.C., ..., & Zee, D.S. (1996).
Clinical research criteria for the diagnosis of progressive supranuclear palsy (Steele-Richardson-Olszewski syndrome): report of the NINDS-SPSP international workshop. Neurology, 47(1), 1-9. [PubMed:8710059] [WorldCat] [DOI] - ↑ 3.0 3.1
Williams, D.R., de Silva, R., Paviour, D.C., Pittman, A., Watt, H.C., Kilford, L., ..., & Lees, A.J. (2005).
Characteristics of two distinct clinical phenotypes in pathologically proven progressive supranuclear palsy: Richardson's syndrome and PSP-parkinsonism. Brain : a journal of neurology, 128(Pt 6), 1247-58. [PubMed:15788542] [WorldCat] [DOI] - ↑ 4.0 4.1
Williams, D.R., Holton, J.L., Strand, K., Revesz, T., & Lees, A.J. (2007).
Pure akinesia with gait freezing: a third clinical phenotype of progressive supranuclear palsy. Movement disorders : official journal of the Movement Disorder Society, 22(15), 2235-41. [PubMed:17712855] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3 5.4 5.5 5.6 5.7
Höglinger, G.U., Respondek, G., Stamelou, M., Kurz, C., Josephs, K.A., Lang, A.E., ..., & Movement Disorder Society-endorsed PSP Study Group (2017).
Clinical diagnosis of progressive supranuclear palsy: The movement disorder society criteria. Movement disorders : official journal of the Movement Disorder Society, 32(6), 853-864. [PubMed:28467028] [PMC] [WorldCat] [DOI] - ↑
Litvan, I., Hauw, J.J., Bartko, J.J., Lantos, P.L., Daniel, S.E., Horoupian, D.S., ..., & Anderson, D.W. (1996).
Validity and reliability of the preliminary NINDS neuropathologic criteria for progressive supranuclear palsy and related disorders. Journal of neuropathology and experimental neurology, 55(1), 97-105. [PubMed:8558176] [WorldCat] [DOI] - ↑ 7.0 7.1
Yoshida, M. (2014).
Astrocytic inclusions in progressive supranuclear palsy and corticobasal degeneration. Neuropathology : official journal of the Japanese Society of Neuropathology, 34(6), 555-70. [PubMed:25124031] [WorldCat] [DOI] - ↑
Komori, T., Arai, N., Oda, M., Nakayama, H., Mori, H., Yagishita, S., ..., & Iwata, M. (1998).
Astrocytic plaques and tufts of abnormal fibers do not coexist in corticobasal degeneration and progressive supranuclear palsy. Acta neuropathologica, 96(4), 401-8. [PubMed:9797005] [WorldCat] [DOI] - ↑
Arai, T., Ikeda, K., Akiyama, H., Nonaka, T., Hasegawa, M., Ishiguro, K., ..., & Mochizuki, A. (2004).
Identification of amino-terminally cleaved tau fragments that distinguish progressive supranuclear palsy from corticobasal degeneration. Annals of neurology, 55(1), 72-9. [PubMed:14705114] [WorldCat] [DOI] - ↑
Narasimhan, S., Guo, J.L., Changolkar, L., Stieber, A., McBride, J.D., Silva, L.V., ..., & Lee, V.M.Y. (2017).
Pathological Tau Strains from Human Brains Recapitulate the Diversity of Tauopathies in Nontransgenic Mouse Brain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 37(47), 11406-11423. [PubMed:29054878] [PMC] [WorldCat] [DOI] - ↑
Höglinger, G.U., Melhem, N.M., Dickson, D.W., Sleiman, P.M., Wang, L.S., Klei, L., ..., & Schellenberg, G.D. (2011).
Identification of common variants influencing risk of the tauopathy progressive supranuclear palsy. Nature genetics, 43(7), 699-705. [PubMed:21685912] [PMC] [WorldCat] [DOI] - ↑
Jabbari, E., Woodside, J., Tan, M.M.X., Shoai, M., Pittman, A., Ferrari, R., ..., & Morris, H.R. (2018).
Variation at the TRIM11 locus modifies progressive supranuclear palsy phenotype. Annals of neurology, 84(4), 485-496. [PubMed:30066433] [PMC] [WorldCat] [DOI] - ↑
Jabbari, E., Koga, S., Valentino, R.R., Reynolds, R.H., Ferrari, R., Tan, M.M.X., ..., & PSP Genetics Group (2020).
Genetic determinants of survival in progressive supranuclear palsy: a genome-wide association study. The Lancet. Neurology. [PubMed:33341150] [WorldCat] [DOI] - ↑
Baker, M., Litvan, I., Houlden, H., Adamson, J., Dickson, D., Perez-Tur, J., ..., & Hutton, M. (1999).
Association of an extended haplotype in the tau gene with progressive supranuclear palsy. Human molecular genetics, 8(4), 711-5. [PubMed:10072441] [WorldCat] [DOI] - ↑ 15.0 15.1
Takigawa, H., Kitayama, M., Wada-Isoe, K., Kowa, H., & Nakashima, K. (2016).
Prevalence of progressive supranuclear palsy in Yonago: change throughout a decade. Brain and behavior, 6(12), e00557. [PubMed:28031995] [PMC] [WorldCat] [DOI] - ↑
Fujioka, S., Van Gerpen, J.A., Uitti, R.J., Dickson, D.W., & Wszolek, Z.K. (2014).
Familial progressive supranuclear palsy: a literature review. Neuro-degenerative diseases, 13(2-3), 180-2. [PubMed:24080486] [WorldCat] [DOI] - ↑
Caparros-Lefebvre, D., Golbe, L.I., Deramecourt, V., Maurage, C.A., Huin, V., Buée-Scherrer, V., ..., & Lees, A.J. (2015).
A geographical cluster of progressive supranuclear palsy in northern France. Neurology, 85(15), 1293-300. [PubMed:26354981] [PMC] [WorldCat] [DOI] - ↑
Alquezar, C., Felix, J.B., McCandlish, E., Buckley, B.T., Caparros-Lefebvre, D., Karch, C.M., ..., & Kao, A.W. (2020).
Heavy metals contaminating the environment of a progressive supranuclear palsy cluster induce tau accumulation and cell death in cultured neurons. Scientific reports, 10(1), 569. [PubMed:31953414] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1 19.2 19.3 19.4 19.5 19.6
Litvan, I., Mangone, C.A., McKee, A., Verny, M., Parsa, A., Jellinger, K., ..., & Pearce, R.K. (1996).
Natural history of progressive supranuclear palsy (Steele-Richardson-Olszewski syndrome) and clinical predictors of survival: a clinicopathological study. Journal of neurology, neurosurgery, and psychiatry, 60(6), 615-20. [PubMed:8648326] [PMC] [WorldCat] [DOI] - ↑
Litvan, I., Agid, Y., Calne, D., Campbell, G., Dubois, B., Duvoisin, R.C., ..., & Zee, D.S. (1996).
Clinical research criteria for the diagnosis of progressive supranuclear palsy (Steele-Richardson-Olszewski syndrome): report of the NINDS-SPSP international workshop. Neurology, 47(1), 1-9. [PubMed:8710059] [WorldCat] [DOI] - ↑
Williams, D.R., Watt, H.C., & Lees, A.J. (2006).
Predictors of falls and fractures in bradykinetic rigid syndromes: a retrospective study. Journal of neurology, neurosurgery, and psychiatry, 77(4), 468-73. [PubMed:16543524] [PMC] [WorldCat] [DOI] - ↑
Bigio, E.H., Brown, D.F., & White, C.L. (1999).
Progressive supranuclear palsy with dementia: cortical pathology. Journal of neuropathology and experimental neurology, 58(4), 359-64. [PubMed:10218631] [WorldCat] [DOI] - ↑
Kovacs, G.G., Lukic, M.J., Irwin, D.J., Arzberger, T., Respondek, G., Lee, E.B., ..., & Höglinger, G.U. (2020).
Distribution patterns of tau pathology in progressive supranuclear palsy. Acta neuropathologica, 140(2), 99-119. [PubMed:32383020] [PMC] [WorldCat] [DOI] - ↑
Kanazawa, M., Shimohata, T., Toyoshima, Y., Tada, M., Kakita, A., Morita, T., ..., & Nishizawa, M. (2009).
Cerebellar involvement in progressive supranuclear palsy: A clinicopathological study. Movement disorders : official journal of the Movement Disorder Society, 24(9), 1312-8. [PubMed:19412943] [WorldCat] [DOI] - ↑
Shimohata, T., Kanazawa, M., Yoshida, M., Saito, Y., Iwai, K., Yasuda, T., ..., & Aiba, I. (2016).
Clinical and imaging findings of progressive supranuclear palsy with predominant cerebellar ataxia. Movement disorders : official journal of the Movement Disorder Society, 31(5), 760-2. [PubMed:27030358] [WorldCat] [DOI] - ↑
Iankova, V., Respondek, G., Saranza, G., Painous, C., Cámara, A., Compta, Y., ..., & Movement Disorder Society-endorsed PSP Study Group (2020).
Video-tutorial for the Movement Disorder Society criteria for progressive supranuclear palsy. Parkinsonism & related disorders, 78, 200-203. [PubMed:32988736] [WorldCat] [DOI] - ↑
Grimm, M.J., Respondek, G., Stamelou, M., Arzberger, T., Ferguson, L., Gelpi, E., ..., & Movement Disorder Society-endorsed PSP Study Group (2019).
How to apply the movement disorder society criteria for diagnosis of progressive supranuclear palsy. Movement disorders : official journal of the Movement Disorder Society, 34(8), 1228-1232. [PubMed:30884545] [PMC] [WorldCat] [DOI] - ↑
Ali, F., Martin, P.R., Botha, H., Ahlskog, J.E., Bower, J.H., Masumoto, J.Y., ..., & Josephs, K.A. (2019).
Sensitivity and Specificity of Diagnostic Criteria for Progressive Supranuclear Palsy. Movement disorders : official journal of the Movement Disorder Society, 34(8), 1144-1153. [PubMed:30726566] [PMC] [WorldCat] [DOI] - ↑ 29.0 29.1
Whitwell, J.L., Höglinger, G.U., Antonini, A., Bordelon, Y., Boxer, A.L., Colosimo, C., ..., & Movement Disorder Society-endorsed PSP Study Group (2017).
Radiological biomarkers for diagnosis in PSP: Where are we and where do we need to be? Movement disorders : official journal of the Movement Disorder Society, 32(7), 955-971. [PubMed:28500751] [PMC] [WorldCat] [DOI] - ↑ 30.0 30.1
Sakurai, K., Tokumaru, A.M., Shimoji, K., Murayama, S., Kanemaru, K., Morimoto, S., ..., & Shibamoto, Y. (2017).
Beyond the midbrain atrophy: wide spectrum of structural MRI finding in cases of pathologically proven progressive supranuclear palsy. Neuroradiology, 59(5), 431-443. [PubMed:28386688] [WorldCat] [DOI] - ↑ 饗場 郁子、下畑 享良、榊原 隆次、吉田 眞理 (2015).
【神経変性疾患と自律神経障害】進行性核上性麻痺と自律神経障害. 神経内科. 83(1):44-53. - ↑
Endo, H., Shimada, H., Sahara, N., Ono, M., Koga, S., Kitamura, S., ..., & Higuchi, M. (2019).
In vivo binding of a tau imaging probe, [11 C]PBB3, in patients with progressive supranuclear palsy. Movement disorders : official journal of the Movement Disorder Society, 34(5), 744-754. [PubMed:30892739] [PMC] [WorldCat] [DOI] - ↑
Saijo, E., Metrick, M.A., Koga, S., Parchi, P., Litvan, I., Spina, S., ..., & Caughey, B. (2020).
4-Repeat tau seeds and templating subtypes as brain and CSF biomarkers of frontotemporal lobar degeneration. Acta neuropathologica, 139(1), 63-77. [PubMed:31616982] [PMC] [WorldCat] [DOI] - ↑
Osaki, Y., Ben-Shlomo, Y., Lees, A.J., Daniel, S.E., Colosimo, C., Wenning, G., & Quinn, N. (2004).
Accuracy of clinical diagnosis of progressive supranuclear palsy. Movement disorders : official journal of the Movement Disorder Society, 19(2), 181-9. [PubMed:14978673] [WorldCat] [DOI] - ↑
Josephs, K.A., & Dickson, D.W. (2003).
Diagnostic accuracy of progressive supranuclear palsy in the Society for Progressive Supranuclear Palsy brain bank. Movement disorders : official journal of the Movement Disorder Society, 18(9), 1018-26. [PubMed:14502669] [WorldCat] [DOI] - ↑
Williams, D.R., & Lees, A.J. (2010).
What features improve the accuracy of the clinical diagnosis of progressive supranuclear palsy-parkinsonism (PSP-P)? Movement disorders : official journal of the Movement Disorder Society, 25(3), 357-62. [PubMed:20108379] [WorldCat] [DOI] - ↑
van Gerpen, J.A., Al-Shaikh, R.H., Tipton, P.W., Wszolek, Z.K., Uitti, R.J., Ferman, T.J., ..., & Cheshire, W.P. (2019).
Progressive supranuclear palsy is not associated with neurogenic orthostatic hypotension. Neurology, 93(14), e1339-e1347. [PubMed:31484717] [WorldCat] [DOI] - ↑
Armstrong, M.J., Litvan, I., Lang, A.E., Bak, T.H., Bhatia, K.P., Borroni, B., ..., & Weiner, W.J. (2013).
Criteria for the diagnosis of corticobasal degeneration. Neurology, 80(5), 496-503. [PubMed:23359374] [PMC] [WorldCat] [DOI] - ↑
Aiba, I. (2012).
[Corticobasal syndrome: recent advances and future directions]. Brain and nerve = Shinkei kenkyu no shinpo, 64(4), 462-73. [PubMed:22481519] [WorldCat] - ↑
Whitwell, J.L., Jack, C.R., Parisi, J.E., Knopman, D.S., Boeve, B.F., Petersen, R.C., ..., & Josephs, K.A. (2007).
Rates of cerebral atrophy differ in different degenerative pathologies. Brain : a journal of neurology, 130(Pt 4), 1148-58. [PubMed:17347250] [PMC] [WorldCat] [DOI] - ↑
Kawashima, M., Miyake, M., Kusumi, M., Adachi, Y., & Nakashima, K. (2004).
Prevalence of progressive supranuclear palsy in Yonago, Japan. Movement disorders : official journal of the Movement Disorder Society, 19(10), 1239-40. [PubMed:15390010] [WorldCat] [DOI] - ↑ 42.0 42.1 饗場 郁子、齋藤 由扶子、奥田 聡、吉田 眞理、橋詰 良夫 (2002).
【進行性核上性麻痺(PSP)】剖検例からみた進行性核上性麻痺臨床像. 神経内科. 56(2):143-9. - ↑ 43.0 43.1 43.2 饗場 郁子 齋藤 由扶子, 玉腰 暁子, 松岡 幸彦 (2005).
進行性核上性麻痺の生命予後. 臨床神経学. 45(8):565-70 - ↑
Litvan, I., Phipps, M., Pharr, V.L., Hallett, M., Grafman, J., & Salazar, A. (2001).
Randomized placebo-controlled trial of donepezil in patients with progressive supranuclear palsy. Neurology, 57(3), 467-73. [PubMed:11502915] [WorldCat] [DOI] - ↑
Boxer, A.L., Yu, J.T., Golbe, L.I., Litvan, I., Lang, A.E., & Höglinger, G.U. (2017).
Advances in progressive supranuclear palsy: new diagnostic criteria, biomarkers, and therapeutic approaches. The Lancet. Neurology, 16(7), 552-563. [PubMed:28653647] [PMC] [WorldCat] [DOI] - ↑
Vaswani, P.A., & Olsen, A.L. (2020).
Immunotherapy in progressive supranuclear palsy. Current opinion in neurology. [PubMed:32520801] [PMC] [WorldCat] [DOI]