「青斑核」の版間の差分
Suetakanishiike (トーク | 投稿記録) 細 ページの作成:「ラテン語:locus coeruleus、アメリカ英語:locus ceruleus 西池季隆、中村彰治 青斑核(nucleus locus coeruleus, LC)は橋の背側に位置す...」 |
細編集の要約なし |
||
| (2人の利用者による、間の15版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/read0132410 西池 季隆]</font><br> | |||
''大阪労災病院 耳鼻咽喉科・頭頸部外科''<br> | |||
<font size="+1">[http://researchmap.jp/read0043145 中村 彰治]</font><br> | |||
''山口大学''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年4月25日 原稿完成日:2012年6月28日<br> | |||
担当編集委員:[http://researchmap.jp/ichirofujita 藤田 一郎](大阪大学 大学院生命機能研究科)<br> | |||
</div> | |||
[[ファイル:Locus-coeruleus.png|300px|thumb|<b>図 青斑核</b><br>Wikipediaより]] | |||
羅:locus coeruleus 英:locus ceruleus, locus coeruleus 英略称:LC | |||
{{box|text= | |||
青斑核は広く[[wikipedia:ja:脊椎動物|脊椎動物]]の中枢神経に認められる[[橋]]の背側に位置する小さな[[神経核]]である。[[中枢神経系]]の中で最も多数の[[ノルアドレナリン]] (noradrenaline, NA)含有[[ニューロン]]が集合している<ref name="ref1"><pubmed>231924</pubmed></ref> <ref name="ref2"><pubmed>6308694</pubmed></ref>。[[覚醒]]レベルの制御、[[選択的注意]]、[[ストレス]]、[[痛み]]の中枢性抑制、[[姿勢制御]]に関与する。 | |||
}} | |||
== 構造 == | |||
=== 細胞構築 === | |||
''' | ヒトでは10,000から19,000個の細胞が存在するが<ref name="ref3">'''Brody H.'''<br>Cell counts in cerebral cortex and brainstem.<br>In: R. Katzman, R. D. Terry and K. L. Bick (eds). <br>Aging, Alzheimaer's Disease: Senile Dementia and Related Disorders.<br>pp. 345-352: Raven Press; 1978.</ref>、[[wikipedia:ja:ラット|ラット]]では1,000から1,600個<ref name="ref4"><pubmed>1100685</pubmed></ref>、[[ゼブラフィッシュ]]では3から10個の細胞が存在するとされる<ref name="ref5"><pubmed>8077459</pubmed></ref>。[[wikipedia:ja:組織蛍光法|組織蛍光法]]による研究では、青斑核を構成する細胞のほとんどがNA含有ニューロンである<ref name="ref6"><pubmed>922502</pubmed></ref>。ラットでは非ノルアドレナリン性のニューロンは存在しないか<ref name="ref7"><pubmed>6150057</pubmed></ref>、あっても非常にわずかであるとされる<ref name="ref8"><pubmed>3348147</pubmed></ref>。この場合の非ノルアドレナリン性ニューロンは、GABA含有介在ニューロンとされている。[[wikipedia:ja:ネコ|ネコ]]<ref name="ref9"><pubmed>7447036</pubmed></ref>や[[wikipedia:ja:オポッサム|オポッサム]]<ref name="ref10"><pubmed>8980724</pubmed></ref>の青斑核では、非ノルアドレナリン性の介在ニューロンが散在すると報告されている。 | ||
=== 出力 === | |||
青斑核ニューロンは、[[大脳]]、[[視床]]、[[海馬]]、[[小脳]]、[[脊髄]]など中枢の主要なほとんどの脳領域にNA線維を投射し、これらの部位を支配する。このような脳全域にわたる広範な支配様式から推測されるように、青斑核は脳全体の機能の調節に関係している。青斑核ニューロンの[[軸索]]は、損傷に対して高い[[再生]]能力を示すとともに、[[ストレス]]等の外界の刺激に反応して、ダイナミックに線維密度を変化させる<ref name="ref11"><pubmed>2202018</pubmed></ref> <ref name="ref12"><pubmed>1667552</pubmed></ref>。 | |||
青斑核-NA神経系は標的とする細胞へ、複数の[[受容体]]を介して作用する。いままで、[[ノルアドレナリン#受容体|α1]]、[[ノルアドレナリン#受容体|α2]]および[[ノルアドレナリン#受容体|β1]]の三つの受容体サブタイプが同定されている<ref name="ref13"><pubmed>12668290</pubmed></ref>。このうちα1とβは主に[[シナプス後部]]に存在するが、α2は[[シナプス前部]]にもシナプス後部にも存在する。 | |||
=== 入力 === | |||
青斑核-NA神経系は、広範な脳部位に軸索を投射しているが、青斑核への入力線維は非常に限られており、主な入力は[[巨細胞性網様体傍核]](nucleus paragigantocellularis: PGI)と[[舌下神経前位核]](nucleus prepositus hypoglossus: PH)とされている<ref name="ref14"><pubmed>3775363</pubmed></ref>。PGIからは[[グルタミン酸]]を介した興奮性入力が<ref name="ref15"><pubmed>3193175</pubmed></ref>、PHからは[[GABA]]を介した抑制性入力が<ref name="ref16"><pubmed>2769374</pubmed></ref>青斑核ニューロンの電気活動に影響を与える。 | |||
== 機能 == | |||
=== 覚醒制御 === | |||
[[麻酔]]下あるいは無麻酔下の動物では、青斑核ニューロンは5 Hz以下のゆっくりとした自発発火を示す。青斑核に存在するすべてのニューロンは同期して発火する<ref name="ref17"><pubmed>7346593</pubmed></ref>。青斑核ニューロンは、動物の覚醒に先行して発火頻度を増加し、発火頻度が高くなるとともに覚醒レベルは高くなる。青斑核ニューロンの発火頻度は[[ノンレム睡眠]]時に減少し、[[レム睡眠]]時では発火はほとんど消失する<ref name="ref18"><pubmed>6771765</pubmed></ref>。青斑核ニューロンを興奮させると動物は覚醒し<ref name="ref19"><pubmed>1682425</pubmed></ref>、抑制すると動物の[[意識]]レベルは低下する<ref name="ref20"><pubmed>8104319</pubmed></ref>。このように、青斑核は覚醒状態の発現と維持に重要な役割を担っている。 | |||
青斑核ニューロンは外界からのすべての感覚刺激に対して発火頻度を増やし、特に[[痛み]]刺激に強い興奮を示す。したがって、外界からの感覚刺激によって、眠っている動物が目覚め、覚醒している動物が覚醒レベルをさらに上げるのは、外界からの感覚刺激によって青斑核ニューロンが興奮し脳全体にNAを放出するためである。覚醒剤による覚醒効果は、覚醒剤がNAニューロンの神経終末からNAを放出する作用があるために生じる<ref name="ref19" />。一部の[[麻酔薬]](例、クロニジン)の麻酔効果は、それら麻酔薬が青斑核ニューロンの活動を抑制するために生じる<ref name="ref20"><pubmed>8104319</pubmed></ref>。 | |||
=== 選択的注意 === | |||
青斑核ニューロンは、新奇な刺激により強く反応し<ref name="ref21"><pubmed>16022602</pubmed></ref>、同じ刺激が繰り返し与えられると、その刺激に慣れて反応は減弱する。このことは、生体が外界の新奇な刺激に対して注意するときの神経機構に青斑核が関与していることを示している。NAには、標的ニューロンの信号/雑音(S/N)比をあげる作用がある<ref name="ref22"><pubmed>15128405</pubmed></ref> <ref name="ref23"><pubmed>12492432</pubmed></ref>。NAは、標的ニューロンに対する強い入力をより強める一方で、弱い入力を抑えて強い入力を際立たせる。このように、青斑核-NA神経系が活性化しその神経終末でNAを放出することにより、生体にとって意味のある刺激に関連した神経回路だけが脳全体の中で際立つことになり、選択的注意が生じるとされる。 | |||
=== ストレス === | |||
青斑核-NAニューロンは、末梢のNA含有ニューロンである[[交感神経]]と同様にストレス刺激で興奮してNAを放出する<ref name="ref24"><pubmed>3529238</pubmed></ref>。末梢の交感神経が[[内臓]]や[[血管]]を標的とするのに対して、青斑核は脳を標的とする中枢の交感神経系とみなされる。ストレスによる青斑核ニューロンの興奮は、ストレスによって生じる覚醒レベルの上昇や不安などの情動反応の発現と関連している。慢性ストレスによって誘発される[[うつ病]]には、青斑核ニューロンのNA神経線維の退縮あるいは変性が起こっている可能性が示唆されている<ref name="ref12" />。 | |||
=== 痛み === | |||
青斑核は、痛みを中枢性に抑制する[[下行性抑制系]]としても働く<ref name="ref25"><pubmed>6143527</pubmed></ref>。この抑制系は、青斑核を起始核として[[背外側索]]より下行性に[[脊髄後角]]へと投射する。青斑核を電気刺激したりグルタミン酸を注入したりすることで、脊髄後角細胞における痛み応答は抑制される<ref name="ref26"><pubmed>1813927</pubmed></ref>。これは、[[Aδ]]や[[C線維]]の脊髄内の終末部に発現するα2受容体を介して、グルタミン酸の放出量が減少するためである。[[抗てんかん薬]]である[[Gabapentin]]は[[神経因性疼痛]]治療薬としても使用されるが、青斑核においてGABA入力を抑制することによって青斑核を脱抑制し、下行性抑制系を活性化させることによってその作用が生じる<ref name="ref27"><pubmed>19034104</pubmed></ref>。 | |||
=== 姿勢制御 === | |||
[[姿勢制御]]の面では、青斑核は[[前庭脊髄反射]]にも関係する。除脳ネコにおいて、青斑核ニューロンは、全身の傾斜による[[前庭]]入力に反応する<ref name="ref28"><pubmed>2381509</pubmed></ref>。これは[[内耳]]の[[卵形嚢]]刺激による反応と考えられている。青斑核-NA神経系は脊髄投射を介して四肢の筋肉の活動性に影響を与え、前庭脊髄反射の利得を調整して姿勢制御に関与する。青斑核ニューロンは[[外側半規管]]由来の入力も受けており、[[前庭自律神経反射]]に関与すると考えられている<ref name="ref29"><pubmed>8705311</pubmed></ref>。 | |||
== 関連項目 == | |||
*[[ノルアドレナリン]] | |||
*[[選択的注意]] | |||
*[[覚醒]] | |||
*[[ストレス]] | |||
*[[痛覚]] | |||
*[[姿勢制御]] | |||
==参考文献== | |||
<references /> | |||
2014年6月3日 (火) 16:42時点における最新版
西池 季隆
大阪労災病院 耳鼻咽喉科・頭頸部外科
中村 彰治
山口大学
DOI:10.14931/bsd.1181 原稿受付日:2012年4月25日 原稿完成日:2012年6月28日
担当編集委員:藤田 一郎(大阪大学 大学院生命機能研究科)
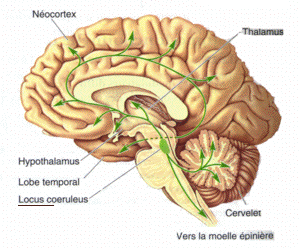
Wikipediaより
羅:locus coeruleus 英:locus ceruleus, locus coeruleus 英略称:LC
青斑核は広く脊椎動物の中枢神経に認められる橋の背側に位置する小さな神経核である。中枢神経系の中で最も多数のノルアドレナリン (noradrenaline, NA)含有ニューロンが集合している[1] [2]。覚醒レベルの制御、選択的注意、ストレス、痛みの中枢性抑制、姿勢制御に関与する。
構造
細胞構築
ヒトでは10,000から19,000個の細胞が存在するが[3]、ラットでは1,000から1,600個[4]、ゼブラフィッシュでは3から10個の細胞が存在するとされる[5]。組織蛍光法による研究では、青斑核を構成する細胞のほとんどがNA含有ニューロンである[6]。ラットでは非ノルアドレナリン性のニューロンは存在しないか[7]、あっても非常にわずかであるとされる[8]。この場合の非ノルアドレナリン性ニューロンは、GABA含有介在ニューロンとされている。ネコ[9]やオポッサム[10]の青斑核では、非ノルアドレナリン性の介在ニューロンが散在すると報告されている。
出力
青斑核ニューロンは、大脳、視床、海馬、小脳、脊髄など中枢の主要なほとんどの脳領域にNA線維を投射し、これらの部位を支配する。このような脳全域にわたる広範な支配様式から推測されるように、青斑核は脳全体の機能の調節に関係している。青斑核ニューロンの軸索は、損傷に対して高い再生能力を示すとともに、ストレス等の外界の刺激に反応して、ダイナミックに線維密度を変化させる[11] [12]。
青斑核-NA神経系は標的とする細胞へ、複数の受容体を介して作用する。いままで、α1、α2およびβ1の三つの受容体サブタイプが同定されている[13]。このうちα1とβは主にシナプス後部に存在するが、α2はシナプス前部にもシナプス後部にも存在する。
入力
青斑核-NA神経系は、広範な脳部位に軸索を投射しているが、青斑核への入力線維は非常に限られており、主な入力は巨細胞性網様体傍核(nucleus paragigantocellularis: PGI)と舌下神経前位核(nucleus prepositus hypoglossus: PH)とされている[14]。PGIからはグルタミン酸を介した興奮性入力が[15]、PHからはGABAを介した抑制性入力が[16]青斑核ニューロンの電気活動に影響を与える。
機能
覚醒制御
麻酔下あるいは無麻酔下の動物では、青斑核ニューロンは5 Hz以下のゆっくりとした自発発火を示す。青斑核に存在するすべてのニューロンは同期して発火する[17]。青斑核ニューロンは、動物の覚醒に先行して発火頻度を増加し、発火頻度が高くなるとともに覚醒レベルは高くなる。青斑核ニューロンの発火頻度はノンレム睡眠時に減少し、レム睡眠時では発火はほとんど消失する[18]。青斑核ニューロンを興奮させると動物は覚醒し[19]、抑制すると動物の意識レベルは低下する[20]。このように、青斑核は覚醒状態の発現と維持に重要な役割を担っている。
青斑核ニューロンは外界からのすべての感覚刺激に対して発火頻度を増やし、特に痛み刺激に強い興奮を示す。したがって、外界からの感覚刺激によって、眠っている動物が目覚め、覚醒している動物が覚醒レベルをさらに上げるのは、外界からの感覚刺激によって青斑核ニューロンが興奮し脳全体にNAを放出するためである。覚醒剤による覚醒効果は、覚醒剤がNAニューロンの神経終末からNAを放出する作用があるために生じる[19]。一部の麻酔薬(例、クロニジン)の麻酔効果は、それら麻酔薬が青斑核ニューロンの活動を抑制するために生じる[20]。
選択的注意
青斑核ニューロンは、新奇な刺激により強く反応し[21]、同じ刺激が繰り返し与えられると、その刺激に慣れて反応は減弱する。このことは、生体が外界の新奇な刺激に対して注意するときの神経機構に青斑核が関与していることを示している。NAには、標的ニューロンの信号/雑音(S/N)比をあげる作用がある[22] [23]。NAは、標的ニューロンに対する強い入力をより強める一方で、弱い入力を抑えて強い入力を際立たせる。このように、青斑核-NA神経系が活性化しその神経終末でNAを放出することにより、生体にとって意味のある刺激に関連した神経回路だけが脳全体の中で際立つことになり、選択的注意が生じるとされる。
ストレス
青斑核-NAニューロンは、末梢のNA含有ニューロンである交感神経と同様にストレス刺激で興奮してNAを放出する[24]。末梢の交感神経が内臓や血管を標的とするのに対して、青斑核は脳を標的とする中枢の交感神経系とみなされる。ストレスによる青斑核ニューロンの興奮は、ストレスによって生じる覚醒レベルの上昇や不安などの情動反応の発現と関連している。慢性ストレスによって誘発されるうつ病には、青斑核ニューロンのNA神経線維の退縮あるいは変性が起こっている可能性が示唆されている[12]。
痛み
青斑核は、痛みを中枢性に抑制する下行性抑制系としても働く[25]。この抑制系は、青斑核を起始核として背外側索より下行性に脊髄後角へと投射する。青斑核を電気刺激したりグルタミン酸を注入したりすることで、脊髄後角細胞における痛み応答は抑制される[26]。これは、AδやC線維の脊髄内の終末部に発現するα2受容体を介して、グルタミン酸の放出量が減少するためである。抗てんかん薬であるGabapentinは神経因性疼痛治療薬としても使用されるが、青斑核においてGABA入力を抑制することによって青斑核を脱抑制し、下行性抑制系を活性化させることによってその作用が生じる[27]。
姿勢制御
姿勢制御の面では、青斑核は前庭脊髄反射にも関係する。除脳ネコにおいて、青斑核ニューロンは、全身の傾斜による前庭入力に反応する[28]。これは内耳の卵形嚢刺激による反応と考えられている。青斑核-NA神経系は脊髄投射を介して四肢の筋肉の活動性に影響を与え、前庭脊髄反射の利得を調整して姿勢制御に関与する。青斑核ニューロンは外側半規管由来の入力も受けており、前庭自律神経反射に関与すると考えられている[29]。
関連項目
参考文献
- ↑
Moore, R.Y., & Bloom, F.E. (1979).
Central catecholamine neuron systems: anatomy and physiology of the norepinephrine and epinephrine systems. Annual review of neuroscience, 2, 113-68. [PubMed:231924] [WorldCat] [DOI] - ↑
Foote, S.L., Bloom, F.E., & Aston-Jones, G. (1983).
Nucleus locus ceruleus: new evidence of anatomical and physiological specificity. Physiological reviews, 63(3), 844-914. [PubMed:6308694] [WorldCat] [DOI] - ↑ Brody H.
Cell counts in cerebral cortex and brainstem.
In: R. Katzman, R. D. Terry and K. L. Bick (eds).
Aging, Alzheimaer's Disease: Senile Dementia and Related Disorders.
pp. 345-352: Raven Press; 1978. - ↑
Swanson, L.W., & Hartman, B.K. (1975).
The central adrenergic system. An immunofluorescence study of the location of cell bodies and their efferent connections in the rat utilizing dopamine-beta-hydroxylase as a marker. The Journal of comparative neurology, 163(4), 467-505. [PubMed:1100685] [WorldCat] [DOI] - ↑
Ma, P.M. (1994).
Catecholaminergic systems in the zebrafish. I. Number, morphology, and histochemical characteristics of neurons in the locus coeruleus. The Journal of comparative neurology, 344(2), 242-55. [PubMed:8077459] [WorldCat] [DOI] - ↑
Aghajanian, G.K., Cedarbaum, J.M., & Wang, R.Y. (1977).
Evidence for norepinephrine-mediated collateral inhibition of locus coeruleus neurons. Brain research, 136(3), 570-7. [PubMed:922502] [WorldCat] [DOI] - ↑
Berod, A., Chat, M., Paut, L., & Tappaz, M. (1984).
Catecholaminergic and GABAergic anatomical relationship in the rat substantia nigra, locus coeruleus, and hypothalamic median eminence: immunocytochemical visualization of biosynthetic enzymes on serial semithin plastic-embedded sections. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society, 32(12), 1331-8. [PubMed:6150057] [WorldCat] [DOI] - ↑
Iijima, K., Ohtomo, K., & Ijima, K. (1988).
Immunocytochemical study using a GABA antiserum for the demonstration of inhibitory neurons in the rat locus ceruleus. The American journal of anatomy, 181(1), 43-52. [PubMed:3348147] [WorldCat] [DOI] - ↑
Léger, L., & Hernandez-Nicaise, M.L. (1980).
The cat locus coeruleus. Light and electron microscopic study of the neuronal somata. Anatomy and embryology, 159(2), 181-98. [PubMed:7447036] [WorldCat] [DOI] - ↑
Crutcher, K.A., & Humbertson, A.O. (1978).
The organization of monoamine neurons within the brainstem of the North American opossum (Didelphis virginiana). The Journal of comparative neurology, 179(1), 195-221. [PubMed:8980724] [WorldCat] [DOI] - ↑
Nakamura, S., & Sakaguchi, T. (1990).
Development and plasticity of the locus coeruleus: a review of recent physiological and pharmacological experimentation. Progress in neurobiology, 34(6), 505-26. [PubMed:2202018] [WorldCat] [DOI] - ↑ 12.0 12.1
Nakamura, S. (1991).
Axonal sprouting of noradrenergic locus coeruleus neurons following repeated stress and antidepressant treatment. Progress in brain research, 88, 587-98. [PubMed:1667552] [WorldCat] [DOI] - ↑
Berridge, C.W., & Waterhouse, B.D. (2003).
The locus coeruleus-noradrenergic system: modulation of behavioral state and state-dependent cognitive processes. Brain research. Brain research reviews, 42(1), 33-84. [PubMed:12668290] - ↑
Aston-Jones, G., Ennis, M., Pieribone, V.A., Nickell, W.T., & Shipley, M.T. (1986).
The brain nucleus locus coeruleus: restricted afferent control of a broad efferent network. Science (New York, N.Y.), 234(4777), 734-7. [PubMed:3775363] [WorldCat] [DOI] - ↑
Ennis, M., & Aston-Jones, G. (1988).
Activation of locus coeruleus from nucleus paragigantocellularis: a new excitatory amino acid pathway in brain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 8(10), 3644-57. [PubMed:3193175] [WorldCat] - ↑
Ennis, M., & Aston-Jones, G. (1989).
GABA-mediated inhibition of locus coeruleus from the dorsomedial rostral medulla. The Journal of neuroscience : the official journal of the Society for Neuroscience, 9(8), 2973-81. [PubMed:2769374] [WorldCat] - ↑
Aston-Jones, G., & Bloom, F.E. (1981).
Norepinephrine-containing locus coeruleus neurons in behaving rats exhibit pronounced responses to non-noxious environmental stimuli. The Journal of neuroscience : the official journal of the Society for Neuroscience, 1(8), 887-900. [PubMed:7346593] [WorldCat] - ↑
Foote, S.L., Aston-Jones, G., & Bloom, F.E. (1980).
Impulse activity of locus coeruleus neurons in awake rats and monkeys is a function of sensory stimulation and arousal. Proceedings of the National Academy of Sciences of the United States of America, 77(5), 3033-7. [PubMed:6771765] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Berridge, C.W., & Foote, S.L. (1991).
Effects of locus coeruleus activation on electroencephalographic activity in neocortex and hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 11(10), 3135-45. [PubMed:1682425] [PMC] [WorldCat] - ↑ 20.0 20.1
Berridge, C.W., Page, M.E., Valentino, R.J., & Foote, S.L. (1993).
Effects of locus coeruleus inactivation on electroencephalographic activity in neocortex and hippocampus. Neuroscience, 55(2), 381-93. [PubMed:8104319] [WorldCat] [DOI] - ↑
Aston-Jones, G., & Cohen, J.D. (2005).
An integrative theory of locus coeruleus-norepinephrine function: adaptive gain and optimal performance. Annual review of neuroscience, 28, 403-50. [PubMed:16022602] [WorldCat] [DOI] - ↑
Lecas, J.C. (2004).
Locus coeruleus activation shortens synaptic drive while decreasing spike latency and jitter in sensorimotor cortex. Implications for neuronal integration. The European journal of neuroscience, 19(9), 2519-30. [PubMed:15128405] [WorldCat] [DOI] - ↑
Bouret, S., & Sara, S.J. (2002).
Locus coeruleus activation modulates firing rate and temporal organization of odour-induced single-cell responses in rat piriform cortex. The European journal of neuroscience, 16(12), 2371-82. [PubMed:12492432] [WorldCat] [DOI] - ↑
Jacobs, B.L. (1986).
Single unit activity of locus coeruleus neurons in behaving animals. Progress in neurobiology, 27(2), 183-94. [PubMed:3529238] [WorldCat] [DOI] - ↑
Basbaum, A.I., & Fields, H.L. (1984).
Endogenous pain control systems: brainstem spinal pathways and endorphin circuitry. Annual review of neuroscience, 7, 309-38. [PubMed:6143527] [WorldCat] [DOI] - ↑
Jones, S.L. (1991).
Descending noradrenergic influences on pain. Progress in brain research, 88, 381-94. [PubMed:1813927] [WorldCat] [DOI] - ↑
Hayashida, K., Obata, H., Nakajima, K., & Eisenach, J.C. (2008).
Gabapentin acts within the locus coeruleus to alleviate neuropathic pain. Anesthesiology, 109(6), 1077-84. [PubMed:19034104] [PMC] [WorldCat] [DOI] - ↑
Pompeiano, O., Manzoni, D., Barnes, C.D., Stampacchia, G., & d'Ascanio, P. (1990).
Responses of locus coeruleus and subcoeruleus neurons to sinusoidal stimulation of labyrinth receptors. Neuroscience, 35(2), 227-48. [PubMed:2381509] [WorldCat] [DOI] - ↑
Nishiike, S., Nakamura, S., Arakawa, S., Takeda, N., & Kubo, T. (1996).
GABAergic inhibitory response of locus coeruleus neurons to caloric vestibular stimulation in rats. Brain research, 712(1), 84-94. [PubMed:8705311] [WorldCat] [DOI]