「トポグラフィックマッピング」の版間の差分
Takeshisakurai (トーク | 投稿記録) 細編集の要約なし |
|||
| (3人の利用者による、間の54版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/sakurai-2-takeshi/ 櫻井 武]</font><br> | |||
''京都大学大学院医学研究科メディカルイノベーションセンター''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年3月2日 原稿完成日:2013年3月25日<br> | |||
担当編集委員:[http://researchmap.jp/noriko1128 大隅 典子](東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)<br> | |||
</div> | |||
英語名:topographic mapping 独:topografische Karte 仏:carte topographique | |||
同義語:神経地図形成 | |||
{{box|text= | |||
トポグラフィックマップとはもともと「地形図」という意味であるが、脳科学においてはトポグラフィックマッピングは「神経地図形成」とも訳され、[[神経細胞]]の[[投射]]が地形図を作製するように特異的な配置をなす過程をいう。例えば感覚系において、ある特定の身体の位置からの情報を担う神経の[[軸索]]が、ある特定の配置をその系路内で取り、脳内のある特定の標的に到達した際に、その投射が標的領域内で特定の配置を取る過程のことである。トポグラフィクマッピングは[[感覚系]]での情報処理の基本となる構造を形成するものである。また、脳の[[運動野]]のある位置に存在する神経細胞からの軸索がある特定の身体の位置に投射する場合、脳内の運動野でトポグラフィックな分布があるといえる。ここでは、トポグラフィックマップの神経機能における意義とその分子機構を歴史的な経緯をふまえて感覚系、特に[[視覚]]系と[[嗅覚]]系を中心にまとめる。 | |||
}} | |||
== | == トポグラフィックマッピングとその意義 == | ||
[[Image:脳科学辞典7.png|thumb|<b>図1. Wilder Penfieldによるcortical homunculus</b><br />それぞれの皮質の領域がそれぞれの身体の部分の感覚に対応している。<br />Wilder Penfieldの原図より改変。]] | |||
トポグラフィックマップの一番単純な例は、[[脊髄]]から[[視床]]へ上行する[[脊髄視床路]]で[[末梢]]から脊髄に入る高さによってその系路内での配置が決まるというものであろう。また、有名なものにはモントリオールの[[ペンフィールド|Wilder Penfield]]による[[大脳皮質]]の[[感覚野]]と運動野におけるどの部位が体のどの部位の感覚、運動に対応するかを人の脳でマッピングしたものがある([[Cortical homunculus]])(図1)。これは脳のどこを刺激すると体のどこが動くか、また、脳のどこを刺激すると体のどこが感じたように感じるかを脳外科手術中の患者の脳でマッピングしたもので、1951年に出版されたこのデータは現在でもそのまま通用する正確なものである。 | |||
感覚系のトポグラフィックマッピングには大きく分けて2つの過程がある。一つは神経細胞の軸索が標的にたどり着き標的内でトポグラフィックに配置する、[[神経活動]]に依存しない(様々な標的認識分子による)過程で、もう一つはその後に行われる標的内での神経活動依存性の配置形成の(ひいてはシナプス形成の)リファインメントの過程である(神経活動依存性ファインチューニング)。このマップは発達段階において形成され、その形成時期は神経系の可塑性の能力の有無とも関係する。 | |||
高等動物の感覚系において、外界から入力される感覚情報は脳内の特定の領域内において2次元上の神経細胞の[[発火]]パターンへと変換され、これが感覚情報の処理の基盤となる。例えば視覚の場合一つの重要な情報は位置情報であるが、視覚フィールド内のある位置における情報はその視覚フィールドを受け持つ[[網膜]]の中のある視細胞によって受け取られ、また、網膜のそれぞれの[[視細胞]]の情報は脳の特異的な細胞へ伝達される。それによって、網膜内での位置関係(つまりは視覚フィールドにおける位置関係)が脳内での位置関係に転換され、視覚フィールドの空間における位置情報を視覚野で認識することができる。これをするためにそれぞれの視細胞につながる網膜[[神経節]]細胞の軸索が視覚系においてトポグラフィックに投射、配置する事が必要となる。これを行う過程がトポグラフィックマッピングであり、その結果、脳内にトポグラフィックなマップができる。さらに両眼視ができる動物では、両方の眼から入った視野内の同じ地点からの情報は脳内の(同じ側の)似たような領域に集束する必要がある。それについてもトポグラフィックなマッピングが必要で、それによって形成される両眼視によってさらに[[立体視]]も可能となる。また、視覚によって得られた情報を認知するにあたって、視覚野からの脳内での行き先によって認知される内容が異なるので(例えばwhatとhow)、この視覚情報の認知の基本に視覚野でのトポグラフィックマッピングがあるとも考えられる([[嗅覚系]]ではある特定の匂いがそれによって引き起こされる特定の行動に結びつく基本にトポグラフィックマップがある。詳しくは嗅覚系の項を参照のこと)。先に述べたように視覚系においても網膜の神経細胞の活動なしに起こる過程と網膜の神経細胞の活動性に依存して起こる過程があり、この両者によって発達段階において視覚系のトポグラフィックマップは形成される。 | |||
== | == 分子機構 == | ||
[[Image:脳科学事典03.jpg|thumb|right|250px| | [[Image:脳科学事典03.jpg|thumb|right|250px|<b>図2. トポグラフィックマッピングの模式図</b><br />網膜内には耳側で高く鼻側で低い濃度勾配を示す分子が存在し(赤)、網膜からの神経線維を受ける視蓋/上丘には後側で高く前側で低い濃度勾配を示す分子が存在する(青)。網膜の耳側からの軸索は(赤)、視蓋/上丘での分子を認識し、その分子を避ける様に前側に投射する。それに対して、耳側からの軸索は(白)、視蓋/上丘での分子に関係なく後側に投射できる。これによって、視覚フィールドにおける位置情報が視蓋/上丘においても位置情報として保存される。図3も参照。]] | ||
[[Image:脳科学辞典6-2.png|thumb|250px|<b>図3. ストライプアッセイによる視蓋の前側と後側で網膜神経節細胞の軸索に対する影響の違い</b><br />ニワトリの視蓋の前側(A)と後側(P)から調整した膜画分をストライプとして配置した基質の上で網膜の片を培養すると、鼻側の網膜はどちらの上にも突起を伸ばすが、耳側の網膜は前側のストライプの上に突起を伸ばす。前側と後側の膜画分を熱処理して(+)それと熱処理しない者とストライプを形成すると、前側を熱処理しても耳側の網膜片からの突起伸長のパターンには影響がなく前側の上にのみ突起を伸ばすが、後側を熱処理すると突起はどちらの上にも伸びる。この結果は後側に耳側網膜からの突起伸長を阻害する物質があることを示唆する。]] | |||
=== 化学親和説の提唱 === | |||
脳内におけるトポグラフィックなマップを示唆する古典的な実験としては1940-50年代の[[wj:ロジャー・スペリー|Roger Sperry]]による[[wj:カエル|カエル]]の目を180度回転した後の神経再生によってカエルの視覚がどうなるかを見たものがある。カエルの目を180度回すとカエルは上下逆転した形で視覚情報を認識するようになる。これは網膜神経節細胞の軸索が再生する際に元々つながっていた標的につながることによって、回転した後の網膜の上と下に位置する視細胞からの位置情報が脳内での位置では上下逆転するために起こる。Sperryはこういった一連の視覚系の操作の実験の結果から、投射する軸索と標的の細胞に分子のタグがついていて、その間の特異的相互作用によって神経細胞間の結合が決定されトポグラフィックマップの形成に関与すると提唱した<ref><pubmed>14077501</pubmed></ref>。また、こういった分子のタグは軸索と標的の両方で相補的な濃度勾配を形成していて、それで最終的にコネクションの形成される位置が決定されるのではないかと推測した(詳しくは[[化学親和説]]の項を参照されたい)。 | |||
=== 化学親和の実体 === | |||
その流れを汲んで、その後視覚系を中心にトポグラフィックマッピングのメカニズムを追求する努力がなされた。 | |||
[[wj:ニワトリ|ニワトリ]]の眼において耳側と鼻側の網膜神経節細胞はそれぞれ[[視蓋]]の前側と後側に軸索を送り、眼の中の耳鼻軸に沿った位置情報は視蓋の中で[[前後軸]]として保存される(図2)。これは眼の中で網膜神経節細胞に耳側と鼻側に軸に沿った分子の濃度勾配があり、それに対応する分子の濃度勾配が標的である視蓋の前後軸にもあり、その相互作用によって、それぞれの網膜神経節細胞の軸索が視蓋で停止する場所が決定されると考えられた。 | |||
[[ | |||
[[wj:チュービンゲン|チュービンゲン]]の[[w:de:Friedrich Bonhoeffer|Friedrich Bonhoeffer]]のグループは生化学的に視蓋での物質的基盤を明らかにすべく以下の様な実験を行った。彼らは、もし、視蓋に前後軸で濃度勾配を呈して発現している物質があってそれが耳側と鼻側の網膜神経節細胞の軸索の投射に重要であるならば、視蓋の前側と後側から調整した膜画分に対する耳側と鼻側の網膜神経節細胞の軸索の反応が変わるであろうと考え、これらの膜画分をインビトロでの基質としてストライプ状に配置した(ストライプアッセイ)。その上で網膜の神経節細胞を培養すると、耳側の細胞の軸索は前側から調整した膜画分の上を好んで成長するのに対して、鼻側の細胞の軸索は前側と後側からの画分で差を示さない事、そして、前側と後側のストライプをそれぞれ熱処理することによって、耳側の軸索は特に前側の膜画分を好むわけではなく、実は後側の膜画分を避ける事が示された(図3)。この事は視蓋の後側に高く前側に低く発現されている物質があり、それが耳側で強く発現し鼻側で弱く発現する分子によって認識される事によって網膜神経節細胞の軸索の視蓋内での位置が決まるという事を示唆する(図2)<ref><pubmed>3503693</pubmed></ref><ref><pubmed>3503703</pubmed></ref>。 | |||
このアッセイを利用してBonhoefferのグループは1990年に生化学的にニワトリの視蓋の後側に発現しているトポグラフィックマッピングに関与している分子を精製した<ref><pubmed>2171592</pubmed></ref>。RAGSと呼ばれた25kDaのこの分子はPI-PLC処理によって膜から外れることから[[GPIリンカー|GPI結合性]]の膜結合タンパク質であることがわかっていた。 | |||
=== クローニングによる分子同定 === | |||
[[ | その後、彼のグループのUwe Drescherらが遺伝子クローニングを含めて更なる分子の同定を試みていた。その頃、ファミリーの非常に多い新しい[[チロシンキナーゼ]]分子(後にEphとよばれる)が同定され、それについての研究が様々なグループで行われていた。 | ||
中でも[[w:Regeneron|レジェネロン]]のGeorge Yancopoulosのグループ(Nick Galeら)はこのキナーゼ(Ephにあたる)のファミリーの同定とそのリガンド(ephrinにあたる)の解明を発現クローニングの手法を用いて精力的に行っていた。一方Philip Lederの弟子にあたるJohn Flanaganもハーバードに自分のラボを持った頃で、プロジェクトの一つとして[[Mek4]]([[EphA3]]にあたる)と[[Sek]]([[EphA4]]にあたる)とよばれる上記の[[キナーゼ]]ファミリーに対する[[リガンド]]の発現クローニングを行っていた。それで1994年にとれてきた分子が[[ELF-1]]([[EphrinA2]]にあたる)で、この分子はGPI結合性の膜結合型のタンパク質であることがわかっていた<ref><pubmed>7522971</pubmed></ref><ref><pubmed>3503703</pubmed></ref>。その解析の途中でMek4とELF-1がニワトリ胚の網膜と視蓋で濃度勾配を呈して発現しており、しかもその勾配が相補的であることに気がついた彼のグループは1995年にこのEphA3-ephrinA2がBonhoefferのグループが解析を行ってきたSperryのchemoaffnity theoryを担う分子メカニズムであるという論文を発表した<ref><pubmed>3503693</pubmed></ref><ref><pubmed>7634327</pubmed></ref>。その論文はDrescherらのRAGSがephrinAのグループに属する分子(ephrinA5にあたる)であるという論文と同時に発表されている<ref><pubmed>3503693</pubmed></ref><ref><pubmed>7634326</pubmed></ref>。 | |||
その後、彼ら以外にも様々なグループ(例えばRudiger KleinやDennis O'learyら)が参画しニワトリだけでなく[[マウス]]でもこのEph-ephrinを介したメカニズムが視覚系におけるトポグラフィックマッピングに働いていることが証明された(詳しくは[[エフリン]]、[[Eph受容体]]の項を参照されたい)。 | |||
== 各論 == | |||
= | [[Image:脳科学事典04.jpg|thumb|right|250px|<b>図4. 視覚系におけるトポグラフィックマップ形成の過程とそのメカニズムの模式図</b><br />網膜からの軸索は視蓋/上丘に達すると、本来の到達領域(白)をオーバーシュートする。その後、トポグラフィックシグナルにより、軸索は分枝をだす。そして、その分枝はさらにトポグラフィックシグナルによって、最終目的地に集束する。最後に、神経活動に依存したリファインメントが起こり、網膜からの神経繊維は最終到達エリアに集束する。<br>McLaughlinとO’leary<ref name=McLaughlin_Oleary />による図を改変。]] | ||
上記のような歴史的な経緯もあり、トポグラフィックマッピングについては視覚系において一番研究が進んでいる。以下、いくつかの系について簡単にまとめる。詳細は文献を参照されたい。 | |||
== | === 視覚系 === | ||
== | ==== 網膜-視蓋/上丘投射 ==== | ||
網膜から視蓋/[[上丘]]への投射がトポグラフィックになっていることはよく知られている。この形成には幾つかの過程があり、様々な分子が関与しているが、基本的にはSperryの仮説の様に分子が濃度勾配を呈して発現していることによる。まず、網膜の視神経細胞の軸索は視蓋/上丘に入り、将来の標的位置よりも後方へ越えて、伸長することが知られている。その後、軸索が網膜内の耳側−鼻側の軸内のどこの位置からでているかで視蓋/上丘での前後軸に沿った正しい位置で、EphAs-EphrinAsの濃度勾配によって、軸索の中間部からの枝分かれ形成(interstitial branching)がおこり、その後その枝分かれが、今度は網膜内の背側−腹側軸によって視蓋/上丘の内側−外側の軸に沿った、EphAs-EphrinAsとは異なる分子の濃度勾配(EphBs-EphrinBs)で、正しい最終集結点に導かれる。ここまでは神経活動に依存せずにおこる。その後、更なるマップのリファインメント(標的領域がさらに集束する)が起こるがこれには神経活動が必要であり、ウェーブ状に発生する網膜内での自発的な電気活動の存在が重要であることが示されている(図4)<ref name=McLaughlin_Oleary><pubmed>16022599</pubmed></ref>。 | |||
こういった過程に関わる分子の濃度勾配に関してはカウンターバランスを示す2つの濃度勾配が必要という考え方と、1つの濃度勾配がプッシュとプルと両方やれるという考え方とある。その他、もう一つの可能性として、軸索同士が競合するという可能性もあり、最近の知見では軸索同士の競合も視覚系におけるトポグラフィックマッピングに必要であるとされている<ref><pubmed>22065784</pubmed></ref>。 | |||
==== 外側膝状体-大脳皮質視覚野投射 ==== | |||
[[外側膝状体]]と大脳皮質の視覚野でもトポグラフィックマップは形成されているがその分子メカニズムは視蓋/上丘ほどは明らかにされていない。ここで一つ注意しておきたいのは上記のニワトリの系は両眼視をする系ではないということである。したがって、Eph-エフリンによる化学親和のメカニズムは対側に投射する軸索に当てはまるものである。マウスでは5%くらいの網膜からの投射が同側で、したがって外側膝状体では対側の眼からの軸索の投射する場所と同側の眼からの軸索の投射する場所が存在し、結果として同じ視野フィールドからの情報が同じ側の視覚中枢に集束することになり、ヒトほど顕著ではないものの両眼視をすることができる。この場合、対側からの投射についてはニワトリと同じ様なメカニズムが当てはまると考えられるが、同側からの投射については対側と同じメカニズム(Eph-エフリン)が働くのかそれとも全く異なったメカニズムなのかについてはあまりわかっていない。また、マウスにおいては同側の投射は最初は領域内にある程度広がっているが発達の段階で最終的な標的に集束することが知られているが、この集束する過程には神経活動依存性のメカニズムが働いていることは明らかにされている(またこの過程に何らかの形でEph-エフリンが関与していることも示されている<ref><pubmed>16025107</pubmed></ref>)。ヒトでは50%の投射が同側からであり、したがって上記で推測される対側の投射のメカニズム以外に、同側のトポグラフィックマッピングのメカニズム及び同側と対側の情報の統合のメカニズムが何らかの形で必要である。 | |||
一方、外側膝状体と大脳皮質の視覚野の系でよく研究されているのはこれらの視覚中枢における右目と左目から投射を受けている部位の交互なストライプ状の配置である。大脳皮質においてはこのストライプ状にならんだカラムを[[優位視覚性円柱]] ocular dominance columnという。[[wj:ネコ|ネコ]]で片方の眼を視覚の発達段階に閉じることでこのストライプのサイズに変化を与えることができるのでこのカラム形成には神経活動依存的なメカニズムが関与していることと考えられる。 | |||
トポグラフィックマップの形成後はそれを変えることは難しいが、形成の前に脳の領域ごとに[[可塑性]]が持続する時期があり、それを[[臨界期]]と呼ぶ。この時期は神経活動依存的な修飾が可能な時期であり、この時期内での神経活動の変化は脳内でのマップのパターンを変えることができる。例えば、臨界期における神経活動の変化は上記の優位視覚性円柱(すなわちトポグラフィカルマップ)のパターンを変える(例えば右目と左目のカラムでサイズが変わる)(詳しくは[[臨界期]]及び[[優位視覚性円柱]]の項を参照)。 | |||
=== 嗅覚系 === | |||
[[Image:脳科学事典05.jpg|thumb|right|250px|<b>図5. 嗅覚系におけるトポグラフィックマップ形成の過程とそのメカニズムの模式図</b><br />嗅球の前後軸に沿ったトポグラフィーは、嗅上皮細胞で発現されている嗅覚受容体の違いによって形成されるSema3A/Neuropilin1の発現の差によって嗅球に達する前にソーティングされる。嗅球の背側腹側軸に沿ったトポグラフィーは、まず最初に嗅球に到着する線維の配置がrobo2/slit1の発現パターンによって背側に決定された後、その軸索内で発現の高いSema3Fによって、後から到着するNeuropilin2を強く発現する線維の位置を腹側に規定する。その後、神経活動に依存して嗅上皮細胞内で接着因子や反発因子の発現が制御され、それによって糸球体がきっちりとセグレゲートする。<br>MoriとSakano<ref name=sakano />による図を改変。]] | |||
嗅覚系においてもトポグラフィックマッピングが行われることが知られているが、坂野らのグループによる精力的な研究によりその詳細な分子メカニズムが明らかにされてきている<ref name=sakano><pubmed>21469960</pubmed></ref>。匂いは[[嗅覚受容体]]で感知されるが、一つの嗅上皮細胞は一種類の嗅覚受容体を発現している。しかしながら、同じ嗅覚受容体を発現する細胞の嗅上皮内における分布はバラバラであるので、同じ嗅覚受容体を発現する細胞からの情報は嗅球の中の同じ糸球体に収束する必要がある。嗅覚受容体はヒトでは約350種類、マウスでは約1000種類の嗅覚受容体が存在し、[[嗅球]]上に嗅覚受容体の数に対応した糸球体を素子とする2次元マップが形成される。 | |||
嗅球の中での嗅上皮細胞の軸索の配置は前後軸及び背側腹側の軸で決定されているが、背側腹側の軸での配列は嗅上皮内での配置によって決定される。前後軸に関してはどの嗅覚受容体が発現されているかによって産生される[[cAMP]]の量が変わり、これによって[[Sema3A]]/[[Neuropilin1]]のカウンターバランスを示す濃度勾配が[[嗅上皮細胞]]の軸索内に発生し、これによって標的にたどり着く前に軸索がソーティングされることによって、前後軸のどこに軸索が到着するかが決定される<ref name=sakano />。背側腹側に関しては、まず、嗅上皮内での[[Robo2]]の濃度勾配と嗅球内での[[Slit1]]の濃度勾配よって[[パイオニア軸索]]の嗅球での配置が背側に決定され、その後、嗅上皮細胞の軸索内での[[Sema3F]]/[[Neuropilin2]]のカウンターバランスを示す濃度勾配によって嗅球内での背側腹側の位置が決まる<ref name=sakano />。つまり、後から到着する軸索は先に到着した背側の軸索が発現するSema3Fによってより腹側に配置される(図5)。嗅覚の場合に特徴的なのは、軸索ー軸索の相互作用が非常に重要な役割を果たしていることである。 これはSperryのモデルとは少し異なり、嗅覚系では軸索間で自律的に制御されているということを示しており、また、嗅球がなくてもある程度トポグラフィックマップが形成されるという事実とも合致する。視覚系においては位置情報以外は(網膜のどこからくるか以外は)それぞれの軸索で同じ情報が伝えられているが、嗅覚系では違う嗅覚受容体の情報がそれぞれの軸索によって伝えられているところが異なるのかもしれない。 | |||
こういった過程で軸索が標的位置に到達しシナプスを形成したあと、嗅覚系でも視覚系と同様に神経活動依存的なリファインメントがおこる(隣同士の[[糸球体]]がきっちりとセグレゲートする)。この過程においては神経活動依存的にホモフィリック結合をする[[細胞接着因子]][[Kirrel]]2/3と接着依存性の反発因子である[[EphA5]]-[[EphrinA5]]がやはり濃度勾配を呈する形で発現し、それによって糸球体が相互にセグレゲートする(図3)<ref name=sakano />。 | |||
嗅覚系におけるトポグラフィックマッピングは様々な嗅覚受容体からの情報を処理するのに必要であるだけでなく、その匂いによって誘発される動物の行動を規定するのに重要であり、嗅球から脳のどこにつながるかということとトポグラフィックマッピングは密接に関わっている。詳細は[[嗅覚]]系の項を参照されたい。 | |||
=== その他 === | |||
その他、[[聴覚]]系(音の周波数情報)、[[体性感覚]]系(身体における位置情報、例えばマウスやラットの髭と[[バレル皮質]]の系)、[[味覚]]系(違う味覚物質を感受する受容体からの情報)、及び運動系(身体における位置情報)などのトポグラフィックマップが研究されている。 | |||
== 関連項目 == | |||
*[[標的認識]] | |||
*[[化学親和説]] | |||
*[[エフリン]] | |||
*[[Eph受容体]] | |||
*[[ゾーン構造]] | |||
== 参考文献 == | |||
<references /> | |||
2023年10月1日 (日) 23:03時点における版
櫻井 武
京都大学大学院医学研究科メディカルイノベーションセンター
DOI:10.14931/bsd.581 原稿受付日:2012年3月2日 原稿完成日:2013年3月25日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:topographic mapping 独:topografische Karte 仏:carte topographique
同義語:神経地図形成
トポグラフィックマップとはもともと「地形図」という意味であるが、脳科学においてはトポグラフィックマッピングは「神経地図形成」とも訳され、神経細胞の投射が地形図を作製するように特異的な配置をなす過程をいう。例えば感覚系において、ある特定の身体の位置からの情報を担う神経の軸索が、ある特定の配置をその系路内で取り、脳内のある特定の標的に到達した際に、その投射が標的領域内で特定の配置を取る過程のことである。トポグラフィクマッピングは感覚系での情報処理の基本となる構造を形成するものである。また、脳の運動野のある位置に存在する神経細胞からの軸索がある特定の身体の位置に投射する場合、脳内の運動野でトポグラフィックな分布があるといえる。ここでは、トポグラフィックマップの神経機能における意義とその分子機構を歴史的な経緯をふまえて感覚系、特に視覚系と嗅覚系を中心にまとめる。
トポグラフィックマッピングとその意義
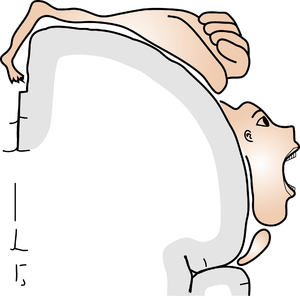
それぞれの皮質の領域がそれぞれの身体の部分の感覚に対応している。
Wilder Penfieldの原図より改変。
トポグラフィックマップの一番単純な例は、脊髄から視床へ上行する脊髄視床路で末梢から脊髄に入る高さによってその系路内での配置が決まるというものであろう。また、有名なものにはモントリオールのWilder Penfieldによる大脳皮質の感覚野と運動野におけるどの部位が体のどの部位の感覚、運動に対応するかを人の脳でマッピングしたものがある(Cortical homunculus)(図1)。これは脳のどこを刺激すると体のどこが動くか、また、脳のどこを刺激すると体のどこが感じたように感じるかを脳外科手術中の患者の脳でマッピングしたもので、1951年に出版されたこのデータは現在でもそのまま通用する正確なものである。
感覚系のトポグラフィックマッピングには大きく分けて2つの過程がある。一つは神経細胞の軸索が標的にたどり着き標的内でトポグラフィックに配置する、神経活動に依存しない(様々な標的認識分子による)過程で、もう一つはその後に行われる標的内での神経活動依存性の配置形成の(ひいてはシナプス形成の)リファインメントの過程である(神経活動依存性ファインチューニング)。このマップは発達段階において形成され、その形成時期は神経系の可塑性の能力の有無とも関係する。
高等動物の感覚系において、外界から入力される感覚情報は脳内の特定の領域内において2次元上の神経細胞の発火パターンへと変換され、これが感覚情報の処理の基盤となる。例えば視覚の場合一つの重要な情報は位置情報であるが、視覚フィールド内のある位置における情報はその視覚フィールドを受け持つ網膜の中のある視細胞によって受け取られ、また、網膜のそれぞれの視細胞の情報は脳の特異的な細胞へ伝達される。それによって、網膜内での位置関係(つまりは視覚フィールドにおける位置関係)が脳内での位置関係に転換され、視覚フィールドの空間における位置情報を視覚野で認識することができる。これをするためにそれぞれの視細胞につながる網膜神経節細胞の軸索が視覚系においてトポグラフィックに投射、配置する事が必要となる。これを行う過程がトポグラフィックマッピングであり、その結果、脳内にトポグラフィックなマップができる。さらに両眼視ができる動物では、両方の眼から入った視野内の同じ地点からの情報は脳内の(同じ側の)似たような領域に集束する必要がある。それについてもトポグラフィックなマッピングが必要で、それによって形成される両眼視によってさらに立体視も可能となる。また、視覚によって得られた情報を認知するにあたって、視覚野からの脳内での行き先によって認知される内容が異なるので(例えばwhatとhow)、この視覚情報の認知の基本に視覚野でのトポグラフィックマッピングがあるとも考えられる(嗅覚系ではある特定の匂いがそれによって引き起こされる特定の行動に結びつく基本にトポグラフィックマップがある。詳しくは嗅覚系の項を参照のこと)。先に述べたように視覚系においても網膜の神経細胞の活動なしに起こる過程と網膜の神経細胞の活動性に依存して起こる過程があり、この両者によって発達段階において視覚系のトポグラフィックマップは形成される。
分子機構

網膜内には耳側で高く鼻側で低い濃度勾配を示す分子が存在し(赤)、網膜からの神経線維を受ける視蓋/上丘には後側で高く前側で低い濃度勾配を示す分子が存在する(青)。網膜の耳側からの軸索は(赤)、視蓋/上丘での分子を認識し、その分子を避ける様に前側に投射する。それに対して、耳側からの軸索は(白)、視蓋/上丘での分子に関係なく後側に投射できる。これによって、視覚フィールドにおける位置情報が視蓋/上丘においても位置情報として保存される。図3も参照。
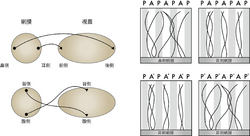
ニワトリの視蓋の前側(A)と後側(P)から調整した膜画分をストライプとして配置した基質の上で網膜の片を培養すると、鼻側の網膜はどちらの上にも突起を伸ばすが、耳側の網膜は前側のストライプの上に突起を伸ばす。前側と後側の膜画分を熱処理して(+)それと熱処理しない者とストライプを形成すると、前側を熱処理しても耳側の網膜片からの突起伸長のパターンには影響がなく前側の上にのみ突起を伸ばすが、後側を熱処理すると突起はどちらの上にも伸びる。この結果は後側に耳側網膜からの突起伸長を阻害する物質があることを示唆する。
化学親和説の提唱
脳内におけるトポグラフィックなマップを示唆する古典的な実験としては1940-50年代のRoger Sperryによるカエルの目を180度回転した後の神経再生によってカエルの視覚がどうなるかを見たものがある。カエルの目を180度回すとカエルは上下逆転した形で視覚情報を認識するようになる。これは網膜神経節細胞の軸索が再生する際に元々つながっていた標的につながることによって、回転した後の網膜の上と下に位置する視細胞からの位置情報が脳内での位置では上下逆転するために起こる。Sperryはこういった一連の視覚系の操作の実験の結果から、投射する軸索と標的の細胞に分子のタグがついていて、その間の特異的相互作用によって神経細胞間の結合が決定されトポグラフィックマップの形成に関与すると提唱した[1]。また、こういった分子のタグは軸索と標的の両方で相補的な濃度勾配を形成していて、それで最終的にコネクションの形成される位置が決定されるのではないかと推測した(詳しくは化学親和説の項を参照されたい)。
化学親和の実体
その流れを汲んで、その後視覚系を中心にトポグラフィックマッピングのメカニズムを追求する努力がなされた。
ニワトリの眼において耳側と鼻側の網膜神経節細胞はそれぞれ視蓋の前側と後側に軸索を送り、眼の中の耳鼻軸に沿った位置情報は視蓋の中で前後軸として保存される(図2)。これは眼の中で網膜神経節細胞に耳側と鼻側に軸に沿った分子の濃度勾配があり、それに対応する分子の濃度勾配が標的である視蓋の前後軸にもあり、その相互作用によって、それぞれの網膜神経節細胞の軸索が視蓋で停止する場所が決定されると考えられた。
チュービンゲンのFriedrich Bonhoefferのグループは生化学的に視蓋での物質的基盤を明らかにすべく以下の様な実験を行った。彼らは、もし、視蓋に前後軸で濃度勾配を呈して発現している物質があってそれが耳側と鼻側の網膜神経節細胞の軸索の投射に重要であるならば、視蓋の前側と後側から調整した膜画分に対する耳側と鼻側の網膜神経節細胞の軸索の反応が変わるであろうと考え、これらの膜画分をインビトロでの基質としてストライプ状に配置した(ストライプアッセイ)。その上で網膜の神経節細胞を培養すると、耳側の細胞の軸索は前側から調整した膜画分の上を好んで成長するのに対して、鼻側の細胞の軸索は前側と後側からの画分で差を示さない事、そして、前側と後側のストライプをそれぞれ熱処理することによって、耳側の軸索は特に前側の膜画分を好むわけではなく、実は後側の膜画分を避ける事が示された(図3)。この事は視蓋の後側に高く前側に低く発現されている物質があり、それが耳側で強く発現し鼻側で弱く発現する分子によって認識される事によって網膜神経節細胞の軸索の視蓋内での位置が決まるという事を示唆する(図2)[2][3]。
このアッセイを利用してBonhoefferのグループは1990年に生化学的にニワトリの視蓋の後側に発現しているトポグラフィックマッピングに関与している分子を精製した[4]。RAGSと呼ばれた25kDaのこの分子はPI-PLC処理によって膜から外れることからGPI結合性の膜結合タンパク質であることがわかっていた。
クローニングによる分子同定
その後、彼のグループのUwe Drescherらが遺伝子クローニングを含めて更なる分子の同定を試みていた。その頃、ファミリーの非常に多い新しいチロシンキナーゼ分子(後にEphとよばれる)が同定され、それについての研究が様々なグループで行われていた。
中でもレジェネロンのGeorge Yancopoulosのグループ(Nick Galeら)はこのキナーゼ(Ephにあたる)のファミリーの同定とそのリガンド(ephrinにあたる)の解明を発現クローニングの手法を用いて精力的に行っていた。一方Philip Lederの弟子にあたるJohn Flanaganもハーバードに自分のラボを持った頃で、プロジェクトの一つとしてMek4(EphA3にあたる)とSek(EphA4にあたる)とよばれる上記のキナーゼファミリーに対するリガンドの発現クローニングを行っていた。それで1994年にとれてきた分子がELF-1(EphrinA2にあたる)で、この分子はGPI結合性の膜結合型のタンパク質であることがわかっていた[5][6]。その解析の途中でMek4とELF-1がニワトリ胚の網膜と視蓋で濃度勾配を呈して発現しており、しかもその勾配が相補的であることに気がついた彼のグループは1995年にこのEphA3-ephrinA2がBonhoefferのグループが解析を行ってきたSperryのchemoaffnity theoryを担う分子メカニズムであるという論文を発表した[7][8]。その論文はDrescherらのRAGSがephrinAのグループに属する分子(ephrinA5にあたる)であるという論文と同時に発表されている[9][10]。
その後、彼ら以外にも様々なグループ(例えばRudiger KleinやDennis O'learyら)が参画しニワトリだけでなくマウスでもこのEph-ephrinを介したメカニズムが視覚系におけるトポグラフィックマッピングに働いていることが証明された(詳しくはエフリン、Eph受容体の項を参照されたい)。
各論

網膜からの軸索は視蓋/上丘に達すると、本来の到達領域(白)をオーバーシュートする。その後、トポグラフィックシグナルにより、軸索は分枝をだす。そして、その分枝はさらにトポグラフィックシグナルによって、最終目的地に集束する。最後に、神経活動に依存したリファインメントが起こり、網膜からの神経繊維は最終到達エリアに集束する。
McLaughlinとO’leary[11]による図を改変。
上記のような歴史的な経緯もあり、トポグラフィックマッピングについては視覚系において一番研究が進んでいる。以下、いくつかの系について簡単にまとめる。詳細は文献を参照されたい。
視覚系
網膜-視蓋/上丘投射
網膜から視蓋/上丘への投射がトポグラフィックになっていることはよく知られている。この形成には幾つかの過程があり、様々な分子が関与しているが、基本的にはSperryの仮説の様に分子が濃度勾配を呈して発現していることによる。まず、網膜の視神経細胞の軸索は視蓋/上丘に入り、将来の標的位置よりも後方へ越えて、伸長することが知られている。その後、軸索が網膜内の耳側−鼻側の軸内のどこの位置からでているかで視蓋/上丘での前後軸に沿った正しい位置で、EphAs-EphrinAsの濃度勾配によって、軸索の中間部からの枝分かれ形成(interstitial branching)がおこり、その後その枝分かれが、今度は網膜内の背側−腹側軸によって視蓋/上丘の内側−外側の軸に沿った、EphAs-EphrinAsとは異なる分子の濃度勾配(EphBs-EphrinBs)で、正しい最終集結点に導かれる。ここまでは神経活動に依存せずにおこる。その後、更なるマップのリファインメント(標的領域がさらに集束する)が起こるがこれには神経活動が必要であり、ウェーブ状に発生する網膜内での自発的な電気活動の存在が重要であることが示されている(図4)[11]。
こういった過程に関わる分子の濃度勾配に関してはカウンターバランスを示す2つの濃度勾配が必要という考え方と、1つの濃度勾配がプッシュとプルと両方やれるという考え方とある。その他、もう一つの可能性として、軸索同士が競合するという可能性もあり、最近の知見では軸索同士の競合も視覚系におけるトポグラフィックマッピングに必要であるとされている[12]。
外側膝状体-大脳皮質視覚野投射
外側膝状体と大脳皮質の視覚野でもトポグラフィックマップは形成されているがその分子メカニズムは視蓋/上丘ほどは明らかにされていない。ここで一つ注意しておきたいのは上記のニワトリの系は両眼視をする系ではないということである。したがって、Eph-エフリンによる化学親和のメカニズムは対側に投射する軸索に当てはまるものである。マウスでは5%くらいの網膜からの投射が同側で、したがって外側膝状体では対側の眼からの軸索の投射する場所と同側の眼からの軸索の投射する場所が存在し、結果として同じ視野フィールドからの情報が同じ側の視覚中枢に集束することになり、ヒトほど顕著ではないものの両眼視をすることができる。この場合、対側からの投射についてはニワトリと同じ様なメカニズムが当てはまると考えられるが、同側からの投射については対側と同じメカニズム(Eph-エフリン)が働くのかそれとも全く異なったメカニズムなのかについてはあまりわかっていない。また、マウスにおいては同側の投射は最初は領域内にある程度広がっているが発達の段階で最終的な標的に集束することが知られているが、この集束する過程には神経活動依存性のメカニズムが働いていることは明らかにされている(またこの過程に何らかの形でEph-エフリンが関与していることも示されている[13])。ヒトでは50%の投射が同側からであり、したがって上記で推測される対側の投射のメカニズム以外に、同側のトポグラフィックマッピングのメカニズム及び同側と対側の情報の統合のメカニズムが何らかの形で必要である。
一方、外側膝状体と大脳皮質の視覚野の系でよく研究されているのはこれらの視覚中枢における右目と左目から投射を受けている部位の交互なストライプ状の配置である。大脳皮質においてはこのストライプ状にならんだカラムを優位視覚性円柱 ocular dominance columnという。ネコで片方の眼を視覚の発達段階に閉じることでこのストライプのサイズに変化を与えることができるのでこのカラム形成には神経活動依存的なメカニズムが関与していることと考えられる。
トポグラフィックマップの形成後はそれを変えることは難しいが、形成の前に脳の領域ごとに可塑性が持続する時期があり、それを臨界期と呼ぶ。この時期は神経活動依存的な修飾が可能な時期であり、この時期内での神経活動の変化は脳内でのマップのパターンを変えることができる。例えば、臨界期における神経活動の変化は上記の優位視覚性円柱(すなわちトポグラフィカルマップ)のパターンを変える(例えば右目と左目のカラムでサイズが変わる)(詳しくは臨界期及び優位視覚性円柱の項を参照)。
嗅覚系

嗅球の前後軸に沿ったトポグラフィーは、嗅上皮細胞で発現されている嗅覚受容体の違いによって形成されるSema3A/Neuropilin1の発現の差によって嗅球に達する前にソーティングされる。嗅球の背側腹側軸に沿ったトポグラフィーは、まず最初に嗅球に到着する線維の配置がrobo2/slit1の発現パターンによって背側に決定された後、その軸索内で発現の高いSema3Fによって、後から到着するNeuropilin2を強く発現する線維の位置を腹側に規定する。その後、神経活動に依存して嗅上皮細胞内で接着因子や反発因子の発現が制御され、それによって糸球体がきっちりとセグレゲートする。
MoriとSakano[14]による図を改変。
嗅覚系においてもトポグラフィックマッピングが行われることが知られているが、坂野らのグループによる精力的な研究によりその詳細な分子メカニズムが明らかにされてきている[14]。匂いは嗅覚受容体で感知されるが、一つの嗅上皮細胞は一種類の嗅覚受容体を発現している。しかしながら、同じ嗅覚受容体を発現する細胞の嗅上皮内における分布はバラバラであるので、同じ嗅覚受容体を発現する細胞からの情報は嗅球の中の同じ糸球体に収束する必要がある。嗅覚受容体はヒトでは約350種類、マウスでは約1000種類の嗅覚受容体が存在し、嗅球上に嗅覚受容体の数に対応した糸球体を素子とする2次元マップが形成される。
嗅球の中での嗅上皮細胞の軸索の配置は前後軸及び背側腹側の軸で決定されているが、背側腹側の軸での配列は嗅上皮内での配置によって決定される。前後軸に関してはどの嗅覚受容体が発現されているかによって産生されるcAMPの量が変わり、これによってSema3A/Neuropilin1のカウンターバランスを示す濃度勾配が嗅上皮細胞の軸索内に発生し、これによって標的にたどり着く前に軸索がソーティングされることによって、前後軸のどこに軸索が到着するかが決定される[14]。背側腹側に関しては、まず、嗅上皮内でのRobo2の濃度勾配と嗅球内でのSlit1の濃度勾配よってパイオニア軸索の嗅球での配置が背側に決定され、その後、嗅上皮細胞の軸索内でのSema3F/Neuropilin2のカウンターバランスを示す濃度勾配によって嗅球内での背側腹側の位置が決まる[14]。つまり、後から到着する軸索は先に到着した背側の軸索が発現するSema3Fによってより腹側に配置される(図5)。嗅覚の場合に特徴的なのは、軸索ー軸索の相互作用が非常に重要な役割を果たしていることである。 これはSperryのモデルとは少し異なり、嗅覚系では軸索間で自律的に制御されているということを示しており、また、嗅球がなくてもある程度トポグラフィックマップが形成されるという事実とも合致する。視覚系においては位置情報以外は(網膜のどこからくるか以外は)それぞれの軸索で同じ情報が伝えられているが、嗅覚系では違う嗅覚受容体の情報がそれぞれの軸索によって伝えられているところが異なるのかもしれない。
こういった過程で軸索が標的位置に到達しシナプスを形成したあと、嗅覚系でも視覚系と同様に神経活動依存的なリファインメントがおこる(隣同士の糸球体がきっちりとセグレゲートする)。この過程においては神経活動依存的にホモフィリック結合をする細胞接着因子Kirrel2/3と接着依存性の反発因子であるEphA5-EphrinA5がやはり濃度勾配を呈する形で発現し、それによって糸球体が相互にセグレゲートする(図3)[14]。
嗅覚系におけるトポグラフィックマッピングは様々な嗅覚受容体からの情報を処理するのに必要であるだけでなく、その匂いによって誘発される動物の行動を規定するのに重要であり、嗅球から脳のどこにつながるかということとトポグラフィックマッピングは密接に関わっている。詳細は嗅覚系の項を参照されたい。
その他
その他、聴覚系(音の周波数情報)、体性感覚系(身体における位置情報、例えばマウスやラットの髭とバレル皮質の系)、味覚系(違う味覚物質を感受する受容体からの情報)、及び運動系(身体における位置情報)などのトポグラフィックマップが研究されている。
関連項目
参考文献
- ↑
SPERRY, R.W. (1963).
CHEMOAFFINITY IN THE ORDERLY GROWTH OF NERVE FIBER PATTERNS AND CONNECTIONS. Proceedings of the National Academy of Sciences of the United States of America, 50, 703-10. [PubMed:14077501] [PMC] [WorldCat] [DOI] - ↑
Walter, J., Kern-Veits, B., Huf, J., Stolze, B., & Bonhoeffer, F. (1987).
Recognition of position-specific properties of tectal cell membranes by retinal axons in vitro. Development (Cambridge, England), 101(4), 685-96. [PubMed:3503693] [WorldCat] - ↑
Walter, J., Henke-Fahle, S., & Bonhoeffer, F. (1987).
Avoidance of posterior tectal membranes by temporal retinal axons. Development (Cambridge, England), 101(4), 909-13. [PubMed:3503703] [WorldCat] - ↑
Stahl, B., Müller, B., von Boxberg, Y., Cox, E.C., & Bonhoeffer, F. (1990).
Biochemical characterization of a putative axonal guidance molecule of the chick visual system. Neuron, 5(5), 735-43. [PubMed:2171592] [WorldCat] [DOI] - ↑
Cheng, H.J., & Flanagan, J.G. (1994).
Identification and cloning of ELF-1, a developmentally expressed ligand for the Mek4 and Sek receptor tyrosine kinases. Cell, 79(1), 157-68. [PubMed:7522971] [WorldCat] [DOI] - ↑
Walter, J., Henke-Fahle, S., & Bonhoeffer, F. (1987).
Avoidance of posterior tectal membranes by temporal retinal axons. Development (Cambridge, England), 101(4), 909-13. [PubMed:3503703] [WorldCat] - ↑
Walter, J., Kern-Veits, B., Huf, J., Stolze, B., & Bonhoeffer, F. (1987).
Recognition of position-specific properties of tectal cell membranes by retinal axons in vitro. Development (Cambridge, England), 101(4), 685-96. [PubMed:3503693] [WorldCat] - ↑
Cheng, H.J., Nakamoto, M., Bergemann, A.D., & Flanagan, J.G. (1995).
Complementary gradients in expression and binding of ELF-1 and Mek4 in development of the topographic retinotectal projection map. Cell, 82(3), 371-81. [PubMed:7634327] [WorldCat] [DOI] - ↑
Walter, J., Kern-Veits, B., Huf, J., Stolze, B., & Bonhoeffer, F. (1987).
Recognition of position-specific properties of tectal cell membranes by retinal axons in vitro. Development (Cambridge, England), 101(4), 685-96. [PubMed:3503693] [WorldCat] - ↑
Drescher, U., Kremoser, C., Handwerker, C., Löschinger, J., Noda, M., & Bonhoeffer, F. (1995).
In vitro guidance of retinal ganglion cell axons by RAGS, a 25 kDa tectal protein related to ligands for Eph receptor tyrosine kinases. Cell, 82(3), 359-70. [PubMed:7634326] [WorldCat] [DOI] - ↑ 11.0 11.1
McLaughlin, T., & O'Leary, D.D. (2005).
Molecular gradients and development of retinotopic maps. Annual review of neuroscience, 28, 327-55. [PubMed:16022599] [WorldCat] [DOI] - ↑
Triplett, J.W., Pfeiffenberger, C., Yamada, J., Stafford, B.K., Sweeney, N.T., Litke, A.M., ..., & Feldheim, D.A. (2011).
Competition is a driving force in topographic mapping. Proceedings of the National Academy of Sciences of the United States of America, 108(47), 19060-5. [PubMed:22065784] [PMC] [WorldCat] [DOI] - ↑
Pfeiffenberger, C., Cutforth, T., Woods, G., Yamada, J., Rentería, R.C., Copenhagen, D.R., ..., & Feldheim, D.A. (2005).
Ephrin-As and neural activity are required for eye-specific patterning during retinogeniculate mapping. Nature neuroscience, 8(8), 1022-7. [PubMed:16025107] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2 14.3 14.4
Mori, K., & Sakano, H. (2011).
How is the olfactory map formed and interpreted in the mammalian brain? Annual review of neuroscience, 34, 467-99. [PubMed:21469960] [WorldCat] [DOI]