「むずむず脚症候群」の版間の差分
| (同じ利用者による、間の8版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">井上雄一</font><br> | <font size="+1">井上雄一</font><br> | ||
''東京医科大学睡眠学講座''<br> | ''東京医科大学睡眠学講座''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2022年8月25日 原稿完成日:2022年9月1日<br> | ||
担当編集委員:[http://researchmap.jp/read0141446 漆谷 真](滋賀医科大学 医学部 脳神経内科)<br> | 担当編集委員:[http://researchmap.jp/read0141446 漆谷 真](滋賀医科大学 医学部 脳神経内科)<br> | ||
</div> | </div> | ||
| 8行目: | 8行目: | ||
英:restless legs syndrome 独:Restless-Legs-Syndrom 仏:syndrome des jambes sans repos | 英:restless legs syndrome 独:Restless-Legs-Syndrom 仏:syndrome des jambes sans repos | ||
同義語:レストレスレッグ症候群、下肢静止不能症候群、周期性四肢運動障害、エクボム症候群<br> | |||
periodic limb movements disorder | periodic limb movements disorder, Ekbom symdrom | ||
{{box|text= | {{box|text= むずむず脚症候群は、夜間の下肢の運動促迫を主症状とする疾患で、これに加えて睡眠中に生じる反復性の下肢の不随意運動(周期性四肢運動)を高頻度に随伴するため、強度の不眠、抑うつ・不安症状、心血管系合併症をきたす可能性がある。症候性(二次性)と特発性に分類され、前者に関して、末期腎不全やパーキンソン病患者、妊娠中の女性で有病率が一般人口の数倍に達することが知られている。後者に関しては、いくつかの遺伝学的特性、中枢ドパミン系神経の機能異常、鉄欠乏などが、その病態生理に関与している可能性が推測されている。治療においては、ドパミン受容体作動薬の効果が最も優れているが、長期連用下で治療前より症状が悪化するオーグメンテーションという現象をきたす可能性があるため、その使用には慎重を期する必要がある。これに代わって、近年では中枢神経の興奮を抑制するα2δリガンドの治療における重要性がクローズアップされており、さらに鉄剤による治療の可能性も検討されている。}} | ||
==むずむず脚症候群とは== | ==むずむず脚症候群とは== | ||
| 19行目: | 19行目: | ||
#この症状が脚を動かすことにより改善する | #この症状が脚を動かすことにより改善する | ||
#夕方から夜間に増悪する | #夕方から夜間に増悪する | ||
という四徴により特徴づけられ、診断基準の数回の変遷を経てもこれらが基本症状であることに変わりは無い<ref name=Allen2014><pubmed>25023924</pubmed></ref> | という四徴により特徴づけられ、診断基準の数回の変遷を経てもこれらが基本症状であることに変わりは無い<ref name=Allen2014><pubmed>25023924</pubmed></ref>。 | ||
むずむず脚症候群の概念は古くから知られており、その特徴的な症状は17世紀のイギリスの内科医[[wj:トーマス・ウィリス|Thomas Willis]]により最初に報告されたが、この病名はスウェーデンの神経内科医[[w:Karl-Axel Ekbom|Karl-Axel Ekbom]]により1945年に命名された<ref name=Ekbom1960><pubmed>13726241</pubmed></ref> | むずむず脚症候群の概念は古くから知られており、その特徴的な症状は17世紀のイギリスの内科医[[wj:トーマス・ウィリス|Thomas Willis]]により最初に報告されたが、この病名はスウェーデンの神経内科医[[w:Karl-Axel Ekbom|Karl-Axel Ekbom]]により1945年に命名された<ref name=Ekbom1960><pubmed>13726241</pubmed></ref>。本邦では下肢静止不能症候群とも呼ばれる。 | ||
==診断基準== | ==診断基準== | ||
診断基準を示す('''表1''' | 診断基準を示す('''表1''')。夜間の就床時に下肢の症状が出現しやすいため、[[入眠障害]]、もしくは中途覚醒後の[[再入眠障害]]を呈しやすく、また、高頻度に足関節を中心にした反復性の運動([[周期性四肢運動]](Periodic limb movements during sleep: PLMs 15回/時間が病的基準とされている)を随伴することにより熟眠感欠如を随伴しやすい<ref name=Hening2004><pubmed>15165529</pubmed></ref>。むずむず脚症候群の運動促迫症状を欠き、周期性四肢運動による熟眠障害ならびに睡眠の頻回な分断による日中眠気を呈している症例は[[周期性四肢運動障害]]([[Periodic limb movements disorder]]; [[PLMD]])と呼ばれるが、むずむず脚症候群と周期性四肢運動障害の基本病態は共通している。 | ||
有病率の比較的高いcommon diseaseであり、[[睡眠障害]]<ref name=Becker2006><pubmed>19412498</pubmed></ref>とQOLの低下をもたらす<ref name=Allen2005><pubmed>15956009</pubmed></ref>。患者の75%に不眠が生じ、その結果、日中の[[認知機能]]に悪影響が及ぶとともに、健康関連のQOLを評価するSF-36の8項目すべてが健常群に比べて悪化したとの報告がある<ref name=Trenkwalder2018><pubmed>30244828</pubmed></ref>。さらに、周期性四肢運動を合併するむずむず脚症候群では、周期性四肢運動に伴って収縮期・拡張期[[血圧]]が上昇することがわかっており、これが[[高血圧]]を含めた[[循環器]]系疾患のリスク要因になるか否かにつき議論がなされている<ref name=Allen2010><pubmed>19464949</pubmed></ref><ref name=Shin2018><pubmed>30032284</pubmed></ref>。 | |||
{| class="wikitable" | {| class="wikitable" | ||
|+ 表1. | |+ 表1. むずむず脚症候群の診断(IRLSSG診断基準)<ref name=Allen2014><pubmed>25023924</pubmed></ref> | ||
|- | |- | ||
! 5つの必須診断基準:診断には全て当てはまる必要あり | ! 5つの必須診断基準:診断には全て当てはまる必要あり | ||
| 38行目: | 38行目: | ||
#その強い欲求及び異常感覚は、運動によって改善する。 | #その強い欲求及び異常感覚は、運動によって改善する。 | ||
#安静時におけるその強い欲求及び異常感覚が日中より夕方・夜間に増悪する。 | #安静時におけるその強い欲求及び異常感覚が日中より夕方・夜間に増悪する。 | ||
#これらの特徴を持つ症状が、他の疾患・習慣的行動で説明できない。<br> | #これらの特徴を持つ症状が、他の疾患・習慣的行動で説明できない。<br>(筋肉痛、静脈鬱血、下肢浮腫、関節炎、腓返り、特定の体位における不快感、フットタッピングなど類似疾患を鑑別除外) | ||
|- | |- | ||
! 診断を補助する4つの特徴 | ! 診断を補助する4つの特徴 | ||
| 50行目: | 50行目: | ||
==疫学== | ==疫学== | ||
欧米での調査では、大多数で有病率はおよそ5-10%の水準にあり<ref name=Becker2006><pubmed>19412498</pubmed></ref><ref name=Trenkwalder2018><pubmed>30244828</pubmed></ref>、いずれの調査においても男性より女性の有病率が高い傾向が示されている。本邦を含めて[[アジア人]]では1.8-4%程度<ref name=Nomura2008><pubmed>18973260</pubmed></ref>と若干低い。また女性に多いという性差は人種間で共通しているが、[[白人]]では高齢者層で有病率が上昇するのに対し、アジア人では年齢による変化は乏しいようである<ref name=Koo2015><pubmed>26329429</pubmed></ref><ref name=Leary2018><pubmed>30243181</pubmed></ref>。アジア諸国で有病率が低い原因として、自覚症状評価に関する文化的な違い、および後述する遺伝的要因の人種差が考えられるが、これらの点は今後の研究で明らかにすべき課題である。 | |||
なお、周期性四肢運動障害に関しては、下肢運動の存在を自覚している者が非常に少ないため、疫学調査にあたっては[[ポリソムノグラフィ]]ないし[[体動/静止ロガー]]による下肢運動の計測を必要とすることから、大規模な研究は少ないが、病的基準(周期性四肢運動指数15/ | なお、周期性四肢運動障害に関しては、下肢運動の存在を自覚している者が非常に少ないため、疫学調査にあたっては[[ポリソムノグラフィ]]ないし[[体動/静止ロガー]]による下肢運動の計測を必要とすることから、大規模な研究は少ないが、病的基準(周期性四肢運動指数15/時間以上)を満たす者は、白人では一般人口の20%以上に達すると考えられている<ref name=Kagimura2011><pubmed>22001218</pubmed></ref><ref name=Leary2018><pubmed>30243181</pubmed></ref>。 | ||
==症状特性== | ==症状特性== | ||
その症状発現が月2回以上の頻度になると慢性化しやすく<ref name=Leary2018><pubmed>30243181</pubmed></ref><ref name=Takahashi2015><pubmed>26002761</pubmed></ref>、週2回以上になるとQOLに悪影響を及ぼすようになる<ref name=Allen2005><pubmed>15956009</pubmed></ref>。また、初期には夜間に限局していた症状が、罹病の長期化、重症化につれて日中にも生じるようになることが少なくない<ref name=Leary2018><pubmed>30243181</pubmed></ref><ref name=Liguori2020><pubmed>31770614</pubmed></ref>。また、その症状は季節変動を示すことがかなり多い<ref name=Allen2003><pubmed>14592341</pubmed></ref><ref name=Leary2018><pubmed>30243181</pubmed></ref>。 | |||
若年発症例に比べて高齢発症例の方が進展が早い。[[認知症]] | 若年発症例に比べて高齢発症例の方が進展が早い。[[認知症]]を有する高齢者にもしばしば存在するが、このような症例では症状を正確に表現できないため、下肢の不快感に伴う頻回な歩行を、[[せん妄]]を始めとする精神症状と見誤られてしまうことがある。夜間特に前半に症状が集中する、睡眠中の周期性四肢運動、家族歴が存在する、後述する[[ドパミン受容体]][[作動薬]]が有効である、などの特徴の有無を吟味すべきである<ref name=Allen2003><pubmed>14592341</pubmed></ref>。 | ||
小児期に発現することもある。この場合、症状が夜間だけでなく日中の座学での授業中などで生じることも少なくない。時には夜間よりも日中の方が症状が強いこともあるし、日中症状のために学業に影響が及ぶケース、落ち着きのなさや注意集中の困難から[[注意欠陥多動障害]]と見誤られるケースも散見される。総じて、小児例は成人例より家族歴を有するケースが多いので、問診では必ずこれを確認するべきであろう。周期性四肢運動は、これにより中途覚醒を誘発するため先に述べたように熟眠障害・日中眠気をきたすが、周期性四肢運動の睡眠感に対する影響は、むずむず脚症候群に合併した症例の方が非合併例より強いし、15回/時間という病的基準の妥当性に疑義を唱える向きもある<ref name=Leary2018><pubmed>30243181</pubmed></ref>。 | |||
==鑑別診断== | ==鑑別診断== | ||
Heningら<ref name=Hening2009><pubmed>19185537</pubmed></ref>は、むずむず脚症候群の4徴のみを項目として設定した従来の質問紙による疫学調査において、確定診断の陽性的中率が低い理由として、むずむず脚症候群 mimicsが少なからず含まれている可能性を指摘している。 | |||
これと関連して、Tisonらは欧米の女性の約1/3が慢性の静脈性疾患([[下肢静脈瘤]] | これと関連して、Tisonらは欧米の女性の約1/3が慢性の静脈性疾患([[下肢静脈瘤]])に罹患しており、これによる下肢の不快感をむずむず脚症候群の症状と混同していることが、白人女性での有病率が高い原因になっていると述べている<ref name=Tison2005><pubmed>16043793</pubmed></ref>。その他のむずむず脚症候群 mimicsとして、[[アカシジア]]、[[痛む脚と動く趾症候群]]([[Painful legs & moving toes syndrome]])、[[線維筋痛症]](ただしむずむず脚症候群の合併が少なくないことに注意<ref name=Goulart2014><pubmed>25249423</pubmed></ref>)、[[多発性神経障害]]、下肢[[血行障害]]、[[感情障害]](特に[[うつ病]])などが挙げられている。 | ||
アカシジアは、明確な日内変動がない点、主たる責任薬剤となる[[抗精神病薬]]の服用ないし増量のタイミングとの因果関係を確認することで除外可能である。 | アカシジアは、明確な日内変動がない点、主たる責任薬剤となる[[抗精神病薬]]の服用ないし増量のタイミングとの因果関係を確認することで除外可能である。 | ||
| 74行目: | 74行目: | ||
多発性神経障害も日内変動や運動による症状軽減を認めないことからむずむず脚症候群と鑑別できる。しかし、多発性神経障害がしばしばむずむず脚症候群を合併する点には注意を要する。 | 多発性神経障害も日内変動や運動による症状軽減を認めないことからむずむず脚症候群と鑑別できる。しかし、多発性神経障害がしばしばむずむず脚症候群を合併する点には注意を要する。 | ||
うつ病や[[身体表現性障害]]では、下肢の不快感や[[しびれ感]]などのむずむず脚症候群に類似した症状を呈することがあるし、治療に用いられる[[抗うつ薬]] | うつ病や[[身体表現性障害]]では、下肢の不快感や[[しびれ感]]などのむずむず脚症候群に類似した症状を呈することがあるし、治療に用いられる[[抗うつ薬]]がむずむず脚症候群を誘発する可能性があること<ref name=Kolla2018><pubmed>28822709</pubmed></ref>にも留意したい。他方、むずむず脚症候群患者は不眠と、これに伴う日中の疲労感・機能低下から[[抑うつ症状]]を呈することが少なくない。むずむず脚症候群様症状を有するうつ病患者では、これらの可能性を考慮しながら鑑別を進めるべきである。 | ||
診断、治療状況を知る上で重要な研究として、欧米6カ国の一般人口を対象(n=15,391名)とした調査がある<ref name=Allen2005><pubmed>15956009</pubmed></ref>。本調査においては、症状を週に2回以上認めた者は2.7%であった。この確定診断群の81%はプライマリケア医を受診していたが、むずむず脚症候群の診断を受けていたのはその中のわずか6.2%で、多くはむずむず脚症候群類似の下肢不快感を訴える下肢血行障害(18.3%)、[[関節炎]](14.3%)、[[脊椎]]疾患(12.7%)、[[静脈瘤]](7.5%)、[[抑うつ不安障害]](6.3%)と診断(誤診)されていた。この結果は、医療従事者のむずむず脚症候群に対する認知度がまだまだ低いことを示していると言えよう。 | |||
[[ファイル:Inoue むずむず脚症候群 Figure1.png|サムネイル|'''図1. 低酸素に関連したむずむず脚症候群の細胞内での病態生理'''<br>細胞内での鉄欠乏、[[一酸化窒素]]、アデノシン、MEIS1の多型は, 単独(実線)にあるいは共同して(点線)、むずむず脚症候群病態に影響を及ぼす。<br> | [[ファイル:Inoue むずむず脚症候群 Figure1.png|サムネイル|'''図1. 低酸素に関連したむずむず脚症候群の細胞内での病態生理'''<br>細胞内での鉄欠乏、[[一酸化窒素]]、アデノシン、MEIS1の多型は, 単独(実線)にあるいは共同して(点線)、むずむず脚症候群病態に影響を及ぼす。<br> | ||
RLS; むずむず脚症候群<br> | RLS; むずむず脚症候群<br> | ||
[[HIF- | [[HIF-1α]]; [[hypoxia inducible factor-1α]]<br> | ||
[[VEGF]]; [[vascular endothelial growth factor]]<br> | [[VEGF]]; [[vascular endothelial growth factor]]<br> | ||
文献<ref name=Trenkwalder2018><pubmed>30244828</pubmed></ref>から改変]] | 文献<ref name=Trenkwalder2018><pubmed>30244828</pubmed></ref>から改変]] | ||
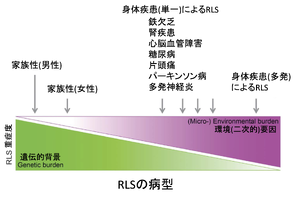
[[ファイル:Inoue むずむず脚症候群 Figure2.png|サムネイル|'''図2. | [[ファイル:Inoue むずむず脚症候群 Figure2.png|サムネイル|'''図2. むずむず脚症候群の遺伝的背景と環境(二次的)要因の関係'''<br>文献<ref name=Trenkwalder2016><pubmed>26944272</pubmed></ref>から改変]] | ||
==病態生理== | ==病態生理== | ||
'''図1'''にTrenkwalderらが動物実験の結果をまとめた、むずむず脚症候群の低酸素状態に関連した細胞内での病態生理を示す6) <ref name=Trenkwalder2018><pubmed>30244828</pubmed></ref> | '''図1'''にTrenkwalderらが動物実験の結果をまとめた、むずむず脚症候群の低酸素状態に関連した細胞内での病態生理を示す6) <ref name=Trenkwalder2018><pubmed>30244828</pubmed></ref>。特に低酸素誘発性因子である[[HIF-1α]]の上方調節は脳血流関門の透過性上昇を含めて、図内に示した神経伝達系の変化を増幅すると考えられる。'''図2'''に、むずむず脚症候群症状の発現に関わる遺伝学的背景と環境(二次性)要因の関与の関係を示す35) <ref name=Trenkwalder2016><pubmed>26944272</pubmed></ref>。一般に若年発症の家族性発症の症例では遺伝的要素が主体となり、中高年期以降の症例では、身体的な背景の関与が高くなると考えられている。 | ||
[[ファイル:Inoue むずむず脚症候群 Figure3.png|サムネイル|'''図3. A11ドパミン神経系からみたむずむず病の病態'''<br>A11ドパミン細胞群は体性感覚知覚に関わる④前頭野/前頭前野、①遠心性に直接あるいは背側縫線核を介する自律神経回路や③骨格筋・疼痛知覚に関わる求心性の体性神経回路に対して抑制性の調節をしているが、A11ドパミン細胞群の機能不全により、[[脊髄後角]]細胞や[[脊髄中間外側細胞]](IML)の[[脱抑制]]をもたらし、筋求心路の[[体性感覚]]信号([[疼痛]]性知覚)の増大を招く。プラミペキソールはドパミン機能不全を改善することで、脱抑制による体性感覚信号の増大を抑えると考えられる。なお、③骨格筋随意運動による非疼痛性固有知覚の増大は脊髄後角細胞に抑制性に働くため、自発的運動により不快感は低減する。また、②これらの抑制性投射系の異常は[[交感神経]]の活性化をもたらし[[ノルアドレナリン]](NA)、[[アドレナリン]](Ad)の放出を促す。この結果、高閾値の筋の求心性神経の活性に異常を生じ、筋の異常活動、すなわち周期性四肢運動を誘発する。文献<ref name=Clemens2006><pubmed>16832090</pubmed></ref>を改変引用。]] | [[ファイル:Inoue むずむず脚症候群 Figure3.png|サムネイル|'''図3. A11ドパミン神経系からみたむずむず病の病態'''<br>A11ドパミン細胞群は体性感覚知覚に関わる④前頭野/前頭前野、①遠心性に直接あるいは背側縫線核を介する自律神経回路や③骨格筋・疼痛知覚に関わる求心性の体性神経回路に対して抑制性の調節をしているが、A11ドパミン細胞群の機能不全により、[[脊髄後角]]細胞や[[脊髄中間外側細胞]](IML)の[[脱抑制]]をもたらし、筋求心路の[[体性感覚]]信号([[疼痛]]性知覚)の増大を招く。プラミペキソールはドパミン機能不全を改善することで、脱抑制による体性感覚信号の増大を抑えると考えられる。なお、③骨格筋随意運動による非疼痛性固有知覚の増大は脊髄後角細胞に抑制性に働くため、自発的運動により不快感は低減する。また、②これらの抑制性投射系の異常は[[交感神経]]の活性化をもたらし[[ノルアドレナリン]](NA)、[[アドレナリン]](Ad)の放出を促す。この結果、高閾値の筋の求心性神経の活性に異常を生じ、筋の異常活動、すなわち周期性四肢運動を誘発する。文献<ref name=Clemens2006><pubmed>16832090</pubmed></ref>を改変引用。]] | ||
===特発性むずむず脚症候群=== | ===特発性むずむず脚症候群=== | ||
特に45歳以前の発症例では、約30%程度で家族集積性がみられ、[[常染色体優性遺伝]]すると考えられている21) <ref name=Winkelmann2017><pubmed>28065402</pubmed></ref> 。候補遺伝子に関しては、いくつかの[[全ゲノム関連解析]](genome-wide association study:GWAS)と、これらから得られた候補遺伝子についての[[ケースコントロール研究]] | 特に45歳以前の発症例では、約30%程度で家族集積性がみられ、[[常染色体優性遺伝]]すると考えられている21) <ref name=Winkelmann2017><pubmed>28065402</pubmed></ref>。候補遺伝子に関しては、いくつかの[[全ゲノム関連解析]](genome-wide association study:GWAS)と、これらから得られた候補遺伝子についての[[ケースコントロール研究]]があり、その結果、[[MEIS1]]、[[BTBD9]]、[[PTPRD]]、[[MAP2K5]]、[[LBXCOR1]]などがその候補となっている('''表2''')<ref name=Jimenez-Jimenez2018><pubmed>29033051</pubmed></ref><ref name=Rye2015><pubmed>26329432</pubmed></ref>。これら遺伝子の[[ノックアウトマウス]]の研究から、特にMEIS1とBTBD9が、重要視されており、前者はむずむず脚症候群ならびに周期性四肢運動との関連性が<ref name=Moore2014><pubmed>25142570</pubmed></ref>、後者はむずむず脚症候群のみならず下に述べる鉄代謝にも影響することが示されている<ref name=Ekbom1960><pubmed>13726241</pubmed></ref>。しかしながら、これらの遺伝子多型に関する人種差は未だ十分解明されていない。 | ||
{| class="wikitable" | {| class="wikitable" | ||
| 105行目: | 105行目: | ||
|} | |} | ||
低用量のドパミン受容体作動薬の有用性はむずむず脚症候群のドパミン仮説を支持する<ref name=Becker1993><pubmed>7909374</pubmed></ref>。実際、鉄はドパミン合成に関わる[[チロシン水酸化酵素]]の[[補因子]]であり、また鉄欠乏はドパミンD2受容体の発現量を減少させる<ref><pubmed>19022977</pubmed></ref>。一般に血清鉄は日中に濃度が上昇し夜間に低下するとされており、これが症状の日内変動と関連する可能性がある。また、患者の脳脊髄液中の鉄が低下しているという報告があるし、後述するように鉄剤の投与が[[血清鉄]]の欠乏の有無によらず有効であることもわかっている。これらは、病態を鉄代謝障害で説明する上で魅力的な所見であり、現時点では、遺伝学的特性とともに、中枢ドパミン神経機能ならびに鉄代謝異常の側面を中心に病態生理研究が進められている。 | |||
また、[[アデノシン受容体]]は[[GABA]]神経やドパミン神経上に存在するが、[[ラット]]を用いた研究により、鉄欠乏状態により[[ | また、[[アデノシン受容体]]は[[GABA]]神経やドパミン神経上に存在するが、[[ラット]]を用いた研究により、鉄欠乏状態により[[線条体]]の[[シナプス前部|シナプス前]]・[[シナプス後部|後]][[アデノシン受容体|アデノシン(A2)受容体]]がアップレギュレーションされると報告されており<ref name=Quiroz2010><pubmed>20385128</pubmed></ref>、むずむず脚症候群とアデノシン受容体異常の関連の詳細も明らかにすべき課題である。 | ||
Clemensらは、[[背後側視床下部]]ドパミン[[A11細胞群]]からの抑制性投射線維連絡の機能不全を病態の中心的存在と捉えている('''図3''' | Clemensらは、[[背後側視床下部]]ドパミン[[A11細胞群]]からの抑制性投射線維連絡の機能不全を病態の中心的存在と捉えている('''図3''')<ref name=Clemens2006><pubmed>16832090</pubmed></ref>。すなわち、ドパミンA11細胞群からの信号は、[[体性感覚]]入力に関わる[[前頭前野]]と、直接あるいは[[橋]]の[[背側縫線核]]を介して脊髄の自律神経回路を構成する脊髄中間外側細胞(IML)、ならびに体性神経回路の[[脊髄]][[後角]]細胞へ抑制性の投射線維連絡を形成しているが、このA11細胞群におけるドパミン活動低下がこれらの抑制性投射系の機能不全をもたらし、その結果、脚の筋肉からの筋求心路を介した不特定の体性感覚入力が増大し、異常感覚発現をもたらすと考えられている。 | ||
また、この抑制性投射系の異常は[[交感神経]]の活性化を介した[[ノルアドレナリン]]や[[アドレナリン]]の放出をもたらし、この結果、高閾値の[[筋]]の[[求心性神経]]の活動異常をもたらし、筋の異常活動、すなわち周期性四肢運動を誘発するとされる。また、[[セロトニン]]作動性の背側縫線核も病態に関与しているので、これが[[選択的セロトニン再取り込み阻害剤]] ([[selective serotonin uptake inhibitor]], [[SSRI]])などの[[抗うつ薬]] | また、この抑制性投射系の異常は[[交感神経]]の活性化を介した[[ノルアドレナリン]]や[[アドレナリン]]の放出をもたらし、この結果、高閾値の[[筋]]の[[求心性神経]]の活動異常をもたらし、筋の異常活動、すなわち周期性四肢運動を誘発するとされる。また、[[セロトニン]]作動性の背側縫線核も病態に関与しているので、これが[[選択的セロトニン再取り込み阻害剤]] ([[selective serotonin uptake inhibitor]], [[SSRI]])などの[[抗うつ薬]]が症状を誘発・悪化させる原因<ref name=Rottach2008><pubmed>18468624</pubmed></ref>になっていると理解できる。 | ||
===二次性むずむず脚症候群=== | ===二次性むずむず脚症候群=== | ||
原因となりうる疾患・身体条件として、慢性[[腎臓病]]、[[パーキンソン病]]、[[関節リウマチ]] | 原因となりうる疾患・身体条件として、慢性[[腎臓病]]、[[パーキンソン病]]、[[関節リウマチ]]、鉄代謝異常、妊娠中期以降(但し、妊娠中に症状を呈した妊婦は、呈さない妊婦に比べ、後年において特発性むずむず脚症候群を発症するリスクが4倍高いと報告されている<ref name=Cesnik2010><pubmed>21135386</pubmed></ref>、また、前述した抗精神病薬などの中枢性ドパミン受容体遮断薬や抗うつ薬、[[抗ヒスタミン剤]]の投与なども挙げられる。 | ||
慢性腎臓病では、段階3以上で有病率が上昇することがわかっており<ref name=Aritake-Okada2011><pubmed>22036105</pubmed></ref>、特に末期腎不全患者における有病率は世界的に高く、筆者らの日本人を対象とした調査でも23%程度<ref name=Kawauchi2006><pubmed>17176916</pubmed></ref>であった。慢性腎不全患者では[[血液透析]]の導入や時間の延長、あるいは[[腎移植]]により改善することから、[[尿毒症]]物質の蓄積が発症に関連すると推測されている。 | |||
野性マウスとBTBD9をノックアウトしたマウスに透析患者の血清を腹腔内投与した場合、後者においてのみ周期性四肢運動様の下肢筋活動が発現したとの研究報告もある<ref name=Muramatsu2019><pubmed>31704978</pubmed></ref>。動物モデル作成と、その運動評価の研究は近年大きく進歩を遂げており、研究手法の標準化も進められているので<ref name=Salminen2021><pubmed>33382140</pubmed></ref>、特に遺伝学的側面での進歩が期待されよう。 | |||
==治療== | ==治療== | ||
まず、二次性むずむず脚症候群特に鉄欠乏が背景となって生じているケースでは、その治療が最優先となる。薬剤誘発性の場合には、原因となりうる薬物の中止や減量、あるいは変更を検討する。[[飲酒]]・[[喫煙]]・[[カフェイン]] | まず、二次性むずむず脚症候群特に鉄欠乏が背景となって生じているケースでは、その治療が最優先となる。薬剤誘発性の場合には、原因となりうる薬物の中止や減量、あるいは変更を検討する。[[飲酒]]・[[喫煙]]・[[カフェイン]]は誘発因子となるので<ref name=Paulson2000><pubmed>10771701</pubmed></ref>、これらの摂取を避けるように指導する。また、過労・睡眠不足によって悪化することもあるので、これを是正すること、適度な運動と入眠前の四肢マッサージ、症状から注意をそらす工夫なども検討すべきである。 | ||
===ドパミン作動薬=== | ===ドパミン作動薬=== | ||
[[ファイル:Inoue むずむず脚症候群 Figure4 | [[ファイル:Inoue むずむず脚症候群 Figure4.png|サムネイル|400px|'''図4. オーグメンテーションに対する診断基準と治療アルゴリズム'''<br>文献<ref name=Garcia-Borreguero2007a><pubmed>17544323</pubmed></ref>を改変]] | ||
薬物療法において、長くその中核になってきたのは、ドパミン作動薬ないし[[L-DOPA]] | 薬物療法において、長くその中核になってきたのは、ドパミン作動薬ないし[[L-DOPA]]の投与であった<ref name=Inoue2010><pubmed>20451927</pubmed></ref>。我が国で本症候群への保険適応と[[プラミペキソール]]と[[ロチゴチン]]は、共に感覚処理機構に関与する脊髄後角のドパミンD3受容体サブタイプへの親和性が強い<ref name=Paulson2000><pubmed>10771701</pubmed></ref><ref name=Clemens2022><pubmed>35435646</pubmed></ref>。ロチゴチンに比べてプラミペキソールの方が効果発現が早く高力価との印象があるが、貼付剤で作用が終日持続するロチゴチンは症状が昼間にも発現する症例には適していると考えられる。プラミペキソール治療により、70%以上の症例で症状の重症度が50%以下に軽減する<ref name=Inoue2010><pubmed>20451927</pubmed></ref>。 | ||
プラミペキソールの主な副作用として、[[嘔気]]、[[傾眠]]、[[頭痛]]、胃部不快感(6.9%)、さらに、高用量を服用した場合には、前兆なく突然眠りに落ちてしまう[[突発的睡眠]]や[[衝動制御障害]] | プラミペキソールの主な副作用として、[[嘔気]]、[[傾眠]]、[[頭痛]]、胃部不快感(6.9%)、さらに、高用量を服用した場合には、前兆なく突然眠りに落ちてしまう[[突発的睡眠]]や[[衝動制御障害]]の報告があるので、これらに対する注意が必要である<ref name=Inoue2010><pubmed>20451927</pubmed></ref><ref name=Mierau1992><pubmed>1356788</pubmed></ref>。また、プラミペキソールは未変化体が腎排出性のため、重度の腎障害患者への投与は原則禁忌である。他方ロチゴチンは、肝排泄性のため、腎機能への配慮は必要ないものの、貼付部位の発赤・かゆみに中止すべきである。 | ||
ドパミン受容体作動薬による治療において、もっとも注意すべきなのは、長期服用下で症状の発現が2時間以上早まり、症状の増悪、ならびに症状発現部位が拡大する[[オーグメンテーション]] (augmentation、症状促進現象)を生じる危険性がある点である<ref name=Garcia-Borreguero2016><pubmed>27448465</pubmed></ref>。'''図4'''にオーグメンテーションの診断基準を記す<ref name=Garcia-Borreguero2007a><pubmed>17544323</pubmed></ref>。 | |||
その発現メカニズムとして、ドパミン作動薬投与による[[シナプス後膜]]のD2受容体のdown regulation、短時間作用のドパミン作動薬での血中濃度の変動性、ドパミン神経活動の[[概日リズム|概日変動]] | その発現メカニズムとして、ドパミン作動薬投与による[[シナプス後膜]]のD2受容体のdown regulation、短時間作用のドパミン作動薬での血中濃度の変動性、ドパミン神経活動の[[概日リズム|概日変動]]などが考えられている<ref name=Garcia-Borreguero2007><pubmed>17580331</pubmed></ref><ref name=Paulus2006><pubmed>16987735</pubmed></ref><ref name=Takahashi2017><pubmed>28264052</pubmed></ref>が、オーグメンテーションの動物モデルが作成されていないためか、その病態は確定されていない。オーグメンテーションは治療を阻害する重要な副作用であり、プラミペキソールではその発現頻度は8~56%と報告されており<ref name=Trenkwalder2008><pubmed>17921065</pubmed></ref>、日本人患者においては本剤の投与量が多いこと(0.375㎎/日以上)がその発現リスク上昇と関連していると考えられている<ref name=Takahashi2017><pubmed>28264052</pubmed></ref>。安易にドパミン作動薬の用量を増加させることはオーグメンテーション発現リスクを高めるので、慎重を期するべきである<ref name=Trenkwalder2008><pubmed>17921065</pubmed></ref>。症状の発現時刻を考慮して、一日量は増やさず、分割投与や服用時刻を前進させるといった対応を行うのも一法である<ref name=Inoue2010b><pubmed>19962941</pubmed></ref>。また、オーグメンテーションを生じる症例では血清フェリチン値が比較的低水準にあるという報告もあり、これも治療管理上の注意点になるだろう。 | ||
半減期の長いロチゴチンは、プラミペキソールに比べてオーグメンテーションをきたすリスクは明らかに低いが<ref name=Winkelmann2018><pubmed>29756335</pubmed></ref>、用量が多いと発現リスクは上昇していくので注意すべきである。 | |||
===α2δリガンド=== | ===α2δリガンド=== | ||
興奮性神経終末において、[[電位依存性カルシウムチャネル]]の[[α2δサブユニット]]に結合し、[[興奮性神経伝達物質]]の遊離を抑制し、GABA系の活動を上昇させる。当初、α2δリガンドの中で、[[ガバペンチン]] | 興奮性神経終末において、[[電位依存性カルシウムチャネル]]の[[α2δサブユニット]]に結合し、[[興奮性神経伝達物質]]の遊離を抑制し、GABA系の活動を上昇させる。当初、α2δリガンドの中で、[[ガバペンチン]]の有効性がMellickら<ref name=Mellick1996><pubmed>8723380</pubmed></ref>により報告されたが、半減期や生体利用効率の問題を考慮してガバペンチンのプロドラッグである[[ガバペンチンエナカルビル]](Gabapentin enacarbil; GEn)や[[プレガバリン]](日本では保険適応外)が治療に導入されている<ref name=Allen2014b><pubmed>24521108</pubmed></ref><ref name=Inoue2013><pubmed>23121149</pubmed></ref>。 | ||
この群の薬剤使用下では、眠気・めまいといった副作用が生じる可能性に注意すべきだが、ドパミン作動薬のようなオーグメンテーションリスクは否定的である。また、この群の薬剤は周期性四肢運動の抑制性ではドパミン作動薬に劣るものの、睡眠の安定化作用において優れている。ガバペンチンエナカルビルないしプレガバリンも未変化体が腎排泄性であるため、腎障害を有する患者では減量もしくは投与を避ける必要がある。プラミペキソールとプレガバリンの効果の同等性を証明した研究でのプレガバリン用量は300㎎/ | この群の薬剤使用下では、眠気・めまいといった副作用が生じる可能性に注意すべきだが、ドパミン作動薬のようなオーグメンテーションリスクは否定的である。また、この群の薬剤は周期性四肢運動の抑制性ではドパミン作動薬に劣るものの、睡眠の安定化作用において優れている。ガバペンチンエナカルビルないしプレガバリンも未変化体が腎排泄性であるため、腎障害を有する患者では減量もしくは投与を避ける必要がある。プラミペキソールとプレガバリンの効果の同等性を証明した研究でのプレガバリン用量は300㎎/日とかなり高い<ref name=Allen2014b><pubmed>24521108</pubmed></ref>。 | ||
これに比べて日本国内で適応を得ているガバペンチンエナカルビルの量は600㎎とかなり低い(もちろんプレガバリンと等力価ではないが)ので、ドパミン作動薬に比べると有効性は低い。われわれが国内のプラセボ対照二重盲検比較試験データを結合して、ガバペンチンエナカルビルの有効例の特性を検討した研究では、家族歴があること、血清フェリチン値が正常であること、先行するドパミン作動薬による治療歴が存在することが本剤の有効性と関連していた<ref name=Inoue2021><pubmed>34329897</pubmed></ref> | これに比べて日本国内で適応を得ているガバペンチンエナカルビルの量は600㎎とかなり低い(もちろんプレガバリンと等力価ではないが)ので、ドパミン作動薬に比べると有効性は低い。われわれが国内のプラセボ対照二重盲検比較試験データを結合して、ガバペンチンエナカルビルの有効例の特性を検討した研究では、家族歴があること、血清フェリチン値が正常であること、先行するドパミン作動薬による治療歴が存在することが本剤の有効性と関連していた<ref name=Inoue2021><pubmed>34329897</pubmed></ref>。しかしながら、効果が若干劣るというデメリットを抱えながらも、オーグメンテーションリスクが決定的に低いことから、全世界的には治療の第一ラインをα2δリガンドにするという流れが出来つつある<ref name=Garcia-Borreguero2018><pubmed>29602660</pubmed></ref>。 | ||
オーグメンテーションを避ける上では、血清フェリチン値を定期的に測定し、50-75μg/l以上を保つことが必要である。ドパミン作動薬使用下でオーグメンテーションが生じた場合には、分割投与や投与時刻の前進、α2δリガンドの投与を考慮する。International restless legs syndrome study group (IRLSSG) | ===その他=== | ||
オーグメンテーションを避ける上では、血清フェリチン値を定期的に測定し、50-75μg/l以上を保つことが必要である。ドパミン作動薬使用下でオーグメンテーションが生じた場合には、分割投与や投与時刻の前進、α2δリガンドの投与を考慮する。International restless legs syndrome study group (IRLSSG)の治療アルゴリズム<ref name=Garcia-Borreguero2016><pubmed>27448465</pubmed></ref>('''図4''')では、オーグメンテーション重症例では、ドパミン系薬剤の休薬(10日間程度)、ロチゴチン、α2δリガンド、[[オピオイド]]製剤(わが国では保険適応外)などを検討すべきとされている。 | |||
治療研究においては、より有効性と安全性の高い薬剤が模索されている。その中では、鉄剤投与が、血清[[フェリチン]]値が正常であっても有効な可能性が示唆されているが<ref name=Allen2018><pubmed>29425576</pubmed></ref><ref name=Trotti2019><pubmed>30609006</pubmed></ref>、まだその効果がドパミン作動薬に比肩しうる水準なのか、日中機能や睡眠の質を改善しうるか、投与のタイミングをどうすべきか、など明らかにすべき課題は多い。また、[[ベンゾジアゼピン]]製剤である[[クロナゼパム]]は、全世界的に長年オフラベル使用されてきたが、その効果と位置づけは不明瞭で、多剤ないし[[プラセボ]]を対照とした[[盲検比較試験]]を含めた系統的な研究が必要であろう。 | |||
==おわりに== | ==おわりに== | ||
むずむず脚症候群は有病率の高いcommon | むずむず脚症候群は有病率の高いcommon diseaseであるが、その認知度はまだ低い。そのため、患者がむずむず脚症候群に精通していない医療機関を受診することが多く、適切な診断・治療を受けられないために高額の医療費が無駄に費やされているという医療経済学的問題も指摘されている<ref name=Allen2005><pubmed>15956009</pubmed></ref>。この10年で病態研究は確実に進展し、診断基準や治療ガイドラインが作成されているが、本症候群病態に関わる決定的なバイオマーカーの同定が今後の重要な課題となろう。治療に関しては、本稿で紹介した薬物だけでなく、ドパミン再取込阻害薬やアデノシン受容体作動薬も、今後その候補に上がる可能性があると思われる。 | ||
==参考文献== | ==参考文献== | ||
2023年1月22日 (日) 21:35時点における最新版
井上雄一
東京医科大学睡眠学講座
DOI:10.14931/bsd.10056 原稿受付日:2022年8月25日 原稿完成日:2022年9月1日
担当編集委員:漆谷 真(滋賀医科大学 医学部 脳神経内科)
英:restless legs syndrome 独:Restless-Legs-Syndrom 仏:syndrome des jambes sans repos
同義語:レストレスレッグ症候群、下肢静止不能症候群、周期性四肢運動障害、エクボム症候群
periodic limb movements disorder, Ekbom symdrom
むずむず脚症候群は、夜間の下肢の運動促迫を主症状とする疾患で、これに加えて睡眠中に生じる反復性の下肢の不随意運動(周期性四肢運動)を高頻度に随伴するため、強度の不眠、抑うつ・不安症状、心血管系合併症をきたす可能性がある。症候性(二次性)と特発性に分類され、前者に関して、末期腎不全やパーキンソン病患者、妊娠中の女性で有病率が一般人口の数倍に達することが知られている。後者に関しては、いくつかの遺伝学的特性、中枢ドパミン系神経の機能異常、鉄欠乏などが、その病態生理に関与している可能性が推測されている。治療においては、ドパミン受容体作動薬の効果が最も優れているが、長期連用下で治療前より症状が悪化するオーグメンテーションという現象をきたす可能性があるため、その使用には慎重を期する必要がある。これに代わって、近年では中枢神経の興奮を抑制するα2δリガンドの治療における重要性がクローズアップされており、さらに鉄剤による治療の可能性も検討されている。
むずむず脚症候群とは
- 脚を動かしたくてたまらなくなる欲求
- この症状が安静臥位ないし座位で出現ないし悪化する
- この症状が脚を動かすことにより改善する
- 夕方から夜間に増悪する
という四徴により特徴づけられ、診断基準の数回の変遷を経てもこれらが基本症状であることに変わりは無い[1]。
むずむず脚症候群の概念は古くから知られており、その特徴的な症状は17世紀のイギリスの内科医Thomas Willisにより最初に報告されたが、この病名はスウェーデンの神経内科医Karl-Axel Ekbomにより1945年に命名された[2]。本邦では下肢静止不能症候群とも呼ばれる。
診断基準
診断基準を示す(表1)。夜間の就床時に下肢の症状が出現しやすいため、入眠障害、もしくは中途覚醒後の再入眠障害を呈しやすく、また、高頻度に足関節を中心にした反復性の運動(周期性四肢運動(Periodic limb movements during sleep: PLMs 15回/時間が病的基準とされている)を随伴することにより熟眠感欠如を随伴しやすい[3]。むずむず脚症候群の運動促迫症状を欠き、周期性四肢運動による熟眠障害ならびに睡眠の頻回な分断による日中眠気を呈している症例は周期性四肢運動障害(Periodic limb movements disorder; PLMD)と呼ばれるが、むずむず脚症候群と周期性四肢運動障害の基本病態は共通している。
有病率の比較的高いcommon diseaseであり、睡眠障害[4]とQOLの低下をもたらす[5]。患者の75%に不眠が生じ、その結果、日中の認知機能に悪影響が及ぶとともに、健康関連のQOLを評価するSF-36の8項目すべてが健常群に比べて悪化したとの報告がある[6]。さらに、周期性四肢運動を合併するむずむず脚症候群では、周期性四肢運動に伴って収縮期・拡張期血圧が上昇することがわかっており、これが高血圧を含めた循環器系疾患のリスク要因になるか否かにつき議論がなされている[7][8]。
| 5つの必須診断基準:診断には全て当てはまる必要あり |
|---|
|
| 診断を補助する4つの特徴 |
|
疫学
欧米での調査では、大多数で有病率はおよそ5-10%の水準にあり[4][6]、いずれの調査においても男性より女性の有病率が高い傾向が示されている。本邦を含めてアジア人では1.8-4%程度[9]と若干低い。また女性に多いという性差は人種間で共通しているが、白人では高齢者層で有病率が上昇するのに対し、アジア人では年齢による変化は乏しいようである[10][11]。アジア諸国で有病率が低い原因として、自覚症状評価に関する文化的な違い、および後述する遺伝的要因の人種差が考えられるが、これらの点は今後の研究で明らかにすべき課題である。
なお、周期性四肢運動障害に関しては、下肢運動の存在を自覚している者が非常に少ないため、疫学調査にあたってはポリソムノグラフィないし体動/静止ロガーによる下肢運動の計測を必要とすることから、大規模な研究は少ないが、病的基準(周期性四肢運動指数15/時間以上)を満たす者は、白人では一般人口の20%以上に達すると考えられている[12][11]。
症状特性
その症状発現が月2回以上の頻度になると慢性化しやすく[11][13]、週2回以上になるとQOLに悪影響を及ぼすようになる[5]。また、初期には夜間に限局していた症状が、罹病の長期化、重症化につれて日中にも生じるようになることが少なくない[11][14]。また、その症状は季節変動を示すことがかなり多い[15][11]。
若年発症例に比べて高齢発症例の方が進展が早い。認知症を有する高齢者にもしばしば存在するが、このような症例では症状を正確に表現できないため、下肢の不快感に伴う頻回な歩行を、せん妄を始めとする精神症状と見誤られてしまうことがある。夜間特に前半に症状が集中する、睡眠中の周期性四肢運動、家族歴が存在する、後述するドパミン受容体作動薬が有効である、などの特徴の有無を吟味すべきである[15]。
小児期に発現することもある。この場合、症状が夜間だけでなく日中の座学での授業中などで生じることも少なくない。時には夜間よりも日中の方が症状が強いこともあるし、日中症状のために学業に影響が及ぶケース、落ち着きのなさや注意集中の困難から注意欠陥多動障害と見誤られるケースも散見される。総じて、小児例は成人例より家族歴を有するケースが多いので、問診では必ずこれを確認するべきであろう。周期性四肢運動は、これにより中途覚醒を誘発するため先に述べたように熟眠障害・日中眠気をきたすが、周期性四肢運動の睡眠感に対する影響は、むずむず脚症候群に合併した症例の方が非合併例より強いし、15回/時間という病的基準の妥当性に疑義を唱える向きもある[11]。
鑑別診断
Heningら[16]は、むずむず脚症候群の4徴のみを項目として設定した従来の質問紙による疫学調査において、確定診断の陽性的中率が低い理由として、むずむず脚症候群 mimicsが少なからず含まれている可能性を指摘している。
これと関連して、Tisonらは欧米の女性の約1/3が慢性の静脈性疾患(下肢静脈瘤)に罹患しており、これによる下肢の不快感をむずむず脚症候群の症状と混同していることが、白人女性での有病率が高い原因になっていると述べている[17]。その他のむずむず脚症候群 mimicsとして、アカシジア、痛む脚と動く趾症候群(Painful legs & moving toes syndrome)、線維筋痛症(ただしむずむず脚症候群の合併が少なくないことに注意[18])、多発性神経障害、下肢血行障害、感情障害(特にうつ病)などが挙げられている。
アカシジアは、明確な日内変動がない点、主たる責任薬剤となる抗精神病薬の服用ないし増量のタイミングとの因果関係を確認することで除外可能である。
痛む脚と動く趾症候群(主に第一趾に多い)は運動による疼痛軽減が見られないし、むずむず脚症候群のような症状の日内変動はみられない。
下肢血行障害では、運動時に疼痛が増してしばしば間欠性跛行を呈するし、安静時に改善するというむずむず脚症候群とは反対の特徴を有する。
多発性神経障害も日内変動や運動による症状軽減を認めないことからむずむず脚症候群と鑑別できる。しかし、多発性神経障害がしばしばむずむず脚症候群を合併する点には注意を要する。
うつ病や身体表現性障害では、下肢の不快感やしびれ感などのむずむず脚症候群に類似した症状を呈することがあるし、治療に用いられる抗うつ薬がむずむず脚症候群を誘発する可能性があること[19]にも留意したい。他方、むずむず脚症候群患者は不眠と、これに伴う日中の疲労感・機能低下から抑うつ症状を呈することが少なくない。むずむず脚症候群様症状を有するうつ病患者では、これらの可能性を考慮しながら鑑別を進めるべきである。
診断、治療状況を知る上で重要な研究として、欧米6カ国の一般人口を対象(n=15,391名)とした調査がある[5]。本調査においては、症状を週に2回以上認めた者は2.7%であった。この確定診断群の81%はプライマリケア医を受診していたが、むずむず脚症候群の診断を受けていたのはその中のわずか6.2%で、多くはむずむず脚症候群類似の下肢不快感を訴える下肢血行障害(18.3%)、関節炎(14.3%)、脊椎疾患(12.7%)、静脈瘤(7.5%)、抑うつ不安障害(6.3%)と診断(誤診)されていた。この結果は、医療従事者のむずむず脚症候群に対する認知度がまだまだ低いことを示していると言えよう。

細胞内での鉄欠乏、一酸化窒素、アデノシン、MEIS1の多型は, 単独(実線)にあるいは共同して(点線)、むずむず脚症候群病態に影響を及ぼす。
RLS; むずむず脚症候群
HIF-1α; hypoxia inducible factor-1α
VEGF; vascular endothelial growth factor
文献[6]から改変
文献[20]から改変
病態生理
図1にTrenkwalderらが動物実験の結果をまとめた、むずむず脚症候群の低酸素状態に関連した細胞内での病態生理を示す6) [6]。特に低酸素誘発性因子であるHIF-1αの上方調節は脳血流関門の透過性上昇を含めて、図内に示した神経伝達系の変化を増幅すると考えられる。図2に、むずむず脚症候群症状の発現に関わる遺伝学的背景と環境(二次性)要因の関与の関係を示す35) [20]。一般に若年発症の家族性発症の症例では遺伝的要素が主体となり、中高年期以降の症例では、身体的な背景の関与が高くなると考えられている。
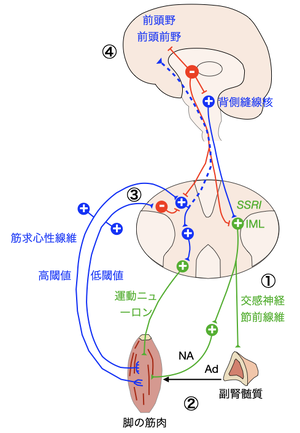
A11ドパミン細胞群は体性感覚知覚に関わる④前頭野/前頭前野、①遠心性に直接あるいは背側縫線核を介する自律神経回路や③骨格筋・疼痛知覚に関わる求心性の体性神経回路に対して抑制性の調節をしているが、A11ドパミン細胞群の機能不全により、脊髄後角細胞や脊髄中間外側細胞(IML)の脱抑制をもたらし、筋求心路の体性感覚信号(疼痛性知覚)の増大を招く。プラミペキソールはドパミン機能不全を改善することで、脱抑制による体性感覚信号の増大を抑えると考えられる。なお、③骨格筋随意運動による非疼痛性固有知覚の増大は脊髄後角細胞に抑制性に働くため、自発的運動により不快感は低減する。また、②これらの抑制性投射系の異常は交感神経の活性化をもたらしノルアドレナリン(NA)、アドレナリン(Ad)の放出を促す。この結果、高閾値の筋の求心性神経の活性に異常を生じ、筋の異常活動、すなわち周期性四肢運動を誘発する。文献[21]を改変引用。
特発性むずむず脚症候群
特に45歳以前の発症例では、約30%程度で家族集積性がみられ、常染色体優性遺伝すると考えられている21) [22]。候補遺伝子に関しては、いくつかの全ゲノム関連解析(genome-wide association study:GWAS)と、これらから得られた候補遺伝子についてのケースコントロール研究があり、その結果、MEIS1、BTBD9、PTPRD、MAP2K5、LBXCOR1などがその候補となっている(表2)[23][24]。これら遺伝子のノックアウトマウスの研究から、特にMEIS1とBTBD9が、重要視されており、前者はむずむず脚症候群ならびに周期性四肢運動との関連性が[25]、後者はむずむず脚症候群のみならず下に述べる鉄代謝にも影響することが示されている[2]。しかしながら、これらの遺伝子多型に関する人種差は未だ十分解明されていない。
| 遺伝子シンボル | 遺伝子名 | 染色体位置 |
|---|---|---|
| MEIS1 | Meis homeobox 1 | 2p |
| BTBD9 | BTB domain containing 9 | 6p |
| PTPRD | protein tyrosine phosphatase receptor type D | 9p |
| MAP2K5 | mitogen-activated protein kinase kinase 5 | 15q |
| LBXCOR1 | corepressor for LBX1 (=SKOR1, SKI family transcriptional corepressor 1) | 15q |
低用量のドパミン受容体作動薬の有用性はむずむず脚症候群のドパミン仮説を支持する[26]。実際、鉄はドパミン合成に関わるチロシン水酸化酵素の補因子であり、また鉄欠乏はドパミンD2受容体の発現量を減少させる[27]。一般に血清鉄は日中に濃度が上昇し夜間に低下するとされており、これが症状の日内変動と関連する可能性がある。また、患者の脳脊髄液中の鉄が低下しているという報告があるし、後述するように鉄剤の投与が血清鉄の欠乏の有無によらず有効であることもわかっている。これらは、病態を鉄代謝障害で説明する上で魅力的な所見であり、現時点では、遺伝学的特性とともに、中枢ドパミン神経機能ならびに鉄代謝異常の側面を中心に病態生理研究が進められている。
また、アデノシン受容体はGABA神経やドパミン神経上に存在するが、ラットを用いた研究により、鉄欠乏状態により線条体のシナプス前・後アデノシン(A2)受容体がアップレギュレーションされると報告されており[28]、むずむず脚症候群とアデノシン受容体異常の関連の詳細も明らかにすべき課題である。
Clemensらは、背後側視床下部ドパミンA11細胞群からの抑制性投射線維連絡の機能不全を病態の中心的存在と捉えている(図3)[21]。すなわち、ドパミンA11細胞群からの信号は、体性感覚入力に関わる前頭前野と、直接あるいは橋の背側縫線核を介して脊髄の自律神経回路を構成する脊髄中間外側細胞(IML)、ならびに体性神経回路の脊髄後角細胞へ抑制性の投射線維連絡を形成しているが、このA11細胞群におけるドパミン活動低下がこれらの抑制性投射系の機能不全をもたらし、その結果、脚の筋肉からの筋求心路を介した不特定の体性感覚入力が増大し、異常感覚発現をもたらすと考えられている。
また、この抑制性投射系の異常は交感神経の活性化を介したノルアドレナリンやアドレナリンの放出をもたらし、この結果、高閾値の筋の求心性神経の活動異常をもたらし、筋の異常活動、すなわち周期性四肢運動を誘発するとされる。また、セロトニン作動性の背側縫線核も病態に関与しているので、これが選択的セロトニン再取り込み阻害剤 (selective serotonin uptake inhibitor, SSRI)などの抗うつ薬が症状を誘発・悪化させる原因[29]になっていると理解できる。
二次性むずむず脚症候群
原因となりうる疾患・身体条件として、慢性腎臓病、パーキンソン病、関節リウマチ、鉄代謝異常、妊娠中期以降(但し、妊娠中に症状を呈した妊婦は、呈さない妊婦に比べ、後年において特発性むずむず脚症候群を発症するリスクが4倍高いと報告されている[30]、また、前述した抗精神病薬などの中枢性ドパミン受容体遮断薬や抗うつ薬、抗ヒスタミン剤の投与なども挙げられる。
慢性腎臓病では、段階3以上で有病率が上昇することがわかっており[31]、特に末期腎不全患者における有病率は世界的に高く、筆者らの日本人を対象とした調査でも23%程度[32]であった。慢性腎不全患者では血液透析の導入や時間の延長、あるいは腎移植により改善することから、尿毒症物質の蓄積が発症に関連すると推測されている。
野性マウスとBTBD9をノックアウトしたマウスに透析患者の血清を腹腔内投与した場合、後者においてのみ周期性四肢運動様の下肢筋活動が発現したとの研究報告もある[33]。動物モデル作成と、その運動評価の研究は近年大きく進歩を遂げており、研究手法の標準化も進められているので[34]、特に遺伝学的側面での進歩が期待されよう。
治療
まず、二次性むずむず脚症候群特に鉄欠乏が背景となって生じているケースでは、その治療が最優先となる。薬剤誘発性の場合には、原因となりうる薬物の中止や減量、あるいは変更を検討する。飲酒・喫煙・カフェインは誘発因子となるので[35]、これらの摂取を避けるように指導する。また、過労・睡眠不足によって悪化することもあるので、これを是正すること、適度な運動と入眠前の四肢マッサージ、症状から注意をそらす工夫なども検討すべきである。
ドパミン作動薬

文献[36]を改変
薬物療法において、長くその中核になってきたのは、ドパミン作動薬ないしL-DOPAの投与であった[37]。我が国で本症候群への保険適応とプラミペキソールとロチゴチンは、共に感覚処理機構に関与する脊髄後角のドパミンD3受容体サブタイプへの親和性が強い[35][38]。ロチゴチンに比べてプラミペキソールの方が効果発現が早く高力価との印象があるが、貼付剤で作用が終日持続するロチゴチンは症状が昼間にも発現する症例には適していると考えられる。プラミペキソール治療により、70%以上の症例で症状の重症度が50%以下に軽減する[37]。
プラミペキソールの主な副作用として、嘔気、傾眠、頭痛、胃部不快感(6.9%)、さらに、高用量を服用した場合には、前兆なく突然眠りに落ちてしまう突発的睡眠や衝動制御障害の報告があるので、これらに対する注意が必要である[37][39]。また、プラミペキソールは未変化体が腎排出性のため、重度の腎障害患者への投与は原則禁忌である。他方ロチゴチンは、肝排泄性のため、腎機能への配慮は必要ないものの、貼付部位の発赤・かゆみに中止すべきである。
ドパミン受容体作動薬による治療において、もっとも注意すべきなのは、長期服用下で症状の発現が2時間以上早まり、症状の増悪、ならびに症状発現部位が拡大するオーグメンテーション (augmentation、症状促進現象)を生じる危険性がある点である[40]。図4にオーグメンテーションの診断基準を記す[36]。
その発現メカニズムとして、ドパミン作動薬投与によるシナプス後膜のD2受容体のdown regulation、短時間作用のドパミン作動薬での血中濃度の変動性、ドパミン神経活動の概日変動などが考えられている[41][42][43]が、オーグメンテーションの動物モデルが作成されていないためか、その病態は確定されていない。オーグメンテーションは治療を阻害する重要な副作用であり、プラミペキソールではその発現頻度は8~56%と報告されており[44]、日本人患者においては本剤の投与量が多いこと(0.375㎎/日以上)がその発現リスク上昇と関連していると考えられている[43]。安易にドパミン作動薬の用量を増加させることはオーグメンテーション発現リスクを高めるので、慎重を期するべきである[44]。症状の発現時刻を考慮して、一日量は増やさず、分割投与や服用時刻を前進させるといった対応を行うのも一法である[45]。また、オーグメンテーションを生じる症例では血清フェリチン値が比較的低水準にあるという報告もあり、これも治療管理上の注意点になるだろう。
半減期の長いロチゴチンは、プラミペキソールに比べてオーグメンテーションをきたすリスクは明らかに低いが[46]、用量が多いと発現リスクは上昇していくので注意すべきである。
α2δリガンド
興奮性神経終末において、電位依存性カルシウムチャネルのα2δサブユニットに結合し、興奮性神経伝達物質の遊離を抑制し、GABA系の活動を上昇させる。当初、α2δリガンドの中で、ガバペンチンの有効性がMellickら[47]により報告されたが、半減期や生体利用効率の問題を考慮してガバペンチンのプロドラッグであるガバペンチンエナカルビル(Gabapentin enacarbil; GEn)やプレガバリン(日本では保険適応外)が治療に導入されている[48][49]。
この群の薬剤使用下では、眠気・めまいといった副作用が生じる可能性に注意すべきだが、ドパミン作動薬のようなオーグメンテーションリスクは否定的である。また、この群の薬剤は周期性四肢運動の抑制性ではドパミン作動薬に劣るものの、睡眠の安定化作用において優れている。ガバペンチンエナカルビルないしプレガバリンも未変化体が腎排泄性であるため、腎障害を有する患者では減量もしくは投与を避ける必要がある。プラミペキソールとプレガバリンの効果の同等性を証明した研究でのプレガバリン用量は300㎎/日とかなり高い[48]。
これに比べて日本国内で適応を得ているガバペンチンエナカルビルの量は600㎎とかなり低い(もちろんプレガバリンと等力価ではないが)ので、ドパミン作動薬に比べると有効性は低い。われわれが国内のプラセボ対照二重盲検比較試験データを結合して、ガバペンチンエナカルビルの有効例の特性を検討した研究では、家族歴があること、血清フェリチン値が正常であること、先行するドパミン作動薬による治療歴が存在することが本剤の有効性と関連していた[50]。しかしながら、効果が若干劣るというデメリットを抱えながらも、オーグメンテーションリスクが決定的に低いことから、全世界的には治療の第一ラインをα2δリガンドにするという流れが出来つつある[51]。
その他
オーグメンテーションを避ける上では、血清フェリチン値を定期的に測定し、50-75μg/l以上を保つことが必要である。ドパミン作動薬使用下でオーグメンテーションが生じた場合には、分割投与や投与時刻の前進、α2δリガンドの投与を考慮する。International restless legs syndrome study group (IRLSSG)の治療アルゴリズム[40](図4)では、オーグメンテーション重症例では、ドパミン系薬剤の休薬(10日間程度)、ロチゴチン、α2δリガンド、オピオイド製剤(わが国では保険適応外)などを検討すべきとされている。
治療研究においては、より有効性と安全性の高い薬剤が模索されている。その中では、鉄剤投与が、血清フェリチン値が正常であっても有効な可能性が示唆されているが[52][53]、まだその効果がドパミン作動薬に比肩しうる水準なのか、日中機能や睡眠の質を改善しうるか、投与のタイミングをどうすべきか、など明らかにすべき課題は多い。また、ベンゾジアゼピン製剤であるクロナゼパムは、全世界的に長年オフラベル使用されてきたが、その効果と位置づけは不明瞭で、多剤ないしプラセボを対照とした盲検比較試験を含めた系統的な研究が必要であろう。
おわりに
むずむず脚症候群は有病率の高いcommon diseaseであるが、その認知度はまだ低い。そのため、患者がむずむず脚症候群に精通していない医療機関を受診することが多く、適切な診断・治療を受けられないために高額の医療費が無駄に費やされているという医療経済学的問題も指摘されている[5]。この10年で病態研究は確実に進展し、診断基準や治療ガイドラインが作成されているが、本症候群病態に関わる決定的なバイオマーカーの同定が今後の重要な課題となろう。治療に関しては、本稿で紹介した薬物だけでなく、ドパミン再取込阻害薬やアデノシン受容体作動薬も、今後その候補に上がる可能性があると思われる。
参考文献
- ↑ 1.0 1.1
Allen, R.P., Picchietti, D.L., Garcia-Borreguero, D., Ondo, W.G., Walters, A.S., Winkelman, J.W., ..., & International Restless Legs Syndrome Study Group (2014).
Restless legs syndrome/Willis-Ekbom disease diagnostic criteria: updated International Restless Legs Syndrome Study Group (IRLSSG) consensus criteria--history, rationale, description, and significance. Sleep medicine, 15(8), 860-73. [PubMed:25023924] [WorldCat] [DOI] - ↑ 2.0 2.1
EKBOM, K.A. (1960).
Restless legs syndrome. Neurology, 10, 868-73. [PubMed:13726241] [WorldCat] [DOI] - ↑
Hening, W., Walters, A.S., Allen, R.P., Montplaisir, J., Myers, A., & Ferini-Strambi, L. (2004).
Impact, diagnosis and treatment of restless legs syndrome (RLS) in a primary care population: the REST (RLS epidemiology, symptoms, and treatment) primary care study. Sleep medicine, 5(3), 237-46. [PubMed:15165529] [WorldCat] [DOI] - ↑ 4.0 4.1
Becker, P.M. (2006).
The biopsychosocial effects of restless legs syndrome (RLS). Neuropsychiatric disease and treatment, 2(4), 505-12. [PubMed:19412498] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3
Allen, R.P., Walters, A.S., Montplaisir, J., Hening, W., Myers, A., Bell, T.J., & Ferini-Strambi, L. (2005).
Restless legs syndrome prevalence and impact: REST general population study. Archives of internal medicine, 165(11), 1286-92. [PubMed:15956009] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3
Trenkwalder, C., Allen, R., Högl, B., Clemens, S., Patton, S., Schormair, B., & Winkelmann, J. (2018).
Comorbidities, treatment, and pathophysiology in restless legs syndrome. The Lancet. Neurology, 17(11), 994-1005. [PubMed:30244828] [WorldCat] [DOI] - ↑
Allen, R.P., Stillman, P., & Myers, A.J. (2010).
Physician-diagnosed restless legs syndrome in a large sample of primary medical care patients in western Europe: Prevalence and characteristics. Sleep medicine, 11(1), 31-7. [PubMed:19464949] [WorldCat] [DOI] - ↑
Shin, D.S., Yang, K.I., Kim, D.E., Hwangbo, Y., Koo, B.B., & Cho, Y.W. (2018).
Periodic Limb Movements During Sleep Are Not Associated With Hypertension in a Clinical Cohort of Korean Adults. American journal of hypertension, 31(11), 1228-1233. [PubMed:30032284] [WorldCat] [DOI] - ↑
Nomura, T., Inoue, Y., Kusumi, M., Uemura, Y., & Nakashima, K. (2008).
Prevalence of restless legs syndrome in a rural community in Japan. Movement disorders : official journal of the Movement Disorder Society, 23(16), 2363-9. [PubMed:18973260] [WorldCat] [DOI] - ↑
Koo, B.B. (2015).
Restless Leg Syndrome Across the Globe: Epidemiology of the Restless Legs Syndrome/Willis-Ekbom Disease. Sleep medicine clinics, 10(3), 189-205, xi. [PubMed:26329429] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2 11.3 11.4 11.5
Leary, E.B., Moore, H.E., Schneider, L.D., Finn, L.A., Peppard, P.E., & Mignot, E. (2018).
Periodic limb movements in sleep: Prevalence and associated sleepiness in the Wisconsin Sleep Cohort. Clinical neurophysiology : official journal of the International Federation of Clinical Neurophysiology, 129(11), 2306-2314. [PubMed:30243181] [PMC] [WorldCat] [DOI] - ↑
Kagimura, T., Nomura, T., Kusumi, M., Nakashima, K., & Inoue, Y. (2011).
Prospective survey on the natural course of restless legs syndrome over two years in a closed cohort. Sleep medicine, 12(9), 821-6. [PubMed:22001218] [WorldCat] [DOI] - ↑
Takahashi, M., Ikeda, J., Tomida, T., Hirata, K., Hattori, N., & Inoue, Y. (2015).
Daytime symptoms of restless legs syndrome--clinical characteristics and rotigotine effectiveness. Sleep medicine, 16(7), 871-6. [PubMed:26002761] [WorldCat] [DOI] - ↑
Liguori, C., Holzknecht, E., Placidi, F., Izzi, F., Mercuri, N.B., Högl, B., & Stefani, A. (2020).
Seasonality of restless legs syndrome: symptom variability in winter and summer times. Sleep medicine, 66, 10-14. [PubMed:31770614] [WorldCat] [DOI] - ↑ 15.0 15.1
Allen, R.P., Picchietti, D., Hening, W.A., Trenkwalder, C., Walters, A.S., Montplaisi, J., ..., & International Restless Legs Syndrome Study Group (2003).
Restless legs syndrome: diagnostic criteria, special considerations, and epidemiology. A report from the restless legs syndrome diagnosis and epidemiology workshop at the National Institutes of Health. Sleep medicine, 4(2), 101-19. [PubMed:14592341] [WorldCat] [DOI] - ↑
Hening, W.A., Allen, R.P., Washburn, M., Lesage, S.R., & Earley, C.J. (2009).
The four diagnostic criteria for Restless Legs Syndrome are unable to exclude confounding conditions ("mimics"). Sleep medicine, 10(9), 976-81. [PubMed:19185537] [PMC] [WorldCat] [DOI] - ↑
Tison, F., Crochard, A., Léger, D., Bouée, S., Lainey, E., & El Hasnaoui, A. (2005).
Epidemiology of restless legs syndrome in French adults: a nationwide survey: the INSTANT Study. Neurology, 65(2), 239-46. [PubMed:16043793] [WorldCat] [DOI] - ↑
Goulart, L.I., Delgado Rodrigues, R.N., & Prieto Peres, M.F. (2014).
Restless legs syndrome and pain disorders: what's in common? Current pain and headache reports, 18(11), 461. [PubMed:25249423] [WorldCat] [DOI] - ↑
Kolla, B.P., Mansukhani, M.P., & Bostwick, J.M. (2018).
The influence of antidepressants on restless legs syndrome and periodic limb movements: A systematic review. Sleep medicine reviews, 38, 131-140. [PubMed:28822709] [WorldCat] [DOI] - ↑ 20.0 20.1
Trenkwalder, C., Allen, R., Högl, B., Paulus, W., & Winkelmann, J. (2016).
Restless legs syndrome associated with major diseases: A systematic review and new concept. Neurology, 86(14), 1336-1343. [PubMed:26944272] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1
Clemens, S., Rye, D., & Hochman, S. (2006).
Restless legs syndrome: revisiting the dopamine hypothesis from the spinal cord perspective. Neurology, 67(1), 125-30. [PubMed:16832090] [WorldCat] [DOI] - ↑
Winkelmann, J., Schormair, B., Xiong, L., Dion, P.A., Rye, D.B., & Rouleau, G.A. (2017).
Genetics of restless legs syndrome. Sleep medicine, 31, 18-22. [PubMed:28065402] [WorldCat] [DOI] - ↑
Jiménez-Jiménez, F.J., Alonso-Navarro, H., García-Martín, E., & Agúndez, J.A.G. (2018).
Genetics of restless legs syndrome: An update. Sleep medicine reviews, 39, 108-121. [PubMed:29033051] [WorldCat] [DOI] - ↑
Rye, D.B. (2015).
The Molecular Genetics of Restless Legs Syndrome. Sleep medicine clinics, 10(3), 227-33, xii. [PubMed:26329432] [WorldCat] [DOI] - ↑
Moore, H., Winkelmann, J., Lin, L., Finn, L., Peppard, P., & Mignot, E. (2014).
Periodic leg movements during sleep are associated with polymorphisms in BTBD9, TOX3/BC034767, MEIS1, MAP2K5/SKOR1, and PTPRD. Sleep, 37(9), 1535-42. [PubMed:25142570] [PMC] [WorldCat] [DOI] - ↑
Becker, P.M., Jamieson, A.O., & Brown, W.D. (1993).
Dopaminergic agents in restless legs syndrome and periodic limb movements of sleep: response and complications of extended treatment in 49 cases. Sleep, 16(8), 713-6. [PubMed:7909374] [WorldCat] [DOI] - ↑
Unger, E.L., Wiesinger, J.A., Hao, L., & Beard, J.L. (2008).
Dopamine D2 receptor expression is altered by changes in cellular iron levels in PC12 cells and rat brain tissue. The Journal of nutrition, 138(12), 2487-94. [PubMed:19022977] [PMC] [WorldCat] [DOI] - ↑
Quiroz, C., Pearson, V., Gulyani, S., Allen, R., Earley, C., & Ferré, S. (2010).
Up-regulation of striatal adenosine A(2A) receptors with iron deficiency in rats: effects on locomotion and cortico-striatal neurotransmission. Experimental neurology, 224(1), 292-8. [PubMed:20385128] [PMC] [WorldCat] [DOI] - ↑
Rottach, K.G., Schaner, B.M., Kirch, M.H., Zivotofsky, A.Z., Teufel, L.M., Gallwitz, T., & Messer, T. (2008).
Restless legs syndrome as side effect of second generation antidepressants. Journal of psychiatric research, 43(1), 70-5. [PubMed:18468624] [WorldCat] [DOI] - ↑
Cesnik, E., Casetta, I., Turri, M., Govoni, V., Granieri, E., Strambi, L.F., & Manconi, M. (2010).
Transient RLS during pregnancy is a risk factor for the chronic idiopathic form. Neurology, 75(23), 2117-20. [PubMed:21135386] [WorldCat] [DOI] - ↑
Aritake-Okada, S., Nakao, T., Komada, Y., Asaoka, S., Sakuta, K., Esaki, S., ..., & Inoue, Y. (2011).
Prevalence and clinical characteristics of restless legs syndrome in chronic kidney disease patients. Sleep medicine, 12(10), 1031-3. [PubMed:22036105] [WorldCat] [DOI] - ↑
Kawauchi, A., Inoue, Y., Hashimoto, T., Tachibana, N., Shirakawa, S., Mizutani, Y., ..., & Miki, T. (2006).
Restless legs syndrome in hemodialysis patients: health-related quality of life and laboratory data analysis. Clinical nephrology, 66(6), 440-6. [PubMed:17176916] [WorldCat] [DOI] - ↑
Muramatsu, K., Chikahisa, S., Shimizu, N., Séi, H., & Inoue, Y. (2019).
Rotigotine suppresses sleep-related muscle activity augmented by injection of dialysis patients' sera in a mouse model of restless legs syndrome. Scientific reports, 9(1), 16344. [PubMed:31704978] [PMC] [WorldCat] [DOI] - ↑
Salminen, A.V., Silvani, A., Allen, R.P., Clemens, S., Garcia-Borreguero, D., Ghorayeb, I., ..., & International Restless Legs Syndrome Study Group (IRLSSG) (2021).
Consensus Guidelines on Rodent Models of Restless Legs Syndrome. Movement disorders : official journal of the Movement Disorder Society, 36(3), 558-569. [PubMed:33382140] [PMC] [WorldCat] [DOI] - ↑ 35.0 35.1
Paulson, G.W. (2000).
Restless legs syndrome. How to provide symptom relief with drug and nondrug therapies. Geriatrics, 55(4), 35-8, 43-4, 47-8. [PubMed:10771701] [WorldCat] - ↑ 36.0 36.1
García-Borreguero, D., Allen, R.P., Kohnen, R., Högl, B., Trenkwalder, C., Oertel, W., ..., & International Restless Legs Syndrome Study Group (2007).
Diagnostic standards for dopaminergic augmentation of restless legs syndrome: report from a World Association of Sleep Medicine-International Restless Legs Syndrome Study Group consensus conference at the Max Planck Institute. Sleep medicine, 8(5), 520-30. [PubMed:17544323] [WorldCat] [DOI] - ↑ 37.0 37.1 37.2
Inoue, Y., Kuroda, K., Hirata, K., Uchimura, N., Kagimura, T., & Shimizu, T. (2010).
Long-term open-label study of pramipexole in patients with primary restless legs syndrome. Journal of the neurological sciences, 294(1-2), 62-6. [PubMed:20451927] [WorldCat] [DOI] - ↑
Clemens, S. (2022).
D3 Receptors and Restless Legs Syndrome. Current topics in behavioral neurosciences. [PubMed:35435646] [WorldCat] [DOI] - ↑
Mierau, J., & Schingnitz, G. (1992).
Biochemical and pharmacological studies on pramipexole, a potent and selective dopamine D2 receptor agonist. European journal of pharmacology, 215(2-3), 161-70. [PubMed:1356788] [WorldCat] [DOI] - ↑ 40.0 40.1
Garcia-Borreguero, D., Silber, M.H., Winkelman, J.W., Högl, B., Bainbridge, J., Buchfuhrer, M., ..., & Allen, R.P. (2016).
Guidelines for the first-line treatment of restless legs syndrome/Willis-Ekbom disease, prevention and treatment of dopaminergic augmentation: a combined task force of the IRLSSG, EURLSSG, and the RLS-foundation. Sleep medicine, 21, 1-11. [PubMed:27448465] [WorldCat] [DOI] - ↑
García-Borreguero, D., Allen, R.P., Benes, H., Earley, C., Happe, S., Högl, B., ..., & Winkelmann, J. (2007).
Augmentation as a treatment complication of restless legs syndrome: concept and management. Movement disorders : official journal of the Movement Disorder Society, 22 Suppl 18, S476-84. [PubMed:17580331] [WorldCat] [DOI] - ↑
Paulus, W., & Trenkwalder, C. (2006).
Less is more: pathophysiology of dopaminergic-therapy-related augmentation in restless legs syndrome. The Lancet. Neurology, 5(10), 878-86. [PubMed:16987735] [WorldCat] [DOI] - ↑ 43.0 43.1
Takahashi, M., Nishida, S., Nakamura, M., Kobayashi, M., Matsui, K., Ito, E., ..., & Inoue, Y. (2017).
Restless legs syndrome augmentation among Japanese patients receiving pramipexole therapy: Rate and risk factors in a retrospective study. PloS one, 12(3), e0173535. [PubMed:28264052] [PMC] [WorldCat] [DOI] - ↑ 44.0 44.1
Trenkwalder, C., Högl, B., Benes, H., & Kohnen, R. (2008).
Augmentation in restless legs syndrome is associated with low ferritin. Sleep medicine, 9(5), 572-4. [PubMed:17921065] [WorldCat] [DOI] - ↑
Inoue, Y., Hirata, K., Kuroda, K., Fujita, M., Shimizu, T., Emura, N., ..., & Nozawa, T. (2010).
Efficacy and safety of pramipexole in Japanese patients with primary restless legs syndrome: A polysomnographic randomized, double-blind, placebo-controlled study. Sleep medicine, 11(1), 11-6. [PubMed:19962941] [WorldCat] [DOI] - ↑
Winkelmann, J., Allen, R.P., Högl, B., Inoue, Y., Oertel, W., Salminen, A.V., ..., & Sampaio, C. (2018).
Treatment of restless legs syndrome: Evidence-based review and implications for clinical practice (Revised 2017)§. Movement disorders : official journal of the Movement Disorder Society, 33(7), 1077-1091. [PubMed:29756335] [WorldCat] [DOI] - ↑
Mellick, G.A., & Mellick, L.B. (1996).
Management of restless legs syndrome with gabapentin (Neurontin) Sleep, 19(3), 224-6. [PubMed:8723380] [WorldCat] [DOI] - ↑ 48.0 48.1
Allen, R.P., Chen, C., Garcia-Borreguero, D., Polo, O., DuBrava, S., Miceli, J., ..., & Winkelman, J.W. (2014).
Comparison of pregabalin with pramipexole for restless legs syndrome. The New England journal of medicine, 370(7), 621-31. [PubMed:24521108] [WorldCat] [DOI] - ↑
Inoue, Y., Hirata, K., Uchimura, N., Kuroda, K., Hattori, N., & Takeuchi, M. (2013).
Gabapentin enacarbil in Japanese patients with restless legs syndrome: a 12-week, randomized, double-blind, placebo-controlled, parallel-group study. Current medical research and opinion, 29(1), 13-21. [PubMed:23121149] [WorldCat] [DOI] - ↑
Inoue, Y., Hirata, K., Hoshino, Y., & Yamaguchi, Y. (2021).
Difference in background factors between responders to gabapentin enacarbil treatment and responders to placebo: pooled analyses of two randomized, double-blind, placebo-controlled studies in Japanese patients with restless legs syndrome. Sleep medicine, 85, 138-146. [PubMed:34329897] [WorldCat] [DOI] - ↑
Garcia-Borreguero, D., Cano-Pumarega, I., & Marulanda, R. (2018).
Management of treatment failure in restless legs syndrome (Willis-Ekbom disease). Sleep medicine reviews, 41, 50-60. [PubMed:29602660] [WorldCat] [DOI] - ↑
Allen, R.P., Picchietti, D.L., Auerbach, M., Cho, Y.W., Connor, J.R., Earley, C.J., ..., & International Restless Legs Syndrome Study Group (IRLSSG) (2018).
Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report. Sleep medicine, 41, 27-44. [PubMed:29425576] [WorldCat] [DOI] - ↑
Trotti, L.M., & Becker, L.A. (2019).
Iron for the treatment of restless legs syndrome. The Cochrane database of systematic reviews, 1, CD007834. [PubMed:30609006] [PMC] [WorldCat] [DOI]