「シナプス」の版間の差分
細 (→関連項目) |
細編集の要約なし |
||
| (2人の利用者による、間の3版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/tamune-tky 田宗 秀隆]、[http://researchmap.jp/Hirohide_Iwasaki 岩崎 広英]、[http://researchmap.jp/shigeookabe 岡部 繁男]</font><br> | <font size="+1">[http://researchmap.jp/tamune-tky 田宗 秀隆]、[http://researchmap.jp/Hirohide_Iwasaki 岩崎 広英]、[http://researchmap.jp/shigeookabe 岡部 繁男]</font><br> | ||
''東京大学大学院医学系研究科・神経細胞生物学分野''<br> | ''東京大学大学院医学系研究科・神経細胞生物学分野''<br> | ||
DOI:<selfdoi /> 原稿受付日:2013年11月5日 原稿完成日:2013年11月21日<br> | |||
担当編集委員:[http://researchmap.jp/ | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
英語名:synapse 独:Synapse 仏:synapse | 英語名:synapse 独:Synapse 仏:synapse | ||
{{box|text= シナプスとは、神経情報を出力する側と入力される側の間に発達した、情報伝達のための接触構造である。最も基本的な構造はシナプス前細胞の軸索末端がシナプス後細胞の[[樹状突起]]に接触しているものである。シナプスには大別して[[化学シナプス]] chemical synapseと[[電気シナプス]] electrical synapseがあり、出力する側の細胞を[[シナプス前細胞]]、入力される側の細胞を[[シナプス後細胞]] | {{box|text= シナプスとは、神経情報を出力する側と入力される側の間に発達した、情報伝達のための接触構造である。最も基本的な構造はシナプス前細胞の軸索末端がシナプス後細胞の[[樹状突起]]に接触しているものである。シナプスには大別して[[化学シナプス]] chemical synapseと[[電気シナプス]] electrical synapseがあり、出力する側の細胞を[[シナプス前細胞]]、入力される側の細胞を[[シナプス後細胞]]という。中枢神経系の多くのシナプスを占める[[化学シナプス]]では、[[活動電位]]の到来により、[[シナプス前部]]の[[電位依存性カルシウムチャネル]]が開口し、その結果[[カルシウム]]が流入し、[[シナプス顆粒]]の[[開口放出]]を引き起こす。その結果シナプス顆粒に含まれている[[神経伝達物質]]が[[シナプス間隙]]に放出される。神経伝達物質は、[[シナプス後部]]にある[[神経伝達物質受容体]]に結合し、直接[[膜電位]]を変化させるか[[細胞内二次メッセンジャー]]を活性化する事で伝達を行う。化学シナプスは[[興奮性シナプス]]と[[抑制性シナプス]]に細分される。一方、電気シナプスは接触膜上の[[ギャップ結合]]を介して、膜電位変化を直接的に次の神経細胞に伝える構造である。このように受け取られたシナプス電位が[[細胞体]]まで伝わり、[[軸索小丘]]で統合され、最終的にシナプス後細胞が[[発火]]するかどうかが決まる。この影響の相互作用を[[神経統合]]と呼ぶ。またシナプス伝達の効率は必ずしも一定ではなく、入力の強度により変化する。これを[[シナプス可塑性]]と呼び、[[学習]]・[[記憶]]の細胞メカニズムであると考えられている。}} | ||
[[image:Complete_neuron_cell_diagram_en.png|thumb|350px|'''図1.ニューロン(神経細胞)の構造図'''<br>Dendrites=樹状突起、Rough ER (Nissl body)=粗面小胞体(ニッスル小体)、Polyribosomes=ポリリボソーム、Ribosomes=リボソーム、Golgi apparatus=ゴルジ体、Nucleus=細胞核、Nucleolus=核小体、Membrane=膜、Microtubule=微小管、Mitochondrion=ミトコンドリア、Smooth [[ER]]=滑面小胞体、Synapse (Axodendritic)=軸索樹状突起間シナプス、Synapse=シナプス、Microtubule Neurofibrils=[[微小管]]ニューロフィラメント、Neurotransmitter=神経伝達物質、Receptor=受容体、Synaptic vesicles=シナプス小胞、Synaptic cleft=シナプス間隙、Axon terminal=軸索末端、Node of Ranvier =[[ランヴィエの絞輪]] 、Myelin Sheath (Schwann cell)= シュワン細胞のミエリン鞘、Axon hillock=軸索小丘、 Nucleus (Schwann cell)=シュワン細胞の細胞核、Microfilament=[[マイクロフィラメント]]、Axon=軸索。Wikipediaより引用。]] | [[image:Complete_neuron_cell_diagram_en.png|thumb|350px|'''図1.ニューロン(神経細胞)の構造図'''<br>Dendrites=樹状突起、Rough ER (Nissl body)=粗面小胞体(ニッスル小体)、Polyribosomes=ポリリボソーム、Ribosomes=リボソーム、Golgi apparatus=ゴルジ体、Nucleus=細胞核、Nucleolus=核小体、Membrane=膜、Microtubule=微小管、Mitochondrion=ミトコンドリア、Smooth [[ER]]=滑面小胞体、Synapse (Axodendritic)=軸索樹状突起間シナプス、Synapse=シナプス、Microtubule Neurofibrils=[[微小管]]ニューロフィラメント、Neurotransmitter=神経伝達物質、Receptor=受容体、Synaptic vesicles=シナプス小胞、Synaptic cleft=シナプス間隙、Axon terminal=軸索末端、Node of Ranvier =[[ランヴィエの絞輪]] 、Myelin Sheath (Schwann cell)= シュワン細胞のミエリン鞘、Axon hillock=軸索小丘、 Nucleus (Schwann cell)=シュワン細胞の細胞核、Microfilament=[[マイクロフィラメント]]、Axon=軸索。Wikipediaより引用。]] | ||
== 歴史 == | == 歴史 == | ||
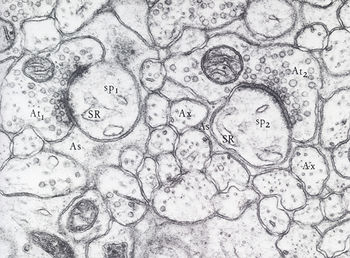
[[wj:サンティアゴ・ラモン・イ・カハール|Cajal]]が1888年に[[小脳]] | [[wj:サンティアゴ・ラモン・イ・カハール|Cajal]]が1888年に[[小脳]]で神経細胞同士が接触していることを明らかにしているが、明確に区分された構造物としてシナプスが観察されたのは1897年がはじめてである(図1)。 | ||
「シナプス」の名付け親は[[wj:チャールズ・シェリントン|Sherrington]]であり、1897年に神経細胞が別の神経細胞につながる特徴的な構造を指して、synapsis(ギリシャ語で、”to clasp”:「留め具」や「握手」といった意味)と呼んだ。synapsisという言葉は多少改変され、1904年にはSherrington自身もsynapseと呼んでいる<ref name=ref2>'''Purves and Lichtman'''<br>"Principles of Neural Development" <br>''Sinauer Associates Inc'', 1985</ref>。 | 「シナプス」の名付け親は[[wj:チャールズ・シェリントン|Sherrington]]であり、1897年に神経細胞が別の神経細胞につながる特徴的な構造を指して、synapsis(ギリシャ語で、”to clasp”:「留め具」や「握手」といった意味)と呼んだ。synapsisという言葉は多少改変され、1904年にはSherrington自身もsynapseと呼んでいる<ref name=ref2>'''Purves and Lichtman'''<br>"Principles of Neural Development" <br>''Sinauer Associates Inc'', 1985</ref>。 | ||
| 130行目: | 130行目: | ||
ニューレキシン/ニューロリギンなどの[[シナプス接着分子]]の異常は[[精神疾患]]とも深く関わることが明らかになっており、[[エピゲノミック]]な制御や[[コピー数多型]]などの新しい知見も含めて今後の研究の発展が望まれる<ref><pubmed> 20510934 </pubmed></ref> <ref><pubmed> 19563756 </pubmed></ref>。 | ニューレキシン/ニューロリギンなどの[[シナプス接着分子]]の異常は[[精神疾患]]とも深く関わることが明らかになっており、[[エピゲノミック]]な制御や[[コピー数多型]]などの新しい知見も含めて今後の研究の発展が望まれる<ref><pubmed> 20510934 </pubmed></ref> <ref><pubmed> 19563756 </pubmed></ref>。 | ||
[[ | 新規研究法の開発も目覚しい。[[二光子励起顕微鏡法]]や神経伝達物質の [[ケージド試薬|アンケージング]]法により、スパイン形成の機構に迫る試みがなされており、[[細胞骨格]]タンパク質や[[足場タンパク質]]の関与もホットなトピックである<ref><pubmed> 15190253 </pubmed></ref> <ref><pubmed> 15378037 </pubmed></ref>。 | ||
[[w:Karl Deisseroth|Deisseroth]]らによる[[光遺伝学]] optogeneticsにより、光学的に細胞の膜電位を制御できるようになり、シナプス・細胞レベルと回路レベルをつなぐ重要なツールになると考えられる<ref><pubmed> 21692661</pubmed></ref>。 | |||
また、従来は神経細胞間の伝達のみだと思われてきたシナプスだが、近年グリアの関与が重要であることがわかってきている。 | また、従来は神経細胞間の伝達のみだと思われてきたシナプスだが、近年グリアの関与が重要であることがわかってきている。 | ||
2014年6月26日 (木) 11:22時点における最新版
田宗 秀隆、岩崎 広英、岡部 繁男
東京大学大学院医学系研究科・神経細胞生物学分野
DOI:10.14931/bsd.4438 原稿受付日:2013年11月5日 原稿完成日:2013年11月21日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:synapse 独:Synapse 仏:synapse
シナプスとは、神経情報を出力する側と入力される側の間に発達した、情報伝達のための接触構造である。最も基本的な構造はシナプス前細胞の軸索末端がシナプス後細胞の樹状突起に接触しているものである。シナプスには大別して化学シナプス chemical synapseと電気シナプス electrical synapseがあり、出力する側の細胞をシナプス前細胞、入力される側の細胞をシナプス後細胞という。中枢神経系の多くのシナプスを占める化学シナプスでは、活動電位の到来により、シナプス前部の電位依存性カルシウムチャネルが開口し、その結果カルシウムが流入し、シナプス顆粒の開口放出を引き起こす。その結果シナプス顆粒に含まれている神経伝達物質がシナプス間隙に放出される。神経伝達物質は、シナプス後部にある神経伝達物質受容体に結合し、直接膜電位を変化させるか細胞内二次メッセンジャーを活性化する事で伝達を行う。化学シナプスは興奮性シナプスと抑制性シナプスに細分される。一方、電気シナプスは接触膜上のギャップ結合を介して、膜電位変化を直接的に次の神経細胞に伝える構造である。このように受け取られたシナプス電位が細胞体まで伝わり、軸索小丘で統合され、最終的にシナプス後細胞が発火するかどうかが決まる。この影響の相互作用を神経統合と呼ぶ。またシナプス伝達の効率は必ずしも一定ではなく、入力の強度により変化する。これをシナプス可塑性と呼び、学習・記憶の細胞メカニズムであると考えられている。
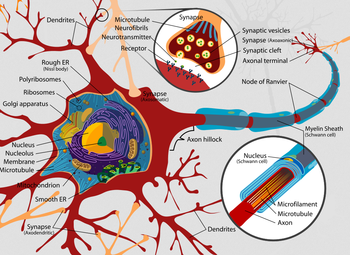
Dendrites=樹状突起、Rough ER (Nissl body)=粗面小胞体(ニッスル小体)、Polyribosomes=ポリリボソーム、Ribosomes=リボソーム、Golgi apparatus=ゴルジ体、Nucleus=細胞核、Nucleolus=核小体、Membrane=膜、Microtubule=微小管、Mitochondrion=ミトコンドリア、Smooth ER=滑面小胞体、Synapse (Axodendritic)=軸索樹状突起間シナプス、Synapse=シナプス、Microtubule Neurofibrils=微小管ニューロフィラメント、Neurotransmitter=神経伝達物質、Receptor=受容体、Synaptic vesicles=シナプス小胞、Synaptic cleft=シナプス間隙、Axon terminal=軸索末端、Node of Ranvier =ランヴィエの絞輪 、Myelin Sheath (Schwann cell)= シュワン細胞のミエリン鞘、Axon hillock=軸索小丘、 Nucleus (Schwann cell)=シュワン細胞の細胞核、Microfilament=マイクロフィラメント、Axon=軸索。Wikipediaより引用。
歴史
Cajalが1888年に小脳で神経細胞同士が接触していることを明らかにしているが、明確に区分された構造物としてシナプスが観察されたのは1897年がはじめてである(図1)。
「シナプス」の名付け親はSherringtonであり、1897年に神経細胞が別の神経細胞につながる特徴的な構造を指して、synapsis(ギリシャ語で、”to clasp”:「留め具」や「握手」といった意味)と呼んだ。synapsisという言葉は多少改変され、1904年にはSherrington自身もsynapseと呼んでいる[1]。
神経細胞同士がシナプスで相互作用していることが光学顕微鏡により明らかになっても、形態的・機能的に神経細胞はつながっているのか否かの論争は50年以上にわたり続いた。Cajalのニューロン説(形態的には非連続で接触contiguityしている)とGolgiの網状説(形態的に連続continuityしている)は、1950年代に電子顕微鏡によりシナプス間隙があることが観察され、ニューロン説が正しいことが示された。情報伝達が化学的であるのか電気的であるのかはいわゆる「泡か電撃か」”soup versus spark” 論争である。1950年代後半になって多くのシナプスは化学シナプスである(電子顕微鏡でシナプス小胞が観察された)が、一部は明らかに電気シナプスであり、稀には化学的にも電気的にも情報伝達を行うシナプスがあることがわかった[2] [3]。
その後、Loewiによる水溶性情報伝達物質(後にアセチルコリンと同定)の発見をはじめ、化学シナプスにおける情報伝達に関わる様々な分子が巧妙な実験により明らかになり、Katzらのシナプス小胞仮説vesicle hypothesis(情報伝達が量子的単位を持っているという仮説)につながっていく。同時期には標本固定法と顕微鏡法が発達し、形態と機能の両面から研究が発展する足がかりとなった[2] [3]。
1970年代、80年代前半には、アセチルコリン以外の神経伝達物質や、カルシウムイオンの下流の機構が次々と明らかになった。クローニングの技術と相まって、遺伝学的な探索ができるようになり、臨床分野の神経内科や精神科との関わりがはじまったのもこの頃である。
1973年にはBliss & Lømoにより海馬における長期増強 Long-Term Potentiation (LTP)が報告され、1982年には伊藤正男らにより小脳における長期抑圧 Long-Term Depressionが報告された。
1980年代頃からは分子生物学を用いて、シナプス形成 synaptogenesisやシナプス可塑性 synaptic plasticityが重要な研究テーマとして認識されるようになった[4][2] [3]。
1990年代には、Kandelらにより、アメフラシを用いて行動の「慣れ」と「感作」に関連するシナプスの研究が進み、動物の学習行動の基盤にシナプス伝達効率の変化が存在し、その実体がカリウムチャネルの活性化と抑制であることが示された。なお、他に有名なモデルシナプスとしては、イカのGiant synapseや、聴覚中枢のCalyx of Heldなどがある[2] [5]。
その後現在に至るまで、遺伝子・分子・細胞・神経回路・脳・個体など、多様な階層で精力的な研究が行われている。
用法上の注意点
シナプスが広い意味で使われている場合がある。
- 例えば神経筋接合部(NMJ; neuromuscular junction)や、腺に分布する神経終末をシナプスと呼ぶか
- 2つの神経終末がお互いにシナプス前・シナプス後の特性を持っているものをシナプスと呼ぶか
- 樹状突起―樹状突起、軸索―軸索同士の接触をシナプスと呼ぶか
など、「シナプス」の使用方法には一部コンセンサスがない部分もあり、注意が必要である[1]。
このページでは、上に述べたものも広い意味でシナプスと捉えて解説するが、一般的には、特に注釈を付けずに「シナプス」といった場合、化学シナプスを指すことが多い。
化学シナプス
電気信号として情報伝達されたシナプス前細胞が、シナプス前終末で化学的な情報伝達物質としてその情報を出力し、シナプス後細胞が化学的情報を受容体で受け取る仕組みを化学シナプスという[4]。
構造
図2に示したとおり、化学シナプスは、基本的に2つの細胞膜(シナプス前膜・シナプス後膜)からなり、向かい合った細胞膜同士の隙間をシナプス間隙 synaptic cleftと呼ぶ。
情報伝達には基本的には方向性があるので、情報の出力する側をシナプス前細胞(シナプス前ニューロン)、入力される側をシナプス後細胞(シナプス後ニューロン)と呼ぶ。
多くの場合、シナプス前要素 presynaptic elementsは軸索終末であり、その構造から終末ボタン presynaptic boutonと呼ばれる。シナプス間隙に面する軸索膜(シナプス前膜)には、電子密度が高い裏打ち構造を持つ部位があり、アクティブゾーン(活性部位; active zone)という。アクティブゾーンは後述するように、開口放出の場と考えられている。
一方、多くの場合、シナプス後要素 postsynaptic elementは細胞体や樹状突起dendriteである。シナプス間隙を挟んだアクティブゾーンの対向面には膜の電子密度が高い裏打ち構造(シナプス後肥厚部:postsynaptic density (PSD))が厚く発達している[4] [7]。
シナプス前膜の厚さにくらべシナプス後肥厚部が極端に厚いものを非対称性シナプス asymmetrical synapse(Gray 1型)と呼び、興奮性シナプス excitatory synapseの特徴とされている。シナプス間隙は約30 nmと広く、シナプス前終末のシナプス小胞の形状は小型球形である。なお、興奮性シナプスが樹状突起に投射する場合、樹状突起棘 dendritic spineという特徴的な構造をとることがある。
一方、シナプス前膜の厚さとシナプス後肥厚部の厚さがあまり変わらないものを対称性シナプス symmetrical synapse(Gray 2型)と呼び、抑制性シナプス inhibitory synapseの特徴とされている。シナプス間隙は約20 nm弱であり、興奮性シナプスのシナプス間隙に比べて狭い[4] [7]。
軸索―軸索のシナプスや樹状突起―樹状突起のシナプスの存在も知られており、また、軸索の途中でシナプスをつくるen passant終末などの構造を取る場合もあるので、それらは各項目・成書を参照されたい。
機能
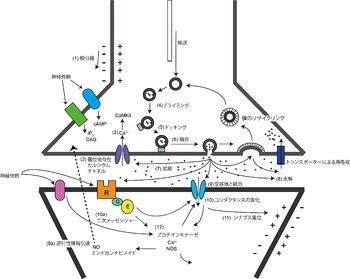
(1) シナプス前細胞の軸索で活動電位(膜の脱分極)が伝わり、シナプス前終末まで到達する。
(2) カルシウムイオンがシナプス前終末に流入する。
(3) カルシウムイオンの下流で一連のシグナル伝達が引き起こされる。
(4,5) シナプス小胞 synaptic vesicleが細胞膜と結合する。
(6) 神経伝達物質 neurotransmitterのパケットpacket (quantum)が開口放出される。
(7) 伝達物質がシナプス間隙 synaptic cleftを拡散する。
(8) 一部は分解されたり、前終末に再び取り込まれてリサイクルされたりする。
(9) シナプス後部で適切な受容体と結合した情報伝達物質は、
(10) イオン透過型受容体 ionotropic receptorのコンダクタンス(イオンの通りやすさ)を変化させる。
(11) これによってシナプス電位(膜電位、シナプス後電位ともいう)が変化し、シナプス後部の興奮が引き起こされる。
イオン透過型受容体によって制御されるこの機構は、速い情報伝達(1-20 msec程度)を担い、知覚、反射、自発運動を引き起こす。情報がシナプスを通過するのにかかる時間をシナプス遅延 synaptic delayと呼ぶ。
(10a) なお、情報伝達物質は代謝型受容体 metabotropic receptorをも活性化し、(12)セカンドメッセンジャー second messengerを通じて、他の代謝性効果も引き起こす。
(9a) シナプス前終末もまた情報伝達物質の標的である。 シナプス後部ではNitric oxide synthase(NOS; 一酸化窒素合成酵素)がセカンドメッセンジャーである一酸化窒素や2-アラキドノイルグリセロール(2-AG)などをはじめとするエンドカンナビノイドが産生されることで、活動依存的にシナプス前終末の情報伝達物質の放出を調節している。この機構は、逆行性情報伝達とも呼ばれており、現在ではシナプスはただ単に一方向性の情報伝達を行うだけではなく、より複雑な、両方向性を持った細胞同士の接点と認識されている[8]。
種類
伝えられる情報により、化学シナプスは興奮性シナプス、抑制性シナプスに大別される。
興奮性シナプス
シナプス前細胞の発火がシナプス後細胞の興奮(脱分極)を促す。その機構として、興奮性シナプス電位(EPSP)・興奮性シナプス電流(EPSC)があり、情報伝達物質としてはグルタミン酸が有名である。
抑制性シナプス
シナプス前細胞の発火がシナプス後細胞の発火を抑制(過分極)する。その機構として、抑制性シナプス電位(IPSP)・興奮性シナプス電流(IPSC)があり、情報伝達物質としてはGABAやグリシンが有名である[2]。
興奮性シナプスによるEPSPを減少させる働きを指してシナプス前抑制性、と呼ぶことがあるため、抑制性シナプスを特に「シナプス後抑制性」と区別して呼ぶこともある。
神経統合
神経細胞がシナプスを介して相互に結合し、活動電位がいかにして神経伝達物質の放出を引き起こすかを解説してきたが、シナプス後細胞では、受け取った興奮性シナプス電位と抑制性シナプス電位が細胞体まで伝わり、軸索小丘 axon hillockで統合され、最終的に発火するかどうかが決まる。この影響の相互作用を神経統合 neural integrationと呼ぶ[9]。
ここで重要なのは、神経細胞同士の結合は1対1とは限らず、1対多、多対1であることが多いということである。すなわち、1つの神経細胞が多くの神経細胞に投射することを発散divergenceといい、多くの神経細胞から1つの神経細胞が投射を受けることを収斂convergenceという。実際には、多対多の投射が演算されて神経回路が形成されている[4]。
なお、抑制性シナプスの発火は、必ずしも行動レベルでの抑制につながるわけではないので注意する必要がある[9]。
シナプス一つの性質をとっても、シナプスの活動状態によって情報伝達効率が変化する性質があり、これをシナプス可塑性と呼ぶ。
先ほど述べたように、シナプスでは、シナプス後部でAMPA型グルタミン酸受容体などの発現量を変える機構や、逆行性情報伝達によってシナプス前細胞の開口放出の特性を変える機構が備わっており、神経統合の際の重み付けも含め、記憶や学習に重要な役割を果たしていると考えられている[4]。
電気シナプス
電気シナプスは接触膜上の電気抵抗の低いところを介して、膜電位変化を直接的に次の神経細胞に伝える構造である。無脊椎動物で主要なシナプスで、系統発生的には化学シナプスより古いものであると考えられている。しかし、哺乳動物の脳でも下オリーブ核などの部位では観察されており、高等動物においても多くの神経細胞が同期して働くための重要な機構であると考えられている。
電気シナプスの本体は、ギャップ結合 gap junctionである。シナプス前膜と後膜の脂質二重膜が3 nmほどの狭い隙間を挟んで対向しており、両膜上に対になって分布する膜貫通型チャネルタンパク粒子コネクソン connexonによって連結されている。コネクソン一つは、6個のコネキシン分子が輪状に配列した構造をしており、コネクソン中心に前膜と後膜を貫く穴central channelが作られ、これによってシナプス前後の細胞質間でイオン分子などの低分子の物質交換を可能にしている[4]。
シナプスの形成・維持
シナプス形成のはじめのステップは軸索と樹状突起の相互認識の過程である。この過程には、軸索誘導 axon guidanceや、ニューレキシン/ニューロリギンなどのシナプス形成分子による標的認識target recognitionをはじめ、様々な機構が関与しており、シナプスの多様性と標的特異性を確保していると考えられている[4]。
シナプスの維持にはシナプス接着因子が重要な役割を果たしているが、活動依存的で特徴的な維持機構も存在すると考えられている。
シナプス形成段階初期で、過剰なシナプスを形成し、発達過程において必要な結合だけが強められ、不要な結合が除去されて成熟した機能的な神経回路が完成する過程をシナプスの刈り込み synaptic prunningと呼ぶ。
また、シナプス前細胞の発火がシナプス後細胞を発火させるとその神経細胞同士の結合が強くなるというヘブ則 Hebbian learnin ruleが知られている。
活動が亢進したシナプスは、よりシナプスが安定になりやすい「タグ」がつくというシナプスタグ仮説 synaptic tagging hypothesisも提唱されている。
脳損傷を受けると、神経細胞が新しく突起を伸ばして他の細胞に投射する、発芽と呼ばれる過程が引き起こされる。シナプスレベルで新しい結合が生まれることをシナプス発芽という。一方、定常状態でも一定の割合でシナプスが絶えず形成と消滅を繰り返していることも明らかになっており、複雑な神経回路の形成と維持に寄与していると考えられる。
研究の展望
シナプスの研究は、19世紀より神経科学者を魅了してきた。基本的な構造と機能は明らかになったものの、シナプス形成・維持の機構や神経回路レベルでの研究は未解明の部分が多い。
シナプス前終末からの伝達物質放出機構についての研究では、開口放出に関連する分子群の機能解析が構造生物学的なデータの蓄積を含めて着実に進展しており、さらに遺伝子改変動物を利用した研究を統合することで、シナプス前終末における分子機構の包括的な理解が進むことが期待される。
ニューレキシン/ニューロリギンなどのシナプス接着分子の異常は精神疾患とも深く関わることが明らかになっており、エピゲノミックな制御やコピー数多型などの新しい知見も含めて今後の研究の発展が望まれる[10] [11]。
新規研究法の開発も目覚しい。二光子励起顕微鏡法や神経伝達物質の アンケージング法により、スパイン形成の機構に迫る試みがなされており、細胞骨格タンパク質や足場タンパク質の関与もホットなトピックである[12] [13]。
Deisserothらによる光遺伝学 optogeneticsにより、光学的に細胞の膜電位を制御できるようになり、シナプス・細胞レベルと回路レベルをつなぐ重要なツールになると考えられる[14]。
また、従来は神経細胞間の伝達のみだと思われてきたシナプスだが、近年グリアの関与が重要であることがわかってきている。 すなわち、三者間シナプス tripartite synapseとして、アストロサイト astrocyteが積極的に情報伝達に関与しているという仮説や、アストロサイト・ミクログリア microgliaがシナプスの維持を制御しているという知見である[15]。
シナプス研究は一般的な多細胞の情報伝達のモデル系であるとともに、脳とこころの生物学的理解を目指す研究全体の基礎となる。よりミクロにはゲノム科学やタンパク質構造科学の進歩が、よりマクロにはシナプスを分子機械として包括的に理解するためのシステムバイオロジーが発達し、研究成果が統合されることで、新たな脳科学のブレイクスルーが生まれることが期待される。
関連項目
- 電気シナプス
- ギャップ結合
- シナプス間隙
- シナプス形成
- シナプス後電位
- シナプス後電流
- シナプス後肥厚
- シナプス後膜
- シナプス後要素
- シナプス前膜
- シナプス前抑制
- シナプス遅延
- シナプス伝達
- シナプス電位
- シナプス発芽
- シナプス発散
- 化学シナプス
- シナプスタグ仮説
- シナプスの刈り込み
- シナプス可塑性
- シナプス小胞
- シナプス接着分子
- アクティブゾーン
- 神経筋接合部
- 興奮性シナプス
- 抑制性シナプス
参考文献
- ↑ 1.0 1.1 Purves and Lichtman
"Principles of Neural Development"
Sinauer Associates Inc, 1985 - ↑ 2.0 2.1 2.2 2.3 2.4 Cowan, Sudhof and Stevens
"Synapses"
The Johns Hopkins University Press, 2001 - ↑ 3.0 3.1 3.2 Kuno
"The Synapse: Function, Plasticity, and Neurotrophism"
Oxford University Press, 1995 - ↑ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7 甘利俊一監修・古市貞一編
「シリーズ脳科学5―分子・細胞・シナプスからみる脳」
東京大学出版会、2008 - ↑ Kandel, Schwartz and Jessell
"Principles of Neural Science 4th ed."
McGraw-Hill Medical, 2000 - ↑ Peters, Palay and Webster
"Fine Structure of the Nervous System: Neurons and Their Supporting Cells"
Oxford University Press, 1991 - ↑ 7.0 7.1 Shepherd
"The Synaptic Organization of the Brain 5th ed."
Oxford University Press, 2004 - ↑ Shepherd
"The Synaptic Organization of the Brain 4th ed."
Oxford University Press, 1998 - ↑ 9.0 9.1 Neil R.Carlson著、泰羅雅登・中村克樹監訳
「第3版 カールソン 神経科学テキスト 脳と行動」
丸善株式会社、2010 - ↑
Baudouin, S., & Scheiffele, P. (2010).
SnapShot: Neuroligin-neurexin complexes. Cell, 141(5), 908, 908.e1. [PubMed:20510934] [WorldCat] [DOI] - ↑
Nakatani, J., Tamada, K., Hatanaka, F., Ise, S., Ohta, H., Inoue, K., ..., & Takumi, T. (2009).
Abnormal behavior in a chromosome-engineered mouse model for human 15q11-13 duplication seen in autism. Cell, 137(7), 1235-46. [PubMed:19563756] [PMC] [WorldCat] [DOI] - ↑
Matsuzaki, M., Honkura, N., Ellis-Davies, G.C., & Kasai, H. (2004).
Structural basis of long-term potentiation in single dendritic spines. Nature, 429(6993), 761-6. [PubMed:15190253] [PMC] [WorldCat] [DOI] - ↑
Kim, E., & Sheng, M. (2004).
PDZ domain proteins of synapses. Nature reviews. Neuroscience, 5(10), 771-81. [PubMed:15378037] [WorldCat] [DOI] - ↑
Fenno, L., Yizhar, O., & Deisseroth, K. (2011).
The development and application of optogenetics. Annual review of neuroscience, 34, 389-412. [PubMed:21692661] [PMC] [WorldCat] [DOI] - ↑
Allen, N.J., & Barres, B.A. (2009).
Neuroscience: Glia - more than just brain glue. Nature, 457(7230), 675-7. [PubMed:19194443] [WorldCat] [DOI]