「電位依存性カルシウムチャネル」の版間の差分
細編集の要約なし |
|||
| (2人の利用者による、間の27版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:Calcium channel | |||
同義語:電位依存性カルシウムチャネル (Voltage-dependent calcium channel : VDCC、Voltage-gated calcium channel : VGCC)<br> | |||
[[形質膜]]越えの[[カルシウム]]イオン (Ca<sup>2+</sup>) 流入経路として、異なる活性化機構により開口するカルシウムチャネルが知られる。 それらの中でも[[膜電位]]の[[脱分極]]によって開口する[[電位依存性カルシウムチャネル]] (Voltage-dependent calcium channel : VDCC) が最も深く研究されてきた。VDCCは神経細胞や筋細胞を始めとする興奮性細胞において、様々な分子と相互作用することにより[[神経伝達物質]]放出、[[wikipedia:ja:|筋]]収縮、[[遺伝子発現]]など様々なCa<sup>2+</sup>依存性の細胞応答を制御する。 本項目では他のカルシウムチャネルについても言及したい。 | |||
[[形質膜]]越えの[[カルシウム]]イオン (Ca<sup>2+</sup>) 流入経路として、異なる活性化機構により開口するカルシウムチャネルが知られる。 それらの中でも[[膜電位]]の[[脱分極]]によって開口する[[電位依存性カルシウムチャネル]] (Voltage-dependent calcium channel | |||
== 分類、構造、発現 | == 分類、構造、発現 == | ||
[[Image:Yasuomori fig 1.jpg|thumb|right|300px|<b>図1. VDCCのサブユニット構造</b><br />高電位活性化型のVDCCは、α<sub>1</sub>、α<sub>2</sub>δ、βおよびγサブユニットから成るヘテロ4量体を形成する。]] | [[Image:Yasuomori fig 1.jpg|thumb|right|300px|<b>図1. VDCCのサブユニット構造</b><br />高電位活性化型のVDCCは、α<sub>1</sub>、α<sub>2</sub>δ、βおよびγサブユニットから成るヘテロ4量体を形成する。]] | ||
VDCCは、形質膜の脱分極を感知して活性化開口し、細胞外から細胞内へCa<sup>2+</sup>を選択的に透過させる[[イオンチャネル]]であり、細胞の電気的興奮をCa<sup>2+</sup>依存的な生理応答に変換する役割を担う。開口する電位によりVDCCは、高電位 (~−20 mV)で活性化するL型 (Ca<sub>v</sub>1)および非L型 (Ca<sub>v</sub>2) と低電位 (~−60 mV) で活性するT型 (Ca<sub>v</sub>3) に大別される<ref name="ref1"><pubmed> 6087159 </pubmed></ref><ref><pubmed>2582115</pubmed></ref><ref name="ref3"><pubmed>16382099</pubmed></ref>。高電位活性化型のVDCCは、α<sub>1</sub>、α<sub>2</sub>δ、βおよびγサブユニットから成るヘテロ4量体を形成すると考えられている (図1)。 | VDCCは、形質膜の脱分極を感知して活性化開口し、細胞外から細胞内へCa<sup>2+</sup>を選択的に透過させる[[イオンチャネル]]であり、細胞の電気的興奮をCa<sup>2+</sup>依存的な生理応答に変換する役割を担う。開口する電位によりVDCCは、高電位 (~−20 mV)で活性化するL型 (Ca<sub>v</sub>1)および非L型 (Ca<sub>v</sub>2) と低電位 (~−60 mV) で活性するT型 (Ca<sub>v</sub>3) に大別される<ref name="ref1"><pubmed> 6087159 </pubmed></ref><ref><pubmed>2582115</pubmed></ref><ref name="ref3"><pubmed>16382099</pubmed></ref>。高電位活性化型のVDCCは、α<sub>1</sub>、α<sub>2</sub>δ、βおよびγサブユニットから成るヘテロ4量体を形成すると考えられている (図1)。 | ||
=== α<sub>1</sub>サブユニット | === α<sub>1</sub>サブユニット === | ||
[[Image:Yasuomori fig 3.jpg|thumb|right|300px|<b>図2. α<sub>1</sub>サブユニットの進化系統樹</b>]] | [[Image:Yasuomori fig 3.jpg|thumb|right|300px|<b>図2. α<sub>1</sub>サブユニットの進化系統樹</b>]] | ||
{| width="856" cellspacing="1" cellpadding="1" border="1" height="279" | |||
|- | |- | ||
| style=" | | style="text-align:center" | Ca<sup>2+</sup>電流 | ||
| style=" | | style="text-align:center" | α<sub>1</sub>サブユニット | ||
| style=" | | style="text-align:center" | 遺伝子 | ||
| style=" | | style="text-align:center" | 選択的阻害剤 | ||
| style=" | | style="text-align:center" | 主要な発現部位 | ||
| style=" | | style="text-align:center" | 主要な細胞機能 | ||
|- | |- | ||
| | | L型<br><br><br><br> | ||
| | | Ca<sub>v</sub>1.1<br>Ca<sub>v</sub>1.2<br>Ca<sub>v</sub>1.3<br>Ca<sub>v</sub>1.4 | ||
| | | CACNA1S<br>CACNA1C<br>CACNA1D<br>CACNA1F | ||
| | | DHP, PAA, BTZ<br><br><br><br> | ||
| | | 骨格筋<br>心臓、脳<br>内分泌組織、脳<br>網膜 | ||
| | | 筋収縮<br>筋収縮、遺伝子発現、シナプス可塑性<br>ホルモン分泌、遺伝子発現、シナプス可塑性<br>神経伝達物質放出 | ||
|- | |- | ||
| | | P/Q型<br>N型<br>R型 | ||
| | | Ca<sub>v</sub>2.1<br>Ca<sub>v</sub>2.2<br>Ca<sub>v</sub>2.3 | ||
| | | CACNA1A<br>CACNA1B<br>CACNA1E | ||
| | | ω-アガトキシンIVA<br>ω-コノトキシンGVIA<br>SNX-482 | ||
| 脳<br><br><br> | |||
| | | 神経伝達物質放出、ホルモン分泌<br>神経伝達物質放出、ホルモン分泌<br>神経伝達物質放出 | ||
|- | |- | ||
| T型<br><br><br> | |||
| Ca<sub>v</sub>3.1 | | Ca<sub>v</sub>3.1<br>Ca<sub>v</sub>3.2<br>Ca<sub>v</sub>3.3 | ||
| CACNA1G<br>CACNA1H<br>CACNA1I | |||
| | |||
| 脳、心臓<br>脳、心臓<br>脳 | |||
| ペースメイキング、反復性発火<br><br><br> | |||
| CACNA1I | |||
| 脳 | |||
| ペースメイキング、反復性発火 | |||
|} | |} | ||
'''図3. α<sub>1</sub>サブユニットの分類とその特性'''<br>α<sub>1</sub>サブユニットには10種類のアイソフォームが存在し、その電気生理学的特性や薬理学的特性によって分類、命名されている。 | |||
[[電位センサー]]とチャネル孔を有するα<sub>1</sub>サブユニットは、おおよそ2000アミノ酸残基からなるタンパク質であり、[[wikipedia:ja:|膜貫通領域]]S1~S6の構造単位が4回繰り返す (リピートI~IV) 。S5領域とS6領域の間がCa<sup>2+</sup>を選択的に透過させるチャネル孔を形成し、S4領域が電位センサーとして働く。α<sub>1</sub>サブユニットは10種類の異なる遺伝子Ca<sub>v</sub>によりコードされて、電気生理学的特性や薬理学的特性による機能分類 (L, P/Q, N, R, T) に対応付けられている (図2)<ref name="ref4"><pubmed>21746798</pubmed></ref>。 | |||
==== Ca<sub>v</sub>1 (L型) | ==== Ca<sub>v</sub>1 (L型) ==== | ||
[[ | [[L型]] (Ca<sub>v</sub>1) は遅い不活性化 (<u>L</u>ong lasting) と大きな (<u>L</u>arge) 単一チャネルコンダクタンスを有することから名づけられた<ref><pubmed>6207437</pubmed></ref>。ジヒドロピリジン(Dihydropyridine, DHP)やフェニルアルキルアミン(Phenylalkylamine, PAA)、ベンゾチアゼピン(Benzothiazepine, BTZ)といった[[Ca<sup>2+</sup>拮抗薬]]の作用点である。Ca<sub>v</sub>1.1は[[wikipedia:ja:|骨格筋]]、Ca<sub>v</sub>1.2は[[wikipedia:ja:|心臓]]や[[脳]]、Ca<sub>v</sub>1.3は[[wikipedia:ja:|膵臓]]などの[[wikipedia:ja:|内分泌組織]]や脳、Ca<sub>v</sub>1.4は[[網膜]]に主に発現している<ref name="ref3" />。 | ||
==== Ca<sub>v</sub>2 (N, P/Q, R型) | ==== Ca<sub>v</sub>2 (N, P/Q, R型) ==== | ||
非L型 (Ca<sub>v</sub>2) には[[ | 非L型 (Ca<sub>v</sub>2) には[[N]]、[[P/Q]]、[[R型]]が含まれる。N型 (Ca<sub>v</sub>2.2) には、L型ではない (<u>N</u>on-L) 、[[神経細胞]]に発現する (<u>N</u>euronal) という意味がある<ref name="ref6"><pubmed>2410796</pubmed></ref>。ペプチド性の[[wikipedia:ja:|イモ貝]]毒[[ω-コノトキシン GVIA]]により選択的に阻害される<ref><pubmed>2438698</pubmed></ref>。P型は[[小脳]][[プルキンエ]] (<u>P</u>urkinje) 細胞においてDHPとω-コノトキシン GVIAの両方に非感受性のCa<sup>2+</sup>電流として同定された<ref><pubmed> 2545128</pubmed></ref>。クモ毒[[ω-アガトキシンIVA]]によって選択的に阻害される<ref><pubmed>1321648</pubmed></ref>。Q型は、同じ遺伝子 (Ca<sub>v</sub>2.1) の[[wikipedia:ja:|スプライスバリアント]]であると考えられており<sup>[11]</sup>、小脳顆粒細胞において初めて電流が同定された。Q型はP型よりω-アガトキシンIVAに対する親和性が低い<ref><pubmed> 7722641</pubmed></ref>。R型 (Ca<sub>v</sub>2.3) は小脳顆粒細胞においてDHP、ω-コノトキシン GVIA、ω-アガトキシンIVAによって阻害されない残りの成分 (<u>R</u>esidual) という意味で名づけられ<ref><pubmed>10321243</pubmed></ref>、[[wikipedia:ja:|タランチュラ]]毒素[[SNX-482]]によって選択的に阻害される<ref><pubmed> 9799496</pubmed></ref>。これら非L型のVDCCは広く神経系に発現している<ref name="ref3" />。 | ||
==== Ca<sub>v</sub>3 (T型) ==== | |||
[[T型]] (Ca<sub>v</sub>3) は低電位 (~−60 mV) で活性化し、早い不活性化や遅い脱活性化 (一過的: <u>T</u>ransient)、小さい (<u>T</u>iny) 単一チャネルコンダクタンスを特徴とする<ref name="ref1" /><ref name="ref6" />。T型は脳に最も豊富に発現する他、心臓の[[wikipedia:ja:|ペースメーカー細胞]]にも発現している。T型は高閾値活性化型のVDCCとは異なり、α<sub>2</sub>δ、β、γサブユニットとの相互作用が確認されていない。<br> | |||
=== 副サブユニット (α<sub>2</sub>δ、β、γ) === | |||
α<sub>2</sub>δ、βおよびγサブユニットは、チャネル本体であるα<sub>1</sub>サブユニットの発現調節、機能調節や細胞内局在に重要であり、複数の遺伝子によってコードされている<ref name="ref13"><pubmed>3037387</pubmed></ref>。 | |||
大きな細胞外領域を有するα<sub>2</sub>δサブユニットは、単一の遺伝子にコードされるα<sub>2</sub>およびδが[[wikipedia:ja:|ジスルフィド結合]]によって結ばれた二量体で、4種類のアイソフォームが知られる (α<sub>2</sub>δ1-4)。α<sub>2</sub>δサブユニットは、α<sub>1</sub>サブユニットの形質膜への輸送に働いている<ref name="ref14"><pubmed>17403543</pubmed></ref>。α<sub>1</sub>サブユニットのリピートIとIIをつなぐ細胞内リンカーに結合するβサブユニットは、4種類のアイソフォームが知られている (β1-4)。このβサブユニットは、α<sub>1</sub>サブユニットの形質膜における機能的な発現に重要であり<ref name="ref15"><pubmed>1849233</pubmed></ref>、VDCCの活性化や不活性化を促進する<ref name="ref16"><pubmed>20959621</pubmed></ref>。各アイソフォームには複数のスプライスバリアントが存在し、発現分布やチャネル機能の調節に違いがある<ref name="ref16" />。γサブユニットは4回膜貫通のタンパク質であり、VDCCと相互作用することで不活性化曲線をシフトさせる<ref name="ref17"><pubmed>17652770</pubmed></ref>。γサブユニットには8種類のアイソフォームが存在し (γ1~8)、その中のいくつかのアイソフォームは、[[AMPA受容体]] (2-amino-3-[3-hydroxy-5-methyl-4-isoxazolyl]propionic acid receptor) の輸送や機能調節を担う主要なタンパク質[[TARPs]] (Transmembrane AMPA receptor regulatory proteins) とも呼ばれている<ref name="ref17" />。 | |||
大きな細胞外領域を有するα<sub>2</sub>δサブユニットは、単一の遺伝子にコードされるα<sub>2</sub>およびδが[[wikipedia:ja: | |||
== 機能 == | == 機能 == | ||
| 136行目: | 74行目: | ||
=== Ca<sub>v</sub>1 (L型) === | === Ca<sub>v</sub>1 (L型) === | ||
[[Image:Yasuomori fig 2.jpg|thumb|right|300px|<b>図4. α<sub>1</sub>サブユニットの構造</b><br /> 膜貫通領域S1~S6の構造単位が4回繰り返す (リピートI~IV) 。各リピートのS5領域とS6領域の間がCa<sup>2+</sup>を選択的に透過させるチャネル孔を形成し、S4領域が電位センサーとして働く。VDCCのβサブユニットはリピートI-II間のループに結合する。N, P/Q型VDCCのリピートII-III間のループには、 | [[Image:Yasuomori fig 2.jpg|thumb|right|300px|<b>図4. α<sub>1</sub>サブユニットの構造</b><br /> 膜貫通領域S1~S6の構造単位が4回繰り返す (リピートI~IV) 。各リピートのS5領域とS6領域の間がCa<sup>2+</sup>を選択的に透過させるチャネル孔を形成し、S4領域が電位センサーとして働く。VDCCのβサブユニットはリピートI-II間のループに結合する。N, P/Q型VDCCのリピートII-III間のループには、[[アクティブゾーン]]に存在するタンパク質との相互作用部位 (Synprint)が保存されている。[[カルモジュリン]](CaM)やAKAP、[[カルシニューリン]](CaN)はC末端側の細胞質領域に結合することが報告されている。]] | ||
L型は、骨格筋や心筋、[[wikipedia:ja:|平滑筋]]の収縮に始まり、ホルモンや神経伝達物質の放出、遺伝子発現まで様々な細胞応答に関わる。骨格筋の[[wikipedia:ja:|横行小管]] (T管) に発現するCa<sub>v</sub>1.1は、脱分極による構造変化を介して[[リアノジン受容体]]を直接活性化し、Ca<sup>2+</sup>放出を誘導することで筋収縮を引き起こす<ref name="ref18"><pubmed>1966760</pubmed></ref>。一方、心筋ではCa<sub>v</sub>1.2からのCa<sup>2+</sup>流入がCa<sup>2+</sup>依存的にリアノジン受容体を活性化し、筋収縮を引き起こす<ref name="ref19"><pubmed>6346892</pubmed></ref>。Ca<sub>v</sub>1.2およびCa<sub>v</sub>1.3は、膵臓のβ細胞におけるインスリン分泌も制御している<ref name="ref20"><pubmed>18511483</pubmed></ref>。また、Ca<sub>v</sub>1.3およびCa<sub>v</sub>1.4は感覚受容細胞の[[リボンシナプス]]における神経伝達物質放出に関与している<ref name="ref4" />。[[聴覚]][[有毛細胞]]ではCa<sub>v</sub>1.3が<ref name="ref21"><pubmed>9405708</pubmed></ref>、網膜の[[光受容細胞]]ではCa<sub>v</sub>1.4が神経伝達物質の放出を制御している<ref name="ref22"><pubmed>9174087</pubmed></ref>。神経細胞においては、L型は細胞体や細胞体近傍の[[樹状突起]]に局在しており、近い位置での細胞内Ca<sup>2+</sup>濃度 ([Ca<sup>2+</sup>]<sub>i</sub>) 上昇の引き金となり、下流で核内の[[シグナル伝達]]、およびCa<sup>2+</sup>濃度上昇を引き起こす<ref name="ref4" />。L型は、遺伝子発現に重要なシグナル分子である[[CaM]] (calmodulin) 、AKAP (A kinase anchor protein) ファミリー、[[チロシンリン酸化]]酵素であるSrc、[[脱リン酸化酵素]]である[[CaN]] (calcineurin) などと共役して働き (図4)、[[CREB]] ([[CAMP]] response element binding protein) <ref name="ref23"><pubmed>8980227</pubmed></ref>やNFAT (Nuclear factor of activated T-cells) といった[[転写因子]]の活性を調節することが知られる<ref name="ref4" /> 。 | |||
=== Ca<sub>v</sub>2 (N, P/Q, R型) === | === Ca<sub>v</sub>2 (N, P/Q, R型) === | ||
N、P/Q、R型は主に神経系に発現し、神経伝達物質放出を始めとする神経機能を制御する<ref name="ref24"><pubmed>7901765</pubmed></ref><ref name="ref25"><pubmed>7832825</pubmed></ref>。[[活動電位]]が[[シナプス前終末]]に達すると、N、P/Q、R型などのVDCCを介したCa<sup>2+</sup> | N、P/Q、R型は主に神経系に発現し、神経伝達物質放出を始めとする神経機能を制御する<ref name="ref24"><pubmed>7901765</pubmed></ref><ref name="ref25"><pubmed>7832825</pubmed></ref>。[[活動電位]]が[[シナプス前終末]]に達すると、N、P/Q、R型などのVDCCを介したCa<sup>2+</sup>流入が引き起こされ、神経伝達物質が放出される。シナプス前終末において神経伝達物質放出を効率的に制御するため、[[シナプス小胞]]の[[膜融合]]を制御する[[SNARE]] (soluble N-ethylmaleimide-sensitive factor attachment protein receptor ) タンパク質 ([[Syntaxin]]、[[SNAP-25]]、[[VAMP/synaptobrevin]])やCa<sup>2+</sup>センサーと考えられている[[Synaptotagmin]]、[[足場タンパク質]]として働く[[RIM]] ([[Rab]]-3 interacting molecule) ファミリー、CAST、Munc13、Bassoon、Piccoloといったタンパク質群とVDCCは巨大タンパク質複合体である、[[アクティブゾーン]]を形成している。N、P/Q型のα<sub>1</sub>サブユニットのII-IIIリンカーにはアクティブゾーンに存在するタンパク質との相互作用部位 (Synprint ; synaptic protein interaction) が保存されており、syntaxinやSNAP-25、CSP (cysteine string protein)、RIM、synaptotagminと相互作用する (図4) <ref name="ref4" /><ref name="ref26"><pubmed>16942804</pubmed></ref>。syntaxinやSNAP-25はsynprint領域を介してVDCCと相互作用し、チャネルの不活性化状態を安定化させることでチャネル活性を抑制することが報告されている<ref name="ref26" />。また、βサブユニットもCASTやRIM、synaptotagminといったアクティブゾーンに存在するタンパク質と相互作用する (図4) <ref name="ref27"><pubmed>22577167</pubmed></ref><ref name="ref28"><pubmed>17496890</pubmed></ref><ref name="ref29"><pubmed>16525042</pubmed></ref>。これらのタンパク質との相互作用は、神経伝達物質放出複合体を形成し、VDCCの機能修飾も担う。RIM1のα型バリアント (RIM1α) はシナプス小胞のRab-3と相互作用する足場タンパク質であることから、VDCCとシナプス小胞の距離を規定する分子である可能性が高い<ref name="ref30"><pubmed> 9252191</pubmed></ref>。4種類のRIM (RIM1~4) はどれもVDCCの不活性化を著しく遅らせることでCa<sup>2+</sup>流入量を増加させる<ref name="ref28" />。このように、VDCCはアクティブゾーンのタンパク質と共役して働くことで、高効率的に神経伝達物質放出やシナプス可塑性を制御すると考えられる。 | ||
=== Ca<sub>v</sub>3 (T型) === | === Ca<sub>v</sub>3 (T型) === | ||
T型は、一過的にCa<sup>2+</sup> | T型は、一過的にCa<sup>2+</sup>を流入させることで、活動電位の発生パターンを調節する。心臓の洞房結節に存在するペースメーカー細胞における拍動の形成や<ref name="ref31"><pubmed>16690884</pubmed></ref>、[[睡眠]]時の特徴的な[[脳波]]を形成する[[視床]]のリレー細胞における周期的な発火に関わっている<ref name="ref32"><pubmed>9570789</pubmed></ref>。 | ||
== 疾患との関係 | == 疾患との関係 == | ||
Ca<sub>v</sub>1.1遺伝子 (''CACNA1S'') | Ca<sub>v</sub>1.1遺伝子 (''CACNA1S'') は、骨格筋の機能不全から発作的な筋力低下症状を示す低カリウム性周期性四肢麻痺、Ca<sub>v</sub>1.2遺伝子 (''CACNA1C'') は、心臓のQT延長や、合指、[[自閉症]]といった症状を示すTimothy症候群の原因遺伝子である<ref name="ref4" /><ref name="ref33"><pubmed>15000527</pubmed></ref>。Ca<sub>v</sub>2.1遺伝子 (''CACNA1A'') は、様々な遺伝子疾患、運動失調を呈する[[脊髄小脳失調症]]6型、家族性偏頭痛1型、発作性小脳失調を呈する反復発作性失調症2型などの原因遺伝子である。また、運動失調や[[てんかん]]症状を呈する変異マウスtottering、leaner、rolling Nagoyaの原因遺伝子でもある<ref name="ref31" />。Ca<sub>v</sub>3.1遺伝子 (''CACNA1G'') は、若年ミオクロニーてんかん、Ca<sub>v</sub>3.2遺伝子 (''CACNA1H'') は、小児欠神てんかんや突発性全般てんかん、また[[自閉症]]スペクトラム障害との関連が示唆されている<ref name="ref34"><pubmed> 19071165</pubmed></ref>。<br><br> | ||
== その他のCa<sup>2+</sup>チャネル == | |||
=== TRP チャネル === | |||
TRPチャネル ([[wikipedia:Transient receptor potential channel|Transient receptor potential channel]]) は、ショウジョウバエの光受容応答変異株の原因遺伝子として発見されたチャネル分子である<ref name="ref35"><pubmed> 2516726</pubmed></ref>。哺乳類においては28種の遺伝子が同定され、C, M, P, ML, V, Aといった6つのサブファミリーを構成する。TRPチャネルは、温度、機械刺激、痛み、酸-塩基といった種々の物理化学的刺激によって活性化されるカチオンチャネルファミリーを形成している。その多くがCa<sup>2+</sup>透過能を有し、中枢・末梢神経系を始めとするほぼ全ての組織に発現が見られる。TRPCやTRPMファミリーに属するTRPチャネルを介したCa<sup>2+</sup>シグナルは、神経細胞において重要な役割を担っていることが示されている。[[受容体]]刺激、[[細胞内Ca<sup>2+</sup>ストア]]枯渇、および他のタンパク質との相互作用によって活性化されるTRPCチャネル (TRPC1~7) を介したCa<sup>2+</sup>流入が、神経細胞の分化、増殖、生存や神経突起の伸長・誘導、[[スパイン]]形成といった多くの神経機能に関連する<ref name="ref36"><pubmed> 19999578</pubmed></ref>。一方、[[酸化ストレス]]や温度、pH、機械刺激などで活性化されるTRPMチャネル (TRPM1~8)を介したCa<sup>2+</sup>流入が、神経細胞の成長・発達や[[細胞死]]に関連する<ref name="ref36" />。 | |||
=== ストア作動性Ca<sup>2+</sup>チャネル (SOCチャネル) === | |||
= | SOCチャネル (store-operated calcium channel : SOC channel, calcium release-activated calcium channel : CRAC channel) は、小胞体Ca<sup>2+</sup>ストアのCa<sup>2+</sup>枯渇によって活性化開口される細胞外からのCa<sup>2+</sup>流入経路である。TRPCチャネルがチャネル分子実態として考えられていたが、近年、重症複合免疫不全症(sevefe combined immunodeficiency : SCID)の患者から遺伝子変異が発見されたOrai1がSOCチャネルとして同定され、主要な分子実態として認識され始めている。Orai (Orai1, 2, 3) は、小胞体のCa<sup>2+</sup>枯渇を感知した小胞体Ca<sup>2+</sup>センサー分子STIM (stromal interacting molecule : STIM1, 2) との相互作用を介して4量体を形成し、活性化開口する<ref name="ref37"><pubmed>19488056</pubmed></ref>。<br>SOCチャネルによるCa<sup>2+</sup>流入 (SOC流入) は、免疫細胞における主要なCa<sup>2+</sup>流入経路であり、免疫機能に必須であるとされ、抗原受容体といった受容体活性化の下流でSOC流入が誘導される。これは持続的な [Ca<sup>2+</sup>]<sub>i</sub>上昇によりCa<sup>2+</sup>[[シグナル伝達]]を担い、転写因子NFATの活性を調節することが知られる。近年になって、神経細胞や筋細胞といった興奮性細胞においてもSOC流入が確認され、種々の生理機能や疾患との関連が調べられている<ref name="ref37" />。 | ||
== | == 関連項目 == | ||
[[イオンチャネル]] | |||
[[電位依存性チャネル]] | |||
[[NMDA受容体]] | |||
[[イオンチャネル型グルタミン酸受容体]] | |||
== | == 参考文献 == | ||
<references /> | |||
(執筆者:澤村晴志朗、中尾章人、森泰生 担当編集委員:尾藤晴彦) | |||
2012年8月8日 (水) 10:24時点における版
英語名:Calcium channel
同義語:電位依存性カルシウムチャネル (Voltage-dependent calcium channel : VDCC、Voltage-gated calcium channel : VGCC)
形質膜越えのカルシウムイオン (Ca2+) 流入経路として、異なる活性化機構により開口するカルシウムチャネルが知られる。 それらの中でも膜電位の脱分極によって開口する電位依存性カルシウムチャネル (Voltage-dependent calcium channel : VDCC) が最も深く研究されてきた。VDCCは神経細胞や筋細胞を始めとする興奮性細胞において、様々な分子と相互作用することにより神経伝達物質放出、筋収縮、遺伝子発現など様々なCa2+依存性の細胞応答を制御する。 本項目では他のカルシウムチャネルについても言及したい。
分類、構造、発現
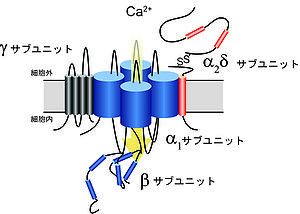
高電位活性化型のVDCCは、α1、α2δ、βおよびγサブユニットから成るヘテロ4量体を形成する。
VDCCは、形質膜の脱分極を感知して活性化開口し、細胞外から細胞内へCa2+を選択的に透過させるイオンチャネルであり、細胞の電気的興奮をCa2+依存的な生理応答に変換する役割を担う。開口する電位によりVDCCは、高電位 (~−20 mV)で活性化するL型 (Cav1)および非L型 (Cav2) と低電位 (~−60 mV) で活性するT型 (Cav3) に大別される[1][2][3]。高電位活性化型のVDCCは、α1、α2δ、βおよびγサブユニットから成るヘテロ4量体を形成すると考えられている (図1)。
α1サブユニット

| Ca2+電流 | α1サブユニット | 遺伝子 | 選択的阻害剤 | 主要な発現部位 | 主要な細胞機能 |
| L型 |
Cav1.1 Cav1.2 Cav1.3 Cav1.4 |
CACNA1S CACNA1C CACNA1D CACNA1F |
DHP, PAA, BTZ |
骨格筋 心臓、脳 内分泌組織、脳 網膜 |
筋収縮 筋収縮、遺伝子発現、シナプス可塑性 ホルモン分泌、遺伝子発現、シナプス可塑性 神経伝達物質放出 |
| P/Q型 N型 R型 |
Cav2.1 Cav2.2 Cav2.3 |
CACNA1A CACNA1B CACNA1E |
ω-アガトキシンIVA ω-コノトキシンGVIA SNX-482 |
脳 |
神経伝達物質放出、ホルモン分泌 神経伝達物質放出、ホルモン分泌 神経伝達物質放出 |
| T型 |
Cav3.1 Cav3.2 Cav3.3 |
CACNA1G CACNA1H CACNA1I |
脳、心臓 脳、心臓 脳 |
ペースメイキング、反復性発火 |
図3. α1サブユニットの分類とその特性
α1サブユニットには10種類のアイソフォームが存在し、その電気生理学的特性や薬理学的特性によって分類、命名されている。
電位センサーとチャネル孔を有するα1サブユニットは、おおよそ2000アミノ酸残基からなるタンパク質であり、膜貫通領域S1~S6の構造単位が4回繰り返す (リピートI~IV) 。S5領域とS6領域の間がCa2+を選択的に透過させるチャネル孔を形成し、S4領域が電位センサーとして働く。α1サブユニットは10種類の異なる遺伝子Cavによりコードされて、電気生理学的特性や薬理学的特性による機能分類 (L, P/Q, N, R, T) に対応付けられている (図2)[4]。
Cav1 (L型)
L型 (Cav1) は遅い不活性化 (Long lasting) と大きな (Large) 単一チャネルコンダクタンスを有することから名づけられた[5]。ジヒドロピリジン(Dihydropyridine, DHP)やフェニルアルキルアミン(Phenylalkylamine, PAA)、ベンゾチアゼピン(Benzothiazepine, BTZ)といった[[Ca2+拮抗薬]]の作用点である。Cav1.1は骨格筋、Cav1.2は心臓や脳、Cav1.3は膵臓などの内分泌組織や脳、Cav1.4は網膜に主に発現している[3]。
Cav2 (N, P/Q, R型)
非L型 (Cav2) にはN、P/Q、R型が含まれる。N型 (Cav2.2) には、L型ではない (Non-L) 、神経細胞に発現する (Neuronal) という意味がある[6]。ペプチド性のイモ貝毒ω-コノトキシン GVIAにより選択的に阻害される[7]。P型は小脳プルキンエ (Purkinje) 細胞においてDHPとω-コノトキシン GVIAの両方に非感受性のCa2+電流として同定された[8]。クモ毒ω-アガトキシンIVAによって選択的に阻害される[9]。Q型は、同じ遺伝子 (Cav2.1) のスプライスバリアントであると考えられており[11]、小脳顆粒細胞において初めて電流が同定された。Q型はP型よりω-アガトキシンIVAに対する親和性が低い[10]。R型 (Cav2.3) は小脳顆粒細胞においてDHP、ω-コノトキシン GVIA、ω-アガトキシンIVAによって阻害されない残りの成分 (Residual) という意味で名づけられ[11]、タランチュラ毒素SNX-482によって選択的に阻害される[12]。これら非L型のVDCCは広く神経系に発現している[3]。
Cav3 (T型)
T型 (Cav3) は低電位 (~−60 mV) で活性化し、早い不活性化や遅い脱活性化 (一過的: Transient)、小さい (Tiny) 単一チャネルコンダクタンスを特徴とする[1][6]。T型は脳に最も豊富に発現する他、心臓のペースメーカー細胞にも発現している。T型は高閾値活性化型のVDCCとは異なり、α2δ、β、γサブユニットとの相互作用が確認されていない。
副サブユニット (α2δ、β、γ)
α2δ、βおよびγサブユニットは、チャネル本体であるα1サブユニットの発現調節、機能調節や細胞内局在に重要であり、複数の遺伝子によってコードされている[13]。
大きな細胞外領域を有するα2δサブユニットは、単一の遺伝子にコードされるα2およびδがジスルフィド結合によって結ばれた二量体で、4種類のアイソフォームが知られる (α2δ1-4)。α2δサブユニットは、α1サブユニットの形質膜への輸送に働いている[14]。α1サブユニットのリピートIとIIをつなぐ細胞内リンカーに結合するβサブユニットは、4種類のアイソフォームが知られている (β1-4)。このβサブユニットは、α1サブユニットの形質膜における機能的な発現に重要であり[15]、VDCCの活性化や不活性化を促進する[16]。各アイソフォームには複数のスプライスバリアントが存在し、発現分布やチャネル機能の調節に違いがある[16]。γサブユニットは4回膜貫通のタンパク質であり、VDCCと相互作用することで不活性化曲線をシフトさせる[17]。γサブユニットには8種類のアイソフォームが存在し (γ1~8)、その中のいくつかのアイソフォームは、AMPA受容体 (2-amino-3-[3-hydroxy-5-methyl-4-isoxazolyl]propionic acid receptor) の輸送や機能調節を担う主要なタンパク質TARPs (Transmembrane AMPA receptor regulatory proteins) とも呼ばれている[17]。
機能
異なるαサブユニット (Cav) を含むVDCCは、神経伝達物質放出、シナプス可塑性、細胞の興奮性の調節、筋収縮、遺伝子発現など、異なる生理応答を制御する (図3)。
Cav1 (L型)
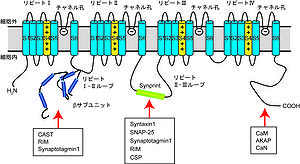
膜貫通領域S1~S6の構造単位が4回繰り返す (リピートI~IV) 。各リピートのS5領域とS6領域の間がCa2+を選択的に透過させるチャネル孔を形成し、S4領域が電位センサーとして働く。VDCCのβサブユニットはリピートI-II間のループに結合する。N, P/Q型VDCCのリピートII-III間のループには、アクティブゾーンに存在するタンパク質との相互作用部位 (Synprint)が保存されている。カルモジュリン(CaM)やAKAP、カルシニューリン(CaN)はC末端側の細胞質領域に結合することが報告されている。
L型は、骨格筋や心筋、平滑筋の収縮に始まり、ホルモンや神経伝達物質の放出、遺伝子発現まで様々な細胞応答に関わる。骨格筋の横行小管 (T管) に発現するCav1.1は、脱分極による構造変化を介してリアノジン受容体を直接活性化し、Ca2+放出を誘導することで筋収縮を引き起こす[18]。一方、心筋ではCav1.2からのCa2+流入がCa2+依存的にリアノジン受容体を活性化し、筋収縮を引き起こす[19]。Cav1.2およびCav1.3は、膵臓のβ細胞におけるインスリン分泌も制御している[20]。また、Cav1.3およびCav1.4は感覚受容細胞のリボンシナプスにおける神経伝達物質放出に関与している[4]。聴覚有毛細胞ではCav1.3が[21]、網膜の光受容細胞ではCav1.4が神経伝達物質の放出を制御している[22]。神経細胞においては、L型は細胞体や細胞体近傍の樹状突起に局在しており、近い位置での細胞内Ca2+濃度 ([Ca2+]i) 上昇の引き金となり、下流で核内のシグナル伝達、およびCa2+濃度上昇を引き起こす[4]。L型は、遺伝子発現に重要なシグナル分子であるCaM (calmodulin) 、AKAP (A kinase anchor protein) ファミリー、チロシンリン酸化酵素であるSrc、脱リン酸化酵素であるCaN (calcineurin) などと共役して働き (図4)、CREB (CAMP response element binding protein) [23]やNFAT (Nuclear factor of activated T-cells) といった転写因子の活性を調節することが知られる[4] 。
Cav2 (N, P/Q, R型)
N、P/Q、R型は主に神経系に発現し、神経伝達物質放出を始めとする神経機能を制御する[24][25]。活動電位がシナプス前終末に達すると、N、P/Q、R型などのVDCCを介したCa2+流入が引き起こされ、神経伝達物質が放出される。シナプス前終末において神経伝達物質放出を効率的に制御するため、シナプス小胞の膜融合を制御するSNARE (soluble N-ethylmaleimide-sensitive factor attachment protein receptor ) タンパク質 (Syntaxin、SNAP-25、VAMP/synaptobrevin)やCa2+センサーと考えられているSynaptotagmin、足場タンパク質として働くRIM (Rab-3 interacting molecule) ファミリー、CAST、Munc13、Bassoon、Piccoloといったタンパク質群とVDCCは巨大タンパク質複合体である、アクティブゾーンを形成している。N、P/Q型のα1サブユニットのII-IIIリンカーにはアクティブゾーンに存在するタンパク質との相互作用部位 (Synprint ; synaptic protein interaction) が保存されており、syntaxinやSNAP-25、CSP (cysteine string protein)、RIM、synaptotagminと相互作用する (図4) [4][26]。syntaxinやSNAP-25はsynprint領域を介してVDCCと相互作用し、チャネルの不活性化状態を安定化させることでチャネル活性を抑制することが報告されている[26]。また、βサブユニットもCASTやRIM、synaptotagminといったアクティブゾーンに存在するタンパク質と相互作用する (図4) [27][28][29]。これらのタンパク質との相互作用は、神経伝達物質放出複合体を形成し、VDCCの機能修飾も担う。RIM1のα型バリアント (RIM1α) はシナプス小胞のRab-3と相互作用する足場タンパク質であることから、VDCCとシナプス小胞の距離を規定する分子である可能性が高い[30]。4種類のRIM (RIM1~4) はどれもVDCCの不活性化を著しく遅らせることでCa2+流入量を増加させる[28]。このように、VDCCはアクティブゾーンのタンパク質と共役して働くことで、高効率的に神経伝達物質放出やシナプス可塑性を制御すると考えられる。
Cav3 (T型)
T型は、一過的にCa2+を流入させることで、活動電位の発生パターンを調節する。心臓の洞房結節に存在するペースメーカー細胞における拍動の形成や[31]、睡眠時の特徴的な脳波を形成する視床のリレー細胞における周期的な発火に関わっている[32]。
疾患との関係
Cav1.1遺伝子 (CACNA1S) は、骨格筋の機能不全から発作的な筋力低下症状を示す低カリウム性周期性四肢麻痺、Cav1.2遺伝子 (CACNA1C) は、心臓のQT延長や、合指、自閉症といった症状を示すTimothy症候群の原因遺伝子である[4][33]。Cav2.1遺伝子 (CACNA1A) は、様々な遺伝子疾患、運動失調を呈する脊髄小脳失調症6型、家族性偏頭痛1型、発作性小脳失調を呈する反復発作性失調症2型などの原因遺伝子である。また、運動失調やてんかん症状を呈する変異マウスtottering、leaner、rolling Nagoyaの原因遺伝子でもある[31]。Cav3.1遺伝子 (CACNA1G) は、若年ミオクロニーてんかん、Cav3.2遺伝子 (CACNA1H) は、小児欠神てんかんや突発性全般てんかん、また自閉症スペクトラム障害との関連が示唆されている[34]。
その他のCa2+チャネル
TRP チャネル
TRPチャネル (Transient receptor potential channel) は、ショウジョウバエの光受容応答変異株の原因遺伝子として発見されたチャネル分子である[35]。哺乳類においては28種の遺伝子が同定され、C, M, P, ML, V, Aといった6つのサブファミリーを構成する。TRPチャネルは、温度、機械刺激、痛み、酸-塩基といった種々の物理化学的刺激によって活性化されるカチオンチャネルファミリーを形成している。その多くがCa2+透過能を有し、中枢・末梢神経系を始めとするほぼ全ての組織に発現が見られる。TRPCやTRPMファミリーに属するTRPチャネルを介したCa2+シグナルは、神経細胞において重要な役割を担っていることが示されている。受容体刺激、[[細胞内Ca2+ストア]]枯渇、および他のタンパク質との相互作用によって活性化されるTRPCチャネル (TRPC1~7) を介したCa2+流入が、神経細胞の分化、増殖、生存や神経突起の伸長・誘導、スパイン形成といった多くの神経機能に関連する[36]。一方、酸化ストレスや温度、pH、機械刺激などで活性化されるTRPMチャネル (TRPM1~8)を介したCa2+流入が、神経細胞の成長・発達や細胞死に関連する[36]。
ストア作動性Ca2+チャネル (SOCチャネル)
SOCチャネル (store-operated calcium channel : SOC channel, calcium release-activated calcium channel : CRAC channel) は、小胞体Ca2+ストアのCa2+枯渇によって活性化開口される細胞外からのCa2+流入経路である。TRPCチャネルがチャネル分子実態として考えられていたが、近年、重症複合免疫不全症(sevefe combined immunodeficiency : SCID)の患者から遺伝子変異が発見されたOrai1がSOCチャネルとして同定され、主要な分子実態として認識され始めている。Orai (Orai1, 2, 3) は、小胞体のCa2+枯渇を感知した小胞体Ca2+センサー分子STIM (stromal interacting molecule : STIM1, 2) との相互作用を介して4量体を形成し、活性化開口する[37]。
SOCチャネルによるCa2+流入 (SOC流入) は、免疫細胞における主要なCa2+流入経路であり、免疫機能に必須であるとされ、抗原受容体といった受容体活性化の下流でSOC流入が誘導される。これは持続的な [Ca2+]i上昇によりCa2+シグナル伝達を担い、転写因子NFATの活性を調節することが知られる。近年になって、神経細胞や筋細胞といった興奮性細胞においてもSOC流入が確認され、種々の生理機能や疾患との関連が調べられている[37]。
関連項目
参考文献
- ↑ 1.0 1.1
Carbone, E., & Lux, H.D. (1984).
A low voltage-activated, fully inactivating Ca channel in vertebrate sensory neurones. Nature, 310(5977), 501-2. [PubMed:6087159] [WorldCat] [DOI] - ↑
Fedulova, S.A., Kostyuk, P.G., & Veselovsky, N.S. (1985).
Two types of calcium channels in the somatic membrane of new-born rat dorsal root ganglion neurones. The Journal of physiology, 359, 431-46. [PubMed:2582115] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2
Catterall, W.A., Perez-Reyes, E., Snutch, T.P., & Striessnig, J. (2005).
International Union of Pharmacology. XLVIII. Nomenclature and structure-function relationships of voltage-gated calcium channels. Pharmacological reviews, 57(4), 411-25. [PubMed:16382099] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3 4.4 4.5
Catterall, W.A. (2011).
Voltage-gated calcium channels. Cold Spring Harbor perspectives in biology, 3(8), a003947. [PubMed:21746798] [PMC] [WorldCat] [DOI] - ↑
Hess, P., Lansman, J.B., & Tsien, R.W. (1984).
Different modes of Ca channel gating behaviour favoured by dihydropyridine Ca agonists and antagonists. Nature, 311(5986), 538-44. [PubMed:6207437] [WorldCat] [DOI] - ↑ 6.0 6.1
Nowycky, M.C., Fox, A.P., & Tsien, R.W. (1985).
Three types of neuronal calcium channel with different calcium agonist sensitivity. Nature, 316(6027), 440-3. [PubMed:2410796] [WorldCat] [DOI] - ↑
McCleskey, E.W., Fox, A.P., Feldman, D.H., Cruz, L.J., Olivera, B.M., Tsien, R.W., & Yoshikami, D. (1987).
Omega-conotoxin: direct and persistent blockade of specific types of calcium channels in neurons but not muscle. Proceedings of the National Academy of Sciences of the United States of America, 84(12), 4327-31. [PubMed:2438698] [PMC] [WorldCat] [DOI] - ↑
Llinás, R.R., Sugimori, M., & Cherksey, B. (1989).
Voltage-dependent calcium conductances in mammalian neurons. The P channel. Annals of the New York Academy of Sciences, 560, 103-11. [PubMed:2545128] [WorldCat] [DOI] - ↑
Mintz, I.M., Adams, M.E., & Bean, B.P. (1992).
P-type calcium channels in rat central and peripheral neurons. Neuron, 9(1), 85-95. [PubMed:1321648] [WorldCat] [DOI] - ↑
Randall, A., & Tsien, R.W. (1995).
Pharmacological dissection of multiple types of Ca2+ channel currents in rat cerebellar granule neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 15(4), 2995-3012. [PubMed:7722641] [WorldCat] - ↑
Bourinet, E., Soong, T.W., Sutton, K., Slaymaker, S., Mathews, E., Monteil, A., ..., & Snutch, T.P. (1999).
Splicing of alpha 1A subunit gene generates phenotypic variants of P- and Q-type calcium channels. Nature neuroscience, 2(5), 407-15. [PubMed:10321243] [WorldCat] [DOI] - ↑
Newcomb, R., Szoke, B., Palma, A., Wang, G., Chen, X.h., Hopkins, W., ..., & Miljanich, G. (1998).
Selective peptide antagonist of the class E calcium channel from the venom of the tarantula Hysterocrates gigas. Biochemistry, 37(44), 15353-62. [PubMed:9799496] [WorldCat] [DOI] - ↑
Tanabe, T., Takeshima, H., Mikami, A., Flockerzi, V., Takahashi, H., Kangawa, K., ..., & Numa, S. (1987).
Primary structure of the receptor for calcium channel blockers from skeletal muscle. Nature, 328(6128), 313-8. [PubMed:3037387] [WorldCat] [DOI] - ↑
Davies, A., Hendrich, J., Van Minh, A.T., Wratten, J., Douglas, L., & Dolphin, A.C. (2007).
Functional biology of the alpha(2)delta subunits of voltage-gated calcium channels. Trends in pharmacological sciences, 28(5), 220-8. [PubMed:17403543] [WorldCat] [DOI] - ↑
Mori, Y., Friedrich, T., Kim, M.S., Mikami, A., Nakai, J., Ruth, P., ..., & Furuichi, T. (1991).
Primary structure and functional expression from complementary DNA of a brain calcium channel. Nature, 350(6317), 398-402. [PubMed:1849233] [WorldCat] [DOI] - ↑ 16.0 16.1
Buraei, Z., & Yang, J. (2010).
The ß subunit of voltage-gated Ca2+ channels. Physiological reviews, 90(4), 1461-506. [PubMed:20959621] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1
Chen, R.S., Deng, T.C., Garcia, T., Sellers, Z.M., & Best, P.M. (2007).
Calcium channel gamma subunits: a functionally diverse protein family. Cell biochemistry and biophysics, 47(2), 178-86. [PubMed:17652770] [WorldCat] - ↑
Numa, S., Tanabe, T., Takeshima, H., Mikami, A., Niidome, T., Nishimura, S., ..., & Beam, K.G. (1990).
Molecular insights into excitation-contraction coupling. Cold Spring Harbor symposia on quantitative biology, 55, 1-7. [PubMed:1966760] [WorldCat] [DOI] - ↑
Fabiato, A. (1983).
Calcium-induced release of calcium from the cardiac sarcoplasmic reticulum. The American journal of physiology, 245(1), C1-14. [PubMed:6346892] [WorldCat] [DOI] - ↑
Eliasson, L., Abdulkader, F., Braun, M., Galvanovskis, J., Hoppa, M.B., & Rorsman, P. (2008).
Novel aspects of the molecular mechanisms controlling insulin secretion. The Journal of physiology, 586(14), 3313-24. [PubMed:18511483] [PMC] [WorldCat] [DOI] - ↑
Kollmar, R., Montgomery, L.G., Fak, J., Henry, L.J., & Hudspeth, A.J. (1997).
Predominance of the alpha1D subunit in L-type voltage-gated Ca2+ channels of hair cells in the chicken's cochlea. Proceedings of the National Academy of Sciences of the United States of America, 94(26), 14883-8. [PubMed:9405708] [PMC] [WorldCat] [DOI] - ↑
Schmitz, Y., & Witkovsky, P. (1997).
Dependence of photoreceptor glutamate release on a dihydropyridine-sensitive calcium channel. Neuroscience, 78(4), 1209-16. [PubMed:9174087] [WorldCat] [DOI] - ↑
Bito, H., Deisseroth, K., & Tsien, R.W. (1996).
CREB phosphorylation and dephosphorylation: a Ca(2+)- and stimulus duration-dependent switch for hippocampal gene expression. Cell, 87(7), 1203-14. [PubMed:8980227] [WorldCat] [DOI] - ↑
Takahashi, T., & Momiyama, A. (1993).
Different types of calcium channels mediate central synaptic transmission. Nature, 366(6451), 156-8. [PubMed:7901765] [WorldCat] [DOI] - ↑
Wheeler, D.B., Randall, A., & Tsien, R.W. (1994).
Roles of N-type and Q-type Ca2+ channels in supporting hippocampal synaptic transmission. Science (New York, N.Y.), 264(5155), 107-11. [PubMed:7832825] [WorldCat] [DOI] - ↑ 26.0 26.1
Evans, R.M., & Zamponi, G.W. (2006).
Presynaptic Ca2+ channels--integration centers for neuronal signaling pathways. Trends in neurosciences, 29(11), 617-24. [PubMed:16942804] [WorldCat] [DOI] - ↑
Kiyonaka, S., Nakajima, H., Takada, Y., Hida, Y., Yoshioka, T., Hagiwara, A., ..., & Ohtsuka, T. (2012).
Physical and functional interaction of the active zone protein CAST/ERC2 and the β-subunit of the voltage-dependent Ca(2+) channel. Journal of biochemistry, 152(2), 149-59. [PubMed:22577167] [WorldCat] [DOI] - ↑ 28.0 28.1
Kiyonaka, S., Wakamori, M., Miki, T., Uriu, Y., Nonaka, M., Bito, H., ..., & Mori, Y. (2007).
RIM1 confers sustained activity and neurotransmitter vesicle anchoring to presynaptic Ca2+ channels. Nature neuroscience, 10(6), 691-701. [PubMed:17496890] [PMC] [WorldCat] [DOI] - ↑
Vendel, A.C., Terry, M.D., Striegel, A.R., Iverson, N.M., Leuranguer, V., Rithner, C.D., ..., & Horne, W.A. (2006).
Alternative splicing of the voltage-gated Ca2+ channel beta4 subunit creates a uniquely folded N-terminal protein binding domain with cell-specific expression in the cerebellar cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(10), 2635-44. [PubMed:16525042] [PMC] [WorldCat] [DOI] - ↑
Wang, Y., Okamoto, M., Schmitz, F., Hofmann, K., & Südhof, T.C. (1997).
Rim is a putative Rab3 effector in regulating synaptic-vesicle fusion. Nature, 388(6642), 593-8. [PubMed:9252191] [WorldCat] [DOI] - ↑ 31.0 31.1
Mangoni, M.E., Traboulsie, A., Leoni, A.L., Couette, B., Marger, L., Le Quang, K., ..., & Lory, P. (2006).
Bradycardia and slowing of the atrioventricular conduction in mice lacking CaV3.1/alpha1G T-type calcium channels. Circulation research, 98(11), 1422-30. [PubMed:16690884] [WorldCat] [DOI] - ↑
Destexhe, A., Neubig, M., Ulrich, D., & Huguenard, J. (1998).
Dendritic low-threshold calcium currents in thalamic relay cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 18(10), 3574-88. [PubMed:9570789] [PMC] [WorldCat] - ↑
Liu, L., Zwingman, T.A., & Fletcher, C.F. (2003).
In vivo analysis of voltage-dependent calcium channels. Journal of bioenergetics and biomembranes, 35(6), 671-85. [PubMed:15000527] [WorldCat] [DOI] - ↑
Huc, S., Monteil, A., Bidaud, I., Barbara, G., Chemin, J., & Lory, P. (2009).
Regulation of T-type calcium channels: signalling pathways and functional implications. Biochimica et biophysica acta, 1793(6), 947-52. [PubMed:19071165] [WorldCat] [DOI] - ↑
Montell, C., & Rubin, G.M. (1989).
Molecular characterization of the Drosophila trp locus: a putative integral membrane protein required for phototransduction. Neuron, 2(4), 1313-23. [PubMed:2516726] [WorldCat] [DOI] - ↑ 36.0 36.1
Numata, T., Kozai, D., Takahashi, N., Kato, K., Uriu, Y., Yamamoto, S., ..., & Mori, Y. (2009).
[Structures and variable functions of TRP channels]. Seikagaku. The Journal of Japanese Biochemical Society, 81(11), 962-83. [PubMed:19999578] [WorldCat] - ↑ 37.0 37.1
Cahalan, M.D. (2009).
STIMulating store-operated Ca(2+) entry. Nature cell biology, 11(6), 669-77. [PubMed:19488056] [PMC] [WorldCat] [DOI]
(執筆者:澤村晴志朗、中尾章人、森泰生 担当編集委員:尾藤晴彦)